Пфк что это в медицине
Пфк что это в медицине
Фетальное кровообращение у новорожденных детей частично функционирует в течение 10—15 ч внеутробной жизни. В это время сохраняется небольшой кровоток через овальное окно и артериальный проток. Возможен и двухсторонний шунт с током крови справа-налево и слева-направо. Установлено, что в первые 4 ч после рождения у большинства детей двухстороннее шунтирование крови через артериальный проток имеет несколько вариантов:
1) право-левый шунт в систолу и лево-правый шунт в диастолу;
2) право-левый шунт в систолу и двухсторонний шунт в диастолу;
3) непрерывный двухсторонний шунт в систолу и диастолу.
Право-левый ток крови обычно регистрируется в раннюю систолу, лево-правый ток крови, наблюдающийся в диастолу, продолжается длительно в течение всей диастолы. Двухсторонний турбулентный кровоток через артериальный проток имеет высокую скорость и продолжительность. С возрастанием скорости кровотока по артериальному протоку в диастолу двухсторонний шунт сменяется на лево-правый. Скорость лево-правого шунта в диастолу возрастает в первые 12 ч после рождения ребенка.
Частично циркулирующие фетальные коммуникации у новорожденного ребенка играют регуляторную роль, снижая гемодинамическую нагрузку на миокард ПЖ во время послеродовой сердечно-легочной адаптации.
После рождения ребенка происходят изменения и в системе общего кровообращения. Плацентарный артериальный кровоток прекращается в течение 45—60 с после рождения. Скорость плацентарного венозного кровотока составляет 75 мл/кг-мин, замедляется через 2 мин после рождения, почти полностью прекращается на 3-й и заканчивается на 5-й минуте жизни.
Перестройка кровообращения приводит к возрастанию выброса ЛЖ примерно на 25%. В первые 2 ч после рождения резистентность периферических регуляторных сосудов низкая, в последующее время она повышается, обеспечивая таким образом необходимый уровень АД крови. В первые сутки после рождения у здоровых доношенных новорожденных наблюдается гиперкинетический тип сокращения межжелудочковой перегородки, который регистрируется до конца первой недели жизни. Такой тип сокращения межжелудочковой перегородки с высоким давлением крови в легочной артерии при транзиторной легочной гипертензии служит для облегчения работы миокарда ЛЖ. После закрытия артериального протока ударный объем ЛЖ в среднем равняется 4,0 мл, а скорость кровотока в общей системе циркуляции составляет 2,3—3,1 л/мин*м2.
Перестройка общего кровообращения сопровождается улучшением оксигенации крови и выделения углекислого газа из организма ребенка. Так, парциальное напряжение кислорода в крови в первые 10 мин жизни равняется 30 мм рт. ст., в последующие 15 мин возрастает до 60 мм рт. ст., в течение 1-го часа — до 80 мм рт. ст. и к концу первых суток жизни устанавливается на уровне 90 мм рт. ст. Парциальное напряжение углекислого газа в крови при рождении высокое (60 мм рт. ст.) и достигает уровня взрослого в течение 2-го часа жизни.
С первых по пятые сутки жизни отмечается нарастание минутного объема кровообращения, с максимальным подъемом на 3-й день после рождения. Увеличение минутного объема кровообращения происходит в значительной мере за счет возрастания ударного объема ЛЖ. Возрастание минутного объема кровообращения вместе с нормализацией общего периферического сопротивления сосудов в конечном итоге приводит к улучшению периферической циркуляции крови, увеличению кровенаполнения периферических сосудов, улучшению оттока крови из тканей и возрастанию скорости кровотока по сосудам.
После рождения постепенно повышается АД крови, особенно максимальное. Системное АД после рождения составляет в среднем 72/47 мм рт. ст., со 2—3-го дня жизни возрастает в среднем до 94/72 мм рт. ст. с наиболее значительным подъемом на 4—5-й день жизни. Возрастание системного АД связано с увеличением не только сердечного выброса, но и общего сосудистого периферического сопротивления, что обусловлено увеличением относительной массы мышечной стенки сосудистого ложа и повышением тонуса сфинктеров периферических регуляторных сосудов.
После рождения имеется устойчивая тенденция к снижению гематокрита, что также влияет на состояние общего кровотока: с уменьшением гематокрита снижается вязкость крови и возрастает скорость кровотока в общем сосудистом русле.
Метаболизм миокарда новорожденных постепенно переходит от утилизации глюкозы как основного источника энергии к потреблению жирных кислот.
Функциональное закрытие венозного протока происходит в течение первых нескольких минут жизни, а полное анатомическое закрытие — на 2—3-й неделе после рождения.
На качестве переходного кровообращения сказывается такой фактор, как время перевязки пуповины. При поздней перевязке пуповины (наложение скобок более чем через 3 мин после рождения плода) происходит возрастание объема циркулирующей крови до 60%. Этот дополнительный объем крови обеспечивает увеличение объема крови в правом и левом предсердиях («плюс-объем»), обусловливая более высокий уровень среднего АД. Среднее давление крови в предсердиях достигает исходного уровня только спустя 2—3 ч. В этом случае на сердце новорожденного ребенка падает дополнительная работа по перекачиванию большего объема крови. Кроме того, при позднем наложении скобок на пуповину происходит увеличение массы эритроцитов на 40—50%, что способствует повышению вязкости крови и, соответственно, гемодинамической нагрузки на сердце ребенка.
Переходная циркуляция сопровождается такими клиническими проявлениями, как акроцианоз, периоральный цианоз, усиливающийся при беспокойстве или крике ребенка, сердечные шумы. В первые несколько часов жизни шумы переходного кровообращения над областью сердца выслушиваются у 85% новорожденных детей. Чаще всего они обусловлены временным функционированием артериального протока с лево-правым шунтированием крови или турбулентным движением потока крови на изгибах крупных кровеносных сосудов. Отдельные сердечные шумы выслушиваются в раннюю или позднюю систолу. В первые полчаса-час после рождения на ЭКГ могут регистрироваться удлинение интервалов P-R, QRS, инверсия зубца Т в отведении VI, который в это время становится положительным за счет систолической перегрузки ПЖ.
Синдром персистирующего фатального кровообращения
Постнатальный персистирующий право-левый шунт через артериальный проток и/или овальное окно имеет в литературе несколько названий. Наиболее популярно — синдром персистирующего фетального кровообращения (ПФК), но отсутствие плацентарного кровообращения делает этот термин недостаточно точным. Патогенетически более правильным является название, учитывающее основной патофизиологический механизм этого патологического процесса — легочную гипертензию. Отсюда вторым конкурирующим термином считают персистирующая легочная гипертен-зия новорожденных, при которой из-за значительного право-левого шунта увеличивается примесь венозной крови в системном кровотоке, приводящая к стойкой гипоксемии и цианозу, рефрактерным к оксигенотерапии. Степень гипоксемии обычно непропорциональна тяжести поражения легких.
ПФК встречается с частотой 1 случай на 1500 родов. В отделении реанимации новорожденных его диагностируют у 2 — 9 % больных.
Причины легочной гипертензии новорожденных в зависимости от характера сосудистых изменений могут быть объединены в 3 группы:
Нарушения адаптации сосудов легких к становлению дыхания проявляются в том, что малые мышечные легочные артерии (менее 250 мкм), имея нормальное структурное развитие и анатомию, после рождения не расправляются из-за перинатального стресса: кровотечения, гипогликемии, гипокальциемии, полицитемии, аспирации мекония, гипоксии, бактериальной инфекции. Первоначально эти воздействия обусловливают спазм артерий, который разрешается сосудорасширяющими препаратами, но позднее длительная легочная ги-пертензия вызывает усиленное образование соединительной ткани вокруг гладкомышечных клеток, что уменьшает их способность в вазодилатации. Причины спазма не ясны, хотя доказано влияние на этот процесс эйкозаноидов, вазоактивных субстанций нейроэпителиальных телец (серотонин, бомбе-зин), повреждения эндотелия
Задержка внутриутробного созревания сосудов легких проявляется в сохранении гипертрофии среднего слоя мышечных артерий ацинуса и в распространении гладкомышечных клеток на более дистальные легочные артериолы Подобные характеристики типичны для малого гестационного возраста Они обусловливают сохранение высокого сосудистого сопротивления и гипертен-зии Чрезмерный мышечный слой обнаружен не только в артериях, но и в венах Задержка развития сосудов отмечена у новорожденных, подвергавшихся хроническому внутриутробному стрессу и гипоксии, при некоторых ВСП (аномалиях легочного венозного дренажа, нарушении выхода из левого желудочка, синдроме гипоплазии левого желудочка) Более чем в 30% случаев она имеет идиопатический характер Особенность этого вида ПФК в том, что легочные сосуды при нем чрезвычайно предрасположены к спазму под влиянием гипоксии и ацидоза
Одновременное недоразвитие легких и легочного сосудистого ложа с повышенной мускуляризацией артериол — типичная морфологическая картина при врожденной диафрагмальной грыже У новорожденных, умерших при этом пороке развития, обнаружено нормальное соотношение артерий и альвеол, но абсолютное их число снижено на 1/3 и более Мышечный слой артериол у этих детей такой же толщины, как на фоне обструкции выхода из левого желудочка Как уменьшенный суммарный просвет сосудов, так и гипоксия и гиперкапния (следствие первого фактора) вызывают повышенное сопротивление легочному кровотоку, легочную гипертензию и право-левый шунт
Другими причинами этого вида ПФК могут явиться агенезия и гипоплазия почек, резус-конфликт, глубокая недоношенность
Патогенез начальных этапов ПФК определяют вышеперечисленные причины легочной гипертензии, на фоне которых возникает право-левый шунт Дальнейшее течение усугубляют два фактора гипоксия и гиперкап-ния, усиливающие гипертензию и замыкающие порочный круг, и объемная перегрузка левых отделов сердца Она, в свою очередь, приводит к сердечной недостаточности и отеку легкого Процесс переходит во вторую стадию к спастической легочной гипертензии присоединяется застойная (см рис 19 2)
Клинические проявления ПФК зависят от стадии нарушения гемодинамики, однако во всех случаях должен присутствовать кардинальный симптом праволевого шунта цианоз, не поддающийся воздействию 100% кислородом и положительным давлением на выдохе Последствия гипоксемии — стойкий метаболический ацидоз с рН крови менее 7,25 и BE больше — 10 ммоль/л Кровь, взятая из верхних и нижних конечностей, имеет разницу в рН более 0,01 Легочная гипертензия проявляется аускультативно либо акцентом II тона над легочной артерией и его расщеплением над верхушкой сердца, либо при слабости миокарда, наоборот, отсутствием II тона Рентгенограмма грудной клетки в этой стадии выявляет обеднение малого круга кровообращения и прозрачные легкие На ЭКГ — депрессия интервала ST в левых грудных отведениях
где MAP — среднее давление в дыхательных путях, если ребенок находится на традиционной вентиляции, или CDP, если на ВЧО ИВЛ,
FiO2 — фракция вдыхаемого кислорода,
парциальное давление кислорода в артериальной крови пациента
Для фармакологической ликвидации легочной гипертензии в настоящее время наиболее широко используют α-адренолитик короткого действия — то-лазолин и реже натрия нитропруссид, быстродействующий препарат, обладающий миотропным эффектом преимущественно на сосуды малого круга кровообращения. Показанием к их назначению служит рефрактерность к ИВЛ у больных с ПФК. Оба препарата вводят микроструйно внутривенно.
Кроме перечисленных препаратов, в эксперименте и единичных клинических исследованиях для лечения ПФК применяли простациклин, блокаторы кальциевых каналов (нифедепин), оксид азота. Однако оптимистических выводов для рекомендации этих препаратов в широкую практику пока еще нет.
Количество наблюдений по применению ЭКМО при ПФК прогрессивно нарастает с каждым годом. Показанием для нее считают резистентные к традиционной терапии случаи ПФК у детей с массой тела более 2000 г и ИО более 40 при отсутствии ВПС и геморрагического синдрома. Выживаемость, по данным различных авторов, после ЭКМО колеблется от 56 до 100%.
По мере накопления опыта в традиционной терапии ПФК среди неонато-логов возрастает неудовлетворенность от применения этих подходов, что прежде всего объясняется все еще сохраняющейся высокой летальностью и большим процентом осложнений лечения. Так, по данным С.Хакман и соавт. (1985), гипервентиляционный режим ИВЛ в 47% осложнялся пневмотораксом, склонностью к артериальной гипотензии, олигурии, тромбоцитопении, повышенной кровоточивости, парезу кишечника. Все еще трудной и дорогостоящей процедурой остается ЭКМО.
Перечисленные факты, по-видимому, послужили причиной того, что в последние годы растет число сторонников более консервативного подхода к лечению легочной гипертензии (Ванг Дж. и др., 1985). Наиболее четко эту точку зрения высказал У.Лонг (1990), который считает, что при ПФК необходимо лечить предрасполагающую болезнь и ожидать, когда у ребенка состояние улучшится спонтанно. Меньшая терапия является лучшей терапией. Время — лучший лекарь, чем какие-либо активные воздействия. Диагноз ПФК не должен быть диктатом к гипероксии и жесткой ИВЛ. Их используют только при абсолютной необходимости. Ребенка с легочной гипертензией следует вести так тщательно и неинвазивно, насколько это возможно. Однако справедливость этих пложений окончательно еще не доказана достаточной статистикой.
Гипервентиляционный синдром и дисфункциональное дыхание
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях
Клинические особенности, диагностические критерии гипервентиляционного синдрома (ГВС) и дисфункционального дыхания (ДД) недостаточно знакомы широкому кругу врачей [1, 2, 3]. К одной из исторических вех, связанной с понятиями о функциональных нарушениях дыхания, относят 1871 год, когда Да Коста (Da Costa Jacob, 1833–1900), американский врач, принимавший участие в Гражданской войне США, применил термин «гипервентиляционый синдром» (ГВС) у пациентов с так называемым «солдатским сердцем». С тех пор для характеристики дыхательных расстройств предлагались различные альтернативные определения: «дыхательный невроз», «нейрореспираторная дистония», «респираторный синдром», «респираторная дискинезия», «идиопатическая гипервентиляция», «нейрореспираторный синдром», «неустойчивое дыхание» и др. Однако указанные термины не получили широкого признания. Они являются достаточно общими и не отражают особенностей нарушений дыхания у конкретного больного [4]. Перечисленные определения нередко связывают с понятием «непонятная одышка» (unexplained dyspnea).
ГВС встречается в 6–11% от числа пациентов общей практики. Соотношение мужчин и женщин составляет 1:4, 1:5; чаще наблюдается в 30–40 лет, но возможно развитие в других возрастных группах, включая детей и пожилых. L. Lum (1987) подчеркивал, что «каждый врач в течение недели может встретить хотя бы одного больного с ГВС». Врачи различных специальностей — невропатологи, кардиологи, пульмонологи, психиатры — могут наблюдать у своих пациентов явления гипервентиляции. Острое течение ГВС встречается значительно реже, чем хроническое, и составляет лишь 1–2% от общего числа больных [2, 6, 7].
Причины развития ГВС довольно многочисленны. Это неврологические и психические расстройства, вегетативные нарушения, болезни органов дыхания, некоторые заболевания сердечно-сосудистой системы, органов пищеварения, экзогенные и эндогенные интоксикации, лекарственные средства (салицилаты, метилксантины, β-агонисты, прогестерон) и др. Считается, что в 5% случаев ГВС имеет только органическую природу, в 60% случаев — только психогенную, в остальных — комбинации этих причин [6].
Важной особенностью развития ГВС является то обстоятельство, что если причины, являющиеся триггерными, устраняются, то гипервентиляция, которая уже не соответствует требованиям конкретной ситуации, сохраняется, сохраняется и гипокапния. Происходит стабилизация гипокапнических нарушений газообмена и формируется «порочный круг» ГВС, который начинает циркулировать автономно, и симптомы могут персистировать достаточно долго — феномен «махового колеса». Эти изменения реакции дыхания указывают на уязвимую систему контроля дыхания, которая не способна поддержать нормальное парциальное давление углекислого газа в крови (РСО2) и кислотно-щелочной гомеостаз [8, 9, 10, 11].
В основе развития клинических проявлений ГВС лежат гипокапнические нарушения газообмена [2, 3, 10]. Среди множества клинических проявлений ГВС одышка является ведущей жалобой и встречается практически в 100% случаев. Одышка может быть единственным клиническим проявлением, но чаще сочетается с другими симптомами.
Основные клинические проявления ГВС
Респираторные: одышка, вздохи, зевота, сухой кашель.
Общие: снижение трудоспособности, слабость, утомляемость, субфебрилитет.
Кардиальные: кардиалгия, экстрасистолия, тахикардия.
Психоэмоциональные: тревога, беспокойство, бессонница.
Гастроэнтерологические: дисфагия, боли в эпигастрии, сухость во рту, аэрофагия, запоры.
Неврологические: головокружение, обмороки, парестезии, тетания (редко).
Мышечные: мышечная боль, тремор.
Диагностика ГВС в первую очередь опирается на знание врачей самых различных специальностей об особенностях клинической картины ГВС. ГВС должен устанавливаться только после проведения дифференциальной диагностики с другими заболеваниями, протекающими с синдромом одышки. Полиморфизм клинических проявлений ГВС вызывает диагностические проблемы. Назначаются многочисленные обследования, дорогостоящие, ненужные, а иногда и опасные для больного. L. Lum (1987), обсуждая диагностические проблемы, называет среди врачебных ошибок бесполезные абдоминальные операции, операции на позвоночнике и других органах, инвазивные исследования, проводимые не без риска, и, что еще хуже, такие диагнозы, как эпилепсия и инфаркт миокарда. Взаимосвязи гипокапнии и ассоциированных с ней симптомов являются чрезвычайно сложными. Многие врачи при регистрации у больных низких значений РСО2 автоматически устанавливают диагноз ГВС, что является неправильным. Известно, что явления гипокапнии могут быть у больных рестриктивными легочными процессами, при лихорадочных состояниях, сердечной патологии, однако при этом «классических» гипокапнических жалоб может и не быть. И наоборот, так называемые гипокапнические жалобы, например тревога, одышка, парестезии и др., встречаются у пациентов с нормокапнией.
В практической медицине больной с ГВС — это пациент, предъявляющий жалобы на одышку, которая не соответствует данным объективного осмотра, показателям клинико-инструментальных исследований дыхания, с диспропорциональной, непонятной одышкой, субъективное восприятие которой является довольно тягостным. К сожалению, при отсутствии достоверных объяснений одышки больные обычно направляются для консультаций в различные лечебные учреждения. В конечном итоге они и формируют основной контингент альтернативной медицины, различных псевдоспециалистов «по тренировке правильного дыхания».
Исследование функции внешнего дыхания, имеющее важное значение в дифференциальной диагностике одышки, не помогает в верификации функциональных нарушений дыхания. Основным подтверждением ГВС служит выявление гипокапнических нарушений газообмена. Снижение РСО2 — прямое свидетельство альвеолярной гипервентиляции. Однако исходная гипокапния у больных с ГВС встречается не так часто. Поэтому в тех случаях, когда у пациента с предположительным ГВС в условиях покоя определяются нормальные значения углекислоты, рекомендуется определение изменений уровня СО2 при различных провокационных тестах. К «золотому стандарту» диагностики ГВС относят пробу с произвольной гипервентиляцией.
Департаментом пульмонологии университета г. Наймиген (Голландия) разработан Наймигенский опросник (Nijmegen questionnaire) для выявления физиологических показателей дизрегуляции вентиляции, сопоставимых с ГВС (табл.). Анкета содержит 16 пунктов, которые оцениваются по 5-балльной шкале (0 — никогда, 4 — очень часто). Минимальные и максимальные достижимые числа — 0 и 64 соответственно.
Данный опросник нашел свое применение прежде всего для скрининг-диагностики ГВС. Существует положение, согласно которому использование данного опросника позволяет корректно предсказывать ГВС в 90% от всех случаев [2, 12].
В последние годы в клиническую практику начинает внедряться понятие «дисфункциональное дыхание» (ДД). Приоритет внедрения термина принадлежит Ван Диксхорну (J. van Dixhoorn), который привел его в работе Hyperventilation and dysfunctional breathing (1997). Основанием для этого явилось понимание, что при функциональных нарушениях дыхания возможны различные изменения паттерна дыхания и значений РCO2, а не только гипокапнические расстройства, характерные для ГВС. ДД может проявляться также быстрым, аритмичным, поверхностным дыханием, частыми вздохами, преобладанием грудного типа дыхания.
Одной из сложных и дискуссионных проблем в пульмонологии является понимание взаимоотношений ГВС, ДД и бронхиальной астмы (БА) [15–18]. С. И. Овчаренко и др. (2002) у 22 из 80 больных БА выявили нарушения дыхания, соответствующие критериям ГВС. Сведений относительно встречаемости дисфункциональных нарушений дыхания при астме немного. Установлено, что среди лиц с диагнозом БА и по крайней мере с одним предписанием антиастматического препарата 29% имеют клинические признаки ДД [19]. Указывается, что ДД может усиливать симптомы БА и приводить к избыточному назначению лекарств.
Достаточно сложным является понимание механизмов развития дисфункциональных расстройств дыхания при БА; существует ряд предположений. К достаточно обоснованным факторам развития гипервентиляции относят тревожные расстройства. Использование больными бронходилататоров (β-2-агонисты, теофиллин), которые обладают эффектами стимуляции дыхания, также относят к факторам развития гипервентиляции. Обсуждается роль изменений перцепции одышки при БА. Анализ существующих проблем взаимосвязи ДД и БА провел M. Morgan (2002), представив следующие ключевые положения:
В зависимости от установления особенностей ДД должна осуществляться и программа лечения больных. При выявлении ГВС релаксирующие методы дыхательной гимнастики проводятся под руководством опытных инструкторов, назначаются β-адреноблокаторы, бензодиазепины [5, 22, 23]. При явлениях гиповентиляции — массаж дыхательных мышц, использование дыхательных тренажеров. Выявление ГВС при БА указывает на необходимость применения методов коррекции функциональных нарушений дыхания. Релаксирующие дыхательные упражнения за счет неспецифических механизмов дыхательного тренинга улучшают качество жизни у этих больных.
По вопросам литературы обращайтесь в редакцию.
В. Н. Абросимов, доктор медицинских наук, профессор
Рязанский ГМУ им. акад. И. П. Павлова, Рязань
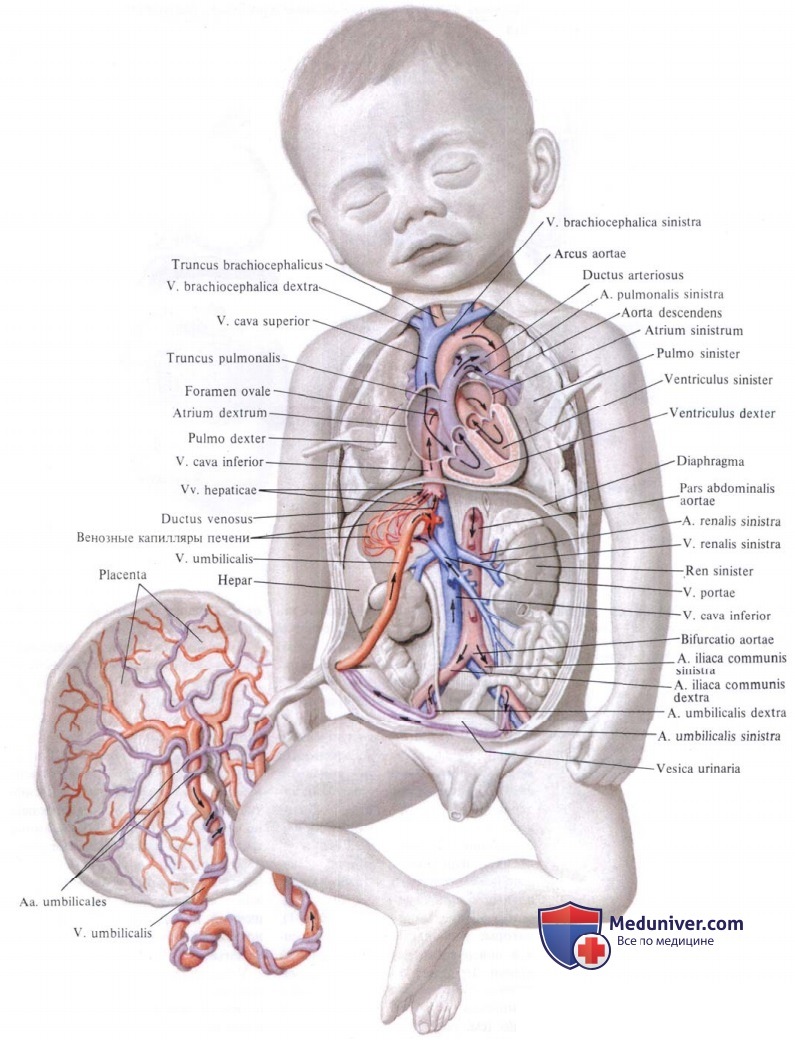
Персистирующее фетальное кровообращение у новорожденных
I. Определение. Персистирующее фетальное кровообращение (ПФК) характеризуется легочной гипертензией, обусловленной вазоконстрикцией в малом круге кровообращения. В свою очередь легочная гипертензия является причиной праволевого шунтирования крови через артериальный проток и овальное окно. Это состояние обычно сохраняется в течение 3—5 дней. Если жизнь ребенка удается спасти в этом остром периоде заболевания, в дальнейшем синдром персистирующего фетального кровообращения, как правило, купируется самостоятельно.
II. Патофизиология. Сразу после рождения происходит последовательный ряд событий, обеспечивающих переход от кровообращения плода к кровообращению взрослого человека. В норме расправляются легкие, снижается легочное сосудистое сопротивление, растет PО2, вызывая констрикцию артериального протока. Системное сосудистое сопротивление увеличивается, происходит функциональное закрытие овального окна. Однако, если во время этого нормального процесса развивается легочная гипертензия, овальное окно и артериальный проток остаются открытыми, так как легочное сосудистое сопротивление превышает системное, обусловливая сброс крови справа налево. В результате развиваются гипоксия и ацидоз, вызывающие прогрессирование вазоконстрикции в легких и легочной гипертензии. Легочная гипертензия, ведущая к развитию у новорожденного синдрома персистирующего фетального кровообращения, может быть вызвана следующими причинами:
A. Легочная вазоконстрикция. Вазоконстрикция и легких может быть результатом гипоксии, ацидоза, преждевременного закрытия артериального протока вследствие приема матерью ингибиторов простагландинсинтетазы, например, аспирина.
Б. Гипоплазия легочного сосудистого русла. Она может быть следствием хронического олигогидрамниона. Чаще всего наблюдается при синдроме Поттера и врожденной диафрагмальной грыже.
B. Обструкция легочного сосудистого русла является следствием полицитемии.
Г. Заболевание сердца. Причиной легочной гипертензии могут быть врожденные пороки сердца или транзиторная дисфункция левого желудочка.
Д. Патологические изменения гладких мышц сосудистой стенки легочных артерий. Патологическая маскуляризация и гипертрофия мышечного слоя сосудистой стенки артерий могут быть результатом внутриутробной гипоксии или дистресса плода, а также отклонений в его развитии.
Е. Гуморальные факторы. Тромбоксан A2, являющийся мощным легочным вазоконстриктором и продуктом липоксигеназного пути метаболизма арахидоновой кислоты, может способствовать развитию легочной гипертензии.
III. Факторы риска. Высокий риск развития персистирующего фетального кровообращения наблюдается при следующих состояниях:
A. Заболевание легких или аспирация мекония. Заболевания легких являются причиной гипоксемии.
Б. Диафрагмальная грыжа. Диафрагмальная грыжа обусловливает гипоплазию сосудистого русла легких, увеличение легочного сосудистого сопротивления и легочную гипертензию.
B. Гестационный возраст. Мышечный слой в легочных артериолах формируется в последние недели беременности. Это приводит к уменьшению общей площади поперечного сечения легочного сосудистого русла с последующим увеличением сопротивления кровотоку, обусловливающему персистирующую легочную гипертензию.
Г. Гипоксия и ацидоз. Гипоксия и ацидоз могут быть следствием асфиксии в родах (о чем свидетельствует низкая оценка по шкале Апгар) и вызывают развитие легочной гипертензии.
Д. Дистресс плода. Внутриутробный дистресс плода, проявляющийся урежением сердцебиений перед его рождением, ведет к развитию гипоксии и ацидоза.
Е. Новорожденный от матери с сахарным диабетом. У новорожденных от матерей с сахарным диабетом часто наблюдается полицитемия. Она может вызывать обструкцию легочного сосудистого русла, ведя к синдрому персистирующего фетального кровообращения. Заболевания легких также чаще встречаются в этой группе детей.
Ж. Сепсис. У новорожденных с сепсисом нередко развивается тяжелый метаболический ацидоз, вызывающий спазм сосудов легких.
З. Повторное плановое кесарево сечение. Самопроизвольные роды являются фактором, стимулирующим снижение легочного сосудистого сопротивления, всасывание жидкости из легких, их созревание и высвобождение из пневмоцитов сурфактанта. Если самопроизвольные роды заменяются кесаревым сечением, этот механизм нарушается, приводя к легочной гипертензии.
И. Гипокальциемия или гипогликемия. Эти нарушения обусловливают снижение сердечного выброса, следствием чего являются гипоксия и ацидоз.
IV. Клинические данные
А. Симптомы и признаки. Для оценки тяжести заболевания и принятия решения о выборе тактики лечения удобно пользоваться классификацией заболевания по стадиям, принятой в медицинском центре университета Кентукки.
1. Стадия 1 (новорожденные, угрожаемые по развитию синдрома персистирующего фетального кровообращения)
а. Растет альвеолярно-артериальный градиент по кислороду и повышается риск развития у ребенка ПФК. В этом случае проводят тщательное наблюдение.
б. Необходим динамический контроль газов крови.
в. Альвеолярно-артериальный градиент (в норме обычно не превышает 20 мм рт. ст.) рассчитывают следующим образом:
(7 х FiO2) — (РCO2 + PO2).
а. Альвеолярно-артериальный градиент по кислороду превышает 250 мм рт. ст.
б. Отмечается выраженная лабильность показателей газов крови (во время пеленания, забора крови, возбуждения, крика и нарастания двигательной активности ребенка, а также в ответ на действие громкого шума, появляется цианоз и падают показатели транскутанного монитора или пульсоксиметра). Прекратить проведение оксигенотерапии невозможно из-за нестабильного клинического состояния ребенка,
в. Вследствие высокого альвеолярно-артериального градиента показано проведение механической вентиляции легких.
а. Альвеолярно-артериальный градиент по кислороду превышает 500 мм рт. ст.
б. Выраженная лабильность оксигенации крови ведет к персистирующему цианозу.
в. Обычно возникают трудности в поддержании адекватного объема циркулирующей крови.
г. Трудно поддерживать уровень PO2 более 60 мм рт. ст.
д. Периодически возникающий цианоз в конечном итоге сменяется персистирующим цианозом.
е. Даже при постоянной инфузии коллоидных растворов с трудом удается поддерживать нормальное центральное венозное давление и системное артериальное давление. Диурез снижен.
а. Альвеолярно-артериальный градиент превышает 600 мм рт. ст.
б. Очень трудно поддерживать PO2 выше 40 мм рт. ст.
в. Центральное венозное давление и системное артериальное давление низкие.
5. Стадия 5. Это терминальная стадия персистирующего фетального кровообращения. Предложено много схем лечения, но эффективность их невысока.
а. Альвеолярно-артериальный градиент превышает 625 мм рт. ст.
б. Выражена стойкая гипоксия (PO2 менее 40 мм рт. ст.).
в. Отмечается стойкая ацидемия (pH менее 7,25).
Б. Лабораторные исследования. У больного с подозрением на синдром персистирующего фетального кровообращения необходимо тщательно контролировать следующие показатели:
1. Уровень общего и ионизированного кальция. Гипокальциемия (если она имеется) может вызвать снижение сердечного выброса и нарастание гипоксии.
2. Уровень глюкозы в сыворотке крови. Гипогликемия также усугубляет гипоксию за счет снижения сердечного выброса.
3. Газы артериальной крови. Тщательный мониторинг газов артериальной крови необходим для расчета альвеолярно-артериального градиента по кислороду, выявления метаболического ацидоза, гиперкапнии или гипоксии.
В. Рентгенография. Рентгенография позволяет выявить поражение легких. Часто говорят о том, что при ПФК потребность в кислороде не соответствует тяжести поражения легких поданным рентгенографии грудной клетки. Изменения на рентгенограмме включают признаки пневмонии, синдрома утечки воздуха из легких (пневмоторакса, интерстициальной эмфиземы, пневмомедиастинума, пневмоперикарда) или отек легких. Ho изменения легких на рентгенограмме могут быть и не видны.
Г. Эхокардиография. Эхокардиография необходима для исключения врожденного порока сердца синего типа. После того как диагноз врожденного порока сердца исключен, эхокардиография теряет свою диагностическую ценность для выявления персистирующего фетального кровообращения, так как изменения на эхокардиограмме может не быть. К признакам ПФК, которые могут выявляться на эхокардиограмме, относятся правожелудочковая недостаточность со снижением сократимости миокарда и дилатацией правого желудочка.
Д. Дифференциальная оксиметрия. Оксиметрия помогает выявить праволевый шунт крови, свидетельствующий о наличии у ребенка персистирующего фетального кровообращения. Используют два транскутанных оксиметра. Один датчик фиксируют в верхней правой части грудной клетки (предпротоковый датчик), второй — в нижней левой части живота (послепротоковый датчик). Если разница показаний оксиметров превышает 10 мм рт. ст., следует предположить наличие праволевого шунта крови через артериальный проток.
V. Лечение
А. Медикаментозная терапия.
1. Жидкости и электролиты. Для поддержания адекватного сердечного выброса необходимо обеспечивать нормальный уровень глюкозы и кальция в сыворотке крови. Требуется частое введение щелочей с целью коррекции pH, так как ацидоз является главной причиной вазоконстрикции в легких. Решение об использовании гидрокарбоната натрия или трометамина (Tham) зависит от уровня электролитов в сыворотке крови, функции легких и диуреза.
2. Седативные препараты. Седативная терапия часто используется у новорожденных с выраженным возбуждением ЦНС и «борющихся» с респиратором. Хороший седативный эффект и уменьшение частоты развития синдрома утечки воздуха из легких дает введение фенобарбитала.
3. Миорелаксанты. Миорелаксанты применяют у новорожденных, не реагирующих на седативную терапию, остающихся возбужденными и не синхронизирующихся с респиратором. Наиболее широко применяют панкуроний (павулон), так как он не оказывает гипотензивного действия, свойственного тубокурарину.
4. Растворы для восполнения объема циркулирующей крови. Артериальное давление необходимо поддерживать частым введением коллоидов: свежезамороженной плазмы, белковой фракции плазмы (плаз-манат) или цельной крови в зависимости от уровня гематокрита. При низком гематокрите применяйте цельную кровь, при высоком — коллоидные препараты, названные выше. Поддержание нормального артериального давления обеспечивает увеличение системного сосудистого сопротивления, что может способствовать уменьшению праволевого шунта.
5. Прессорные агенты. Когда не удается поддерживать нормальное артериальное давление и есть подозрение на снижение почечного кровотока, применяют допамин (интропин). Соблюдайте осторожность при использовании допамина, так как в экспериментах на животных было показано, что он может повышать сосудистое сопротивление в легких, а это может способствовать увеличению праволевого шунта.
6. Легочные вазодилататоры. Толазолин (присколин), блокатор альфа-адренергических рецепторов, применяют только в тех случаях, когда трудно поддерживать адекватный уровень оксигенации. Считают, что он вызывает дилатацию сосудов легких. Сначала, как правило, вводят пробную дозу. Если отмечается улучшение оксигенации (обычно более чем на 10—25 мм рт. ст.), начинают непрерывное введение препарата.
Б. Механическая вентиляция легких
1. Показаниями к механической вентиляции легких являются альвеолярно-артериальный градиент по кислороду более 250 мм рт. ст. и неспособность ребенка самостоятельно поддерживать адекватную вентиляцию. Главная цель — обеспечить эффективную вентиляцию легких, используя возможно минимальное среднее давление в дыхательных путях. Уровни газов крови во время механической вентиляции легких будут идеальными, если поддерживаются следующие параметры: pH 7,4—7,5; РСО2 25—30 мм рт. ст.; PО2 более 50 мм рт. ст.
2. Высокочастотную вентиляцию легких можно использовать для обеспечения гипервентиляции и поддержания критического уровня РСО2 (следствием чего является расширение легочных артерий и повышение P(S2). У разных больных критический уровень РСО2 бывает различным, составляя приблизительно 15—25 мм рт. ст.
3. Синдром утечки воздуха из легких является частым осложнением механической вентиляции с применением высокого среднего давления в дыхательных путях. Необходимо внимательно следить за появлением признаков пневмоторакса и других разновидностей баротравмы легких.
4. Вентиляция с помощью мешка-маски с различными значениями частоты и давления на вдохе может оказаться полезной для определения оптимальных параметров механической вентиляции легких. Новорожденные с персистирующим фетальным кровообращением обычно хорошо реагируют на этот тест.
В. Экстракорпоральная мембранная оксигенация (ЭКМО) ЭКМО в настоящее время применяют только в нескольких клиниках. Ее рекомендуют проводить новорожденным не старше 7 дней жизни с гестационным возрастом более 34 нед и массой тела свыше 2 кг. Для выполнения операции требуется канюляция внутренней яремной вены и общей сонной артерии, а также использование аппарата искусственного кровообращения. Пока еще ограниченный опыт применения ЭКМО представляется обнадеживающим.