Car t клеточная терапия в россии
Car t клеточная терапия в россии
CAR-T, деньги и стволы: кто первым легализует в России перспективный метод лечения рака крови
С июня 2021 года в отделе онкоиммунологии НМИЦ онкологии им. Н.Н. Петрова в тестовом режиме работает производство аутологичных T-клеток с химерными антигенными рецепторами (ТН T-CAR-19). Суть метода такова: собственные T-лимфоциты пациента генетически модифицируют путем введения искусственного гена, кодирующего химерный антигенный рецептор. Этот рецептор взаимодействует с белком, который содержится на поверхности опухолевых клеток. Затем такие клетки «размножают» in vitro и вводят пациенту. В США, Европе и других развитых странах CAR-T-терапия одобрена и применяется для лечения рецидивирующего или рефрактерного острого лимфобластного лейкоза у детей и молодых людей, диффузной крупноклеточной B-клеточной лимфомы и множественной миеломы у взрослых.
В России в настоящее время метод применяется только в НМИЦ ДГОИ им. Дмитрия Рогачева в экспериментальном формате – изготовление CAR-T проводится за счет благотворителей, а пребывание в стационаре оплачивается как госзадание. Всего, уточнили в НМИЦ, к августу 2021 года такое лечение прошли более 60 пациентов, у 90% из них наступила ремиссия, а у 50% пациентов, которым также была выполнена трансплантация гемопоэтических стволовых клеток, стойкая ремиссия наблюдается уже в течение двух лет. При этом центру удалось начать работу без лицензирования своей лаборатории в соответствии с требованиями 180-ФЗ «О биомедицинских клеточных продуктах». Пациенты получают лечение каждый раз по решению врачебного консилиума, когда уже исчерпаны другие возможности, рассказал Vademecum замгендиректора Института молекулярной и экспериментальной медицины НМИЦ ДГОИ им. Дмитрия Рогачева Михаил Масчан.
Работа по реконструкции лаборатории НМИЦ онкологии им. Н.Н. Петрова под требования закона о БМКП сейчас ведется, сообщила Vademecum руководитель отдела онкоиммунологии центра Ирина Балдуева. На эти цели, по ее словам, по минимальным расчетам потребуется 22,5 млн рублей. Контракт на создание рабочей документации стоимостью 2 млн рублей уже заключен. Ожидается, что подать заявку на лицензирование производства НМИЦ сможет в июне 2022 года, а затем уже заняться лицензированием своего продукта. Пока питерский центр, как и НМИЦ ДГОИ, использует для модификации T-клеток вирусный вектор от немецкой Miltenyi Biotec. В дальнейшем планируется разработка собственного вектора, говорит Балдуева.
Профильную активность НМИЦ им. Н.Н. Петрова ограничивает не только жесткое законодательство, но и скромные мощности собственной лаборатории: в месяц там можно произвести три CAR-T-продукта. Это, по словам Ирины Балдуевой, один из главных минусов локального производства CAR-T в «академических» лабораториях, в отличие от площадок Big Pharma. «Централизованное производство обеспечивает высокое качество, такому производству легче соответствовать требованиям регулятора, его проще контролировать, – отмечает эксперт. – Но здесь есть свои минусы – сложности с логистикой, отложенный во времени момент введения препарата, тогда как в процессе ожидания состояние пациента может ухудшиться».
В НМИЦ ДГОИ им. Дмитрия Рогачева с 2019 года готовят досье для лицензирования – по словам Масчана, документы должны попасть в Минздрав нынешней осенью. Однако мощность локальной лаборатории также будет невысокой – лечить здесь и дальше планируют максимум четырех пациентов в месяц. «Наша цель – полностью вывести КИ в легальное поле. У нас нет продукта, который мы хотели и могли бы коммерциализировать. А продукт, на который у нас нет интеллектуальных прав, мы зарегистрировать не можем, – объясняет Михаил Масчан. – Miltenyi Biotec, насколько мне известно, не собиралась предоставлять лицензию на свою технологию. Я считаю, что академический центр должен либо получить такую лицензию, либо создать продукт самостоятельно, что мне кажется целью почти недостижимой. Поэтому оптимальный формат для академических центров – клинические испытания».
На своей базе CAR-T планировали внедрять и частные медицинские операторы, однако в практике далеко не продвинулись. В Hadassah Medical Skolkovo анонсировали организацию отделения CAR-T-терапии в терапевтическом корпусе, запуск которого намечен на 2021 год. Пока клиника только рекрутирует пациентов для участия в КИ CAR-T-технологии лечения множественной миеломы в иерусалимском подразделении Hadassah – в России на платной основе проводится диагностика, а терапия финансируется организатором КИ. Претендовать на участие в исследованиях могут пациенты с рецидивом, развившимся после трех линий лекарственной противоопухолевой терапии. Число россиян, принявших участие в КИ, в клинике не раскрывают.
Как пояснили Vademecum в Hadassah Medical Skolkovo, организация собственной лаборатории по подготовке T-клеток сопряжена с сертификацией по правилам GMP и получением разрешения Минздрава, после чего можно будет проводить КИ в России. В «Мать и дитя» не конкретизировали сроки внедрения технологии в свою практику, но сообщили, что планы сохраняются и, более того, рассматривается возможность применения CAR-T для лечения солидных опухолей. Впрочем, среди более 280 профильных КИ в мире испытания для солидных опухолей единичны и находятся на I фазе. Кроме того, в этих КИ, например, при метастатическом раке почки, обнаружилась серьезная токсичность.
Ближе всех к коммерческому рынку CAR-T в России пока только разработчик оригинального продукта – Novartis. Компания в июне 2021 года подала досье на регистрацию препарата по правилам Евразийского экономического союза (ЕАЭС). И тут есть нюансы: представители Novartis долго обсуждали с регуляторами, как соблюсти при выводе препарата на российский рынок требования закона о БМКП и требования на уровне ЕАЭС. В результате tisaglenlecleucel будет зарегистрирован как «высокотехнологический» лекарственный препарат (такое понятие есть в Правилах регистрации и экспертизы лекарственных средств), к которым относятся генотерапевтические средства и препараты на основе соматических клеток. В Novartis ожидают регистрацию tisaglenlecleucel до конца 2022 года, сообщили Vademecum в компании, следом будет определена стоимость препарата.
Отечественные фармкомпании, обладающие достаточными для развертывания производства CAR-T средствами и мощностями, тоже начинали подобные проекты, но реализовать их пока не сподобились. Еще в мае 2018 года на Петербургском международном экономическом форуме «Биокад» подписал соглашение с НМИЦ им. В.А. Алмазова об исследованиях в сфере лечения онкозаболеваний с помощью CAR-T. Гендиректор компании Дмитрий Морозов обещал, что стоимость продукта от «Биокада» будет вдвое ниже импортных аналогов – 16 млн рублей. Такие же договоренности были у «Р-Фарм» с ПМГМУ им. И.М. Сеченова, подписавших соглашение о партнерстве на том же ПМЭФ-2018.
«Биокад» закрыл проект, сообщил Vademecum Дмитрий Морозов: «Во-первых, законодательство предполагает, что компания должна сначала инвестировать в производство, а это существенные средства, и лишь потом переходить к клиническим испытаниям продукта. А может быть, он не работает? А может быть, у нас недостаточно эффективные научные обоснования для создания этого продукта? А второе – абсолютная неготовность системы здравоохранения платить за такие типы препаратов, потому что считается, что такие процедуры можно делать по цене реактивов. При требуемом объеме инвестиций индустриальные игроки тут не могут конкурировать с предложением «академических» лабораторий. Но у них – минимальный объем и в основном исследовательский процесс».
В «Р-Фарм» от комментариев по поводу CAR-T отказались.
В России применили CAR-T в первой линии терапии взрослого пациента
Как рассказали в НМИЦ гематологии, 68-летний пациент поступил с коморбидностью и был оперативно направлен в реанимацию. «Мы обнаружили 1,5 млн лейкоцитов при нормальных значениях от 5 до 8 тысяч мкл. Так как это жизнеугрожающая ситуация, пациента сразу госпитализировали, очень быстро выполнили обследование, диагностировали лимфому из клеток мантийной зоны, так называемый бластоидный вариант, – это крайне агрессивное течение. В дальнейшем нашли генетические поломки, связанные с абсолютной резистентностью к стандартной химиотерапии», – рассказал заведующий отделением интенсивной высокодозной химиотерапии лимфом НМИЦ гематологии Евгений Звонков.
У пациента была выявлена мутация в гене ТР53, поэтому сначала была проведена таргетная терапия ибрутинибом и венетоклаксом. «Практически через неделю от опухоли практически ничего не осталось, вместо 1,5 млн лейкоцитов стало 700, а селезенка, размер которой был 30 см, стала нормальной, восстановились тромбоциты и гемоглобин. Мы решили обратиться в Центр Рогачева и применить CAR-T-клеточную терапию в качестве консолидации – закрепления эффекта», – пояснил Звонков.
Это стало возможным, потому что в НМИЦ ДГОИ уже несколько лет проводится CAR-T-терапия детей с лимфобластным лейкозом и В-клеточной лимфомой (пролечено более 60 пациентов). Использовать метод для взрослых пациентов намерены в НМИЦ онкологии им. Н.Н. Петрова. Кроме того, пока на этапе научного изыскания находится применение CAR-T для терапии солидной опухоли – рака яичников. В НМИЦ гематологии считают, что этот случай может стать началом выхода в ниши, где CAR-T может быть максимально эффективным методом, так как на третьей и четвертой линиях терапии T-клетки уже значительно повреждены предыдущими курсами химиотерапевтического лечения.
Этот тезис подтверждается клиническим исследованием ZUMA-12, которое проводится компанией Gilead. Промежуточные результаты свидетельствуют, что использование Yescarta (axicabtagene ciloleucel) при крупноклеточной В-клеточной лимфоме высокого риска позволяет достигать объективного ответа у 85% пациентов. Пока препарат одобрен FDA для лечения взрослых пациентов с рецидивирующей или рефрактерной крупноклеточной В-клеточной лимфомой после двух или более линий терапии.
Помимо «академических» CAR-T-продуктов, то есть полученных и применяемых в пределах научной медорганизации, есть и коммерческие. В России ни один такой препарат пока не зарегистрирован. Компания Novartis в июне 2021 года подала досье на регистрацию Kymriah по правилам Евразийского экономического союза. Озвучивались планы выхода на российский рынок разработки J&J, которая недавно была зарегистрирована для терапии множественной миеломы в США.
CAR-T терапия: как стать доступной в России?
Современная медицина все активнее использует достижения биотехнологии и клеточной биологии для обеспечения не только большей продолжительности жизни, но и улучшения ее качества. Однако зачастую от успехов фундаментальной науки, в частности, экспериментальной онкологии и онкоиммунологии, до клинической практики очень большое расстояние. Многие семьи в России, столкнувшись со страшным диагнозом «онкология», отказываются считать его приговором и очень ждут доступных научных разработок, современной качественной медицинской помощи и терапии.
Одним из перспективных направлений в терапии онкологии является иммунотерапия. Она основана на том факте, что наша собственная иммунная система обладает всем необходимым, чтобы предотвращать развитие онкологических заболеваний. Ее ослабление – временное или хроническое – может приводить к сбою противоопухолевого контроля. Таким образом, целью иммунотерапии является использование иммунных клеток человека для уничтожения опухолевых клеток. Однако запуск или «перезапуск» угнетенного противоопухолевого иммунитета, как правило, требует серьезных, высокотехнологичных и дорогостоящих манипуляций с клетками.
Клеточная иммунотерапия, в том числе недавно утвержденные FDA препараты CAR-T, ингибиторы контрольных точек иммунитета и цитокиновая терапия, — это самые передовые подходы терапии онкологических заболеваний. CAR-T терапия при этом одна из самых перспективных и эффективных. Ее принцип прост: из крови человека можно выделить Т-лимфоциты, размножить и генетически модифицировать их так, чтобы они начали «узнавать» опухоль, а затем вернуть их пациенту в виде инфузии уже биомедицинского клеточного препарата (БМКП). Такой БМКП самостоятельно найдет и уничтожит опухоль.
Хранение образцов лимфоцитов в жидком азоте
С конца 2014 года научный сотрудник Центра Алмазова Алексей Петухов и его коллеги успешно проводят лабораторное получение и тестирование противоопухолевых генетически модифицированных Т-клеток человека (CAR-T). Работа ведется как в фундаментальном направлении, так и в практическом для разработки отечественного доступного CAR-T препарата. Главная цель молодых ученых Центра Алмазова — осуществить переход от слов к делу, не концентрироваться лишь на фундаментальной науке и сделать доступными свои разработки для онкологических больных.
В России сейчас несколько компаний и академических институтов находятся на стадии разработки собственных CAR-T продуктов. Кроме того, деятельность лидера продукции CAR-T, компании Novartis, в данном направлении на территории Российской Федерации также остается вероятной. Несмотря на это и появление зарегистрированного CAR-T препарата в мире еще в 2017 году, CAR-T терапия по-прежнему практически недоступна для граждан Российской Федерации.
В НМИЦ им. В. А. Алмазова лабораторное получение и тестирование противоопухолевых генетически модифицированных Т-клеток человека (CAR-T) проводят с 2014 года
Национальный медицинский исследовательский центр имени В. А. Алмазова (Санкт-Петербург) работает в нескольких направлениях в области CAR-T: экспериментальное GMP-производство и собственный патентный портфель; новые варианты антиCD19 CAR; CAR для солидных опухолей; аллогенные CAR-T; снижение стоимости CAR-T технологий и создание CAR-T для борьбы с неонкологическими заболеваниями; разработка технологии получения CAR-Т без культивирования ex vivo; использование генетического редактирования для терапии онкологических заболеваний; проведение фундаментальных исследований.
Добиться наиболее полной реализации этих направлений и помочь исправить ситуацию в стране с доступностью высокотехнологичной медицины для онкологических больных можно, только объединив усилия различных специалистов: медиков, биологов, инженеров, биотехнологов, генетиков, биоинформатиков, — и сделать это можно в условиях адекватно финансируемых центров геномных исследований мирового уровня. Несколько таких центров будет создано в России в рамках национального проекта «Наука» и федеральной научно-технической программой развития генетических технологий на 2019—2027 годы. НМИЦ им. В. А. Алмазова готовится стать базовым для создания и развития такого центра вместе с партнерами по консорциуму «Трансляционная медицина» — и это возможно в случае победы в конкурсе Министерства науки и высшего образования РФ. Особая ставка при этом будет сделана на привлечение молодого поколения научных сотрудников и врачей, нацеленных на блестящие результаты у себя дома, а не за границей.
«Из вышеназванных направлений, — рассказал Алексей Петухов, — на наш взгляд, сегодня самое перспективное — получение аллогенных CAR-T против онкогематологических заболеваний. Аллогенные CAR-T представляют собой стандартизированный БМКП в 10-100 раз меньше по стоимости, чем аутологичный продукт (то, что сейчас используется как зарегистрированные препараты). Стандартизированный продукт подходит любому пациенту с показаниями применения данного вида терапии и не требует 2-3 недель продукции. Аллогенные CAR-T, прежде всего, делают терапию широкодоступной, сохраняя ее эффективность и безопасность». В плане развития иммунотерапевтических подходов для пациентов с солидными опухолями, в Центре Алмазова ведутся исследования CAR-T терапии рака легкого, рака молочной железы, рака шейки матки и др.
При этом для успешной реализации начатых проектов, кроме научных изысканий, основное внимание сотрудниками Центра Алмазова уделяется формированию технологической цепочки производства компонентов CAR-T препарата, в том числе получению векторов для генетической модификации Т-клеток, которые в настоящее время являются наиболее дорогостоящим и сложно получаемым компонентом процедуры.
Уникальные особенности Центра – это прямое общение врачей и ученых, четкое понимание, зачем делать те или иные шаги в научной работе, ориентированность исследований на нужды пациентов. Мировой статус клинического и исследовательского учреждения будет способствовать активному развитию CAR-T технологии, ее широкой доступности и практической применимости.
Иван Моисеев, НИИ им. Горбачевой — о том, как в России создают и тестируют новые терапии против рака
Взрослые пациенты с рецидивирующими B-клеточными лимфомами еще до недавнего времени относились к категории практически безнадежно больных. Но в Петербурге в 2022 стартует программа терапии с помощью CAR-T-клеток: когда собственные клетки человека после генной модификации способны уничтожить опухоль. Этот подход может спасти жизни тысячи людей ежегодно. «Хайтек» вместе с благотворительным фондом AdVita поговорил с Иваном Моисеевым, заместителем директора по научной работе НИИ детской онкологии, гематологии и трансплантологии им. Р. М. Горбачевой, о том, как устроена разработка новых методик лечения онкологических заболеваний, кто в России это финансирует и как устроена CAR-T-терапия.
Читайте «Хайтек» в
Иван Сергеевич Моисеев окончил Первый Санкт-Петербургский государственный медицинский университет им. И.П. Павлова в 2007 году. В 2010 году получил специализацию по гематологии на кафедре факультетской терапии и был принят в качестве врача-гематолога и аспиранта в НИИ онкологии, гематологии и трансплантологии имени Р. М. Горбачевой. В 2013 году защитил кандидатскую диссертацию по теме микрососудистых осложнений после трансплантации гемопоэтических стволовых клеток.
С 2013 года научные интересы сосредоточены на снижении летальности от осложнений трансплантации гемопоэтических клеток и реакции «трансплантат против хозяина». С 2015 года стал руководителем отдела гематологии и трансплантации для взрослых в НИИ ДОГиТ им. Р. М. Горбачевой. С 2017 работает в должности заместителя директора по науке НИИ ДОГиТ им. Р. М. Горбачевой. В 2019 году защитил докторскую диссертацию по теме профилактики и лечения реакции «трансплантат против хозяина». С 2021 года — профессор кафедры онкологии, гематологии и трансплантологии в университете им. И.П. Павлова.
Автор и соавтор более 100 публикаций, освещающих различные аспекты клинической гематологии и трансплантации гемопоэтических стволовых клеток. Является активным членом Европейской Ассоциации по Трансплантации Костного Мозга (EBMT) и секретарем рабочей группы по трансплантационным осложнениям.
«CAR-T применяется в тех ситуациях, когда альтернативы нет»
— В НИИ им. Горбачевой начинают внедрение нового вида терапии против онкологических заболеваний — CAR-T. Расскажите, в чем ее суть и для каких диагнозов она применяется?
— Мы прошли все валидационные этапы, и в этом году начинается клиническая апробация методики — лечение пациентов мы будем проводить в рамках совместного проекта с НМИЦ онкологии им. Н.Н. Петрова.
Технология основана на генетически модифицированных клетках самого пациента. Генетическая модификация включает в себя соединение одного белка от B-клеток человека и второго белка от T-клеток человека, а также дополнительно усиливающего белка. В природе такой тройной конструкции не существует.
Впервые эта технология была разработана в Израиле еще в начале 90-х годов, но клиническое применение нашла только в последние пять лет, потому что ключевым фактором стало наличие этого усиливающего сигнал белка, это позволило Т-клеткам заработать на полную мощность. Все остальные модификации до этого были клинически не очень эффективны.
Проблема с этой терапией заключается в том, что Т-клетки, направленные против мишени, убивают целевую клетку в любом случае, даже если она нормальная и опасна только потенциально. Поэтому ограничением этой терапии на сегодняшний день является так называемый оффтаргет-эффект, когда возникает нейротоксичность в отношении нормальных тканей пациента. И здесь как раз выделяются именно B-клеточные опухоли — лейкозы и лимфомы, потому что даже если препарат уничтожит все B-клетки пациента, пациент сможет это пережить (помогут переливания крови и иммуноглобулины) и восстановиться уже здоровыми клетками.
Если говорить о солидных опухолях — например, раке желудочно-кишечного тракта, то эпителиальные клетки у человека встречаются везде. И если таргетный препарат нападет на все эпителиальные клетки организма, выльется это в токсический шок. Поэтому на сегодняшний день существует достаточно узкий спектр мишеней, при котором это возможно для текущей технологии.
Солидные опухоли — твердое четко ограниченное разрастание из собственной зрелой (дифференцированный) ткани или незрелой (зачаточный, недифференцированный) ткани. Могут появиться в любом из внутренних органов или в системах органов. Бывают доброкачественными и злокачественными.
Гемобластозы — опухолевые (неопластические) заболевания кроветворной и лимфатической ткани. Подразделяют на системные заболевания — лейкозы, а также регионарные — лимфомы.
— Для каких пациентов будет применяться это лечение?
— Наш первый этап проекта связан со взрослыми пациентами. Для детей на сегодняшний день терапия применяется в институте Димы Рогачева в Москве (НМИЦ ДГОИ им. Дмитрия Рогачева — «Хайтек»).
— Каким образом терапия вводится в организм — это инъекции, таблетка или что?
— Это небольшой пакетик для внутривенной инфузии, который обычно содержит около 100–200 миллилитров суспензии этих клеток и вводится внутривенно.
— И это разовая процедура?
— Есть описание повторных применений клеток, но они пока достаточно ограничены.
— Как повышаются шансы на успешный результат лечения при этой терапии, как меняется выживаемость пациентов?
— Терапия CAR-T применяется в тех ситуациях, когда альтернативы нет. То есть для ситуаций рецидивов и рефрактерных заболеваний. Когда другого способа получить эффект уже не существует. Поэтому с точки зрения достижения уменьшения опухолевой массы это практически жизнеспасающий метод для части пациентов, у которых как раз наблюдаются эти формы злокачественных образований. С другой стороны, сейчас уже известно, что, по крайней мере, второе поколение CAR-T-клеток требует последующего закрепления эффекта с помощью трансплантации костного мозга.
Рефрактерная форма заболевания — форма заболевания, не поддающаяся лечению (в онкологии и гематологии чаще всего имеется в виду нечувствительность к химиотерапии).
— То есть для пациентов, которым в ближайшем будущем станет назначаться этот метод, это уже последняя надежда?
— Да, фактически это так. Но нельзя сказать, что это полностью безопасный метод. Поэтому и применяется он только в тех ситуациях, когда нет других более безопасных альтернатив лечения.
— Вы уже упомянули про осложнения: как с ними будут бороться и существует ли уже соответствующая терапия?
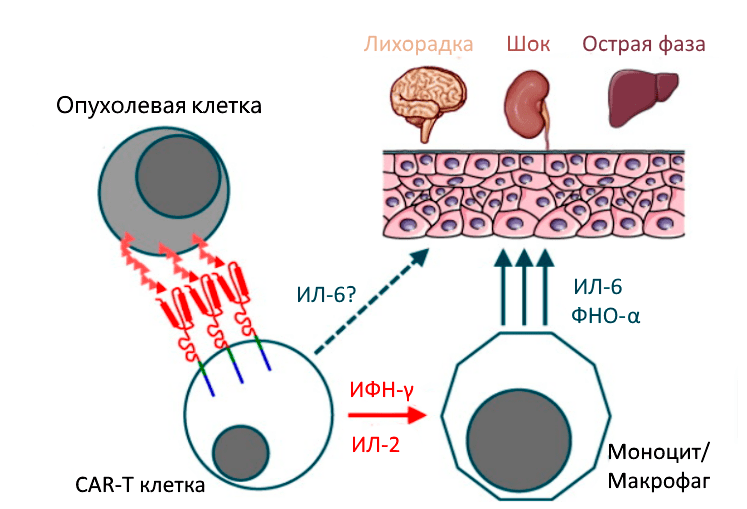
— Нейротоксичность — не единственное осложнение терапии генно-модифицированными клетками. Существует также синдром выброса цитокинов — сейчас с приходом COVID-19 практически все знают про этот синдром. Но вообще сам термин появился в контексте клинических исследований CAR-T-клеток. До этого считалось, что это просто лихорадка, совокупность токсичности. Как отдельный синдром его выделили после того, как начались исследования CAR-T-клеток. Была выявлена четкая связь с введением клеток, сроки возникновения этих симптомов были всегда одинаковые, а симптомы имели определенный спектр.
Синдром выброса цитокинов (СВЦ) — это комплекс симптомов, которые могут развиться как побочный эффект определенных видов иммунотерапии, особенно при задействовании Т-лимфоцитов. Синдром возникает, когда иммунные клетки активируются и выбрасывают в организм значительное количество цитокинов.
Цитокины — это малые белки, работающие в качестве клеточных мессенджеров и направляющие иммунный ответ организма. Однако высокие уровни цитокинов могут спровоцировать повышенный воспалительный ответ в организме. Он может нанести вред и нарушить целый ряд функций организма. В тяжелых случаях СВЦ может привести к полиорганной недостаточности и даже смерти.
Нейротоксичность — это частный вариант синдром выброса цитокинов, при котором основой всех жизнеугрожающих проблем является увеличение проницаемости сосудов за счет избыточной продукции различных белков (вызывающих повышенный воспалительный ответ в организме) этими генно-модифицированные клетками. Конечным итогом является то, что увеличивается сосудистая проницаемость и жидкость из кровеносных сосудов переходит в органы, возникает отек, в частности отек головного мозга. Такие проблемы есть у 50–80% пациентов, в зависимости от того варианта CAR-T-клеточного конструкта, который используется в терапии. Уже есть международные рекомендации по лечению этого синдрома, определена последовательность действий для данного осложнения. В принципе, эта ситуация достаточно хорошо отработана.
«Лечение тысячи пациентов в год — четверть бюджета Петербурга на здравоохранение»
— Сколько стоит эта процедура для пациента и кто вообще это сейчас финансирует?
— На сегодняшний день в России не зарегистрировано ни одного продукта CAR-T-клеточной терапии. Предварительная оценка стоимости первого продукта, который сейчас готовит к регистрации в России иностранный производитель, — 21 млн рублей. Естественно, что никаких финансовых инструментов для того, чтобы обеспечить такое дорогостоящее лечение, пока не существует. Та программа, которая планируется у нас, это этап академического исследования, это не коммерческий продукт.
Альтернатива заводскому производству — производство CAR-T в специализированных лабораториях. По этому пути, например, пошли некоторые европейские страны, у которых нет средств платить за заводское производство. Клетки, созданные в рамках таких проектов, стоят примерно в 10 раз дешевле заводских.
Сомневаюсь, что мы получим бюджет, сопоставимый с тем, какой тратят на заводские CAR-T в США и некоторых европейских странах. Скорее всего, нам больше подходит именно вариант производства клеток в специально сертифицированных лабораториях — например, как в Испании, где разработали и применяют некоммерческий и локального производства вариант этой терапии.
Поэтому мы очень надеемся в том числе и на поддержку благотворителей для того, чтобы поддержать это исследование и обеспечить расходными материалами. В случае нашего проекта пациент не будет платить, но, с другой стороны, и государственные источники финансирования здесь невозможно привлечь из-за того, что это незарегистрированные технологии, а многие расходные материалы для производства не имеют государственной регистрации для медицинского применения.
— А если говорить о гипотетическом будущем: есть ли шанс, что государство будет как-то субсидировать для пациентов этот вид терапии?
— По-видимому, со временем появится ограниченное число квот. Но за счет существующего бюджета здравоохранения покрыть потребность для всех пациентов невозможно. К какому-то из совещаний я подсчитал, какой объем по текущим ценам потребуется. Если покупать по ценам заводских производителей, это четверть годового бюджета Петербурга на здравоохранение. Если будет принято решение о локальном производстве в специальных лабораториях — тогда да, эта терапия будет доступна для всех нуждающихся: лечение требуется примерно тысяче пациентов в год.
— Вы сказали: «тысяча пациентов в год». Это и взрослые, и дети?
— Да, дети и взрослые, но больше все-таки взрослых пациентов. Потому что лечение этих групп заболеваний у детей более эффективно, чем у взрослых. На стандартном лечении они имеют большую вероятность вылечиться полностью, а у взрослых, из-за другой биологии опухоли, вероятность полного излечения от первоначальных видов терапии существенно меньше.
«Таргетная терапия может быть менее эффективна, чем классическая химиотерапия»
— Если говорить в целом о видах терапии против онкологических заболеваний. Отходит ли сейчас медицина от химиотерапии в сторону таргетных методик?
— На самом деле, это непрерывный процесс — переход к таргетным методикам, который активно начался где-то около 10 лет назад, когда стали появляться новые препараты. В некоторых ситуациях таргетная терапия не так эффективна, как классическая химиотерапия. И нельзя сказать, что она всегда менее токсична, она имеет известный профиль осложнений, с которым понятно, как бороться.
Другое дело, что действительно есть нозологии, где успехи очень большие и где удается полностью, например, отходить от токсичных методов лечения и проводить амбулаторную терапию. Таким прорывом лет пять назад стало появление нетоксичной терапии при лимфомах. Появились ингибиторы контрольных точек, за которые в 2018 году Джеймсу Аллисону и Тасуко Хондзе дали Нобелевскую премию по медицине.
Ингибиторы контрольных точек применяются в противораковой терапии. Опухоли используют особые молекулы — именно их называют контрольными точками иммунного ответа — для того, чтобы защитить себя от действия иммунной системы организма. При помощи ингибиторов врачи активизируют иммунную систему, направляя ее клетки на борьбу с опухолями.
На сегодняшний день есть целый спектр нозологий либо генетических вариантов нозологий, которые позволяют применять этот вид лечения с излечением более половины пациентов, по крайней мере, или с достижением глубокого ответа со стороны опухоли. И при этом терапия с ингибиторами контрольных точек имеет очень ограниченные побочные эффекты, то есть это амбулаторное лечение, которое проводится раз в месяц или раз в две недели в зависимости от варианта.
— Сегодня в России пациенты могут получить таргетную терапию бесплатно?
— Да, она, как и диагностика, входит в программу обязательного медицинского страхования. Но, конечно, надо понимать, что ни одна система здравоохранения в мире не может себе позволить обеспечить всех всеми вариантами терапии. Приходится дифференцировать: где-то стохастически, то есть случайным образом, где-то учитывают пользу для здравоохранения, выбирая наиболее адекватные по соотношению затраты / полученный эффект. То есть, например, когда появились те же ингибиторы контрольных точек, в некоторых странах Европы они не прошли ценз на степень соотношения пользы и экономических затрат.
— И, получается, они не применяют эти препараты?
— В рамках программ государственного здравоохранения в некоторых странах — нет. Очень мало государств, где поддерживаются вообще все варианты терапии. Основная проблема заключается вот в чем: сейчас производителю препарата важно доказать, что препарат в принципе работает. Но на деле это значит, что срок жизни может быть продлен всего на несколько месяцев — и это все равно считается успехом клинических исследований, при этом вылечить пациента не получится. Но нельзя сказать, что системе здравоохранения выгодно заплатить 5 или 10 миллионов рублей за то, чтобы человек прожил на несколько недель дольше. Эта этическая проблема существует для всех систем здравоохранения мира, даже самых богатых.
Производителям лекарственных средств достаточно показать эту разницу между плацебо и лекарственным препаратом в отношении какой-то нозологии, чтобы получить регистрационные удостоверения и начать продавать препарат. Академическое сообщество, со своей стороны, пытается именно вылечить пациента. И для того, чтобы это сделать, нужен целый комплекс мер.
В последней лекции, которую я готовил, мы это назвали «траекторией пациента» по существующим методам лечения. Она необходима для того, чтобы определить биологические свойства его опухоли, к каким потенциальным препаратам она может быть чувствительна, какие комбинации и какие последовательно методы лечения применять. Это все, чем фармакологические компании сегодня не занимаются.
— А в России такие исследования проводятся?
— Да, конечно, в том числе НИИ им. Горбачевой проводит достаточно большое количество таких исследований: и отдельно у нас, и в кооперации с другими онкологическими центрами.
«Это утопия — история, что мы всем можем себя обеспечивать»
— А где, если говорить о географии, производятся препараты для таргетной терапии? В России фарма этим занимается?
— Вообще вышел закон о том, что все зарубежные препараты должны фасоваться в Российской Федерации. Поэтому формально мы неплохо все производим сами. Другое дело, что сама субстанция производится вне России. И надо понимать, что вообще ни одна страна мира полностью не обеспечивает себя произведенными внутри государства лекарствами, поэтому это утопия — история, что мы всем можем себя обеспечивать. В любом случае это конкурентная среда, и какие-то препараты разрабатываются и производятся в одной стране, какие-то — в другой. И очень важно, чтобы был свободный доступ ко всем методам лечения. Проблема заградительных мер выливается в то, что медицинский туризм в Турцию на 30% дешевле, чем в Россию. Просто потому что все ввозимые препараты в нашу страну проходят через стадию таможенных пошлин, а в Турции такого нет.
— А если все-таки про производство: мы способны производить такие препараты? Возможна ли такая ситуация, что какая-нибудь клиника в США будет применять наш таргетный препарат?
— Ну пока этого не произошло. Но сейчас есть несколько хороших примеров на этапе клинических исследований, могу сказать, что таких примеров до 10 в России.
— Но это лучше, чем ноль. А если возвращаться к заградительным мерам: как вы относитесь к правилу «второй лишний»? Как оно может повлиять, прежде всего, на пациентов и на уровень доверия к нашей медицине?
— Могу сказать, что уровень доверия все-таки растет, в том числе со стороны медицинского туризма, например, у нас, например, в прошлом году появился пациент из Китая. Но я не противник дженериков или биоаналогов, в особенности если они качественно сделаны. Мы много лет работаем с дженериками и от большинства препаратов ничего плохого с точки зрения побочных эффектов не видели. Другое дело, что эффективность зачастую существенно меньше, но доказать это невозможно. Поэтому в том числе и наша клиника активно участвует в программах, когда мы пытаемся привлечь внимание правительства к проблемам лечения детей, применению препаратов-дженериков для детей с онкологическими заболеваниями. Иногда такие замены сопровождаются некоторым ухудшением результатов лечения, но нет механизмов вывода некачественных дженериков с рынка.
— Но я так понимаю, что при правиле «второй лишний» и у пациентов, и у врача просто нет выбора…
— Скорее, должно быть решение на государственном уровне о необходимости создания стратегического списка препаратов, качество которых должно контролироваться. Потому что нельзя сказать, что и раньше у пациента был выбор: онкологическая помощь в основном относится к категории государственной бесплатной медицины. Очень небольшой процент людей может себе позволить онкологического помощь за счет собственных средств на сегодняшний день. Кто может себе позволить терапию за 21 млн рублей, как в случае с CAR-T?
«Для внедрения нового метода лечения требуется минимум пять лет»
— Как сегодня благотворительность помогает в проведении исследований?
— Спонсирует примерно половину всех исследований в области лечения онкологических заболеваний. И тут есть несколько проблем. Во-первых, академические исследования включают в себя несколько этапов. Для диагностики требуются методы и исследования, которые еще не имеют регистрационных удостоверений. То есть мы не можем тратить на них те деньги, которые выделяет государство. Поскольку такие методы появляются очень быстро — за 2-3 года практически кардинально меняется подход к современной диагностике злокачественных опухолей, — производители этих реагентов не заинтересованы в том, чтобы регистрировать свой продукт, проходить этот длинный путь который занимает около года или дольше. Соответственно, единственный вариант — это благотворительность.
Во-вторых, это все-таки препараты, которые могут применяться вне рамок зарегистрированных показаний, по новым показаниям, или это настолько редкая история, что производители лекарственных средств просто не регистрируют те или иные показания: им экономически невыгодно. И в этом случае мы тоже не можем использовать государственные деньги.
Благотворительный фонд AdVita с 2002 года помогает взрослым и детям, которые лечатся от рака в клиниках Петербурга, и онкологическим отделениям больниц.
Задача фонда — сделать современное лечение доступным любому человеку независимо от возраста, уровня дохода, медицинского прогноза. Мы помогаем на всех этапах: от постановки диагноза до завершения лечения. AdVita оплачивает диагностику, лекарства, поиск и активацию доноров костного мозга, оборудование, реагенты и расходные материалы для клиник, поддерживает научные исследования.
Вы тоже можете помочь российским ученым в разработке новых видов терапии и, как следствие, спасти тысячи жизней:
— Как происходит внедрение новых методик, если говорить о терапиях онкологических заболеваний: от лаборатории до конкретного врача, который будет применять новую методику?
— Есть два типа клиник — академические и муниципального здравоохранения. Последние, по текущим приказам, не могут сами инициировать какие-то исследования. Поэтому они работают в рамках существующих стандартов лечения и клинических рекомендаций. Академические клиники, под которыми я подразумеваю научные и образовательные учреждения, могут инициировать исследования. И результаты их исследований потом могут лечь в основу национальных рекомендаций, которые мы должны обновлять раз в два года. Уже на основании этих рекомендаций муниципальные клиники применяют новый метод лечения, который показал большую эффективность. Поскольку в России проводится небольшое количество академических исследований, чаще транслируются результаты американских и европейских рабочих групп, которые тоже потом входят в клинические рекомендации и стандарты лечения.
— Как устроена коммуникация между разработчиками методов лечения и практикующими врачами? Может ли условный врач из Самары позвонить в Петербург и спросить: я применяю вашу терапию, у меня что-то идет не так, что делать?
— Вообще мы пытаемся к такому варианту прийти и создать рабочие группы в отношении конкретных проблем в области онкологии и гематологии, где была бы открыта коммуникация между всеми участвующими сторонами. Потому что это известный факт для любой области человеческой деятельности: чем больше коммуникаций, тем лучше результат.
— А сколько времени требуется на полный цикл от начала разработки терапии до ее внедрения?
— Минимум — примерно пять лет, потому что сейчас, конечно, утверждают виды лечения просто по уровню ответов, но чаще всего стандартом является оценка доли пациентов, у которых опухоль не прогрессирует через 2–5 лет. Соответственно нужно подождать, понаблюдать за пациентами и определить, насколько эффективен тот или иной метод.
— Какие направления лечения онкологических заболеваний можно назвать наиболее перспективными?
— Понятно, что будут появляться новые препараты. Следующее поколение препаратов будет основано на активации возможностей собственной иммунной системы человека, и это уже сейчас происходит. У нас буквально каждый год есть новый препарат для какой-то болезни, который использует механизм, который основан на том, чтобы помочь иммунным клеткам справиться с болезнью. Ну и, конечно, будет более активно применяться генная модификация различных клеток организма человека.
— Какую роль в этих разработках занимает российская наука?
— Роль очень серьезно догоняющего участника процесса.
— Что бы вы назвали своей профессиональной миссией?
— Когда я поступал в институт, у меня была одна из таких фантастических идей: попытаться полностью побороть рак. А потом, когда я стал работать, то понял, что это полная утопия. Но в каких-то областях получается сдвинуть эту проблему чуть-чуть дальше. И, пожалуй, это доставляет удовольствие, но и, конечно, любой человек в любой профессии вам скажет, что 90–95% жизни — это рутинная работа.
Car t клеточная терапия в россии
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России;
ФГБУ «Научно-исследовательский финансовый институт Министерства финансов Российской Федерации»
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГБУ «Научно-исследовательский финансовый институт Министерства финансов Российской Федерации»
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГБОУ ВО «Санкт-Петербургский государственный химико-фармацевтический университет» Минздрава России;
ФГБОУ ВО «Российская академия народного хозяйства и государственной службы при Президенте Российской Федерации»
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГБУ «Научно-исследовательский финансовый институт Министерства финансов Российской Федерации»
Регистрация первых CAR-T технологий в мире: уроки для России
Журнал: Медицинские технологии. Оценка и выбор. 2020;(2): 18‑25
Омельяновский В.В., Безденежных Т.П., Тепцова Т.С., Мусина Н.З., Мельникова Л.С. Регистрация первых CAR-T технологий в мире: уроки для России. Медицинские технологии. Оценка и выбор. 2020;(2):18‑25.
Omelyanovskiy VV, Bezdenezhnykh TP, Teptsova TS, Musina NZ, Melnikova LS. Registering the first CAR-T technologies: useful experience for Russia. Medical Technologies. Assessment and Choice. 2020;(2):18‑25. (In Russ.).
https://doi.org/10.17116/medtech20204002118
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России;
ФГБУ «Научно-исследовательский финансовый институт Министерства финансов Российской Федерации»
Клеточная иммунотерапия CAR-T (Chimeric Antigen Receptor T-Cell, или T-клетки с химерным антигенным рецептором) является передовым подходом к лечению онкологических заболеваний. В зарубежной практике препараты CAR-T терапии относятся к регуляторной группе лекарственных средств передовой терапии. Из-за клеточной и генной природы данных препаратов их гораздо сложнее разрабатывать, чем другие, более традиционные, лекарственные препараты. Первые клинические испытания CAR-T показали обнадеживающие результаты в терапии онкологических заболеваний последних стадий. К текущему моменту уже два CAR-T препарата, Kymriah и Yescarta, одобрены для использования в США и Европе. В данном обзоре рассмотрена существующая практика регистрации CAR-T препаратов как особого класса лекарственных средств передовой терапии в FDA (U.S. Food and Drug Administration) и EMA (European Medicines Agency), включая путь к утверждению и использование специальных инструментов регулирования. Кроме того, определены важные будущие тенденции в данной области.
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России;
ФГБУ «Научно-исследовательский финансовый институт Министерства финансов Российской Федерации»
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГБУ «Научно-исследовательский финансовый институт Министерства финансов Российской Федерации»
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГБОУ ВО «Санкт-Петербургский государственный химико-фармацевтический университет» Минздрава России;
ФГБОУ ВО «Российская академия народного хозяйства и государственной службы при Президенте Российской Федерации»
ФГБУ «Центр экспертизы и контроля качества медицинской помощи» Минздрава России;
ФГБУ «Научно-исследовательский финансовый институт Министерства финансов Российской Федерации»
Дата принятия в печать:
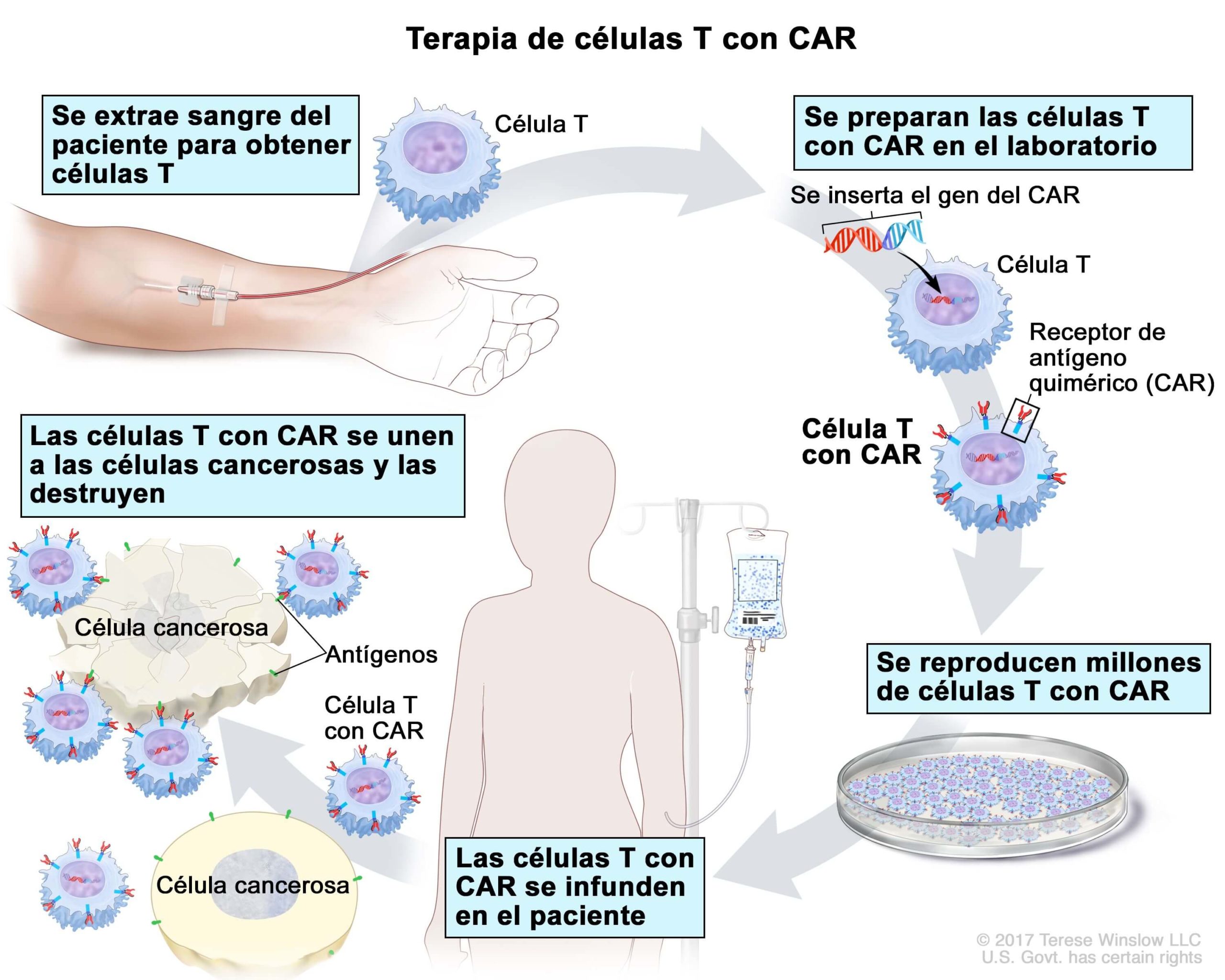
Клеточная иммунотерапия, в частности технологии CAR-T (Chimeric Antigen Receptor T-Cell, или T-клетки с химерным антигенным рецептором), является передовым подходом к лечению онкологических заболеваний. Существуют широкие перспективы лечения пациентов на последних стадиях заболевания с помощью данного метода. CAR-T-клеточная терапия заключается в извлечении T-лимфоцитов из организма пациента (клеток, относящихся к иммунной системе). После их модификации в лабораторных условиях и обратной инфузии в организм пациента Т-лимфоциты приобретают способность распознавать и атаковать опухолевые клетки.
В данном обзоре описан опыт регистрации первых препаратов CAR-T терапии на основании анализа зарубежных методических материалов, нормативно-правовых документов и других открытых официальных источников. Для этого проанализирован опыт Управления по контролю продуктов и лекарственных средств США (Food and Drug Administration, FDA) и Европейского агентства лекарственных средств (European Medicines Agency, EMA). Рассмотрены важные проблемы российского правового поля в области регистрации биомедицинских клеточных продуктов. Описаны также перспективы рынка препаратов CAR-T на ближайшие годы.
Технология CAR-T
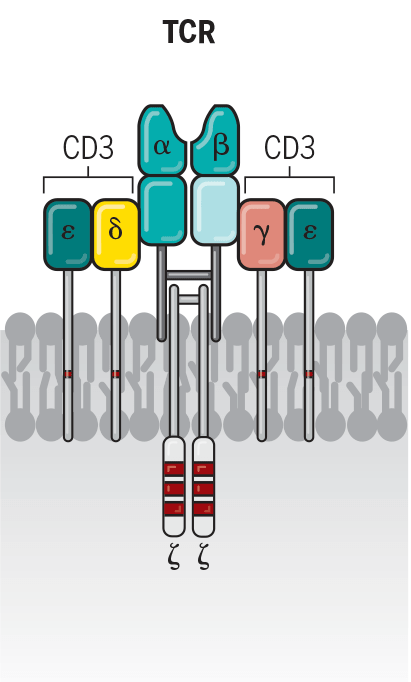
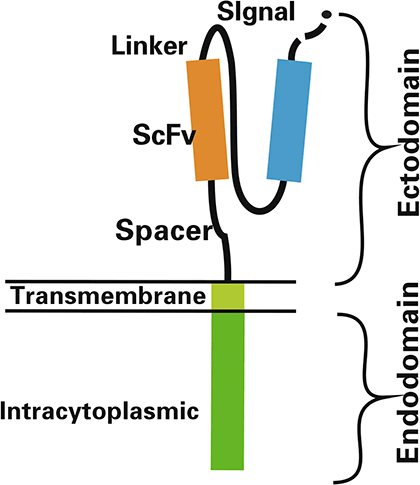
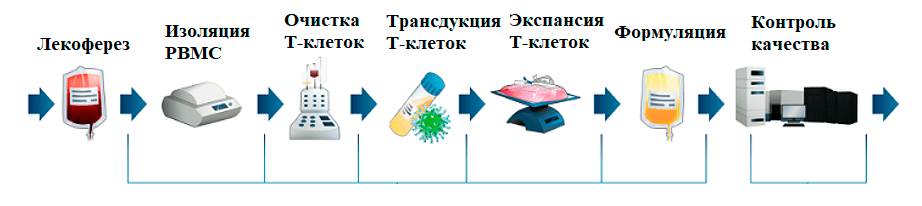
CAR-Т-клеточная терапия представляет собой новый, быстро развивающийся иммунотерапевтический подход, который выводит лечение онкологических заболеваний на новый уровень. Клетки CAR-T представляют собой генетически модифицированные Т-лимфоциты, взятые у пациента с помощью афереза — технологии, которая позволяет разделить кровь на компоненты и получить определенное количество лимфоцитов. В Т-лимфоциты пациента в лабораторных условиях встраивают химерные рецепторы, способные распознать специфичный антиген опухоли и уничтожать ее так же, как они это обычно делают с чужеродными патогенами [1].
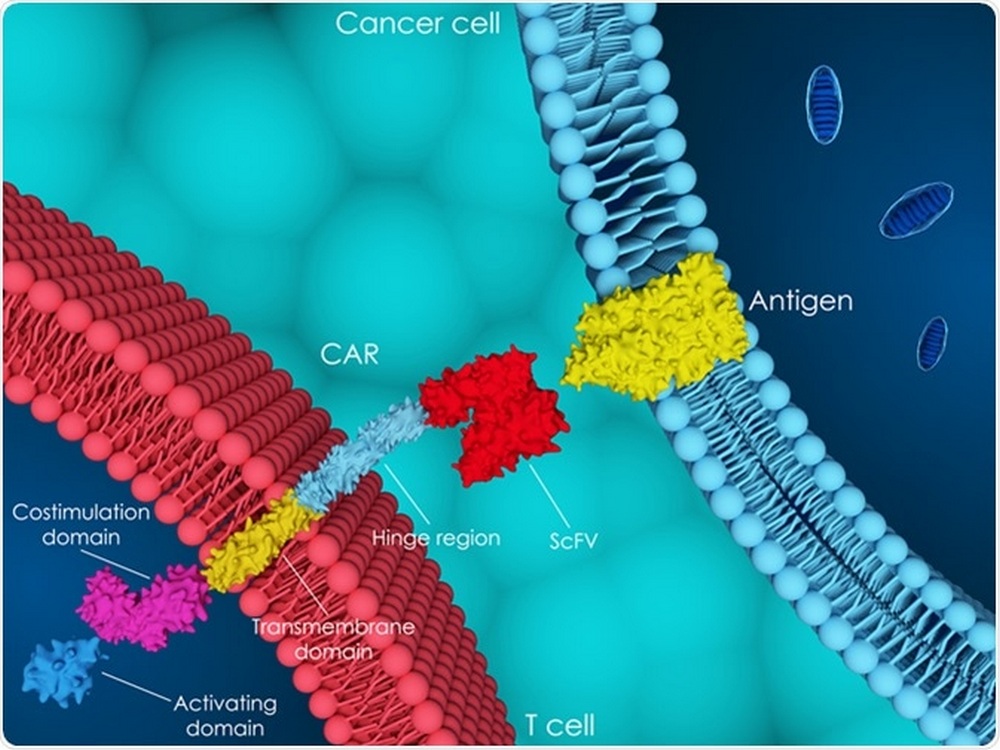
Часть СAR в модифицированной клетке CAR-T — это рекомбинантный рецептор, обеспечивающий как специфичность взаимодействия, так и активацию Т-лимфоцитов. CAR распознает мишень с помощью внеклеточного домена — одноцепочечного вариабельного фрагмента антитела (single-chain variable fragment, scFv), отвечающего за специфичность узнавания антигена, в частности опухолевой клетки. На рис. 1 представлена схема взаимодействия клетки CAR-T с клеткой опухоли.
Рис. 1. Клетка CAR-T и процесс ее взаимодействия с клеткой опухоли (схема).
Fig. 1. CAR-T cell and the process of its interaction with the tumor cell (scheme).
Выбор подходящих антигенов (мишеней) для клеток CAR-T имеет решающее значение для снижения риска развития нежелательных явлений, в частности высокой токсичности данной терапии. Многие потенциальные мишени экспрессируются и на здоровых клетках и тканях организма. Идеальным антигеном-мишенью в терапии множественной миеломы для CAR-Т терапии является молекула, которая широко экспрессируется на поверхности всех опухолевых клеток плазмы. Гамма-ретровирусные векторы первыми использовали для создания клеток CAR-Т с мишенью CD19. На сегодняшний день их применяют в 50% клинических исследований (КИ). Лентивирусные векторные системы широко используются для трансдукции неделящихся клеток и теоретически более безопасны с точки зрения риска развития инсерционного мутагенеза и злокачественной трансформации [2].
Совсем недавно антиген созревания В-клеток (B cell maturation antigen, BCMA) привлек к себе внимание как мишень клеток CAR-T в терапии множественной миеломы. ВСМА представляет собой белок клеточной мембраны, участвующий в дифференцировке и созревании B-лимфоцитов в плазматические клетки. Это трансмембранный белок типа III, в котором отсутствует сигнальный пептид, но он содержит богатые цистеином внеклеточные домены и способствует выживанию и дифференцировке В-клеток. При этом ВСМА экспрессируется также на опухолевых клетках множественной миеломы и не присутствует на здоровых В-клетках или гематопоэтических стволовых клетках, но активируется при дифференцировке В-клеток в плазменные бласты [3].
Терапия CAR-Т препаратами является сложным процессом с несколькими стадиями [4]:
1) аферез лейкоцитов пациента;
2) генетическая модификация Т-лимфоцитов в лаборатории (часто место производства CAR-T-клеток находится на значительном расстоянии от места проведения афереза);
3) размножение модифицированных Т-клеток (экспансия в среде, обогащенной цитокинами);
4) контроль качества клеточного препарата;
6) подготовка пациента (предварительная химиотерапия, чтобы предупредить возможное отторжение организмом и способствовать сохранению и пролиферации CAR-T-клеток);
Несмотря на очевидные клинические преимущества CAR-T терапии в лечении онкологических заболеваний, существует ряд проблем при ее регистрации и регулировании в связи с инновационным характером [5]. Затратоемкость производства и стоимость препаратов, контроль качества продукта, высокие требования соответствия надлежащей клинической и производственной практике, законодательство стран в области генно-модифицированных организмов, сложные логистические конструкции при производстве и реализации и инновационный характер данной медицинской технологии обусловливают гибкость подходов регуляторов и производителей в организации доступа на рынок. На сегодняшний день в мире официально зарегистрировано для обращения две CAR-T технологии — Kymriah (tisagenlecleucel) и Yescarta (axicabtagene ciloleucel). Kymriah и Yescarta относятся к новому поколению препаратов для индивидуальной противоопухолевой иммунотерапии, которая позволяет «перепрограммировать» собственные иммунные клетки пациента так, чтобы они распознавали злокачественные клетки и боролись с ними [6].
Регистрация технологии CAR-T в Управлении по контролю продуктов и лекарственных средств США (FDA)
В 2017 г. FDA впервые зарегистрировало CAR-T препараты под торговыми названиями Kymriah (Novartis International AG, Швейцария) и Yescarta (Kite Pharma, США, ныне — Gilead Sciences, Inc, США).
Препарат Kymriah одобрен для лечения:
— пациентов до 25 лет с рефрактерным или рецидивирующим В-клеточным острым лимфобластным лейкозом;
— взрослых пациентов с рецидивирующей или рефрактерной крупноклеточной лимфомой после двух или более линий системной терапии.
Препарат Yescarta одобрен для лечения:
— взрослых пациентов с рецидивирующей или рефрактерной диффузной крупноклеточной лимфомой после двух или более линий системной терапии.
В соответствии с классификацией FDA Kymriah и Yescarta относятся к классу медицинских продуктов передовой терапии (МППТ, Advanced Therapy Medicinal Products, ATMP). FDA считает, что клинические преимущества МППТ достигаются за счет контролируемого производственного процесса, поскольку качество, безопасность и эффективность продукции неразрывно связаны между собой [7]. Так, FDA отслеживает процесс разработки и клинических испытаний любого медицинского препарата с момента проведения исследований нового препарата на людях, т.е. после того, как безопасность и токсичность нового продукта проверены на животных. С этого момента вещество приобретает иной правовой статус в соответствии с Федеральным законом о пищевых продуктах, лекарствах и косметике [8] и становится новым лекарственным средством, отвечающим особым требованиям системы регулирования лекарственных средств. Для начала взаимодействия с FDA компания — разработчик препарата должна подать заявку на исследование нового препарата (investigational new drug application, IND-application). За регулирование и регистрацию МППТ в FDA несет ответственность Центр биологической оценки и исследований (Center for Biologics Evaluation and Research, CBER).
Для организации более быстрого доступа новой медицинской технологии на рынок США существует несколько программ ускоренного одобрения (Expedited Development Programs):
— фаст-трек (fast-track) — ускоренное рассмотрение заявки на регистрацию медицинских технологий для терапии серьезного или угрожающего жизни заболевания либо медицинской технологии, которая удовлетворяет неудовлетворенные медицинские потребности;
— приоритетное рассмотрение (priority review) — направлено на ускорение процесса рассмотрения продуктов, которые, как ожидается, окажут особенно большое влияние на лечение заболевания (различие между приоритетным и стандартным временем рассмотрения заключается в том, что FDA уделит дополнительное внимание и выделит ресурсы для процесса рассмотрения);
— статус прорывной терапии (break-through therapy);
— статус передовой терапии регенеративной медицины (Regenerative Medicine Advanced Therapy, RMAT).
FDA объявило о введении в использование нового статуса RMAT только в марте 2017 г., признав огромный потенциал CAR-T препаратов и необходимость в эффективных устойчивых инструментах для ускорения их разработки и обеспечения их доступности для пациентов [5]. Запрос на получение статуса RMAT должен быть сделан компанией-заявителем одновременно с подачей заявки на исследование нового препарата (IND-application) или в качестве дополнения к существующей заявке. На основании Закона о терапии XXI века [9] (The 21st Century Cures Act) продукт имеет право получить статус передовой терапии регенеративной медицины при выполнении трех условий:
1) если является средством клеточной терапии, продуктом тканевой инженерии, продуктом, произведенным с использованием человеческих клеток и тканей либо комбинированным продуктом; в частности, к данной группе относятся терапия с применением генетически модифицированных клеток и генная терапия, обеспечивающие длительный эффект;
2) продукт предназначен для лечения тяжелого или опасного для жизни заболевания или состояния;
3) предварительные клинические данные указывают на то, что препарат способен удовлетворить неудовлетворенные медицинские потребности для данного заболевания или состояния [10].
Статус RMAT не применялся в процессе разработки ни для Kymriah, ни для Yescarta, так как к моменту внедрения данного статуса в практику FDA данные CAR-T технологии уже находились на поздних стадиях рассмотрения агентством. По состоянию на 31 марта 2020 г. в общей сложности в FDA поступило 139 заявок на получение данного статуса (рис. 2) [11].
Рис. 2. Заявки на получение статуса RMAT в FDA [11].
Fig. 2. Requests for RMAT status approval in the FDA [11].
Процесс рассмотрения Kymriah и Yescarta в FDA протекал сходным образом [12]:
— в сентябре (Kymriah) и декабре (Yeskarta) 2014 г. компании-заявители подали заявку на исследование нового препарата (IND-application) для начала проведения КИ CAR-T с участием людей;
— в 2014 г. оба препарата получили статус орфанных;
— в феврале 2016 г. (Kymriah) и декабре 2015 г. (Yeskarta) препараты получили статус прорывной терапии;
— в августе (Kymriah) и октябре (Yeskarta) 2017 г. компании-заявители заполнили заявление на получение лицензии на биологические препараты (Biologics License Application); данное заявление представляет собой запрос на получение разрешения на внедрение в обращение на рынке США нового биологического препарата и содержит информацию об эффективности и безопасности, процессе производства и прочее;
— в октябре (Kymriah) и ноябре (Yeskarta) 2017 г. первые CAR-T технологии были одобрены для обращения на территории США.
Следует отметить, что на протяжении всего периода рассмотрения данных CAR-T технологий Novartis и Kite Pharma находились в тесном взаимодействии с FDA, в частности с Центром биологической оценки и исследований, предоставляя необходимую недостающую или обновленную информацию, получая консультации по поводу возможных стратегий проведения клинических и постмаркетинговых исследований. До октября 2018 г. в агентстве не существовало специальной программы, нацеленной на раннее консультирование компаний — производителей биологических медицинских технологий. Так, 1 октября 2018 г. Центр исследования и оценки биотехнологий объявил о запуске программы INTERACT (INitial Targeted Engagement for Regulatory Advice on CBER ProducTs). Встречи в формате INTERACT — это неформальные, необязательные консультативные обмены между компаниями-производителями и представителем Центра на ранних стадиях разработки продукта, которые помогают компаниям решать определенные вопросы до консультационных совещаний по подготовке IND-application. Программа INTERACT теперь заменяет текущую программу консультационных совещаний по подготовке IND-application для всех биологических продуктов.
Регистрация технологии CAR-T в Европейском агентстве лекарственных средств (EMA)
В 2018 г. EMA впервые зарегистрировало технологии CAR-T под торговыми названиями Kymriah (Novartis International AG, Швейцария) и Yescarta (Kite Pharma, США, ныне — Gilead Sciences, Inc, США).
Kymriah — для лечения:
— пациентов до 25 лет с острым лимфобластным лейкозом, рефрактерным, рецидивирующим после пересадки костного мозга или после второго рецидива;
— взрослых пациентов с рецидивирующей или рефрактерной крупноклеточной лимфомой после двух или более линий системной терапии.
Yescarta — для лечения:
— взрослых пациентов с рецидивирующей или рефрактерной диффузной крупноклеточной лимфомой после двух или более линий системной терапии.
EMA, так же как и FDA, классифицирует Kymriah и Yescarta как медицинские продукты передовой терапии (МППТ, Advanced Therapy Medicinal Products, ATMP) [13].
Для начала процесса оценки нового МППТ EMA компания — разработчик препарата должна подать заявку на получение разрешения выхода на рынок (Marketing authorisation application). EMA полагается на результаты КИ, проведенных фармацевтическими компаниями, для принятия решения о регистрации медицинских продуктов на рынке Европы. Хотя разрешение на проведение КИ выдается на уровне государств — членов Евросоюза, EMA играет ключевую роль в обеспечении того, чтобы стандарты надлежащей производственной (Good Manufacturing Practice, GMP) и клинической (Good Clinical Practice, GCP) практики применялись в Европейской экономической зоне (ЕЭЗ, European Economic Area, EEA). Помимо этого, EMA управляет базой данных КИ, проводимых в ЕС. В случае импорта в ЕС из третьих стран незарегистрированных МППТ для проведения КИ лица, сертифицирующие ввозимую партию, должны дать гарантии, что качество партии соответствует условиям разрешения на КИ (включая соответствие спецификации на продукт) и что ввозимые в ЕС МППТ изготовлены в соответствии со стандартами качества, по крайней мере эквивалентными требованиям GMP, применяемым в ЕС [14]. Несмотря на то что партии МППТ должны быть повторно протестированы при импорте в ЕС, как того требует Статья 51 (1) (b) Директивы 2001/83/EC, существует возможность полагаться на меры контроля, принимаемые за пределами ЕС [15]. Например, Европа и США подписали соглашение о взаимном признании результатов контроля качества. Вместе с тем все еще существуют большие расхождения между требованиями к скринингу и обследованию доноров, к отслеживаемости партии и маркировке, к понятиям о конфиденциальности пациентов и требованиям надлежащей практики афереза. Таким образом, вместе с заявкой на регистрацию нового МППТ, производимого на территории третьих стран, EMA может выдать освобождение от повторного тестирования ввозимых на территорию ЕЭЗ партий зарегистрированного МППТ по заявлению компании-производителя и при выполнении соответствующих требований [15].
После подачи заявки на регистрацию в EMA научную оценку МППТ проводят Комитет по медицинским продуктам для применения у человека (Committee for Medicinal Products for Human Use, CHMP), Комитет по оценке рисков фармаконадзора (Pharmacovigilance Risk Assessment Committee, PRAC) и Комитет по передовым методам терапии (Committee for Advanced Therapies, CAT). По результатам научной оценки CHMP оглашает свое мнение, и Европейская комиссия выносит окончательное решение о регистрации продукта [16].
EMA предоставляет формальную поддержку разработчикам МППТ посредством:
— выдачи орфанного статуса;
— программы административной, нормативной и финансовой поддержки малых и средних компаний, занимающихся разработкой МППТ;
— консультационных совещаний по вопросам классификации МППТ и дальнейшего их регулирования;
— программы поддержки приоритетных медицинских продуктов (PRIority MEdicines, PRIME).
Европейское законодательство предусматривает научные и финансовые инструменты для стимулирования исследований и разработок в области передовых методов лечения. Разработчики МППТ могут получить 65% снижение стоимости научной консультации для МППТ (90% для малых и средних компаний) и 90% снижение платы за процедуру сертификации.
Помимо этого, EMA в 2016 г. запустило программу PRIME для поддержки производителей медицинских продуктов, предназначенных для неудовлетворенных медицинских нужд пациентов. Основу программы составляет раннее взаимодействие между разработчиками препаратов и регуляторами. Участие в PRIME является добровольным и помогает оптимизировать полученные данные о преимуществах и рисках препарата, улучшить дизайн КИ и ускорить процесс научной оценки релевантными комитетами EMA для более скорого доступа пациентов к новым альтернативам лечения.
PRIME основывается на существующей нормативной базе и уже доступных инструментах, таких как научное консультирование и ускоренная оценка. Это означает, что разработчики МППТ, включенных в программу PRIME, могут рассчитывать на получение ускоренной оценки во время подачи заявки на регистрацию и приблизить авторизацию на европейском рынке [17]. Для ускоренной оценки разработчик должен предоставить сведения, что препарат соответствует стандартам надлежащей производственной (GMP) и клинической (GCP) практики [18].
Для принятия участия в PRIME препараты должны показать эффективность в предварительных КИ. Kymriah и Yescarta стали первыми препаратами программы PRIME, получившими одобрение EMA. Право на участие в программе PRIME Yescarta получил 26 мая 2016 г. для лечения диффузной крупной B-клеточной лимфомы, а Kymriah — 23 июня 2016 г. для лечения острого лимфобластного лейкоза. Kymriah и Yescarta также получили положительные отзывы от CHMP [5].
По состоянию на 27 февраля 2020 г. подано 285 заявок на участие в программе PRIME (рис. 3) [19].
Рис. 3. Заявки на участие в программе PRIME [19].
Fig. 3. Requests for participation in the PRIME program [19].
Таким образом, процесс рассмотрения Kymriah и Yescarta в EMA протекал по схожему сценарию [5]:
— в 2014 г. Kymriah получил статус орфанного препарата для острого лимфобластного лейкоза и в 2015 г. — для крупноклеточной В-лимфомы; в 2014 г. Yescarta получил статус орфанного препарата для крупноклеточной В-лимфомы и в 2015 г. — для острого лимфобластного лейкоза, хронического лимфолейкоза;
— с 2014 по 2017 г. проходили совещания и консультации по вопросам качества и доклинических испытаний (2 раза в год);
— в 2015 г. Kymriah и в 2017 г. Yescarta вошли в План педиатрических исследований (Pediatric Investigation Plan) — программу, направленную на улучшение сбора необходимых данных в ходе КИ с участием детей для поддержки авторизации новых препаратов на европейском рынке;
— в 2016 г. оба препарата стали первыми участниками программы PRIME;
— в ноябре (Kymriah) и в июле (Yescarta) 2017 г. подано заявление на регистрацию;
— 28 июня 2018 г. CHMP одобрил регистрацию препаратов;
— 23 августа 2018 г. Европейская комиссия авторизовала препараты для обращения на рынке.
Перспективы регистрации CAR-T в РФ
CAR-терапия (CAR-T) — передовая медицинская технология, находящаяся на стыке генотерапии, клеточной терапии и иммунотерапии, с которой связывают прорыв в лечении онкогематологических заболеваний. CAR-T уже доступна более чем в 20 странах мира, однако ее регистрация и обеспечение доступности для пациентов с онкологическими заболеваниями в РФ могут быть сопряжены со значительными трудностями в связи с неоднозначностью отнесения данной терапии к препаратам генотерапии, биомедицинским клеточным продуктам, биологическим лекарственным препаратам или высокотехнологичной медицинской помощи. Возможность отнесения CAR-T к генотерапии определяется тем, что извлеченные из крови пациента Т-лимфоциты проходят генетическую модификацию, получая новый компонент CAR, способный к распознаванию раковых клеток. Следовательно, правовые нормы Федерального закона от 05.07.96 №86-ФЗ (ред. от 03.07.16) «О государственном регулировании в области генно-инженерной деятельности» (с изменениями и дополнениями) распространяются на данный метод. Однако базовые правовые нормы указанного закона, принятые в прошлом веке, на этапе формирования медицинского законодательства и других отраслей права РФ, в значительной степени неконкретны и носят отсылочный характер. Кроме того, метод CAR-T основан на использовании клеток крови пациента и формировании клеточной линии с модифицированными функциями. Правовое регулирование такой деятельности в российском законодательстве осуществляется Федеральным законом от 23.06.16 №180-ФЗ (ред. от 03.08.18) «О биомедицинских клеточных продуктах» (с изменениями и дополнениями). Однако, безусловно, не все правовые нормы этого закона можно применить к методу CAR-T. Метод CAR-T в определенной степени может быть отнесен и к предмету регулирования Федерального закона от 12.04.10 №61-ФЗ (ред. от 02.08.19) «Об обращении лекарственных средств» (с изменениями и дополнениями), так как подпадает под определение биологических генотерапевтических лекарственных препаратов. Вместе с тем многие этапы обращения лекарственных средств неприменимы для метода CAR-T, так же как и для других препаратов генной терапии, поскольку правовые нормы закона не рассчитаны на персонифицированные препараты. Такая неопределенность правовых норм российского законодательства в отношении инновационных персонифицированных препаратов и технологий затрудняет внедрение их в медицинскую практику.
Перспективы развития CAR-T
В результате выхода на рынок США и Европы обладающих большим терапевтическим потенциалом препаратов ex vivo клеточной терапии CD19 CAR-T Kymriah и Yescarta в 2018 г., для получения которых необходимы сложные, дорогостоящие производственные процессы, регуляторы и производители вынужденно начали пересматривать модели регулирования, производства, ценообразования и финансирования.
Несмотря на то что в 2019 г. не было новых одобренных ex vivo препаратов клеточной терапии, в течение ближайших лет ожидаются многочисленные публикации данных КИ, а также потенциально могут быть зарегистрированы новые CAR-T препараты. Масштабы исследовательской CAR-Т-клеточной терапии быстро расширились более чем до 500 КИ, проводимых в 2019 г. [20]. После публикации результатов выполняемых в настоящее время КИ станет возможным сравнение различных видов клеточной терапии, например аутологичных (полученных от пациентов) и аллогенных (полученных от доноров) технологий CAR-T, а также сопоставление CAR-T с другим типом клеточной иммунной терапии — CAR-NK и NKT [21].
Наиболее устоявшейся и конкурентоспособной областью клеточной терапии является терапия CD19 CAR-T при лейкозах и лимфомах. Есть два утвержденных препарата и еще два ожидающих решения FDA по заявке на получение биологической лицензии (Biologics license application, BLA), поданной в декабре 2019 г.: Kymriah (Novartis International AG, Швейцария), Yescarta (Gilead Sciences, Inc, США), Liso-cel (Bristol-Myers Squibb, США) [22] и KTE-X19 (Gilead Sciences, Inc, США) [23] соответственно. Второй CAR-T препарат компании Gilead Sciences, Inc (США) — KTE-X19 является версией Yescarta с измененным производственным процессом, подразумевающим дополнительное расширение количества лейкоцитов. В заявке KTE-X19 — данные об эффективности KTE-X19 при мантийноклеточной лимфоме с общим процентом ответов 93% и полным ответом 67% [24]. Компания Gilead Sciences подала заявку на биологическую лицензию на утверждение FDA в декабре 2019 г. и в EMA в январе 2020 г. [24]. KTE-X19 находится во второй фазе КИ для терапии острого лимфобластного лейкоза, мантийноклеточной лимфомы и хронического лимфолейкоза и может потенциально конкурировать с Kymriah в случае одобрения. Одновременно с Gilead Sciences, Inc (США) другая фармацевтическая компания, Celgene Corporation, США (дочерняя компания Bristol-Myers Squibb), подала заявку в FDA в декабре 2019 г. на лицензирование CAR-T препарата на основе мишени CD19 Lisocabtagene Maraleucel (Liso-cel) [22]. Компания опубликовала в начале декабря 2019 г. данные, подтверждающие сопоставимую эффективность с Kymriah или Yescarta, но заметно более низкие показатели синдрома высвобождения цитокинов (CRS). Однако получение Liso-cel связано с более медленным производственным процессом, который занимает 24 дня против 16 дней для Yescarta.
Следующей волной CAR-T препаратов, на которые будут поданы заявки на регистрацию, станет аутологичная BCMA CAR-T терапия. Первым из таковых стал Idecabtagene Vicleucel (Ide-cel) компании Celgene Corporation, США (дочерней компании Bristol-Myers Squibb). В конце марта 2020 г. компания Bristol-Myers Squibb анонсировала подачу заявки на лицензирование в FDA, представив положительные результаты КИ второй фазы в терапии множественной миеломы с общим уровнем ответа 73,4% [25]. Помимо этого, компания Janssen Pharmaceutica (Бельгия) в декабре 2019 г. объявила о получении статуса прорывной терапии в FDA для препарата JNJ-4528, предназначенного для терапии множественной миеломы и показавшего положительные результаты в КИ фазы 1b/2 (полный ответ 69%), и об ожидаемой регистрации к концу 2020 г. [26].
Заключение
Приход дорогостоящих инновационных и высокоэффективных препаратов, таких как CAR-T, на западный фармацевтический рынок заставил пересмотреть старые алгоритмы регистрации медицинских технологий. Во многих отношениях одобрение первых CAR-T препаратов проложит путь к регистрации новых средств передовой терапии в ближайшем будущем. Оба продукта доказали эффективность и потенциал клеточной терапии CAR-T и одобрены примерно на 1 год раньше в США по сравнению с ЕС. Это не редкость для инновационных технологий в онкологии. Необходимо признать, что FDA работает в рамках одной страны, в то время как ЕС является объединением нескольких стран, в которых различия в нормативном регулировании все еще существуют, несмотря на все усилия по гармонизации. Компании — производители Kymriah и Yescarta активно использовали статус прорывной технологии и статус PRIME как важные инструменты регулирования доступа новых технологий в США и в ЕС соответственно. Статус RMAT мог бы быть потенциально полезным для обоих препаратов в США, но компании не смогли получить данный статус ввиду поздней стадии рассмотрения. Как показано на примерах Yescarta и Kymriah, использование специализированных инструментов регулирования может помочь сократить время выхода на рынок прорывных медицинских технологий.
В 2020—2021 гг. ожидается одобрение еще нескольких CAR-T препаратов, показавших хорошие результаты в клинических испытаниях. Так, некоторые из них могут стать потенциальными альтернативами уже одобренным препаратам для терапии острого лимфобластного лейкоза, в то время как другие смогут стать первыми в терапии множественной миеломы (аутологичная BCMA CAR-T терапия). В то же время в большом количестве доклинических исследований и клинических испытаний на ранней стадии изучается потенциал CAR-T-клеток в терапии солидных опухолей различных локализаций.
В РФ на данный момент не зарегистрировано ни одного CAR-T препарата. Авторы надеются, что международная практика регистрации и внедрения данного метода и препаратов позволит выбрать правильное направление совершенствования российского законодательства в этой сфере.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
1 Федеральный закон от 21.11.11 №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации». Ссылка активна на 13.07.19. http://www.pravo.gov.ru
2 Приказ Минздрава России от 30.11.17 №965н «Об утверждении порядка организации и оказания медицинской помощи с применением телемедицинских технологий» (зарегистрирован в Минюсте России 09.01.18 за №49577). Ссылка активна на 13.07.19. http://www.pravo.gov.ru
3 Приказ Минздрава России от 12.11.12 №902н «Об утверждении Порядка оказания медицинской помощи взрослому населению при заболеваниях глаза, его придаточного аппарата и орбиты» (зарегистрирован в Минюсте России 13.12.12 за №26116). «Российская газета» (специальный выпуск), №78/1, 11.04.13.
4 Приказ Минздрава России от 15.11.12 №920н «Об утверждении Порядка оказания медицинской помощи населению по профилю «диетология»« (зарегистрирован в Минюсте России 17.04.13 за №28162). «Российская газета» (специальный выпуск), №122/1, 07.06.13.
Способны ли CAR-Т-клетки уничтожить опухоль?
Т-клетки атакуют опухолевую клетку. Т-клеточная терапия химерным рецептором антигена — это новая форма лечения рака, одобренная FDA. Терапия разработана на собственных Т-клетках пациента для поиска и уничтожения раковых клеток.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Способность использовать иммунные клетки, направленно изменять их и обучать нацеливаться на опухолевые клетки изменила парадигму лечения многих гематологических опухолевых заболеваний, в том числе неходжкинской лимфомы и острого лимфобластного лейкоза. Т-клеточная терапия химерным рецептором антигена (CAR) показала замечательную противоопухолевую активность против В-клеточных опухолей. В 2017 году Управление по санитарному надзору за качеством пищевых продуктов и лекарственных препаратов (FDA) одобрило две терапии CAR-T, что дало шанс на ремиссию и увеличение продолжительности жизни множеству пациентов. Наш обзор посвящен эволюции CAR-T-клеток, способам их производства, а также будущим перспективам использования.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2019.
Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступила компания BioVitrum.
Способность иммунной системы выявлять и уничтожать возникающие опухоли известна давно. Иммунная система играет три основные роли в профилактике опухолей.
Во-первых, она защищает хозяина от вирусных опухолей, устраняя и подавляя вирусные инфекции.
Во-вторых, своевременная ликвидация патогенных микроорганизмов и быстрое устранение воспаления может предотвратить создание воспалительной среды, способствующей онкогенезу.
В-третьих, иммунная система может специфически распознавать и устранять опухолевые клетки на основе присутствия на их поверхности специфических антигенов или молекул, индуцированных клеточным стрессом.
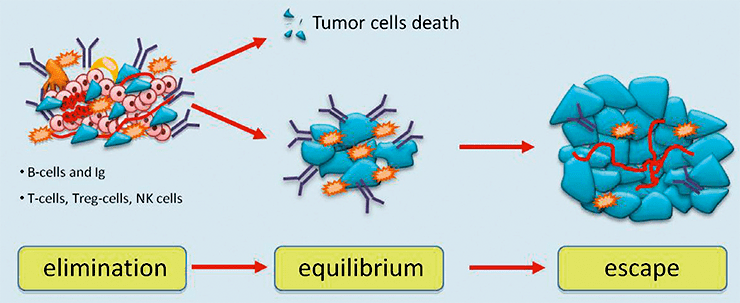
Третий процесс называется иммунным надзором, при котором иммунная система способна выявлять раковые и предраковые клетки и уничтожать их до того, как они начнут причинять вред организму. Несмотря на иммунный надзор, опухоли развиваются в присутствии функционирующей иммунной системы. Этот процесс делится на три стадии, или фазы: устранения, или элиминации (elimination), равновесия (equilibrium) и избегания (escape) (рис. 1) [1–4].
Рисунок 1. Три фазы иммуноредактирования рака. Различные иммунные реакции уничтожают опухоль. Однако некоторые опухолевые клетки могут вступить в фазу равновесия с иммунными клетками. Опухоль не увеличивается, но и не исчезает. Со временем опухолевые клетки могут выйти из-под иммунного надзора и расти, вызывая увеличение массы опухоли.
Фаза элиминации — это процесс обнаружения и уничтожения опухолевых клеток иммунной системой. Фаза элиминации завершается либо уничтожением всех опухолевых клеток, либо только их части. В случае частичной элиминации между иммунной системой и опухолью может развиться временное состояние равновесия.
В течение фазы равновесия опухолевые клетки могут оставаться в состоянии покоя или продолжать развиваться и накапливать мутации. Во время этой фазы иммунная система способна контролировать прогрессирование опухоли, но иммунный ответ все еще не может полностью уничтожить ее. При этом происходит отбор опухолевых клеток, которые способны подавлять иммунный ответ, приводящий к фазе избегания.
Во время фазы избегания иммунная система больше не может сдерживать прогрессирование опухоли. Противоопухолевый иммунный ответ существует в организме, но, к сожалению, он не настолько эффективен, чтобы полностью сдерживать мишень, в результате чего опухоль подавляет его.
Тем не менее данная концепция стала основой современной иммуноонкологии, включая клеточную адоптивную терапию, которая заключается в использовании иммунных клеток для лечения рака [5]. Клеточная терапия CAR-T является формой адоптивной терапии. Она привлекла к себе особое внимание благодаря успехам в клинических испытаниях уже двух одобренных FDA таких стратегий лечения опухолевых заболеваний [5].
Как и другие методы лечения опухолей, это не решает полностью проблему эффективности лечения, но предоставляет клиницистам еще один ресурс в их арсенал, который сегодня включает хирургические, химиотерапевтические, радиационные и иммунотерапевтические методы, в том числе использование антител, цитокинов, онколитических вирусов, биспецифических молекул [6].
Что такое CAR-T-клетки?
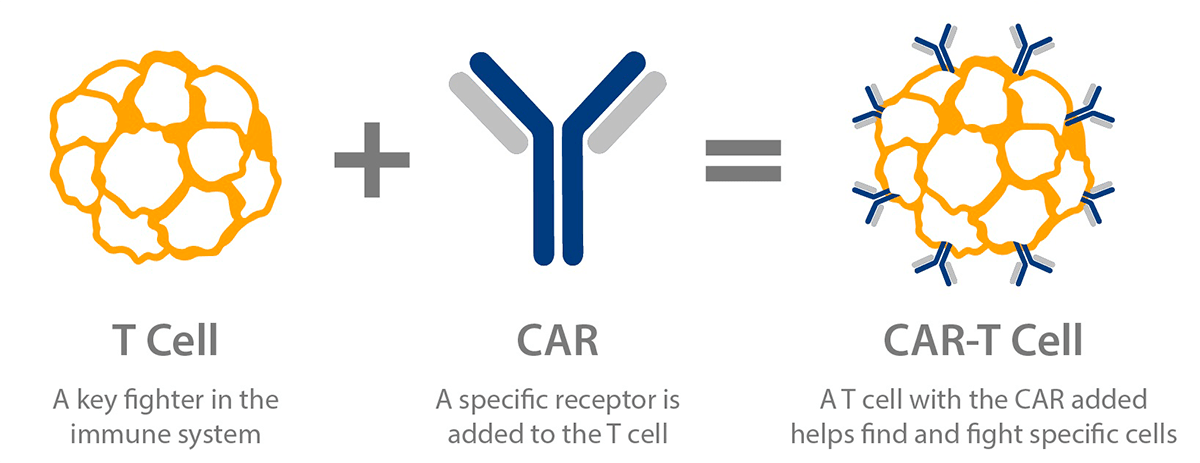
Т-клетки, несущие химерный антигенный рецептор, или CAR-T-клетки, — это генно-инженерные Т-клетки, выставляющие CAR на своей поверхности (рис. 2) [5]. CAR является модифицированным поверхностным рецептором, который прибавляет специфичность Т-клеткам к предварительно определенному антигену-мишени, выставленному на опухолевых клетках [5], [7]. Например, CD19 CAR-T-клетки несут на своей поверхности химерный рецептор, нацеленный против CD19 — трансмембранного белка, который синтезируется во всех лимфоцитах линии В, в том числе при В-клеточных лейкозах и лимфомах [5], [7], [8].
Рисунок 2. Схема CAR-T-клеток. Т-клетка несет на своей поверхности специфический рецептор, называемый химерным антигенным рецептором, который помогает находить определенные виды клеток и уничтожать их.
Структура и механизм действия CAR-T-клеток
Все Т-клетки берут свое начало в красном костном мозге, дифференцируясь из гемопоэтических стволовых клеток. Затем они мигрируют в тимус, который создает среду, необходимую для дальнейшей дифференцировки. Стадии дифференциации тимоцитов зависят от выставления на поверхность различных маркеров. На ранней стадии они не синтезируют корецепторы (CD4 и CD8), поэтому называются двойными негативными. На следующей стадии производятся оба рецептора. Такие тимоциты носят название двойных позитивных. В конце концов, клетки начинают выставлять на поверхность только один из корецепторов. При выставлении CD8 Т-клетка связывается с МНС (главным комплексом гистосовместимости) I класса и в дальнейшем становится эффекторной клеткой, то есть цитотоксическим Т-лимфоцитом; а при выставлении CD4 — с МНС II класса, и становится Т-хелпером, то есть помощником [10–14].
В итоге образуются наивные Т-клетки, которые успешно прошли селекцию, но не контактировали с антигеном. После распознавания антигена, Т-клетки активируются и начинают выполнять свои функции в организме [11].
Рисунок 3. Т-клеточный рецепторный комплекс
Т-клеточный рецептор (TCR) выставляется на поверхность зрелых Т-клеток. Он состоит из двух цепей и принадлежит суперсемейству иммуноглобулинов. Цепи имеют сходное строение и могут принадлежать двум классам: альфа и бета, гамма и дельта. Более 95% зрелых Т-клеток имеют рецептор с альфа- и бета-цепями. Однако только один Т-клеточный рецептор не способен активировать Т-клетку. Он является частью рецепторного комплекса, который в сочетании с несколькими структурами обеспечивает возникновение сигнала (рис. 3). К этим структурам относятся: CD3-комплекс (CD3γ-, CD3δ-, CD3ε-цепи) и ζ-цепи, которые содержат ITAMs (immunoreceptor tyrosine-based activation motifs). После распознавания антигена происходит фосфорилирование тирозиновых остатков ITAMs, в результате чего запускается весь сигнальный каскад. Такой сигналинг называется сигналом 1, он необходим, но не достаточен для активации Т-клеток. Для активации необходимо сочетание сигнала 1 и сигнала 2. Сигнал 2 — это взаимодействие корецептора с соответствующим лигандом на той же антигенпрезентирующей клетке [10–13].
Костимулирующие рецепторы стабилизируют взаимодействие антигенного рецептора и комплекса «пептид—МНС», которое может быть непрочным и недостаточно продолжительным для активации рецептора [11], [12]. Также наличие двух сигналов необходимо для того, чтобы активация клеток происходила только тогда, когда она нужна. Активированный Т-лимфоцит убивает зараженную клетку или выделяет цитокины, привлекающие другие иммунные клетки [11].
Таким образом, Т-клеточный рецептор состоит из антиген-специфических α- и β-цепей, связанных с комплексом CD3, который определяет целевой антиген, представленный в контексте главного комплекса гистосовместимости (МНС) [4], [5].
Рисунок 4. Структура химерного антигенного рецептора (CAR)
Основной задачей химерных рецепторов является использование цитотоксического потенциала Т-лимфоцитов путем замены собой TCR. Химерными они называются потому, что «собраны» в единый рецептор из комплексов различного происхождения [13].
CAR включает эктодомен, трансмембранный домен и эндодомен (рис. 4).
Все эти домены методами генной инженерии собраны в одну аминокислотную последовательность, то есть кодируются одним геном. Такая структура позволяет целенаправленно активировать Т-лимфоциты при контакте с клетками-мишенями и не зависеть от МНС, то есть появляется возможность распознавать любые антигены, а не только пептидные [12], [16].
Эволюция CAR-T-клеток
Начала CAR
Иммунологи годами боролись за то, чтобы перепрограммировать иммунную систему для борьбы с раком. Достижения в области ретровирусных систем, используемых для генетической инженерии иммунных клеток, впервые продемонстрировали многообещающие результаты с рецепторами Т-клеток, предназначенными для нацеливания на опухолевые пептиды [17], [18]. Положительные результаты были замечены, в частности, при синовиальной саркоме и меланоме, но методы лечения на основе TCR ограничены вариантами главного комплекса гистосовместимости, которые уменьшают количество потенциальных пациентов: многообразие этих белков настолько велико, что каждый человек обладает индивидуальным набором [8].
Учитывая все ограничения, Зелиг Эшхар первым выработал концепцию и получил первую Т-клетку с химерным рецептором, который впоследствии стал известен как рецептор химерного антигена (CAR) [19].
Т-клеточный рецептор включал ζ-сигнальный домен CD3, подобно TCR, но заменял субъединицы α и β одноцепочечным вариабельным фрагментом (scFv) из антитела (рис. 5). Этот единственный маневр после более чем десяти лет исследований и улучшений превратился в первую чрезвычайно успешную целевую иммунотерапию при рецидивах и рефрактных злокачественных новообразованиях В-клеток [8].
Рисунок 5. Схема строения TCR и CAR первого поколения. а — Эндогенный TCR при обнаружении комплекса пептид—МНС на антигенпрезентирующей клетке обеспечивает сигнал 1 через домен CD3-дзета. Полная активация не достигается, пока не будет обеспечен сигнал 2 (например, взаимодействие CD80—CD28). б — CAR-клетки 1 поколения основаны на МНС-независимом взаимодействии для обеспечения сигнала 1, однако не происходит полной активации вследствие отсутствия дополнительной стадии костимуляции.
CAR первого поколения проявляли активность в доклинических исследованиях, однако ранние испытания на людях показали минимальную активность из-за неполной активации Т-клеток [5], [8].
Второе и третье поколения
Наблюдения Мартина Пуля за пациентами, получившими CAR-T-клетки первого поколения, показали ограничения такого вида терапии [20]. После инфузии CAR-T-клеток только у 5 из 11 пациентов были обнаружены циркулирующие CAR-T-клетки. Это говорит о том, что у некоторых пациентов CAR-T-клетки взаимодействовали с антигенами опухоли (сигнал 1). То есть они были способны успешно нацеливаться и взаимодействовать с злокачественными клетками, но не способны их уничтожить, так как им не удавалось полностью активироваться (отсутствовал сигнал 2). У остальных пациентов не были обнаружены CAR-T-клетки, так как активация не происходила. Одной из причин отсутствия активации являлось то, что многие раковые клетки, особенно при остром лимфоцитарном лейкозе, подавляют действие иммунных клеток, вмешиваясь в костимуляторный сигналинг [8], [21].
Этот барьер был преодолен в ходе разработки CAR второго и третьего поколений (рис. 6). CAR второго поколения пытались обойти это ограничение путем включения костимуляторного домена непосредственно в рецептор [3], [5]. Костимулирующие молекулы работают в тандеме с CD3: CD3, обеспечивая активацию Т-клеток, усиливают пролиферацию и выживаемость клеток, а также обеспечивают выработку цитокинов [8]. Существует несколько доменов-кандидатов, но чаще всего используются CD28 и 4-1BB (CD137).
Рисунок 6. Схема строения CAR-T-клеток второго и третьего поколений. а — Интеграция CD3-ζ и костимуляторного домена в одном и том же рецепторе дает CAR 2 поколения способность полностью активировать Т-клетки за один этап. б — CAR 3 поколения включают два костимулирующих домена с CD3-ζ.
Таким образом, добавление костимулирующей молекулы к ζ-домену CD3 значительно усиливает функцию CAR-T-клеток. Важно, что это достигается за счет одного взаимодействия с антигеном-мишенью, а не с помощью многоэтапного процесса, зависящего от активированных антигенпрезентирующих клеток. Кроме того, отрицательные иммуномодуляторы, такие как регуляторные Т-клетки или другие иммуносупрессивные сигналы от опухолей или микроокружения, не влияют на костимуляцию CAR, по крайней мере, в течение начального периода действия [8].
К сожалению, CAR третьего поколения, содержащие CD3-ζ и два костимуляторных домена, не были более успешными, чем их аналоги второго поколения [22]. Несмотря на эффективное уничтожение опухолевых клеток в кратковременных анализах цитотоксичности in vitro, тестирование in vivo не было настолько эффективным. Во-первых, это могло быть связано с чрезмерной активаций CAR-T-клеток, что приводило к потере аутотолерантности и последующему апоптозу. Во-вторых, у ряда пациентов наблюдалось ингибирование активности CAR-T-клеток [23].
Четвертое и последующие поколения
В дополнение к CAR второго и третьего поколений были созданы «бронированные» CAR, или CAR четвертого поколения (рис. 7) [5]. Они были получены путем добавления доменов, кодирующих иммуностимулирующие цитокины (IL-2, IL-12, IL-8, IL-15, IL-18). Их добавление к основанию конструкций второго поколения позволяет увеличить экспансию CAR-T-клеток, в то же время делая их устойчивыми к иммуносупрессивной среде опухоли. Однако чрезмерная экспрессия иммуностимулирующих цитокинов может привести к ряду побочных эффектов, поэтому необходимо уделить особое внимание безопасности данного вида терапии [24].
Рисунок 7. Структура CAR четвертого и последующих поколений. CAR четвертого поколения были основаны на CAR второго поколения в паре с конститутивно или индуцибельно синтезируемым хемокином (например, IL-12).
Пятое и следующие поколения также основаны на CAR 2 поколения с добавлением внутриклеточных доменов цитокиновых рецепторов [22].
Применение CAR-T-терапии
Клинические испытания CAR-T-клеток в лечении злокачественных новообразований В-клеток разворачивались быстро. В-клетки являются привлекательной мишенью, так как несут на своей поверхности специфические молекулы, такие как CD19, CD20 и CD22, которые не характерны для других типов клеток. Результаты доклинических исследований показали, что опухоли В-клеток могут быть уничтожены CAR-T-клетками. Первые клинические исследования на пациентах с хроническим лимфолейкозом, острым лимфоцитарным лейкозом и неходжкинской лимфомой показали замечательные противоопухолевые эффекты CD19-специфических CAR-T-клеток [6]. В настоящее время CAR-T-клеточная терапия одобрена FDA в качестве стандарта лечения некоторых форм агрессивной, рефрактерной неходжкинской лимфомы и пациентов с рецидивирующим или рефрактерным острым лимфобластным лейкозом в возрасте до 25 лет [8], [25], [26].
Кроме того, на стадии клинических исследований находятся CAR-T-клеточные терапии для других форм онкогематологических заболеваний, например, В-крупноклеточной лимфомы, хронического лимфолейкоза, малой лимфоцитарной лимфомы [6–8], [26].
Таким образом, в основном CAR-T-терапия используется при гематологических злокачественных новообразованиях, когда неконтролируемое размножение и рост злокачественных клеток затрагивает саму кровь, костный мозг, лимфу и ликвор [8].
Однако эти успехи еще не были воспроизведены на арене сóлидных (плотных) опухолей.
Эффективность CAR-T-клеток при гематологических злокачественных новообразованиях частично может быть объяснена наличием лучшего доступа к опухолевым клеткам в костном мозге и лимфатических узлах, где обычно перемещаются T-клетки [8]. Распознавание сóлидных опухолей требует выхода терапевтических Т-клеток из крови в опухоль, а многие злокачественные новообразования развиваются так, что их инфильтрация затруднена. В данном случае может быть эффективным региональное, а не системное введение CAR-T-клеток [8].
Также в отличие от гематологических злокачественных новообразований, терапия сóлидных опухолей встречает на своем пути множество проблем. Помимо неполной активации CAR первого поколения, одним из возможных объяснений недостаточной эффективности T-клеток CAR в сóлидных опухолях может быть микроокружение опухоли, которое часто является иммуносупрессивным, или неэффективный перенос Т-клеток CAR в опухоль [8].
Побочные эффекты CAR-T-терапии
Однако нужно быть реалистами. CAR-T-клетки — это не чудодейственное лекарство от рака. CAR-T-терапия, как и другие методы лечения онкологических заболеваний, имеют нежелательные эффекты. Несмотря на то, что эта терапия работает там, где другие методы бессильны, у нее довольно много тревожных и потенциально смертельных токсических побочных эффектов.
Существует несколько механизмов, влияющих на развитие побочных эффектов при инфузии CAR-T-клеток. Во-первых, это влияние на мишень, которое возникает в результате интенсивного высвобождения цитокинов из Т-клеток CAR. Во-вторых, это повреждения, нанесенные нормальной ткани в результате производства ею антигена-мишени либо белка, перекрестно взаимодействующего с CAR. Также в ряде исследований сообщалось об аллергических реакциях и синдроме лизиса опухоли — метаболического нарушения, вызванного гибелью большого количества клеток опухоли за короткий период времени, при котором их содержимое попадает в кровь [5], [8], [27]. В литературе наиболее часто упоминаются два специфических эффекта: синдром высвобождения цитокинов и нейротоксичность [5], [8], [28].
В рамках своих обязанностей, связанных с иммунитетом, Т-клетки высвобождают цитокины — химические мессенджеры, которые помогают стимулировать и направлять иммунный ответ. В случае цитокинового шторма происходит быстрое и массивное выделение цитокинов в кровоток, что может привести к опасно высокой температуре и резким падениям артериального давления (рис. 8) [5].
Рисунок 8. Цитокиновый шторм. У пациентов с массивной опухолью высок риск развития тяжелого цитокинового шторма. Ранними маркерами являются высокие уровни IL-6, IL-15, IL-8 INF-γ до введения или в течение одного дня после введения. Поэтому стандартом применения CAR-T-терапии является обязательная госпитализация пациента.
Синдром цитокинового шторма характеризуется высокими уровнями интерлейкина-6 (IL-6) и интерферона-γ (IFN-γ). Для его предупреждения используется тоцилизумаб — антагонист IL-6, одобренный FDA [5], [8]. Глюкокортикоиды показаны при отсутствии быстрого ответа на тоцилизумаб [5].
Нейротоксичность была отмечена множеством исследовательских групп, тестирующих CD19 CAR-T-клетки [5], [8]. Обычно сообщаемые симптомы включают головную боль, делирий, афазию, очаговый неврологический дефицит, судороги и потерю сознания. Патофизиология неврологических симптомов еще не выяснена, но обычно она полностью обратима, за исключением нескольких случаев фатального кровоизлияния в мозг или отека [5].
Как и в случае с другими методами иммуномодуляции, лечение Т-клетками CAR может предрасполагать к инфекциям. Пациенты, получающие Т-клетки CAR, часто страдают лимфопенией и нейтропенией, что делает их восприимчивыми к оппортунистическим инфекциям [5], [8].
Механизмы сопротивления опухолей
Существует несколько механизмов развития устойчивости к CAR-T-терапии: антиидиотипические антитела, утрата опухолевого антигена, мутация антигенного гена, встраивание CAR в лейкемические клетки [5], [29].
ScFv, используемые для производства CAR, могут быть получены из мышиных моноклональных антител. На данный фрагмент может выработаться иммунный ответ, который ингибирует действие CAR-T-клеток, что делает терапию неэффективной [1]. Для решения проблемы можно использовать человеческие scFv, которые устранят образование антител против мышиных последовательностей, но вероятность появления антиидиотипических антител все же сохраняется [5].
Пониженная регуляция или потеря презентации целевого антигена на лейкозных клетках является механизмом, приводящим к рецидиву опухоли [30]. Значительный объем данных в этом отношении поступает из исследований, включающих использование анти-CD19 CAR. Утрата презентации антигена и переключение опухолевой линии на синтез другого антигена являются двумя различными способами потери CD19, описанными в литературе [5]. Если после ремиссии происходит рецидив с утратой целевого антигена, то развивается фенотипически сходное заболевание. В случае CD19-клеток, переключение клонов приводит к фенотипически различному, но генетически связанному злокачественному новообразованию, например, острому миелолейкозу [5], [30]. Разработка CAR, нацеленных на более чем один антиген, может потенциально помочь в преодолении утраты антигена.
В 2018 году описан случай, когда ген CAR был случайно включен в лейкозную B-клетку во время конструирования T-клеток. Это, в свою очередь, привело к получению продукта, который связывался с эпитопом CD19 на поверхности лейкозной клетки и, следовательно, маскировал его от распознавания терапевтическими Т-клетками. У пациента отмечался рецидив. Пациент получил спасательную химиотерапию и иммунотерапию, но в конце концов скончался [5], [7].
Производство CAR-T-клеток
Несмотря на различные конструкции, процедура производства CAR-T-клеток остается неизменной. Она включает в себя сбор у пациента Т-клеток с их последующей обработкой и подготовкой: активацией Т-клеток, их генетической модификацией, крупномасштабной экспансией, формованием [8].
Далее более подробно рассмотрим каждый из этапов производства (рис. 9).
Рисунок 9. Схема производства CAR-T-клеток
1. Источник Т-клеток. Поскольку зарегистрированные CAR-T — аутологичная клеточная терапия, процесс производства CAR-T-клеток начинается со сбора мононуклеарных клеток периферической крови у пациента, обычно с помощью лейкафереза. Врачи выбирают подходящее время для сбора на основе схемы лечения, чтобы обеспечить достаточное количество Т-лимфоцитов. Ориентировочно необходимо 100×10 6 клеток, следовательно, сбор желательно проводить до курсов химиотерапии [8], [31].
2. Обработка Т-клеток. Собранные продукты лейкафереза могут быть обработаны различными способами в зависимости от дальнейших процедур. Т-клетки отбираются с помощью проточного центрифугирования. Обработанный исходный материал может быть использован непосредственно для последующей процедуры или криоконсервирован для будущего использования [8], [31].
3. Т-клеточная активация. Для дальнейшей трансдукции необходимо активировать клетки. Существует множество методов активации, но обычно используется синтетический поликлональный активатор, связывающийся с рецепторами CD3 и CD28 [20].
4. Генетическая модификация Т-клеток. Современные методы модификации Т-клеток в значительной степени основаны на стабильной экспрессии CAR при доставки вирусными и невирусными системами переноса генов. Существует три основных подхода к стабильной экспрессии генов:
Ретровирусы, γ-ретровирус (γ-RV) и лентивирусы (LV), остаются основным механизмом трансдукции Т-клеток [8]. Вирусные векторы обеспечивают высокую эффективность переноса генов и стабильный уровень экспрессии CAR. Однако ретровирусные векторы представляют собой сложные биологические реагенты, которые требуют постоянного и дорогостоящего тестирования биобезопасности. Также существует высокий риск возникновения в них спонтанных мутаций, которые могут привести к развитию онкологических заболеваний [5], [8], [31].
Относительно новая система экспрессии на основе плазмидной системы транспозон/транспозаза обладает рядом преимуществ: простая производственная процедура и относительно низкая стоимость. Однако интеграция конструкта является случайной и, соответственно, представляет потенциальный онкогенный риск. При этом исследования показали низкую токсичность для Т-клеток. Однако эффективность CAR-T-клеток, получаемых этим методом, еще предстоит продемонстрировать [8], [32].
Использование матричной РНК для трансфекции обеспечивает кратковременную экспрессию в цитоплазме. В этом процессе не происходит никакой геномной интеграции, и поэтому устраняются проблемы генотоксичности [8], [31].
5. Экспансия CAR-T-клеток. Этот процесс происходит в биореакторе в течение нескольких дней под действием цитокинов (IL-2, IL-7, IL-15), поддерживающих пролиферацию Т-клеток [31].
6. Промывка и концентрирование продукта [31].
7. Контроль качества клеточного продукта [31]. Согласно правилам GMP, качество продукта закладывается при его разработке и проверяется на каждом этапе производства. В связи со сложной природой клеточных продуктов необходимо тщательно продумать список тестов, чтобы обеспечить безопасность, чистоту и эффективность.
Так, безопасность CAR-T-клеток определяется по отсутствию загрязнителей: эндотоксина, микоплазмы, компетентного по репликации ретровируса. Чистота продукта зависит от соотношения количества определенных уровней активированных и неактивированных CD3+ и CAR+ Т-клеток CAR. Примеси, такие как нежелательные типы клеток, опухолевая нагрузка и др., должны быть ниже определенных установленных уровней [33]. До настоящего времени активность клеток CAR-T часто определяли анализом цитотоксических Т-лимфоцитов in vitro или секрецией интерферона-γ [33].
8. Криоконсервация для удобства транспортировки [31].
9. Инфузия пациенту готового продукта [31].
Доставка персонализированных лекарств зависит от параметров высвобождения сложных биологических молекул, входящих в их состав. Качество клеточных продуктов CAR-T изменяется от донора к донору, но также в значительной степени зависит от условий производства, качества и доступности вспомогательного сырья и материалов [31].
Производство CAR-T должно соответствовать требованиям GMP. Согласно им, чистые помещения должны быть надлежащим образом оборудованы системами обеспечения условий окружающей среды (кондиционер), оборудованием для мониторинга окружающей среды (счетчик частиц), технологическим (биореакторы) и аналитическим (автоматические счетчики клеток) оборудованием. Еще одним ключевым компонентом GMP-производства является наличие высококвалифицированного персонала, обладающего обширными знаниями в области производства [31].
Тщательное документирование и своевременный анализ производственных процессов являются важной частью GMP-производства и необходимы для успешного выполнения сложной процедуры изготовления клеток CAR-T [33].
Производство включает в себя использование различных вспомогательных компонентов (культуральной среды, цитокинов, реагентов для генетической модификации, криоконсервации и т.д.). Все материалы и сырье, используемое при производстве клеточного продукта, должны пройти тщательный контроль [33].
Будущие направления
Разработка CAR-T-клеток, которые успешно убивают свои клетки-мишени, является сложной задачей. Вероятно, может потребоваться разработка нескольких CAR для нескольких мишеней одной и той же опухоли, поскольку опухоль стремится ускользнуть от действия терапии. Так, у пациентов с лейкемией, получавших иммунотерапию, направленную на CD19, через некоторое время обнаруживаются CD19-отрицательные клоны [8]. Ориентация на несколько антигенов опухоли, конечно, добавит трудностей в и без того сложный процесс разработки успешной терапии, однако это поможет в борьбе с резистентностью опухолевых клеток.
Другим подходом к нацеливанию на опухолевые антигены может стать разработка одного универсального CAR. Например, CAR, нацеленный на биотин. В этом случае пациенту предварительно вводят биотинилированные моноклональные антитела к опухолевым антигенам — таким образом происходит маркировка опухолевых клеток. Затем уже вводят CAR-T-клетки со специфичностью к биотину (рис. 10). Такие препараты уже разрабатываются и сейчас находятся на ранних стадиях доклинических исследований [35].
Рисунок 10. Механизм действия CAR-T-клеток, нацеленных на биотин
Разрабатываются различные методы усиления иммунотерапии и модуляции микроокружения для обеспечения более эффективного эндогенного иммунного надзора за опухолями [5], [8]. То есть вместо того, чтобы блокировать ингибирующие сигналы с помощью моноклональных антител, они заменяются на стимулирующие. Например, это может быть достигнуто добавлением второго химерного рецептора PD-1 в сигнальный домен CD28 CAR-T-клеток. Рецептор PD-1 выставляется на поверхность активированных Т- и В-клеток. Он относится к иммунологическим контрольным точкам, которые участвуют в регуляции иммунного ответа. Взаимодействие PD-1 с лигандом PD-L1 на опухолевых клетках и клетках опухолевого микроокружения способствует подавлению противоопухолевого иммунного ответа [36], [37]. Использование PD-1 в качестве второго химерного рецептора обеспечивает дополнительную стимуляцию, которая преодолевает ингибирование [8]. Таким образом, механизмы, способствующие иммунологическому избеганию опухоли, могут быть использованы для устранения злокачественных новообразований.
Один из перспективных способов нацелить Т-клетки на опухоль — использование аллогенной (или полученной от здорового донора) CAR-T-терапии, где Т-клетки от здорового донора модифицированы для использования у нескольких пациентов. Тем не менее аллогенная терапия имеет свой собственный набор проблем, которые необходимо преодолеть, а именно: опасный для жизни побочный эффект, называемый реакцией трансплантата против хозяина. Он возникает, когда донорские CAR-T-клетки распознают клетки пациента как чужеродные и атакуют их. Однако большинство разработок CAR-T-терапий, нацеленных на B-клеточные опухоли, в настоящее время направлены на использование аллогенных Т-клеток [6–8].
Несмотря на ранний успех, область CAR-T-клеточной терапии все еще находится в стадии становления, и пройдет некоторое время, прежде чем она увидит свет в качестве традиционной терапии. Время, необходимое для подготовки пациентов к инфузии, высокая цена самой терапии и значительные расходы на здравоохранение, связанные с ее назначением, являются существенными ограничивающими факторами для обеспечения доступности такой терапии широкому кругу пациентов [8].
Дальнейшие исследования в области Т-клеточной терапии должны привести к более быстрому производству, расширению использования готовых продуктов с более низкой токсичностью, что поможет сделать CAR-T-терапию более дешевой и доступной.
Car t клеточная терапия в россии
КОММЕРЧЕСКИЕ ПРЕПАРАТЫ ДЛЯ КЛЕТОЧНОЙ ТЕРАПИИ НА ОСНОВЕ CAR T
Первым препаратом на основе CAR T-клеток, представленным для регистрации Управлению по контролю над качеством пищевых продуктов и лекарственных средств США (FDA), был тисагенлеклейсел Т для лечения пациентов в возрасте не старше 25 лет с рецидивирующим или рефрактерным В-клеточным острым лимфобластным лейкозом (В-ОЛЛ). Самым последним препаратом, зарегистрированным FDA, был идекабтаген виклейсел для лечения пациентов с рецидивирующей или рефрактерной множественной миеломой. Между этими двумя ключевыми препаратами были зарегистрированы еще пять препаратов: аксикабтаген силолейсел, тисагенлеклейсел (два отдельных регистрационных удостоверения), брексукабтаген аутолейсел и лисокабтаген маралейсел для лечения агрессивной и медленно прогрессирующей В-клеточной неходжкинской лимфомы (таблица 1).
Таблица 1. Коммерческие препараты для CAR T-клеточной терапии.
| Наименование | Показание | Дата регистрации FDA | Производитель | Описанные данные исследований |
|---|---|---|---|---|
| Тисагенлеклейсел | 30 августа 2017 г. | «Новартис» | Опорное исследование ELIANA [1] и исследование в условиях реальной клинической практики [2] | |
| Аксикабтаген силолейсел | Р/Р крупноклеточная В-клеточная лимфома (ДКВКЛ, ПМВКЛ, В-клеточная лимфома высокой степени злокачественности, трансформированная ФЛ) | 18 октября 2017 г. | «Кайт Фарма» | Опорное исследование ZUMA-1 [3] и исследование в условиях реальной клинической практики [4] |
| Тисагенлеклейсел | Взрослые пациенты Р/Р ДКВКЛ | 1 мая 2018 г. | «Новартис» | Опорное исследование JULIET [5] и исследование в условиях реальной клинической практики [2] |
| Брексукабтаген аутолейсел | Мантийноклеточная лимфома | 24 июля 2020 г. | «Кайт Фарма» | Опорное исследование ZUMA-2 [79] |
| Лисокабтаген маралейсел | Р/Р крупноклеточная В-клеточная лимфома | 5 февраля 2021 г. | «Джуно Терапьютикс» | Опорное исследование TRANSCEND NHL001 [51] |
| Аксикабтаген силолейсел | Р/Р ФЛ | 5 марта 2021 г. | «Кайт Фарма» | Опорное исследование ZUMA-5 [20] |
| Идекабтаген виклейсел | Множественная миелома | 26 марта 2021 г. | «BMS» и «Блюберд Био» | Опорное исследование KarMMa (данные не опубликованы) |
Сокращения: ДКВКЛ – диффузная крупноклеточная В-клеточная лимфома; FDA – Управление по контролю качества пищевых продуктов и лекарственных средств США; ФЛ – фолликулярная лимфома; ПМВКЛ – первичная медиастинальная В-клеточная лимфома; Р/Р – рецидивирующий/рефрактерный.
Эти препараты изготавливаются из аутологичных клеток, полученных от пациента методом афереза, и содержат химерный антигенный рецептор (CAR), действие которого направлено на ассоциированный с заболеванием линейный антиген (CD19 для B-клеточных гемобластозов, BCMA для множественной миеломы). Трансген CAR внедряется в клетки с использованием ретровирусного (аксикабтаген и брексукабтаген) или лентивирусного (все остальные препараты) вектора с дефектом репликации и содержит костимулирующую молекулу (CD28 для аксикабтагена и брексукабтагена; CD137, также известный как 4-1BB, для всех остальных препаратов). Согласно требованию FDA, перед инфузией препарата необходимо проведение лимфодеплеции, включающей флударабин и циклофосфамид (кроме применения тисагенлеклейсела у взрослых пациентов с В-клеточной неходжкинской лимфомой, которым вместо этого можно назначить бендамустин или полностью отказаться от химиотерапии, если количество лейкоцитов у пациента составляет 1×10 9 /л или менее за неделю до инфузии). Лисокабтаген уникален тем, что содержит заданное соотношение CD4 и CD8 клеток, равное 1:1.
Примечательно, что все эти продукты CAR T-клеток зарегистрированы регуляторным органом на основании исследований, проведенных в одной группе, со средним объемом выборки (92 пациента с детским ОЛЛ, 74-344 пациента с неходжкинской лимфомой и 140 пациентов с множественной миеломой). Последующие сообщения по результатам регистровых исследований в реальной клинической практике в значительной мере подтвердили данные, полученные в опорных исследованиях: частота полного ответа (ПО) на тисагенлеклейсел у пациентов с В-ОЛЛ составила 81% в опорном исследовании ELIANA и 86% в популяции из 255 пациентов, проходивших лечение в условиях реальной клинической практики, а расчетная 12-месячная бессобытийная выживаемость составила 50% и 52% соответственно [1,2]. При лечении крупноклеточной В-клеточной лимфомы аксикабтагеном в опорном исследовании ZUMA-1 ПО и 12-месячная выживаемость без прогрессирования составили 58% и 44% соответственно по сравнению с 64% и 45% соответственно в популяции из 275 пациентов в условиях реальной клинической практики [3,4]. В опорном исследовании JULIET частота ПО при лечении крупноклеточной В-клеточной лимфомы тисагенлеклейселом составила 40% по сравнению с 40% в популяции из 155 пациентов в условиях реальной клинической практики [2,5]. Эти результаты обобщены в таблице 2.
Таблица 2. Результаты применения коммерческих и перспективных препаратов для CAR T-клеточной терапии.
| Наименование | Исследование | Пациенты | Ответы | Выживаемость |
|---|---|---|---|---|
| Дети и молодые люди (в возрасте ≤25 лет). Пациенты с Р/Р острым лимфобластным лейкозом | ||||
| Тисагенлеклейсел | Опорное исследование ELIANA [1] | 92 включены, 75 проходили лечение | По протоколу: ПО/нпПО, 81% через 3 месяца | По протоколу: БСВ, 50%; ОВ, 76% (12 месяцев) |
| Тисагенлеклейсел | Исследование в условиях реальной клинической практики [2] | 255 проходили лечение | ПО, 86% | БСВ, 52%; ОВ, 77% (12 месяцев) |
| Р/Р крупноклеточная В-клеточная лимфома | ||||
| Аксикабтаген силолейсел | Опорное исследование ZUMA-1 [3] | 111 включены, 101 проходил лечение | ОЧО 82%; ПО, 58% | ВБП, 44% (12 месяцев); ОВ, 52% (18 месяцев) |
| Аксикабтаген силолейсел | Исследование в условиях реальной клинической практики [4] | 275 проходили лечение | ОЧО 82%; ПО, 64% | ВБП, 45%; ОВ, 64% (12 месяцев) |
| Аксикабтаген силолейсел | Исследование в условиях реальной клинической практики [50] | 122 | ОЧО, 70%; ПО, 50% | ОВ, 57% (12 месяцев) |
| Тисагенлеклейсел | Опорное исследование JULIET [5] | 165 включены, 93 проходили лечение | ОЧО, 52%; ПО, 40% | БРВ, 65%; ОВ, 49% (12 месяцев) |
| Тисагенлеклейсел | Исследование в условиях реальной клинической практики [2] | 155 проходили лечение | ОЧО, 62%; ПО, 40% | ВБП, 39%; ОВ, 71% (6 месяцев) |
| Лисокабтаген маралейсел | Опорное исследование TRANSCEND NHL001 [51] | 344 выполнялся аферез, 269 проходили лечение, у 256 получены данные, пригодные для оценки эффективности | ОЧО, 73%; ПО, 53% | ВБП, 44%; ОВ, 58% (12 месяцев) |
| Мантийноклеточная лимфома | ||||
| Брексукабтаген аутолейсел | Опорное исследование ZUMA-2 [79] | 74 включены, 68 проходили лечение | ОЧО, 93%; ПО, 67% | ВБП, 61%; ОВ, 83% (12 месяцев) |
| Р/Р фолликулярная лимфома | ||||
| Аксикабтаген силолейсел | Опорное исследование ZUMA-5 [20] | 123 проходили лечение (только пациенты с фолликулярной лимфомой) | ОЧО, 94%; ПО, 80% | ВБП, 74%; ОВ, 93% (12 месяцев) |
| Множественная миелома (BCMA) | ||||
| Идекабтаген виклейсел | Опорное исследование KarMMa [115] | 140 включены, 128 проходили лечение (в нарастающих дозах) | ОЧО, 73%; ПО, 33%; Без МОЗ, 26% | Медиана ВБП, 8,8 месяца; ОВ, 78% (12 месяцев) |
Сокращения: ПО – полный ответ; нпПО – ПО с неполным гематологическим восстановлением; БСВ – бессобытийная выживаемость; без МОЗ – без минимального остаточного заболевания; ОЧО – общая частота ответа; ОВ – общая выживаемость; ВБП – выживаемость без прогрессирования; БРВ – безрецидивная выживаемость; Р/Р – рецидивирующий/рефрактерный.
Для назначения CAR T-клеточной терапии в Соединенных штатах медицинский центр должен быть аккредитован Организацией по аккредитации клеточной терапии (Foundation for Accreditation of Cellular Therapy), а лечащий врач должен пройти обучение в соответствии со стратегией оценки и снижения рисков в рамках программы по оценке безопасности лекарственного препарата, что определено FDA как обязательное условие. Пациенты должны оставаться в пределах досягаемости (обычно имеется в виду возможность доехать на машине за 2 часа) от медицинского центра, где проводится лечение, в течение не менее 4 недель после применения препарата, что связано с его возможными токсическими эффектами, такими как синдром высвобождения цитокинов и синдром нейротоксичности, ассоциированный с иммунными клетками, которые требуют особой бдительности, мониторинга и лечения. Все препараты, кроме тисагенлеклейсела, необходимо вводить в стационарных условиях, и пациента следует наблюдать ежедневно в течение как минимум 7 дней. Около 130 центров в США были аккредитованы для лечения пациентов тисагенлеклейселом и 35 центров – для лечения лисокабтагеном.
РАННИЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ CAR T-КЛЕТОК
Помимо упомянутых выше регистрационных исследований, в одноцентровых или небольших многоцентровых исследованиях изучали другие препараты на основе CAR T (таблица 3). Несмотря на ограничения, связанные с перекрестными сравнениями данных исследований, полученные клинические результаты оказались достаточно воспроизводимыми при оценке различных препаратов в разных медицинских учреждениях и разных странах. Это наблюдение указывает на надежность платформы CAR T-клеток и в некоторой степени позволяет прояснить вопросы взаимодействия CAR T-клеток с биологическими аспектами заболевания и организма пациента.
Таблица 3. Примечательные клинические исследования ранней фазы.
| Наименование | Ссылка | Пациенты | Исходы | Примечания |
|---|---|---|---|---|
| Острый лимфобластный лейкоз | ||||
| CART19 (определенный состав субпопуляции) | 59 | 29 взрослых пациентов | ПО, 93% | У некоторых пациентов наблюдались CD8 T-клеточно-опосредованные иммунные ответы против трансгенного CAR. Добавление флударабина к циклофосфамиду способствовало улучшению персистенции и ВБЗ. |
| CART19 (определенный состав субпопуляции) | 6 | 43 пациента детского возраста | ПО, 93% | Продолжительность персистенции Т-клеток была ассоциирована с фенотипическими и функциональными характеристиками препарата Т-клеток, а также CD19-антигенной нагрузкой на момент инфузии. |
| CART19 (долгосрочное наблюдение) | 12 | 53 взрослых пациента | ПО, 83%; медиана БСВ, 6,1 месяца; медиана OS, 12,9 месяца | У пациентов с 5% бластов в костном мозге до начала лечения наблюдалась более продолжительная ремиссия и лучшие профиль токсичности и выживаемость. |
| CART19 (FHCRC) | 13 | 53 взрослых пациента | ПО (без МОЗ), 85% | Описанными прогностическими для БСВ факторами были добавление флударабина и последующая alloHCT. |
| CART19 (Penn) | 14 | 35 взрослых пациентов, 20 пациентов получали оптимизированную терапию по фракционированной схеме в высоких дозах | ПО, 33% в группе терапии в низкой дозе; ПО, 90% в группе оптимизированной терапии в высокой дозе | Нерандомизированное применение последующей alloHCT сопровождалось более высокой БСВ. |
| CART19 (при В-ОЛЛ высокого риска) | 1 | 110 взрослых пациентов и детей | ПО, 93%; ПО без МОЗ, 87%; ВБЛ, 58%; ОВ, 64% (12 месяцев) | ВБЛ и ОВ у пациентов, получавших alloHCT, составили 77% и 79% по сравнению с 12% и 32% пациентов, которым alloHCT не проводили (нерандомизированные). |
| CART19 с низкой аффинностью (CARPALL) | 116 | 14 детей | ПО (без МОЗ), 86%; БСВ, 46%; ОВ, 63% (12 месяцев) | Согласно доклиническим данным, показавшим более высокую эффективность препаратов, связывающихся с CD19 с низкой аффинностью, по сравнению с каноническим клоном FMC63 |
| Коинфузия CAR19 и CAR22 | 15 | 51 взрослых пациентов и детей | ПО (без МОЗ), 96% | Только один рецидив с потерей антигена (CD19-ve, CD22-dim) |
| UCART19 | 17 | 7 детей, 14 взрослых пациентов | ПО/нпПО, 67%; ВБП, 27%; ОВ, 55% (6 месяцев) | alloCART здоровых, полученных от донора клеток с редактированным геномом; ответы наблюдались только у пациентов, получавших алемтузумаб в дополнение к FluCy лимфодеплеции. |
| Невирусный CIK CAR19 | 117 | 13 взрослых пациентов и детей | ПО у шести из семи пациентов, получавших препарат в дозе 3 × 106/кг | Невирусная система (на основе транспозона/транспозазы) |
| CART-22 | 16 | 58 детей и молодых пациентов | ПО, 70%; медиана ОВ, 13,4 месяца | Из 58 пациентов 51 ранее получал анти-CD19 терапию. Проявления по типу HLH наблюдались у 33% пациентов. |
| Р/Р крупноклеточная В-клеточная лимфома | ||||
| CART19 (долгосрочное наблюдение) | 118 | 43 (с ДКВКЛ, ПМВКЛ, ФЛ и ХЛЛ) | Медиана БСВ, 55 месяцев | ДО 3 года наблюдалась у 51% получавших лечение пациентов. В некоторых случаях ремиссия продолжается до 9 лет. |
| CART19 (после autoSCT) | 119 | 15 | ВБП, 30% (2 года) | Высокая частота CRS и ICANS |
| Невирусный CART19 (после autoSCT) | 120 | 7 | ВБП, 71%; ОВ, 86% (5 лет) | Невирусная система (на основе транспозона/транспозазы) |
| Тандемный CAR19/20 Китай | 28 | 33 | ОЧО, 79%; ПО, 71%; ВБП, 64% (12 месяцев) | Система двойной экспрессии тандемного CAR |
| Тандемный CAR19/20 Соединенные Штаты Америки | 121 | 22 (с НХЛ и ХЛЛ) | ОЧО 82%; ПО, 64% | Система двойной экспрессии CAR; исследование с повышением дозы, ПО 92% при применении в оптимальной дозе |
| NK CAR 19 из пуповинной крови | 27 | 11 (с НХЛ и ХЛЛ) | ОЧО, 73%; ПО, 64% | NK-клетки были произведены из стволовых клеток пуповинной крови. Трансген включал систему секреции ИЛ-5 и индуцируемого каспазой 9 «суицидального» переключения. |
| Хронический лимфоцитарный лейкоз | ||||
| CART-19 (MSKCC) | 30 | 16 проходили лечение, у 12 получены пригодные для оценки данные | ПО, 25% | Из трех пациентов, достигших ПО, два получали ибрутиниб на момент проведения лейкафереза и инфузии. |
| CART-19 (Penn) | 31 | 38 проходили лечение, у 32 получены пригодные для оценки данные | ОЧО, 44%; ПО, 28%; медиана ВБП, 1 месяц; медиана ОВ, 64 месяца | Рандомизированы в группы применения CAR T-клеток в низкой или высокой дозе; значимых различий по результатам не выявлено. |
| CART19 (одновременно с ибрутинибом; FHCRC) | 34 | 19 | ОЧО, 83%; ПО (без МОЗ), 61%; ВБП, 38% (1 год) | Небольшая степень тяжести CRS |
| Множественная миелома | ||||
| NCI | 35 | 16 | ОЧО, 81%; ПО/ОХЧО, 63%; медиана БСВ, 31 неделя | Вариабельная экспрессия BCMA; у одного пациента выявлена потеря BCMA. |
| Penn | 122 | 25 с повышением дозы | ОЧО, 48%; медиана ДО, 125 дней | В клетках остаточной ММ у ответивших на терапию отмечена сниженная экспрессия BCMA. |
| Bb2121 | 36 | 33 | ОЧО, 85%; ПО, 45%; медиана ВБП, 11,8 месяца | Повышение дозы с 50 до 800 × 106 CAR T-клеток. У некоторых пациентов отмечена персистенция CAR T-клеток до 1 года. |
| Legend LCAR-B38M | 37 | 57 | ОЧО, 88%; ПО, 68%; медиана ВБП, 15 месяцев | CAR, направленный на два разных эпитопа на BCMA. |
| JNJ-4528 (LCAR-B38M) | CART1TUDE-1 (неопубликованные данные) | 29 | ОЧО, 100%; сПО, 86% | ВБП, 86% (9 месяцев) |
| Миелоидные гемобластозы | ||||
| NKG2D (CYAD-01) | 123 | 7 | ОЧО, 0% | Повышение дозы; NCT03018405 – исследование с повышением дозы и периодом последующего наблюдения |
| CAR33 | 124 | 1 | ЧО | Сообщение о случае |
| CAR123 | 125 | 1 | Сообщение о случае | |
| CAR123 | 41 | 7 | ПО у 2/5 пациентов, получавших 2 × 10s CAR T-клеток | Аннотация |
| Лимфома Ходжкина | ||||
| Анти-CD30 CAR | 40 | 41; 32 с данными, пригодными для оценки ответа | ОЧО, 72%; ПО, 59%; ВБП, 36%; ОВ, 94% (1 год) | Первое масштабное исследование с применением CAR T-клеток при ЛХ |
Сокращения: alloCART – аллогенные CAR T-клетки; alloHCT – трансплантация аллогенных гемопоэтических клеток; B-ОЛЛ – B-клеточный острый лимфобластный лейкоз; CD19-ve – CD19-негативный; ХЛЛ – хронический лимфоцитарный лейкоз; ПО – полный ответ; нпПО – ПО с неполным гематологическим восстановлением; CRS – синдром высвобождения цитокинов; ВБЗ – выживаемость без признаков заболевания; dim – сниженный; ДВККЛ – диффузная крупноклеточная В-клеточная лимфома; ДО – длительность ответа; БСВ – бессобытийная выживаемость; ФЛ – фолликулярная лимфома; FluCy – флударабин/циклофосфамид; ЛХ – лимфома Ходжкина; HLH – гемофагоцитарный лимфогистиоцитоз; ICANS – синдром нейротоксичности, ассоциированный с иммунными клетками; ВБЛ – выживаемость без лекоза; ММ – множественная миелома; без МОЗ – без минимального остаточного заболевания; NK – естественный киллер; ОЧО – общая частота ответа; ОВ – общая выживаемость; ВБП – выживаемость без прогрессирования; ПМВКЛ – первичная медиастинальная В-клеточная лимфома; ЧО – частичный ответ; Р/Р – рецидивирующий/ремиттирующий; сПО – строгий полный ответ; SCT – трансплантация стволовых клеток; ОХЧО – очень хороший частичный ответ.
При В-ОЛЛ инфузия анти-CD19 CAR T-клеток неизменно способствует высокой частоте выраженного, измеримого ПО без признаков остаточного заболевания. Как показано в таблице 3, у 322 взрослых пациентов и детей в семи разных исследованиях частота ПО составила от 83% до 93%.
К сожалению, у многих пациентов наблюдается рецидив, и безрецидивная выживаемость через 12 месяцев составляет приблизительно 50%. У пациентов с персистирующими и сохраняющими свою функциональность CAR T-клетками (о чем свидетельствует продолжающаяся В-клеточная аплазия) рецидив чаще всего возникает вследствие потери CD19 [6,7]. Потеря CD19 происходит вследствие мутаций или эпигенетических изменений, вероятно, в уже существующих субклонах злокачественных клеток 10. Недостаточная экспансия или персистенция CAR T-клеток после инфузии препарата как причина неэффективности лечения при ОЛЛ встречается реже и может быть связана с наследственной или индуцированной дисфункцией Т-клеток [11]. Факторами, которые, по всей видимости, предохраняют от развития рецидива, являются длительность персистенции Т-клеток, низкая антигенная нагрузка и консолидирующая трансплантация аллогенных гемопоэтических стволовых клеток [6,12-14]. CAR T-клетки, специфичные более чем к одному B-клеточному антигену, можно использовать для уменьшения последствий ускользания от действия препаратов, не содержащих антиген клеток лейкоза, либо последовательно (например, применение анти-CD22 CAR T-клеток после неэффективности предшествующей CD19-специфичной терапии), либо одновременно (например, одновременная инфузия CART19 и CART22 или применение препаратов, содержащих CAR с двойной специфичностью) [15,16]. Еще одной примечательной недавней разработкой для лечения пациентов с В-ОЛЛ является применение Т-клеток, полученных от здоровых доноров, у которых вероятность развития реакции «трансплантат против хозяина» исключается благодаря «выключению» гена Т-клеточного рецептора. Следует отметить, что экспансия T-клеток и развитие клинических ответов, по-видимому, требуют добавления высокоактивного иммуносупрессивного анти-CD52 моноклонального антитела, алемтузумаба, для предотвращения иммунного отторжения этих несопоставимых с человеческим лейкоцитарным антигеном клеток [17].
При В-клеточной неходжкинской лимфоме частота ПО была ниже, чем при В-ОЛЛ, но эти ответы, как правило, были продолжительными. Например, долгосрочное последующее наблюдение в исследовании JULIET демонстрирует, что 60% ответивших на лечение пациентов через 5 лет все еще находились в ремиссии [18]. Механизмы, лежащие в основе неэффективности CAR T-клеточной терапии, при В-клеточной неходжкинской лимфоме изучены не так хорошо, как при В-ОЛЛ. В частности, экспансия или персистенция T-клеток коррелировала с ответом при лимфоме в меньшей степени, чем при В-ОЛЛ 19. Вместо этого более значимую прогностическую роль, по-видимому, играют исходная опухолевая нагрузка, характеристики препарата CART19 («память» и многофункциональность) и ответ на лимфодеплецию (повышение «благоприятных» цитокинов, таких как интерлейкин [ИЛ]-7, ИЛ-15 или моноцитарный хемоаттрактантный белок-1) 25. Примечательные недавние разработки включают исследование тандемных анти-CD19/CD20 CAR T-клеток, при применении которых частота ПО составила 71%, а 12-месячная выживаемость без прогрессирования – 64%, и первая демонстрация генно-инженерных анти-CD19 естественных киллеров, полученных из стволовых клеток пуповинной крови здорового человека, при применении которых частота ПО на раннем этапе наблюдения составила 64% [27,28].
Были опубликованы результаты ряда исследований со средним объемом выборки с изучением таргетной терапии множественной миеломы препаратами направленного действия на BCMA. Частота ПО в целом была высокой (45-86%), а медиана выживаемости без прогрессирования в некоторых более масштабных исследованиях составила 12-15 месяцев.
Однако при относительно коротком периоде наблюдения доказательств плато выживаемости было получено немного 36. В настоящее время разрабатывается новый подход с использованием невирусной (основанной на транспозоне/транспозазе) трансдукции в процессе, что приводит к относительному обогащению стволовыми Т-клетками памяти, более медленной кинетике экспансии Т-клеток и низкой частоте синдрома высвобождения цитокинов при общей частоте ответа 57% после однократного применения [39].
CD30 представляет собой валидированную мишень для иммунотерапии при лимфоме Ходжкина. Применение аутологичных анти-CD30 CAR T-клеток при лимфоме Ходжкина было изучено у 41 пациента в двух разных центрах, и частота ПО у 32 пациентов с количеством данных, достаточным для оценки, составила 59%. К сожалению, выживаемость без прогрессирования через 1 год составила всего 36% [40].
Как можно заметить, в литературе отсутствуют опубликованные данные исследований с применением CAR T-клеток при миелоидных гемобластозах. Имеются ранние свидетельства того, что CAR T-клетки могут оказывать действие при миелоидных гемобластозах, например, два из пяти пациентов с острым миелоидным лейкозом достигли ПО после инфузии анти-CD123 CAR T-клеток (данные опубликованы в виде абстракта) [41]. На момент написания статьи в 24 исследования по всему миру был открыт набор пациентов с острым миелоидным лейкозом, в семи исследованиях набор еще не начинался, три были досрочно прекращены, два отменены, одно исследование было активным, но без набора пациентов, и только одно исследование было завершено. Изучаемые мишени при миелоидных гемобластозах: CD123, CD33, CLEC12A или NKG2D лиганды при использовании аутологичных, аллогенных клеток или клеток от универсальных доноров с редактированным геномом.
Несмотря на установленную частоту ответа на лечение, его продолжительность и некоторые параметры, связанные с клиническими исходами, отдельные важные вопросы все еще остаются нерешенными.
МЕХАНИЗМЫ РАЗВИТИЯ И ЛЕЧЕНИЕ КРАТКОВРЕМЕННЫХ И ДОЛГОВРЕМЕННЫХ ТОКСИЧЕСКИХ ЭФФЕКТОВ CAR T-КЛЕТОЧНОЙ ТЕРАПИИ
Краткосрочные токсические эффекты CAR T-клеточной терапии
К краткосрочным токсическим эффектам CAR T-клеточной терапии относятся синдром высвобождения цитокинов и неврологические токсические эффекты. Синдром высвобождения цитокинов (CRS) и токсическое действие на нервную систему, также известное как синдром нейротоксичности, ассоциированный с иммунными эффекторными клетками, являются известными ключевыми препятствиями широкого распространения CAR T-клеточной терапии.
Системные симптомы и проявления, связанные с CRS, включают высокую лихорадку, озноб, дрожь, синусовую тахикардию, миалгии и повышенную утомляемость. Возможно также возникновение более тяжелых проявлений токсичности, таких как гипотензия, гипоксия, аритмии, снижение фракции выброса левого желудочка и другие нарушения функций органов-мишеней. От 7% до 47% пациентов, получающих коммерческие препараты CAR T-клеток, для лечения проявлений токсичности требуется интенсивная терапия [1,50,51]. Токсическое действие на органы-мишени при развитии CRS проявляется обратимой почечной недостаточностью, повышением печеночных ферментов, снижением уровней электролитов, цитопениями и коагулопатией. Неврологические токсические эффекты проявляются различным образом и с разной степенью тяжести: от легкого тремора кистей или слабо выраженного нарушения речи до афазии, судорог и оглушения. Описан случай отека головного мозга после CAR T-клеточной терапии на фоне тяжелой неврологической токсичности [52,53]. Частота отмеченных токсических эффектов коммерческих препаратов для CAR T-клеточной терапии приведена в таблице 4. Неврологические токсические эффекты почти всегда возникают после эпизода лихорадки, хотя описаны и отсроченные проявления [7,54,55]. Однако лечение токсических эффектов CAR T-клеточной терапии со временем становится все эффективнее на фоне более глубокого понимания основных движущих факторов и более широкого применения тоцилизумаба и кортикостероидов.
Таблица 4. Отмеченные нежелательные явления и применение тоцилизумаба и кортикостероидов в клинических исследованиях зарегистрированных FDA препаратов CAR T-клеток.
| Тисагенлек- лейсел для лечения ОЛЛ* [1] | Тисагенлек- лейсел для лечения ДКВКЛ* [5] | Аксикабтаген силолейсел для лечения ДКВКЛ** [3] | Лисокабтаген маралейсел для лечения ДКВКЛ** [51] | Брексукабтаген аутолейсел для лечения МКЛ** [78] | Идекабтаген виклейсел** [115] | |
|---|---|---|---|---|---|---|
| Нежелательные явления, представляющие особый интерес [65] | ||||||
| CRS любой степени (%) | 77 | 58 | 92 | 42 | 91 | 84 |
| CRS ≥3-й степени (%) | 46 | 22 | 11 | 2 | 15 | 5 |
| Любой неврологический токсический эффект (%) | 40 | 21 | 67 | 30 | 63 | 18 |
| Неврологический токсический эффект ≥3-й степени (%) | 13 | 12 | 32 | 10 | 31 | 3 |
| Гипотензия ≥3-й степени | 20 | 9 | 14 | 3 | 22 | НП |
| Необходимость в дополнительном применении кислорода/гипоксия | 44 | 24 | 11 | 10 | 21 | НП |
| Явления 5-й степени, обусловленные терапией (%) | 4,0 | 0 | 1,9 | 2,6 | 2,9 | 3,1 |
| Инфекции ≥3-й степени (%) | 27 | 20 | 28 | 12 | 32 | 22 |
| Применение тоцилизумаба или кортикостероидов для лечения CRS или неврологических токсических эффектов | ||||||
| Тоцилизумаб | 37 | 14 | 43 | 10 | 59 | 52 |
| Применение кортикостероидов для лечения CRS | НП | 10 | НП | 10 | 22 | 15 |
| Применение кортикостероидов для лечения неврологических токсических эффектов | НУ | НУ | НУ | НУ | 38 | 8 |
| Применение кортикостероидов для лечения CRS или неврологических токсических эффектов | НУ | НУ | 27 | НУ | 58 | НУ |
Сокращения: ОЛЛ – B-клеточный острый лимфобластный лейкоз; CRS – синдром высвобождения цитокинов; ДКВКЛ – диффузная крупноклеточная В-клеточная лимфома; МКЛ – мантийноклеточная лимфома; НУ – не указано.
* Степень тяжести CRS оценивали, как описано Porter с соавт. [66].
** Степень тяжести CRS оценивали по критериям от 2014 г., как описано Lee с соавт. [65]. Степень тяжести неврологических токсических эффектов оценивали по Общим терминологическим критериям для оценки нежелательных явлений, версии 4.03, во всех исследованиях.
Хотя для достижения противоопухолевого эффекта необходима экспансия CAR T-клеток, которая считается биомаркером ответа на терапию, увеличение максимального количества CAR T-клеток также сопровождается повышенным риском развития CRS и неврологических токсических эффектов. В этиологии CRS и неврологической токсичности показана роль многих сывороточных цитокинов и воспалительных белков, хотя для разных препаратов CAR T-клеток описывали роль разных белков. К этим белкам относятся фактор некроза опухоли-α, интерферон-γ, ИЛ-2, гранзим B и гранулоцитарно-макрофагальный колониестимулирующий фактор, которые CAR T-клетки могут продуцировать сами по себе при взаимодействии с антигеном-мишенью; ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-5, интерферон-γ-индуцируемый белок 10, моноцитарный хемоаттрактантный белок-1, макрофагальный воспалительный белок-α и оксид азота, продуцируемые далее по ходу каскада реакций миелоидными клетками и «фоновыми» клетками; а также ANG2 и фактор Виллебранда, продуцируемые активированными эндотелиальными клетками [1,54,56-58]. Во время CRS повышены уровни реактантов острой фазы, ферритина и С-реактивного белка, которые можно отслеживать с помощью общедоступных лабораторных анализов. При применении любого конкретного препарата CAR T-клеток более высокие дозы клеточного препарата, изменения в технике обработки клеток и добавление флударабина к циклофосфамиду в качестве кондиционирующей химиотерапии может повышать риск токсических эффектов, хотя применение этих схем также может способствовать более выраженному противоопухолевому ответу [16,59-61]. Бремя вовлечения костного мозга в патологический злокачественный процесс может сопровождаться повышением риска развития тяжелого CRS у пациентов с ОЛЛ или неходжкинской лимфомой [61]. Как вовлечение костного мозга в злокачественный процесс у пациентов с ОЛЛ, так и поражение лимфатических узлов у пациентов с диффузной крупноклеточной В-клеточной лимфомой ассоциировано с более высоким риском тяжелых неврологических токсических эффектов [24,54]. Повышение маркеров активации эндотелия и диссеминированного внутрисосудистого свертывания ассоциировано с развитием тяжелого CRS и неврологической токсичностью [54,61,62]. Было выявлено, что структура CAR играет свою роль в повышении риска токсических эффектов, и более ранние проявления токсичности и более высокий риск развития неврологических токсических эффектов были описаны при использовании конструктов CAR, имеющих костимулирующий домен CD28 [63]. Варианты в шарнирном и трансмембранном доменах влияют на частоту неврологических токсических эффектов, и продемонстрировано, что на продукцию цитокинов и токсичность виляет множество аспектов структуры CAR [55,64].
Опубликовано множество шкал оценки степени тяжести CRS и неврологических токсических эффектов [12,63,65,66], из которых самая последняя – шкала Американского общества специалистов по трансплантации и клеточной терапии (ASTCT), описанная в работе Lee с соавт. [67], которая занимает все более заметное место (таблица 5). Применение различных систем оценки тяжести в клинических исследованиях, изучающих доступные сегодня в продаже препараты для CAR T-клеточной терапии, затрудняют сравнение профилей токсичности каждого препарата. Представленная ASTCT система оценки тяжести CRS обладает тем преимуществом, что проста и удобна в использовании и в первую очередь учитывает состояние гемодинамики и дыхательной системы. При этом следует отметить, что эта система не учитывает токсическое действие на другие органы-мишени. Также при использовании Общих терминологических критериев для оценки нежелательных явлений, системы оценки CARTOX CRES и системы оценки синдрома нейротоксичности, ассоциированной с иммунными эффекторными клетками, можно получить разные результаты при оценке степени тяжести неврологических токсических эффектов [63,67,68]. При этом все чаще используют систему оценки синдрома нейротоксичности, ассоциированной с иммунными эффекторными клетками.
Таблица 5. Оценка степени тяжести синдрома высвобождения цитокинов согласно Консенсусу Американского общества специалистов по трансплантации и клеточной терапии.
| Параметр | Степень 1 | Степень 2 | Степень 3 | Степень 4 |
|---|---|---|---|---|
| Лихорадка* | Температура ≥ | Температура тела ≥38°C | Температура тела ≥38°C | Температура тела ≥38°C |
| С | ||||
| гипотензией | Отсутствует | Применение вазопрессоров не требуется | Требуются вазопрессоры с применением вазопрессина или без него | Требуется несколько вазопрессоров (исключая вазопрессин) |
| И/или** | ||||
| Гипоксия | Отсутствует | Требуется использование низкопоточной** назальной канюли или периодическая подача кислорода | Требуется использование высокопоточной назальной канюли, лицевой маски, кислородной маски с клапаном, пропускающим воздух в одном направлении, или маски Venturi | Требуется положительное давление (например, CPAP, BiPAP, интубация и искусственная вентиляция) |
Сокращения: BiPAP – двухфазная вентиляция с положительным давлением в дыхательных путях; CPAP – постоянное положительное давление в дыхательных путях; CRS – синдром высвобождения цитокинов.
* Лихорадка: определялась как повышение температуры тела ≥38°C, не объясняемое никакой другой причиной. Наличие лихорадки больше не требуется для определения в последующем степени тяжести CRS у пациентов, у которых развился CRS и которые затем получают антипиретики или антицитокиновую терапию. В этих случаях степень тяжести CRS определяется по степени гипотензии и/или гипоксии.
** Степень тяжести CRS определяется по более тяжелому явлению: гипотензии или гипоксии, не объясняемых другими причинами.
† Низкопоточная назальная канюля – канюля, скорость потока кислорода через которую составляет ≤6 л/мин. К низкопоточному режиму также относится периодическая подача кислорода. Высокопоточная назальная канюля – это канюля, скорость потока кислорода через которую составляет 6 л/мин.
По материалам Lee с соавт. [65]. Воспроизведено в соответствии с условиями Creative Commons Attribution-NonCommercial-No Derivatives License (CC BY NC ND).
Лечение синдрома высвобождения цитокинов. Симптоматическая терапия пациентов с CRS предусматривает коррекцию системных симптомов, как правило, с помощью антипиретиков, инфузионной терапии по необходимости даже при незначительных потерях и мониторинга гемодинамических показателей. Пациентов, которым инфузия CAR T-клеток проводится в амбулаторных условиях, и у которых появляется лихорадка или развиваются новые неврологические симптомы, необходимо госпитализировать для мониторинга [69,70]. Симптоматическая терапия госпитализированных пациентов после инфузии CAR T-клеток описана в таблице 6. Поскольку после инфузии CAR T-клеток наблюдался синдром лизиса опухоли [71,72] даже в отсутствие химиотерапии [72], у пациентов с более высокой опухолевой нагрузкой необходимы профилактическое применение аллопуринола и гидратация. В первый месяц после инфузии CAR T-клеток часто возникают цитопении, которые, по крайней мере отчасти, связаны с кондиционирующей химиотерапией. Однако CAR T-клетки могут оказывать миелосупрессивный эффект, поскольку случаи цитопении наблюдались в отсутствие химиотерапии [72], и продолжительность цитопении, по-видимому, была связана с тяжестью CRS [61,73].
Таблица 6. Симптоматическая терапия после инфузии CAR T-клеток.
Сокращения: АЛТ – аланинаминотрансфераза; аЧТВ – активированное частичное тромбопластиновое время; АСТ – аспартатаминотрансфераза; CAPD – шкала Корнелла для оценки детского делирия (Cornell Assessment of Pediatric Delirium); ОАК – общий анализ крови; ЦМВ – цитомегаловирус; КФК – креатинфосфокиназа; СРБ – C-реактивный белок; CRS – синдром высвобождения цитокинов; ЭКГ – электрокардиограмма(-графия); ЭЭГ – электроэнцефалограмма(-графия); СЗП – свежезамороженная плазма; HBcAb+ – положительный результат анализа на антитела к сердцевинному антигену вируса гепатита B; HbsAg – положительный результат анализа на поверхностный антиген вируса гепатита B; ВГВ – вирус гепатита B; HLH – гемофагоцитарный лимфогистиоцитоз; HSV – вирус простого герпеса; ICANS – синдром нейротоксичности, ассоциированный с иммунными эффекторными клетками; ICE – энцефалопатия, ассоциированная с иммунными эффекторными клетками; БИТ – блок интенсивной терапии; в/в – внутривенно; ЛДГ – лактатдегидрогеназа; MUGA – радиоизотопная вентрикулография; НПВП – нестероидные противовоспалительные препараты; НТ – неврологическая токсичность; PJP – пневмония, вызванная Pneumocystis jiroveci; ПТВ/МНО – протромбиновое время/международное нормализованное отношение; SARS-CoV-2 – тяжелый острый респираторный синдром, вызванный коронавирусом 2 типа; VZV – вирус ветряной оспы.
* Некоторые рекомендации относятся к госпитализированным пациентам.
Вопрос о дополнительном применении факторов роста при нейтропении является спорным, поскольку при применении факторов риска гипотетически существует риск усугубления CRS, но у пациентов с нейтропенией совершенно точно существует риск инфекции. Применение гранулоцитарно-макрофагального колониестимулирующего фактора после инфузии CAR T-клеток противопоказано из-за риска усугубления CRS [70]. Рекомендовано отложить дополнительное применение фактора роста, например, филграстима или пегфилграстима, на 3 недели после инфузии CAR T-клеток и вплоть до разрешения CRS [70,74], но при использовании этого подхода обязательно следует учитывать риск инфекции у конкретного пациента. Хотя коагулопатия часто наблюдается при тяжелом CRS, массивные кровотечения возникают нечасто. Мониторинг и заместительное введение фибриногена могут быть особенно необходимы при CRS 3-й и 4-й степени, когда, согласно описанным случаям, возможно развитие тяжелой гипофибриногенемии [75].
Продолжается изучение роли антицитокиновой и кортикостероидной терапии при CRS. Для лечения CRS, опосредованного терапией с применением иммунных эффекторных клеток, FDA зарегистрировало тоцилизумаб, моноклональное антитело с направленным действием на рецептор ИЛ-6, который чаще всего назначают как препарат выбора при CRS. Кортикостероиды обычно оставляют в качестве резервных препаратов для терапии второй линии [63], поскольку, согласно ранним наблюдениям, после применения высоких доз кортикостероидов экспансия CAR T-клеток уменьшается [76]. Единого согласованного мнения по поводу пороговых доз при применении антицитокиновой или кортикостероидной терапии не существует ввиду отсутствия масштабных рандомизированных исследований. Основные подходы предусматривают применение тоцилизумаба при наличии заданного перечня гемодинамических изменений и токсических проявлений со стороны органов-мишеней [69,77] или применение на основании наблюдаемой степени тяжести CRS [56,63,77], с последующей кортикостероидной терапией в случае развития рефрактерного CRS. Множество групп исследователей рекомендуют рассматривать вопрос о применении тоцилизумаба в случае CRS 2-й степени по критериям ASTCT [72] и настоятельно рекомендуют в случае CRS 3-й степени [56,70]. Применение тоцилизумаба предлагалось в случаях устойчивой лихорадки, рефрактерной к применению антипиретиков [63]. Однако, по общему мнению, решение о применении тоцилизумаба следует принимать с учетом токсического действия на органы-мишени и наличия сопутствующих заболеваний у каждого конкретного пациента. Ретроспективные анализы результатов клинического применения аксикабтагена силолейсела [3] и брексукабтагена аутолейсела [78] показали отсутствие четких различий по частоте ответа на лечение у пациентов, получавших тоцилизумаб или кортикостероидную терапию для коррекции токсических эффектов, по сравнению с пациентами, которые не получали эти препараты, однако использование более высоких суммарных доз кортикостероидов, более длительное их применение и более раннее начало использования может отрицательно сказаться на выживаемости после применения аксикабтагена силолейсела [79]. Для оценки различных стратегий раннего вмешательства были проведены проспективные исследования с участием небольшого числа пациентов (таблица 7). Использование упреждающих стратегий применения тоцилизумаба и/или кортикостероидов в низких дозах при CRS невысокой степени тяжести по сравнению с различными принятыми в учреждениях стандартными подходами привело к снижению частоты тяжелого CRS без явного изменения экспансии CAR T-клеток и без усугубления неврологической токсичности 81. Аналогично, профилактическое применение тоцилизумаба в определенные интервалы времени вне зависимости от развития токсических эффектов, по всей видимости, способствует снижению частоты тяжелого CRS без отчетливого увеличения неврологической токсичности [83,84] и без изменения экспансии CAR T-клеток [84]. Раннее назначение тоцилизумаба и/или кортикостероидов, по-видимому, не снижает частоту или длительность ответа на лечение [80-82,84], хотя невозможно сделать однозначные выводы на основании данных, полученных в этих небольших выборках и при использовании нерандомизированных дизайнов.
Таблица 7. Стратегии раннего вмешательства с применением тоцилизумаба и/или кортикостероидов при синдроме высвобождения цитокинов и нейротоксичности.
| Публикация/ Аннотация | Популяция пациентов/ Препарат CAR | Объем выборки | Стратегия раннего вмешательства | Исходы CRS и ICANS | Противо- опухолевый ответ |
|---|---|---|---|---|---|
| Locke и соавт., 2017 [83] (ZUMA-1, когорта 3) | Взрослые пациенты с ДКВКЛ и подтипами/ аксикабтаген силолейсел | 31 | Тоцилизумаб в день +2 и леветирацетам в день 0 для всех пациентов в когорте 3 | CRS ≥3-й степени (по критериям Lee 2014 [65]): когорта 3, 3%; когорты 1-2, 11%. НТ 3-4-й степени (CTCAE): когорта 3, 35% и один случай смерти вследствие отека мозга; когорты 1-2, 32% | НУ |
| Toppetal, 2019 [126] (ZUMA-1, когорта 4) | Взрослые пациенты с ДКВКЛ и подтипами/ аксикабтаген силолейсел | 41 | Тоцилизумаб и кортикостероиды при CRS 1-й степени, не разрешившегося после 3 дней симптоматической терапии; кортикостероиды при НТ 1-й степени | CRS ≥3-й степени (по критериям Lee 2014 [65]): когорта 4, 2%; когорты 1–2, 11%. НТ ≥3-й степени (CTCAE): когорта 4, 17%; когорты 1-2, 32% | Частота ПО: когорта 4, 51%; когорты 1-2, 58%. Продолжающийся ответ ≥6 месяцев: когорта 4, 54%; когорты 1-2, 44% |
| Gardner с соавт., 2019 [80] | Дети с ОЛЛ/SCRI- CAR19vl | 20 в когорте; 23 в когорте оценки ДЛТ* | РВ с применением тоцилизумаба: лихорадка ≥39°C ≥10 часов, не отвечающая на ацетаминофен; рецидивирующая гипотензия, не отвечающая на в/в болюсное введение жидкостей в течение 6 часов; кислородотерапия; допускается повторное введение через 48 часов. РВ с применением дексаметазона: 5-10 мг каждые 6-12 часов; лихорадка ≥39°C, не отвечающая на тоцилизумаб, вазопрессоры в низких дозах в течение 12 часов; более высокие дозы или добавление второго вазопрессора; необходима интенсификация респираторной поддержки или рассмотреть вопрос об интубации | sCRS**: группа РВ, 15%; группа ДЛТ, 30% (p=0,29). НТ тяжелой степени**: группа РВ, 25%; группа ДЛТ, 22% (p=1) | Частота ПО без МОЗ: группа РВ, 95%; группа ДЛТ, 91%. Различия между когортами по ВБЛ или ОВ отсутствуют |
| Caimi с соавт., 2020 [84] | Взрослые пациенты с НХЛ/анти-CD19 TNFRSF19 CD3Z/4-1BB | 15 в группе профилактики тоцилизумабом; 8 в группе без профилактики [82] | Профилактика тоцилизумабом: за 1 час до инфузии CAR T-клеток | CRS ≥2-й степени (по критериям ASTCT [22,66]): группа профилактики тоцилизумабом, 20%; группа без профилактики, 62,5% (p=0,02). NT any grade (CARTOX [17,66]): группа профилактики тоцилизумабом, 30%; группа без профилактики, 38% (p=0,30) | Частота ПО: группа профилактики тоцилизумабом, 80%; группа без профилактики, 50% |
| Kadauke с соавт., 2021 [127] | Дети с ОЛЛ/CTL019 (конструкт тисагенлеклейсела) | 15 в проспективной группе с ОЛЛ с высокой нагрузкой; 26 в исторической когорте с ОЛЛ с высокой нагрузкой, получавших стандартную терапию † | Раннее применение тоцилизумаба при температуре ≥38,5°C дважды с интервалом ≥4 часов за 24-часовой период у пациентов с вовлечением КМ в процесс ОЛЛ ≥40% | CRS 4-й степени (по критериям Penn): группа РТ, 27%; историческая группа, 50% (p=0,18). НТ ≥2-й степени (CTCAE): группа РТ, 53%; историческая группа, 54% (p=0,9) | Наилучшая ОЧО: группа РТ, 87%; историческая группа, 85% (p=0,9) |
Сокращения: ОЛЛ – острый лимфобластный лейкоз; ASTCT – Американское общество специалистов по трансплантации и клеточной терапии; КМ – костный мозг; частота ПО – частота полного ответа; CRS – синдром высвобождения цитокинов; СTCAE – Общие терминологические критерии для оценки нежелательных явлений; ДКВКЛ – диффузная крупноклеточная В-клеточная лимфома; ДЛТ – дозолимитирующая токсичность; РВ – раннее вмешательство; РТ – ранний тоцилизумаб; ICANS – синдром нейротоксичности, ассоциированный с иммунными эффекторными клетками; в/в – внутривенно; ВБЛ – выживаемость без лекоза; без МОЗ – без минимального остаточного заболевания; НХЛ – неходжкинская лимфома; НУ – не указано в опубликованной аннотации; НТ – нейротоксичность; ОЧО – общая частота ответа; ОВ – общая выживаемость; sCRS – тяжелый CRS; TNFRSF – суперсемейство рецепторов фактора некроза опухоли.
* Когорта ДЛТ получала тоцилизумаб +/- кортикостероиды в течение 48 часов при связанной с терапией токсичности 4-й степени, не контролируемой медикаментозной терапией или в течение 48 часов ДЛТ, не контролируемой медикаментозной терапией. Эта группа получала кортикостероиды для лечения негематологических токсических эффектов ≥ 3 степени в течение 48 часов.
** sCRS определяли как требующий применения вазопрессоров, инотропов или интубации. Тяжелую нейротоксичность определяли как любой неврологический токсический эффект ≥3-й степени по критериям CTCAE версии 4 или любые судороги 2 степени.
† При использовании стандартного алгоритма терапии показаниями к применению тоцилизумаба были нестабильность гемодинамики несмотря на в/в введение жидкостей и введение вазопрессоров в средних или высоких дозах; ухудшение состояния дыхательной системы, что подтверждалось наличием инфильтратов в легких; увеличением потребности в кислороде, например, необходимость высокопоточной кислородотерапии или искусственной вентиляции; или быстрое клиническое ухудшение.
Опыт применения альтернативных фармакологических препаратов для лечения CRS в клинических исследованиях остается ограниченным. В случаях рефрактерного к тоцилизумабу CRS использовали ситуксимаб, анакинру и этанерцепт, но оптимальная схема применения этих препаратов с учетом использования кортикостероидов неизвестна [1,85,86].
Описано применение при рефрактерном к стероидам CRS циклофосфамида, антитимоцитарного глобулина и алемтузумаба, однако, эти данные ограничены [1]. Изучается применение других фармакологических препаратов для профилактики и лечения CRS, в том числе таргетных препаратов, воздействующих на сигнальный путь JAK-STAT-киназ, таких как итацитиниб (NCT04071366) 87.
Гемофагоцитарный лимфогистиоцитоз – нечастое осложнение CAR T-клеточной терапии. Неясно, является ли гемофагоцитарный лимфогистиоцитоз отдельной нозологической единицей со своим собственным патофизиологическим механизмом, или он представляет собой проявление тяжелого CRS. Предложенными критериями связанного с CAR T-клеточной терапией гемофагоцитарного лимфогистиоцитоза являются максимальный уровень ферритина в сыворотке более 10 000 нг/мл и не менее двух дополнительных критериев, связанных с нарушением функции почек, печени или легких, и/или изменениями в костном мозге (таблица 6) [63]. Терапия первой линии гемофагоцитарного лимфогистиоцитоза заключается в лечении сопутствующего CRS или неврологических токсических эффектов тоцилизумабом и/или кортикостероидами. Этопозид использовали в случаях недостаточного ответа на тоцилизумаб и кортикостероиды. Описаны случаи успешного лечения гемофагоцитарного лимфогистиоцитоза анакинрой, хотя эти данные ограничены [16].
Лечение неврологических токсических эффектов
Мониторинг неврологического статуса после инфузии CAR T-клеток играет важную роль в раннем распознавании и лечении неврологических токсических эффектов. Госпитализированным пациентам необходимо проводить неврологическое обследование по меньшей мере раз в день, в том числе объективный неврологический осмотр и оценку по шкале оцени энцефалопатии, ассоциированной с иммунными эффекторными клетками [67] или по шкале Корнелла для оценки детского делирия [67], а при наличии неврологических токсических эффектов – чаще. МРТ головного мозга может помочь в оценке неврологической токсичности, если у пациента стабильная гемодинамика, и состояния дыхательных путей не препятствует проведению МРТ, особенно в тяжелых случаях, когда выявление отека головного мозга может потребовать интенсификации кортикостероидной терапии. Исключить другую, например, инфекционную, этиологию изменений психического статуса, а также измерить давление открытия позволяет люмбальная пункция. Однако наличие тромбоцитопении, коагулопатии и тяжелое состояние пациента могут послужить препятствиями к проведению процедуры. Полноценно оценить неврологический дефицит и отследить изменения в динамике поможет осмотр невролога.
Тоцилизумаб в большей степени влияет на CRS, чем на неврологические токсические эффекты [54], поэтому в качестве терапии первой линии при неврологической токсичности, как правило, используют кортикостероиды. До сих пор остается нерешенным вопрос о том, что высокие суммарные дозы кортикостероидов могут повлиять на эффективность CAR T-клеточной терапии [79]. Оптимальные пороговые дозы и сроки применения кортикостероидов не установлены, хотя рекомендуется рассмотреть вопрос о кортикостероидной терапии при развитии синдрома нейротоксичности, ассоциированного с иммунными эффекторными клетками, 2-й степени, и настоятельно рекомендуется – при развитии синдрома 3-4 степени тяжести [70]. В исследовании ZUMA-1 в когорте для оценки безопасности раннее применение кортикостероидов после введения аксикабтагена силолейсела для лечения неврологических токсических эффектов 1-й степени способствовало снижению частоты развития неврологической токсичности 3-й или более высокой степени и при этом не влияло на эффективность терапии у небольшого числа пациентов [81], но необходимы дополнительные исследования. В доклинических исследованиях была показана эффективность анакинры в лечении неврологической токсичности [90], при ограниченных свидетельствах клинической эффективности [91], хотя место этого препарата в алгоритме лечения токсических эффектов и то, какую роль он играет в применении стероид-сберегающего подхода, неизвестно. Установленной оптимальной схемы терапии второй линии для рефрактерной к стероидам неврологической токсичности не существует. В этих случаях было описано интратекальное введение кортикостероидов и химиотерапия [92], но необходимы дополнительные исследования. Повышенные уровни гранулоцитарно-макрофагального колониестимулирующего фактора ассоциированы с более высокой степенью тяжести неврологических токсических эффектов, поэтому изучается профилактическое применение нейтрализующего антитела гранулоцитарно-макрофагального колониестимулирующего фактора, лензилумаба, для предотвращения развития неврологической токсичности и CRS [93]. Также активно изучаются способы оптимизации конструкции препарата CAR T-клеток для минимизации токсичности, включая внедрение «суицидальных» генов и фармакологических «переключателей» генов [87,88,94-96].
Долговременные токсические эффекты CAR T-клеточной терапии
В-клеточная аплазия, гипогаммаглобулинемия и инфекции относятся к долговременной токсичности. Деплеция нормальных В-клеток и нормальных плазматических клеток является ожидаемым проявлением токсичности анти-CD19 и анти-BCMA CAR T-клеточной терапии соответственно. Деплеция В-клеток также была описана после анти-CD22 CAR T-клеточной терапии [97]. Коррекцию гипогаммаглобулинемии можно проводить путем заместительной терапии иммуноглобулином. Предложенным пороговым значением для назначения заместительной терапии иммуноглобулином является уровень иммуноглобулина G менее 400-500 г/дл или наличие серьезной или рецидивирующей инфекции [70,98]. У пациентов, получавших анти-C19 CAR T-клеточную терапию по поводу неходжкинской лимфомы, наблюдалось восстановление популяций нормальных В-клеток [5,99], хотя у детей и молодых пациентов с В-клеточным ОЛЛ, получавших тисагенлеклейсел, определяемые В-клетки чаще служили предвестником рецидива [1,7].
Риск инфекции у пациентов после CAR T-клеточной терапии может обуславливаться множеством факторов. К ним относятся деплеция нормальных В-клеток или плазматических клеток, вызванная непосредственным воздействием CAR T-клеток, деплеция лимфоцитов и гранулоцитов, вызванная кондиционирующей химиотерапией, антицитокиновой терапией и применением кортикостероидов по поводу CRS или неврологической токсичности, а также снижение иммунитета, вызванное основным онкологическим заболеванием пациента. Сообщалось о случаях смерти от инфекционных осложнений после CAR T-клеточной терапии, и наблюдались бактериальные, вирусные и грибковые инфекции [16,71,100-103]. Более тяжелый CRS ассоциируется с более высоким риском инфекции [101,102]. В первые 28 дней после инфузии клеток риск инфекции может быть выше, чем в последующие дни, но инфекции возникают и позднее [101,104]. Описана реактивация цитомегаловирусной инфекции после CAR T-клеточной терапии [78,101], что особенно является проблемой после применения имеющегося в продаже препарата аллогенных CAR T-клеток, если для снижения риска отторжения клеточного трансплантата применяются анти-CD52 антитела. В клиническом исследовании аллогенного препарата UCART19, в котором перед инфузией CAR T-клеток вводили алемтузумаб, у 24% пациентов развились вирусные инфекции 3-й или более высокой степени, в том числе реактивация цитомегаловирусной инфекции 3-й степени у 4,8% [17]. При использовании этой схемы, а также при применении аутологичных клеток, необходимы обследование на цитомегаловирусную инфекцию и мониторинг цитомегаловирусной нагрузки после инфузии CAR T-клеток, особенно если для лечения токсических эффектов назначаются кортикостероиды [103].
При наличии у пациента серьезной или неконтролируемой активной инфекции лимфодеплецию и CAR T-клеточную терапию необходимо отложить [70,98]. Аналогично, хотя имеются некоторые данные, свидетельствующие о том, что можно безопасно продолжать CAR T-клеточную терапию во время пандемии SARS-CoV-2, при условии соблюдения необходимых предосторожностей и надлежащего планирования [105], перед началом кондиционирующей химиотерапии необходимо обследование на SARS-CoV-2, и в случае выявления инфекции терапию следует отложить [106]. Рекомендуется использование ацикловира или валацикловира для профилактики вирусных инфекций, триметоприма-сульфаметоксазола или альтернативного препарата для профилактики пневмонии, вызванной Pneumocystis jirovecii, а также противогрибковых препаратов в случае тяжелой нейтропении или длительного применения кортикостероидов; во время периодов нейтропении также можно рассмотреть вопрос о профилактике грамотрицательных бактериальных инфекций [98,103]. Имеются рекомендации по срокам вакцинации пациентов, получающих анти-CD19 CAR T-клеточную терапию [98], хотя проспективная оценка эффективности вакцинации у таких пациентов не проводилась.
После применения препаратов для CAR T-клеточной терапии с направленным действием на CD19 и BCMA описаны случаи цитопений продолжительностью более 1 месяца, а в некоторых случаях – продолжительностью от нескольких недель до нескольких месяцев [1,36,51,73,104,107,108]. Цитопении 3-й или более высокой степени продолжительностью более 28 дней были отмечены у 32% пациентов, получавших тисагенлеклейсел, и с такой же частотой наблюдались у детей и молодых людей с ОЛЛ, а также у взрослых пациентов с диффузной крупноклеточной В-клеточной лимфомой [1,5].
Также цитопении 3-й или более высокой степени продолжительностью до 29 дней были отмечены у 37% пациентов, получавших лисокабтаген маралейсел [51]. Цитопении 3-й или более высокой степени продолжительностью более 3 месяцев наблюдались у 17% пациентов с диффузной крупноклеточной В-клеточной лимфомой, которые получали аксикабтаген силолейсел в исследовании ZUMA-1 [3], и у 26% пациентов, получавших брексукабтаген аутолейсел по поводу мантийноклеточной лимфомы [78]. Этиология длительной миелосупрессии до конца не ясна. Возможными факторами риска являются CRS высокой степени, более выраженное вовлечение костного мозга в злокачественный процесс на исходном уровне, меньшее исходное количество клеток крови, предшествующая трансплантация стволовых клеток и конструкция CAR [61,73,109,110]. При длительных цитопениях продолжительностью более месяца необходимо выполнить анализ аспирата и биоптата костного мозга, чтобы исключить прогрессирование злокачественного поражения костного мозга или миелодисплазию. Если другой этиологии не выявлено, тактика ведения должна включать тщательный лабораторный мониторинг формулы крови, трансфузионную поддержку и, при необходимости, применение факторов роста. Описаны единичные случаи применения агониста рецепторов тромбопоэтина элтромбопага у пациентов с тяжелыми длительными цитопениями [35,110], однако неясно, вызвал ли восстановление кроветворения лекарственный препарат, или состояние разрешилось с течением времени.
РЕАКЦИЯ «ТРАНСПЛАНТАТ ПРОТИВ ХОЗЯИНА»
При проведении терапии с применением аллогенных CAR T-клеток существует потенциальный риск развития реакции «трансплантат против хозяина». Развитие реакции «трансплантат против хозяина» было описано при применении аутологичных CAR T-клеток, полученных от пациентов, у которых наблюдалось полное приживление донорских клеток после аллогенной трансплантации стволовых клеток [59,111]; после инфузии донорских CAR T-лимфоцитов у пациентов, которым ранее была проведена аллогенная трансплантация стволовых клеток [72]; а также после инфузии аллогенных коммерческих препаратов CAR T-клеток [17]. К счастью, в большинстве случаев реакция «трансплантат против хозяина» наблюдается редко: с частотой от 0% до 10% [7,17,59,72,111-114]. У реципиентов, у которых на исходном этапе отсутствовала или была минимально выражена реакция «трансплантат против хозяина», в последующем она была управляемой. В этих случаях важен правильный выбор пациентов, поскольку наличие тяжелой или неконтролируемой реакции «трансплантат против хозяина» на исходном этапе у реципиентов ранее проведенной трансплантации аллогенных стволовых клеток может послужить препятствием к проведению CAR T-клеточной терапии.
Арсенал препаратов для CAR T-клеточной терапии гемобластозов быстро расширяется. По мере накопления опыта применения в клинических исследованиях и в условиях реальной клинической практики следующей задачей будет систематическое и беспристрастное изучение соответствующего места CAR T-клеточной терапии среди широкого спектра методов лечения наших пациентов с использованием химиотерапии, иммунотерапии и низкомолекулярных ингибиторов сигнальных путей. Уникальным потенциалом CAR T-клеточной терапии является возможность однократного курса терапии с возможностью излечения за счет длительного иммунологического надзора, что может послужить оправданием высокой первоначальной экономической и логистической нагрузки.
Обзор литературы по материалам конгресса ASCO 2021 (Saar Gill с соавторами).
«CAR-T – это как космический корабль на фоне самолета гражданской авиации»
На прошедшем в Москве в конце 2021 года традиционном форуме, организованном Всероссийским союзом пациентов (ВСП), среди множества тем, связанных с доступностью инновационных медицинских технологий и препаратов, особое внимание было уделено клеточной терапии – возможностям применения технологии, правовым и организационным аспектам регистрации препаратов, моделям оплаты такого лечения. Спикеры много говорили о том, как расширить доступ к клеточным препаратам и персонализированным медицинским продуктам.
Тогда в одном из докладов было обозначено, что по итогам 2020 года доля обращающихся в России инновационных препаратов в стоимостном выражении снизилась до 14,6% (в 2019 году – 15,8%). Согласно исследованию IQVIA (включало 24 государства ЕС и 10 стран за пределами Союза), наша страна по уровню обеспеченности инновационной терапией в 2016–2019 годах, определяемому как количество зарегистрированных и входящих в списки возмещения инновационных препаратов (для РФ это список ЖНВЛП, закупки по региональной льготе), находилась на 31-й строчке, соседствуя в этом рейтинге с Турцией, Латвией и Литвой. За анализируемый период в РФ было зарегистрировано только 26 из 152 включенных в исследование инновационных препаратов – в пять раз меньше, чем в Германии и Дании, возглавивших рейтинг. При этом большинство из них – 21 препарат – выведены на российский рынок в 2016-2017 годах.
Для ряда заболеваний именно инновационные персонализированные медицинские продукты могут стать основным способом продления жизни пациента, обеспечения более длительной ремиссии. В настоящее время в мире разработаны и регистрируются CAR-ы для таких типов опухоли, как множественная миелома, B-клеточный острый лимфобластный лейкоз, диффузная крупно-В-клеточная лимфома и т. д.
Ежегодно в мире регистрируют несколько CAR-T препаратов. В частности, 25 мая 2022 года Европейское медицинское агентство зарегистрировало второй CAR-T препарат для лечения взрослых пациентов с множественной миеломой, пролеченных тремя основными группами препаратов (иммуномодуляторами, ингибиторами протеасом и анти-CD38), у которых наблюдается прогрессия на фоне последней схемы.
Однако для российских пациентов такой вид терапии пока недоступен. Ведется работа по адаптации российского законодательства к появлению такого типа индивидуальных препаратов. Необходимость установить особенности обращения отдельных видов высокотехнологических препаратов*** с учетом специфики их производства была прописана еще в сентябре 2021 года в дорожной карте ВСП, составленной по итогам II Форума пациенториентированных инноваций.
Речь идет о сложных и высокотехнологичных продуктах, которые, по словам одного из спикеров сессии, являют собой «космический корабль на фоне самолета гражданской авиации».
Прошлой осенью российское законодательство еще не было в достаточной мере адаптировано к широкому внедрению в клиническую практику клеточных препаратов, однако за относительно короткий срок в этой области произошли существенные подвижки – в начале февраля 2022 года Минздрав РФ представил поправки к ФЗ-61 «Об обращении лекарственных средств».
В частности, для высокотехнологических лекарственных препаратов, к коим относится CAR-T, отменяется обязательное тестирование образцов трех первых ввозимых серий, ежегодное обязательное тестирование и обязательная маркировка, что делает возможным импорт и ввод в гражданский оборот таких препаратов.
Действительно, данная прорывная терапия требует серьезных финансовых затрат. Однако речь идет о лечении самых тяжелых заболеваний, которые сами по себе создают значимую нагрузку и на систему здравоохранения (длительное лечение, госпитализации, развитие осложнений, требующих лечения, дополнительная нагрузка на врачей и т. д.), и на экономические показатели страны (потеря трудоспособности пациента, инвалидизация с сопутствующими расходами и пр.).
Необходимо пересмотреть подходы к финансированию такой терапии и рассматривать подобные затраты в сфере здравоохранения как инвестиции, где выгодой будут дополнительные годы жизни пациента, отсутствие необходимости длительного непрерывного лечения, повышение качества жизни, снижение нагрузки на систему здравоохранения, устойчивый экономический рост в долгосрочной перспективе.
В настоящее время такие препараты, являющиеся частью сложных, высокотехнологичных методов лечения, финансово обеспечиваются программами ВМП (высокотехнологичной медицинской помощи) или клинической апробации (КА), но нуждаются в собственных финансовых механизмах, поскольку заметно отличаются от традиционно применяемых лекарственных схем по целому ряду параметров. Кроме того, практика погружения лекарственного препарата в систему возмещения предусматривает «пробел» в 1,5–2,5 года с момента регистрации препарата до его включения в клинические рекомендации, ЖНВЛП, модели оплаты ВМП и КА. То есть пациенты с тяжелыми прогрессирующими заболеваниями, в частности с онкогематологическими, вынуждены ждать наиболее эффективные опции лечения длительное время. Такое ожидание может приводить не только к ухудшению их состояния, но и к преждевременным смертельным исходам. Не стоит забывать, что ежегодно выдается и множество отказов на одобрение протоколов КА.
ВСП выступает за разработку стратегии погружения инновационной терапии в систему здравоохранения, отмечая, что федеральным проектом «Медицинская наука для человека» госпрограммы «Развитие здравоохранения» предусмотрено «активное развитие, разработка и внедрение современных лекарств на основе инновационных технологий, таких как генотерапевтические и клеточные препараты». При этом, подчеркивают в ВСП, проработанные подходы к погружению «дорогостоящей, но высокоэффективной генной и клеточной терапии в систему здравоохранения» отсутствуют. Обеспечение генной терапией, например, за счет средств фонда «Круг добра» «может являться временным инструментом обеспечения отдельных категорий пациентов, но не заменяет системного подхода к решению вопроса».
Все участники системы здравоохранения понимают, что необходим баланс между обеспечением инноваций и оптимизацией бюджета. Поэтому очень важно предусмотреть определенный правовой механизм, позволяющий ускорить выход на рынок инновационных лекарственных препаратов, а заодно пересмотреть модели возмещения для генной терапии, CAR-T и других передовых способов лечения.
Нужны новые механизмы и инструменты. Например, CAR-T – высокотехнологичный и затратоемкий метод, поэтому и в оплате такой терапии целесообразно применять инновационные подходы с разделением рисков между государством и производителем, готовым отвечать за эффективность использования продукта в каждом конкретном случае. В такой модели может быть предусмотрено возмещение стоимости в зависимости от уровня достижения заявленной эффективности препарата.
Чтобы на практике реализовать этот подход, уже использующийся в ряде стран, потребуется адаптировать к задаче действующие нормативно-правовые акты. В частности, внедрить возможность полной или частичной оплаты производителю препарата на основании эффекта, полученного в реальной клинической практике, в том числе с учетом его длительности.
Эксперты ВСП также предлагают развивать систему наблюдения за пациентами, получившими генную или клеточную терапию. «Учитывая, что генная и клеточная терапии могут иметь отсроченный сложнопредсказуемый эффект в течение долгосрочного периода (>10 лет), создание единого регистра пациентов позволит системно мониторировать изменение состояния пациентов, получивших такую терапию, как в целях оказания медицинской помощи самому пациенту, так и в целях совершенствования методов терапии в целом», – говорится в дорожной карте ВСП.
На этой неделе, 25 июня, на площадке Российского общества онкогематологов состоится новый раунд обсуждения перспектив инновационных CAR-T методов, где ведущие специалисты обсудят место клеточной иммунотерапии в лечении онкогематологических заболеваний у взрослых пациентов.
ООО «Джонсон & Джонсон», Россия, 121614, Москва, ул. Крылатская, д. 17, корп. 2.
Контактный телефон: (495) 755-83-57, факс: (495) 755-83-58.
Информация в материале не заменяет консультацию специалиста здравоохранения. Пожалуйста, обратитесь к лечащему врачу.
*CAR-T – Т-лимфоциты (иммунные клетки) пациента, к которым присоединен химерный антигенный рецептор (CAR). Именно этот специфический рецептор позволяет Т-клетке прицельно находить и уничтожать определенный тип опухолевых клеток. Технически это осуществляется следующим образом: у пациента берут кровь, выделяют из крови Т-лимфоциты, замораживают и отправляют на производство, где к Т-клеткам добавляют определенный химерный антигенный рецептор (CAR). Готовый CAR-T препарат замораживают и пересылают в клинику, где вводят внутривенно пациенту. Курс лечения состоит из одной инъекции.
**«Индустриальными» CAR-T принято называть индивидуальный клеточный препарат, производимый на централизованной производственной площадке. Такой препарат проходит все необходимые лекарственные исследования и регистрируется как лекарственное средство. В российском законодательстве такие препараты относятся к высокотехнологическим лекарственным препаратам.
***Высокотехнологический лекарственный препарат, который может подпадать под определение лекарственного препарата на основе соматических клеток или определение препарата тканевой инженерии и генотерапевтического лекарственного препарата, должен рассматриваться в качестве генотерапевтического лекарственного препарата. Таким образом, CAR-T рассматривается как генотерапевтический препарат. В европейской регуляторной практике такие препараты относятся к лекарственным препаратам передовой терапии (Advanced Therapy Medicinal Products).
Российские пациенты не смогут пройти терапию CAR-T
О том, что Miltenyi Biotec приостановила поставки в Россию оборудования и технологий, «Коммерсанту» рассказал гендиректор компании-дистрибьютора «Биокоммерц».
В Miltenyi Biotec получить комментарий не удалось, но проблему с поставками Vademecum подтвердил один из ведущих специалистов-онкогематологов. По его словам, для того чтобы с нуля восполнить дефицит расходников, потребуется от трех до пяти лет. В благотворительном фонде AdVita, поддерживающем курсы лечения CAR-T в России, тоже знают о возникшей проблеме и обеспокоены грядущим дефицитом материалов.
Глава программного отдела Фонда борьбы с лейкемией Юлия Синицына подчеркнула, что CAR-T является важной технологией для российских пациентов. По ее словам, были надежды, что академические программы позволят дать доступ к технологии нуждающимся пациентам, но сейчас эта возможность откладывается. Доступность индустриальных продуктов при этом будет зависеть от их регистрации и финансирования, которые сейчас трудно прогнозировать, отметила Синицына.
По словам директора отдела клинических исследований Института онкологии «Хадасса Москва» (ГК «Медскан») Игоря Утяшева, все российские научные группы, занимающиеся разработкой академических CAR-T, работали именно на оборудовании и реактивах компании Miltenyi Biotec. Он полагает, что приостановка сотрудничества с немецкой компанией потребует не только поиска новых поставщиков оборудования и реактивов, но и разработки новых технологических процессов и их валидации.
С помощью Miltenyi Biotec CAR-T практиковали в первую очередь в НМИЦ ДГОИ им. Дмитрия Рогачева и с недавних пор внедряют технологию в НМИЦ онкологии им. Н.Н. Петрова. В НМИЦ ДГОИ Vademecum не ответили, а в НМИЦ онкологии уточнили, что продолжают разрабатывать CAR-T-технологию с Институтом молекулярной и клеточной биологии Сибирского отделения РАН и рассчитывают получить дополнительное бюджетное финансирование на завершение исследований.
НМИЦ ДГОИ им. Дмитрия Рогачева, проводящий CAR-T-терапию среди детей, начал трансфер технологии Miltenyi Biotec в 2015 году, а в 2018 году провел процедуру первому пациенту. К августу 2021 года врачи центра применили CAR-T терапию при лечении более 60 пациентов, у 90% из них наступила ремиссия. Недавно совместно с НМИЦ гематологии центр провел CAR-T-терапию пациенту с лимфомой клеток мантийной зоны (вариант В-клеточной неходжкинской лимфомы) в первой линии. Сейчас в НМИЦ ДГОИ осталось расходников на лечение трех-четырех пациентов.
Помимо академических CAR-T-продуктов, существуют так называемые коммерческие. В России ни один такой препарат пока не зарегистрирован. Швейцарская Novartis летом 2021 года подала досье на регистрацию в РФ препарата Kymriah по правилам Евразийского экономического союза. Проведения локальных клинических исследований не потребуется, поскольку оба планируемых к регистрации показания (острый лимфобластный лейкоз и B-клеточная лимфома) являются орфанными заболеваниями, а при регистрации технологий для лечения этого типа заболеваний в России допускается использование данных международных исследований в качестве подтверждения безопасности и эффективности. В Novartis на запрос Vademecum о перспективах регистрации в РФ препарата на основе CAR-T технологии не ответили.
Также озвучивались планы выхода на российский рынок разработки J&J, которая уже зарегистрирована для терапии множественной миеломы в США и Европе. Однако статус подачи документов на регистрацию продукта в России неизвестен.
CAR-T подпадает под требования законодательства о биомедицинских клеточных продуктах, что осложняет их выход на рынок. В начале 2022 года появился законопроект, предполагающий изменения в нормативно-правовой базе, которые призваны снизить существующие барьеры. Кроме того, на фоне санкций в отношении РФ появился законопроект, согласно которому правительство сможет утвердить особенности обращения и особые условия регистрации БМКП.
UPD. В пресс-службе Минздрава РФ 31 марта сообщили, что в целях реализации стартовавшего в 2022 году федпроекта «Медицинская наука для человека» на одной из четырех экспериментальных производственных площадок, предназначенных для обеспечения быстрого внедрения инновационных лекарств и медизделий, предусмотрено создание производства с погружением различных клеточных технологий. «Таким образом, Российская Федерация в ближайшей перспективе получит возможность применять при оказании медицинской помощи собственные клеточные технологии, не завися от зарубежных компонентов», – подчеркнули в ведомстве.
Первый заместитель генерального директора НМИЦ гематологии Минздрава РФ, главный внештатный специалист-трансфузиолог Татьяна Гапонова заявила, что специалисты готовы к прекращению поставок технологий и оборудования для клеточной терапии. По ее словам, такие изменения «не окажут драматического влияния на проекты». Она также отметила, что рынок решений для высокотехнологичной автоматической работы с клетками достаточно велик, существуют решения, производимые не в странах Европы или США, и в настоящее время они рассматриваются.
«Нас интересовало не создание собственного продукта, а введение технологии в клинику и скорейший доступ к ней пациентов»
«ОТ ИДЕИ ДО ПЕРВОГО ПАЦИЕНТА ПРОШЛО ЧЕТЫРЕ ГОДА»
– Как и когда в НМИЦ ДГОИ занялись темой CAR-T?
– На мировом рынке пока есть два коммерчески доступных продукта, еще ряд зарубежных компаний ведет КИ или обещает собственный CAR-T препарат. Сколько групп занимается фундаментальными разработками в этой области?
– Терапия, применяемая в Центре Рогачева, – собственная разработка или у вас был партнер?
– Сколько времени занял перенос технологии?
– В каком нормативном статусе сейчас находится CAR-T в России?
– К сожалению, регулируются плохо, потому что российское законодательство предполагает проведение КИ только с целью вывода коммерческого продукта на рынок. Такой подход верен только с одной стороны, поскольку он игнорирует то, что происходит в академических центрах: назначение терапии, анализ результатов, испытание комбинаций лекарств. Во всем цивилизованном мире это оформляется как IIT.
Я не хочу противопоставлять индустриальные и академические КИ, но индустриальные КИ снимают сливки с академических, а в России мы оказались в ситуации, когда АКИ фактически нет, то есть пациенты получают различную инновационную терапию, но такие исследования не регистрируются как клинические, по ним не оформляются отчеты.
« МЫ ТРАТИМ ЭКСТРЕМАЛЬНОЕ КОЛИЧЕСТВО СИЛ »
– То есть пока это не оформлено как КИ?
– В чем принципиальное отличие АКИ от «обычных»?
– АКИ не имеют целью коммерциализацию продукта. В индустриальных исследованиях – да, вы хотите достичь успеха, но ваша мотивация уходит на очень аккуратный подбор группы пациентов. Чтобы получить хороший результат в индустриальных КИ, в первую очередь нужно подобрать подходящих пациентов: вы не будете включать в исследование тех, кто априори не перенесет терапию, и даже тех, на чей счет у вас есть сомнения, что они ее перенесут. АКИ лишены этого подхода – они нацелены на то, чтобы испытать терапию и на «сложном» пациенте. Второе отличие – как правило, меньшая стоимость АКИ из-за экономии на логистике и отсутствия необходимости использовать большой регуляторный аппарат.
CAR-T – это индивидуальная терапия, которая готовится для каждого пациента отдельно. Здесь необходима гибкость: вы не можете принципиально изменить технологию, но можете изменить время приготовления, дозу и так далее, в то время как в индустриальных КИ с участием сотни пациентов такой подход реализовать трудно.
– Сейчас клинические рекомендации и протоколы Минздрава обязательны к исполнению. Каким образом это соотносится с экспериментальной терапией?
– Как осуществляется финансирование проекта?
« В РЕЗУЛЬТАТЕ МЫ СПАСЛИ ПОЛОВИНУ ПАЦИЕНТОВ »
– Стоимость применения CAR-T может достигать 20 млн рублей на пациента. Как такая дорогостоящая терапия встраивается в ВМП?
– Такая терапия позволяет добиться полной ремиссии?
– CAR-T позволяет добиться полной ремиссии у 85–90% пациентов. Ее эффективность очень высока, выше, чем у любой другой, существовавшей ранее, если мы говорим про рефрактерные формы лейкоза. Самая интересная часть вопроса – это стопроцентная ремиссия: девять из десяти пациентов такой результат получают. Для клиницистов важнее другое: является ли CAR-T терапия самостоятельным излечивающим методом, могут ли CAR-T клетки полностью излечить лейкоз? Ответ на этот вопрос пока неоднозначный. Примерно у половины пациентов развивается рецидив после применения CAR-T, и это связано не с неэффективностью терапии, а с биологией опухоли: единичные клетки не имеют на поверхности CD19 антигена – мишени существующих на сегодняшний день CAR-T препаратов.
Для большинства пациентов с лимфобластным лейкозом сегодня эта терапия – мостик к трансплантации костного мозга, а у пациентов с лимфомами их существенная часть – 30–50% от общего числа – болезнь может быть полностью излечена. Три года назад эти пациенты получали бы только паллиативное лечение и умерли. Сейчас в результате этого проекта мы спасли половину пациентов, и это результат, за который стоит бороться и строить дальнейшие планы.
– Эта терапия дается одним курсом или несколькими?
– Novartis недавно заявила, что готовит свой препарат к регистрации в России. Как свой продукт планируете регистрировать вы?
– То есть вы даже не планируете регистрировать препарат?
« СТОИМОСТЬ ЛОКАЛЬНОГО ПРОИЗВОДСТВА ДОЛЖНА ОТЛИЧАТЬСЯ ОТ КОММЕРЧЕСКОГО НА ПОРЯДОК »
– Какая выборка пациентов требуется для КИ таких препаратов?
– Сколько человек попали в ваше исследование CAR-T?
– Насколько высока вероятность, что CAR-T войдет в первые линии терапии?
– В вашем центре такие исследования не проводились?
– АКИ в Центре Рогачева были международными или только национальными?
– В наших КИ участвовали только российские пациенты, поскольку иностранцы в России лечатся за собственный счет, а мы не считали возможным зарабатывать в ситуации, когда российские пациенты не имеют доступа к терапии. То есть технически мы не давали приоритета платным пациентам, поэтому иностранные пациенты в исследованиях не участвовали.
– Насколько широко метод может быть растиражирован?
– Какова разница в цене между коммерческим продуктом и локально произведенным, например, у вас?
– Сколько центров в России могли бы адаптировать такую технологию у себя?
– Какое число пациентов ежегодно нуждается в таком лечении?
– Применима ли CAR-T терапия для лечения солидных опухолей?
Источники информации:
- http://vademec.ru/news/2022/03/03/v-rossii-primenili-car-t-v-pervoy-linii-terapii-vzroslogo-patsienta/
- http://www.almazovcentre.ru/?p=54907
- http://hightech.fm/2022/02/04/car-t-therapy-moiseev-ivan
- http://www.mediasphera.ru/issues/meditsinskie-tekhnologii-otsenka-i-vybor/2020/2/1221906782020021018
- http://biomolecula.ru/articles/sposobny-li-car-t-kletki-unichtozhit-opukhol
- http://rosoncoweb.ru/news/oncology/2021/06/22-3/
- http://vademec.ru/news/2022/06/21/car-t-eto-kak-kosmicheskiy-korabl-na-fone-samoleta-grazhdanskoy-aviatsii/
- http://vademec.ru/news/2022/03/30/rossiyskie-patsienty-ne-smogut-proyti-terapiyu-car-t-/
- http://vademec.ru/article/nas_interesovalo_ne_sozdanie_sobstvennogo_produkta-_a_vvedenie_tekhnologii_v_kliniku_i_skoreyshiy_do/