дикий тип экспрессии p53 что такое
Опухолевый протеин P53 TP53: Arg72Pro (Ex4+119C>G) в Москве
Приём и исследование биоматериала
Когда нужно сдавать анализ Опухолевый протеин P53 TP53: Arg72Pro (Ex4+119C>G)?
Подробное описание исследования
Название гена: TP53 (Опухолевый протеин P53 / tumor protein p53)
Исследуемый полиморфизм: Arg72Pro (Ex4+119C>G)
Функция гена:
Этот ген кодирует белок p53, который реагируя на разнообразные клеточные стрессовые воздействия, регулирует гены-мишени, которые вызывают торможение клеточного цикла, апоптоз, старение, репарацию ДНК или изменения в обмене веществ.
Уровень экспрессии белка р53 в нормальных клетках снижен, а повышенный уровень экспрессии наблюдается в различных трансформированных клеточных линиях, где как считается, белок р53 вносит свой вклад в преобразование и формирование злокачественных новообразований.
Белок p53 является ДНК-связывающим белком, содержащим домен активации транскрипции, ДНК-связывающий домен и домен, отвечающий за олигомеризацию. Это обуславливает, его присоединение к р53-связывающему сайту и активирование экспрессии генов, регулирующих последующие звенья сигнальных каскадов, которые подавляют рост и/или инвазию, и, следовательно, функционирует как супрессор опухоли.
Мутантные белки p53 часто встречаются среди различных опухолей человека. Перестройки этого гена имеют место не только в качестве соматических мутаций в злокачественных новообразований человека, но и как генеративные мутации в некоторых предрасположенных к злокачественным новообразованиям семьях с синдром Ли-Фраумени. Описано несколько вариантов белков р53, обусловленных альтернативными промоторами и несколько варрантов транскриптов, обусловленных альтернативным сплайсингом. Эти варианты кодирования различных изоформ регулируют транскрипционную активность р53.
Ген белка p53 действует как супрессор опухоли во многих типах опухолей, стимулирует замедление роста или апоптоз в зависимости от физиологических условий и типа клеток. Участвует в регуляции клеточного цикла, как транс-активатор, который отрицательно регулирует деление клеток, управляя набором генов, необходимых для этого процесса.
Характерные проявления мутации:
Хорошо выраженный фенотип семейного рака часто связан с наследуемыми мутациями в гене TP53. Кроме того, мутации в этом гене часто рассматриваются, как приводящие к саркоме, раку груди и злокачественным опухолям мозга.
Точечные мутации и делеции гена р53 наблюдаются примерно в 50 % случаев злокачественных заболеваний, хотя частоты повреждений варьируют в зависимости от типа опухоли. Повышенный риск развития рака толстой кишки у больных с неспецифическим язвенным колитом связан с мутацией гена р53 (имеет очень высокую частоту и возникает рано).
Подготовка к исследованию
Специальной подготовки к исследованию не требуется. Необходимо следовать общим правилам подготовки к исследованиям.
ОБЩИЕ ПРАВИЛА ПОДГОТОВКИ К ИССЛЕДОВАНИЯМ:
Если Вы принимаете лекарства, обязательно предупредите об этом лечащего врача.
Дикий тип экспрессии p53 что такое
Строение р53, его гомологи и изоформы
Супрессор опухолевого роста p53 играет решающую роль в поддержании генетической стабильности клетки и предотвращении развития злокачественных опухолей. Для осуществления этой функции р53 участвует со множестве клеточных реакций, модулируя репарацию и выживаемость клеток, а также апоптоз. В конце девяностых годов были отрыты два родственных белка р53: p63 и p73, которые являются структурными, биологическими и биохимическими гомологами р53. Также были выделены двенадцать изоформ р53, шесть изоформ р63 и четырнадцать изоформ р73.
p53α, – β, – γ
Изоформы р53 p53α, – β, – γ могут быть получены в результате классического или альтернативного сплайсинга гена ТР 53. p53α сохраняет олигомеризационный домен, способный связываться с лигазой MDM2 и, таким образом, регулировать стабилизацию р53. p53β может влиять на транскрипционную активность р53 в отношении промоторов р21 и BAX, в то время как p53γ – только в отношении BAX. p53γ, кроме того, обладает цитотоксической активностью [14].
∆40p53α, ∆40p53β, ∆40p53γ
Изоформы ∆40p53 (p47) образуются в результате альтернативного сплайсинга 2-го интрона и/или альтернативной инициации трансляции. Известно, что ∆40p53α обладает доминантно-негативным влиянием в отношении р53, ингибируя его транскрипционную активность, а также ослабляет р53-опосредованное подавление роста клеток. Также ∆40p53α влияет на убиквитацию и внутриклеточную локализацию р53 [8].
∆133p53 и ∆160p53
Изоформы ∆133p53 и ∆160p53 образуются путем альтернативной иницации трансляции с помощью внутреннего промотера ТР53. ∆133p53α препятствует регулируемому р53 репликативному старению, остановке клеточного цикла клетки в фазе G1 и апоптозу, а также вызывает миграцию эндотелиоцитов, формирование кровеносных сосудов и образование метастазов путем регуляции ангиогенеза независимо от р53, таким образом, принимая активную роль в развитии и прогрессии опухоли [3]. Роль ∆133p53β и ∆133p53γ, экспрессирующихся в неизмененных тканях человека в настоящее время до конца не известна.
Выявление изоформ р53 с помощью различных антител
В настоящее время существует большое количество антител к р53, которые ранее можно было разделить по их специфичности на три большие группы – предназначенные для выявления только дикого, типа р53 (пример: клон PAb1620), для выявления как дикого так и мутантного типов р53 (пример: клоны DO-1, DO-7), и для выявления только мутантного р53 (пример: клон PAb240). Однако в последнее десятилетие были выявлены 12 изоформ р53 и, как оказалось, не все антитела, даже принадлежащие к одной из трех перечисленных групп обладают одинаковой способностью выявлять экспрессию тех или иных изоформ. В таблице представлены данные в отношении клонов р53 из наиболее распространенной группы антител, предназначенных для выявления как дикого, так и мутантного типов р53.
Как видно из таблицы, некоторые из антител к р53 являются тропными сразу к нескольким изоформам р53, в то время как другие – лишь в отношении одной из изоформ. Антитела DO-1 и DO-7, которые имеют одинаковый эпитоп, специфичны только в отношении P53α, P53β и P53γ. Антитела 1801 позволяют выявить экспрессию всех изоформ кроме Δ133 P53 (α,β и γ), в то время как антитела DO-12 являются пантропными в связи с эпитопом, локализованным на ДНК-связывающем домене, и позволяют выявлять все изоформы р53. Антитела BP53.10, 421 и ICA-9 специфичны в отношении изоформ P53α, Δ40 P53α и Δ133 P53α из-за эпитопа, локализованного на С-концевом домене белка р53. Антитела CM-1 и SAPU (оба клона были синтезированы против изоформы P53α) также могут выявлять все изоформы р53, однако CM-1 плохо реагирует в отношении Δ133 P53β и Δ133 P53 γ. Антитела SAPU имеют дополнительный эпитоп на ДНК-связывающем домене, что позволяет им эффективно выявлять все изоформы р53. Однако, поскольку изоформы р53 не содержат всех эпитопов антител CM-1 и SAPU, выявление относительной экспрессии изоформ р53 с использованием данных клонов представляется затруднительным и данная оценка могла бы быть произведена только с помощью клона DO-12. Также с целью научного изучения экспрессии изоформ р53 были синтезированы антитела к β изоформам р53, Δ40 P53 и Δ133 P53, так как не одно из доступных коммерческих антител не позволяет выявлять каждую из изоформ р53 по отдельности [20].
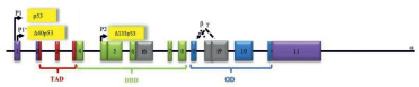
Строение р53. Обозначены проксимальные промотеры Р и Р’ (ответсвтенны за экспрессию, внутренний промотор Р2, домен, активирующий транскрипцию TAD, ДНК-связывающий домен DBD, домен, отвечающий за олигомеризацию OD (адаптировано по Pflaum J. и соавт. [15]
Выявление изоформ р53 с помощью различных клонов антител к р53
Поликлональные антитела к
Примечание. ++ : выраженная экспрессия, +: умеренная экспрессия, +/– :слабая экспрессия, –: нет экспрессии (оценка методом Western Blot) (адаптировано по Khoury M.P. и соавт. [12]).
Изоформы р53 в злокачественных опухолях
Несмотря на то, не во всех разновидностях рака мутация гена ТР 53 является часто встречающейся, известно, что инактивация сигнального пути р53 может происходить в разных опухолях различными путями. В последние годы, учитывая тот факт, что экспрессия изоформ р53 в опухолях отличается от неизменных клеток, изучение роли в канцерогенезе является определяющей.
Накоплены определенные данные, касающиеся экспрессии изоформ р53 в различных опухолях. Так, в молочной железе отмечено, что в то время как в нормальной ткани молочной железы экспрессируются p53α, p53β, и p53γ, в 60 % опухолей молочной железы отмечается потеря экспрессии 53β и p53γ, а в 40 % из них – гиперэкспрессия изоформы [4]. В отношении меланомы было показано, что изоформы p53βand Δ40p53 экспрессируются в опухолевых клетках, но не в меланоцитах или фибробластах [2]. В почечно-клеточной карциноме отмечается гиперэкспрессия изоформ p53β и Δ133p53 по сравнению с нормальными клетками [19]. Также показано, что отличная от неизменных клеток экспрессия изоформ р53 отмечается в холангиокарциномах, глиобластомах, опухолях головы и шеи, раке толстой кишки, яичников и легких [10, 21]. Было показано, что изоформы р53 обладают способностью переключать активность р53 между действием, направленным на выживаемость клетки и направленным на запрограммированную гибель клетки. Таким образом, в условиях их изменённой экспрессии они могут выступать фактором, способствующим развитию и прогрессии опухоли, а также препятствовать развитию чувствительности опухоли к химиотерапии.
Важным аспектом является выявление связи между профайлингом экспрессии изоформ р53 и прогрессией опухоли, а также между клиническим ответом на терапию и прогнозом заболевания. В отличие от p53β, который способствует репликативному старению, ∆133p53α вызывает пролиферацию клеток и препятствует их старению. В результате Fujita и соавт. описали так называемую инверсию соотношения p53β/∆133p53 (снижение экспрессии p53β и сопутствующее увлечении экспрессии ∆133p53α), которая участвует в прогрессии колоректальной аденомы в карциному [7]. В почечноклеточной карциноме гиперэкспрессия p53β в опухоли связана со стадией опухоли и является хорошим методом предиктором опухолевой прогрессии [19]. Было показано, что патологическая экспрессия p53β и ∆133p53 имеет место в муцинозных карциномах яичника. Кроме того, экспрессия ∆40p53α в карциномах яичника с диким типом р53 связана с более высоким процентом безрецидивной выживаемости пациенток [9].
Важно отметить, что в серозных карциномах яичника при III-IV стадии заболевания и наличии мутации в гене TP53 эксперссия ∆133p53α связана с более высоким уровнем выживаемости без признаков заболевания и общей выживаемости, в то время как при III-IV стадиях заболевания без мутации TP53 (дикий тип) отмечается лишь более высокая выживаемость без признаков заболевания [11]. Таким образом, можно предположить, что мутации в гене ТР53 могут влиять на прогностическую ценность изоформ р53. Кроме того, экспрессия p53δ связана с низким ответом на лечение и плохим прогнозом заболевания [10]. Поскольку изоформы р53 влияют на опухоль-супрессорную активность р53, предполагают, что их гиперэкспрессия или потеря экспрессии играет определённую роль в канцирогенезе. Однако в некоторых случаях они могут играть и ингибирующую функцию при таких мутациях ТР53 с приобретением новой функции (gain of function mutation). Примером такого механизма может служить гиперэкспрессия ∆133p53 при карциномах яичника с мутациями в гене ТР53 или гиперэкспрессия p53γ в карциномах молочной железы с мутацией ТР53, что приводит к ослаблению негативного влияния мутации ТР 53 [4, 11].
Клиническое значение активности изоформ р53 при злокачественных опухолях
В настоящее время в разработке находится новая терапевтическая стратегия, направленная на реактивацию р53 в раковых клетках путем активизации мутантного белка р53 или путем ингибирования супрессоров р53, таких как MDM2 [17]. Кроме того, учитывая, что изменение экспрессии изоформ р53 связано с развитием и прогрессией злокачественных опухолей, можно предположить, что профайлинг экспрессии этих изоформ может стать эффективным опухолевым маркером и мишенью таргетной терапии рака. В настоящее время хорошо известны, различные стрессовые воздействия на клетку, так как повреждения ДНК приводят к изменению процесса мРНК-сплайсинга [6]. В некоторых исследованиях было показано, что экспрессию изоформ р53 можно модулировать In vivo с помощью химиотерапии [1, 2]. Некоторые регуляторы экспрессии p53 изоформ уже известны, например дискерин и аннексин A2 [13, 18]. Схемы лечения, направленные на модуляцию этих факторов и, следовательно, на экспрессию изоформ р53, могут снизить негативное влияние повышенного соотношения Δ133p53α/p53β для того, чтобы остановить распространение и прогрессирование рака. Кроме того, экспрессию изоформ р53 можно регулировать путем влияния на деградацию соответствующих белков. Вся схема убиквитации изоформ р53 в настоящее время не известна, однако уже было показано, что изформы р53 по-разному реагируют с основной E3-лигазой р53, MDM2 [5]. Так, антагонист MDM2 нутлин-3а (nutlin-3а) стабилизирует p53α и сенсибилизирует клетки к химиотерапии [16].
Заключение
С момента открытия р53 необходимость расширения знаний об этом белке постоянно увеличивалась, учитывая, прежде всего, его важную роль в процессе карциногенеза. Белок p53 участвует во многих физиологических процессах, однако наиболее изученным является его опухоль-супрессорная функция. Кроме того, p53 объединяет множество клеточных сигналов от поврежденных субклеточных органелл, а также межклеточных контактов, внеклеточного матрикса, гормонов и цитокинов. На основании этих сигналов р53 регулирует такие процессы в клетке, как выживаемость, старение, дифференцировку, миграцию клеток и запрограммированную гибель клеток. На основании многочисленных исследований было выявлено, что ген TP53 кодирует несколько изоформ p53, которые взаимодействуют с p53 и модулируют его активность в отношении стимуляции выживаемости или гибели клеток. Учитывая тот факт, что изоформы p53 играют фундаментальную роль в регулировании сигнального пути p53, их экспрессия часто нарушена в злокачественных клетках. В связи с этим была выдвинута гипотеза о том, что дикий тип р53 может выступать в качестве супрессора опухолевого роста или протоонкогена в зависимости от профайлинга экспрессии изоформ р53. В некоторых видах рака измененная экспрессия изоформ p53 коррелирует с клиническими проявлениями, рецидивированием рака и/или общей выживаемостью. Кроме того, некоторые изоформы р53, как полагают, могут выступать в качестве потенциальных маркеров для терапии рака. Тем не менее, изформы p53 нельзя разделить на онкогенные или опухоль-супрессорные классы, так как их биологическая активность и, следовательно, их прогностическое значение связаны с типом тканей. В то же время было высказано предположение, что некоторые изоформы p53 могут стать успешными объектами таргетной терапии рака, как, например, при тройном негативном раке молочной железы. Чтобы достичь успехов в разработке такой терапии, необходимо более глубокое понимание процессов регуляции экспрессии и реализации эффектов изоформ р53, а также их действия в зависимости от типа ткани и дикого или мутантного типа р53 в тех или иных опухолевых клетках.
Библиотека
Опухолевые супрессоры и мутаторные гены
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
3.3.1. Типы опухолей, ассоциированные с аномалиями р53
Герминальные (произошедшие в половой клетке и передающиеся по наследству) мутации в одном из аллелей гена р53 вызывают синдром Ли-Фраумени, заключающийся во врожденном предрасположении к развитию различных новообразований, в первую очередь сарком, рака молочной железы, лимфолейкозов. Нередко синдром Ли-Фраумени характеризуется возникновением первично-множественных опухолей. Примечательно, что у трансгенных мышей, несущих инактивирующие мутации в гене р53, наблюдается картина, очень напоминающая синдром Ли-Фраумени. Примерно у трети животных, у которых инактивирован один из двух аллелей р53, в течение 6-9 месяцев после рождения возникают новообразования, причем их спектр очень сходен с наблюдаемым при синдроме Ли-Фраумени. При этом в части этих опухолей, как и новообразований у пациентов с синдромом Ли-Фраумени, сохраняется экспрессия неповрежденного аллеля гена р53. При врожденной инактивации во всех клетках организма обоих аллелей гена р53 опухоли развиваются практически у всех животных. Примерно такая же картина наблюдается у трансгенных мышей, несущих дополнительный экзогенный аллель р53, кодирующий белок с миссенс-мутацией.
3.3.2. Структурная организация и биохимические активности белка р53
Продукт гена р53 имеет мол. массу 53кДа и состоит из 392 аминокислотных остатков. Он образует тетрамерный комплекс, способный регулировать транскрипцию ряда генов, имеющих в своем составе специфические последовательности ДНК, так называемые р53-респонсивные элементы. В молекуле р53 картировано несколько функционально-значимых доменов, играющих важную роль в осуществлении или регуляции его активности (Рис. 2).
N-концевой участок (аминокислоты 1-42) представляет собой домен, ответственный за транскрипционную активацию генов-мишеней. Он обладает способностью связываться с компонентами базальных факторов транскрипции, в частности с субъединицами hTAFII31, hTAF70 комплекса TFIID РНК-полимеразы II, а также с транскрипционным кофактором p300/CBP. Кроме того, этот домен участвует в белок-белковых взаимодействиях, регулирующих стабильность молекулы р53. И, наконец, в нем расположено несколько остатков серина и треонина, фосфорилирование которых регулирует активность р53.
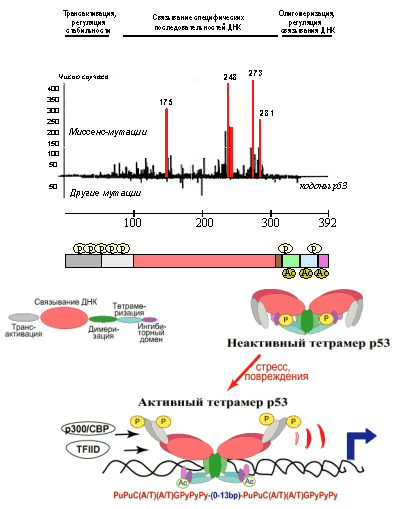
Рис. 2. Схематическое изображение функциональных доменов р53, предполагаемой модели приобретения белком транскрипционно активной конформации и частоты встречаемости в новообразованиях человека мутаций в разных участках молекулы р53.
Далее идут участки ответственные за ядерную локализацию (аминокислоты 305-323) и димеризацию/тетрамеризацию молекул р53 (аминокислоты 323-356). С-концевой участок р53 (аминокислоты 363-392) представляет собой так называемый ингибиторный домен. В немодифицированном состоянии он препятствует посадке ДНК-связывающего домена на специфическую последовательность регулируемого гена. Фосфорилирование и ацетилирование его определенных сайтов вызывают изменения конформации белковой молекулы и переход тетрамеров р53 из неактивного (латентного) состояния в активное. В результате ДНК-связывающие домены освобождаются от блокирующего влияния ингибиторных доменов и приобретают способность садиться на р53-респонсивные элементы. Таким образом, к респонсивным генам привлекаются базовые факторы транскрипции, связывающиеся с N-концевым участком р53, и стимулируется синтез РНК генов-мишеней.
Помимо повышения транскрипции генов, содержащих специфические респонсивные элементы, белок р53 обладает также и рядом других активностей. В частности, он способен подавлять транскрипцию многих других генов, например протоонкогенов BCL2, JUN и FOS, гена фибронектина и т.д. В основе такой транс-репрессии лежит несколько механизмов: связывание и секвестрация активированным р53 ряда базовых факторов транскрипции (p300/CBP, TBP, CBF); способность связывать и рекрутировать к определенным генам гистоновые деацетилазы (HDAC), ремоделирующие хроматин; и т.д. Кроме того, р53 связывается с белками, вовлеченными в репликацию или репарацию ДНК и, как следствие, модулирует эти процессы. Так, взаимодействуя с белком RP-A, он ингибирует его способность активировать ДНК-полимеразы a и d, результатом чего является подавление репликации ДНК. Связывая компоненты комплекса TFIIH (ERCC2, ERCC3 и др.), р53 активирует его функцию и стимулирует тем самым эксцизионную репарацию ДНК. Связывание р53 с белком Rad51 ведет к стимуляции рекомбинаций ДНК и повышению эффективности репарацию двунитевых разрывов ДНК. На участие р53 в репарации ДНК указывает также и его способность проявлять активность 3′-5′-экзонуклеазы и узнавать участки одноцепочечной ДНК и/или неспаренные основания.
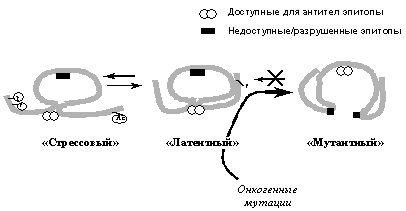
Рис. 3. Схематическое изображение различных конформационных состояний р53, распознаваемых специфическими антителами. Онкогенные мутации вызывают необратимый переход молекулы в денатурированное состояние, при котором открывается ранее недоступный эпитоп и, наоборот, исчезают некоторые ранее доступные эпитопы.
Характерные для опухолевых клеток миссенс-мутации приводят к резкому изменению конформации молекулы белка р53 (Рис. 3), что в значительной степени затрагивает все из вышеуказанных его активностей: происходит потеря или ослабление способности связывать и активировать гены с р53-респонсивными элементами, репрессировать другие специфические гены-мишени, ингибировать репликацию ДНК и стимулировать репарацию ДНК. Причем, так как р53 образует тетрамерные комплексы, мутации в одном аллеле гена р53 вызывают инактивацию и продукта второго, неповрежденного аллеля. Дело в том, что коэкспрессирующиеся нормальный и мутантный белок р53 образуют неактивные гетеромерные комплексы. Таким образом, мутантный белок ингибирует функции нормального белка р53 по доминантно-негативному механизму. По-видимому, именно эта особенность мутантных р53 в значительной мере ответственна за их онкогенный потенциал. В пользу этого свидетельствует тот факт, что введение в клетки короткого полипептида, соответствующего олигомеризационному домену р53, нарушает образование полноценных тетрамерных комплексов р53 и вызывает опухолевую трансформацию. Необходимо заметить, что помимо утраты нормальных функций р53, мутантные р53 с аминокислотными заменами в горячих точках (кодоны 175, 248 и др.) приобретают новые свойства, не свойственные белку р53 дикого типа (gain-of-function). Так, описано приобретение мутантными р53 способности активировать промоторы протоонкогенов MYC и ERB1, антиапоптотического гена BGL1 из семейства Bcl2, гена MDR1, детерминирующего множественную лекарственную устойчивость клеток и т.д. Предполагается, что это обусловлено способностью некоторых мутантных р53 связывать белки, в частности другие факторы транскрипции, с которыми нормальный р53 не взаимодействует, и модифицировать экспрессию генов, регулируемых этими транскрипционными факторами.
3.3.3. Физиологические функции р53 и их нарушения в неопластических клетках
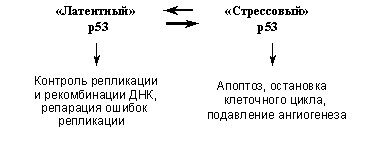
Молекулы белка р53 могут находиться в различных конформационных состояниях, в которых они обладают разными биохимическими активностями и выполняют разные физиологические функции. В обычных условиях р53 находится в так называемой латентной форме, в которой он обладает слабой транскрипционной активностью. Такой р53, однако, связывает белки репарационной машины (см. выше), проявляет активность 3′-5′-экзонуклеазы и стимулирует рекомбинацию и репарацию ДНК. При различных стрессах и внутриклеточных повреждениях происходят пост-трансляционные модификации, в частности фосфорилирование и ацетилирование определенных аминокислот молекулы р53, определяющие ее переход в так называемую стрессовую конформацию. Такой р53 значительно более стабилен (т.е. резко увеличивается его количество в клетке) и эффективно транс-активирует и/или транс-репрессирует специфические гены-мишени, следствием чего является индукция в аномальных клетках либо остановки клеточного цикла, либо апоптоза. Кроме того, активация р53 ведет к изменению экспрессии генов некоторых секретируемых факторов, в результате чего может изменяться размножение и миграция не только поврежденной, но и окружающих клеток. При этом, находясь в стрессовой конформации, р53 в значительной степени утрачивает активности, стимулирующие рекомбинацию и/или репарацию ДНК.
р53 дикого типа, в дополнение к латентной и стрессовой, может временно приобретать и так называемую мутантную конформацию, сходную с той, в которую молекула р53 необратимо переходит при онкогенных мутациях. Транзиторный переход р53 в мутантную конформацию происходит при воздействии определенных цитокинов и/или морфогенов (PDGF, тромбопоэтин, ретиноевая кислота и др.). Биологический смысл такого перехода пока неясен. Возможно, он заключается в полной инактивации рост-ингибирующих активностей р53 и/или изменении набора его генов-мишеней.
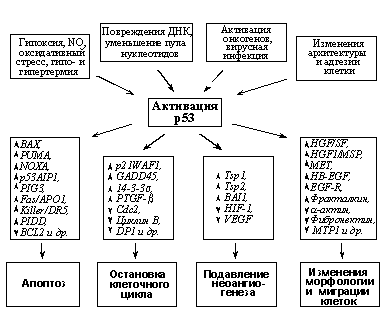
Таким образом, р53 играет важную охранную роль, являясь по образному выражению D.Lane, «стражем генома». Его повседневная функция заключается, по-видимому, в распознавании и исправлении ошибок, неизменно возникающих в ходе репликации ДНК. При массивных повреждениях ДНК, других внутриклеточных нарушениях или угрозе их возникновения происходит переключение функций р53 (Рис. 4): приобретая транскрипционные активности и изменяя экспрессию генов-мишеней, он вызывает либо остановку размножения аномальных клеток (временную, для устранения повреждений, или необратимую), либо их гибель (факторы, определяющие судьбу клетки при активации р53 будут рассмотрены ниже). В результате устраняется возможность накопления в организме генетически измененных клеток.
Механизмы активации р53 при стрессах и внутриклеточных повреждениях. Активация транскрипционных функций р53 наблюдается при самых разнообразных стрессах и внутриклеточных нарушениях: УФ- и g-облучении, присутствии в клетке разорванной ДНК, понижении внутриклеточного пула нуклеотидов, ингибировании ДНК- и РНК-полимераз, гиперэкспрессии онкогенов, вирусной инфекции, гипоксии, оксидативном стрессе, гипо- и гипертермии, различных нарушениях клеточной архитектуры (увеличении числа ядер, изменениях цитоскелета и адгезии) и т.д.
Ключевую роль в стабилизации белка р53 и повышении его транскрипционной активности играют изменения взаимодействия р53 с белком-ингибитором Mdm2, ген которого является потенциальным онкогеном. Белок Mdm2 связывается с N-концом молекулы р53 и, обладая активностями Е3 убиквитин-лигазы, стимулирует убиквитинизацию и, как результат, протеосомную деградацию белка р53. Поэтому, в норме уровень экспрессии р53 очень невелик, а время его жизни составляет всего около 30 минут. Кроме того, связываясь с N-концевым участком р53 в районе домена, взаимодействующего с базовыми факторами транскрипции, Mdm2 подавляет способность р53 транс-активировать гены-мишени.
Рис. 4. Охранные функции р53.
А). Функции «латентной» и «стрессовой» форм р53.
Б) Факторы, вызывающие транскрипционную активацию р53, гены-мишени активированного р53 и вызываемые изменениями их экспрессии биологические эффекты.
Важную роль в приобретении молекулами р53 конформации, способной транс-активировать гены-мишени, играют также модификации С-концевого участка, а именно ацетилирование его определенных аминокислотных остатков. При повреждениях ДНК и экспрессии активированного онкогена RAS эти события инициируются связыванием освобождающегося от Mdm2 N-концевого участка p53 с базальным фактором транскрипции р300/CBP, ацетилирующим сначала ингибиторный домен р53 по лизинам 373 и 382, а затем (после связывания р53 с респонсивными элементами) и белки хроматина в области генов-мишеней. Таким образом, последовательные пост-трансляционные модификации N-концевого и С-концевого участков р53 вызывают увеличение количества белка р53 в клетке, приобретение им способности связывать р53-респонсивные элементы и рекрутировать к генам мишеням базовые факторы транскрипции (компоненты комплекса TFIID РНК-полимеразы II и гистоновые ацетилазы p300/CBP, деконденсирующие хроматин), стимулируя тем самым транскрипцию их мРНК.
При некоторых стрессах, в частности при гипоксии, наблюдаются пост-трансляционные изменения р53, вызывающие его переход не к классической стрессовой конформации, а к ее варианту. Такой р53 не транс-активирует гены, содержащие р53-респонсивные элементы, но подавляет транскрипцию других генов-мишеней. Эта, так называемая репрессионная, форма также фосфорилирована по N-концу, но ее С-концевой участок не ацетилирован и связывает репрессионные комплексы Sin3/HDAC, вызывающие конденсацию хроматина генов-мишеней.
Гены-мишени р53 и их функции. В настоящее время, помимо Mdm2, обеспечивающего регуляцию самого р53 по принципу обратной связи (см. выше), идентифицировано более сотни генов, являющихся мишенями транскрипционных активностей р53. Они могут быть разделены на несколько групп, исходя из их физиологических функций (Рис. 4Б).
Идентифицирован также ряд генов-мишеней р53, продукты которых вызывают остановку в фазе G2 (задержка в ней наблюдается в случае, когда р53 активировался уже после того как клетка прошла G1-чекпойнт, или в клетках с инактивированным G1-чекпойнтом). Активированный р53 подавляет функцию комплекса циклин B/Cdc2, играющего ключевую роль в переходе из G2 в митоз, по нескольким механизмам. Во-первых, он транс-активирует ген 14-3-3-s, белковый продукт которого связывает и секвестрирует комплексы циклин B/Cdc2 в цитоплазме, не давая возможности им попасть в ядро, где они и должны проявлять свою активность. Во-вторых, он транс-активирует ген GADD45, белковый продукт которого обладает способностью связывать Сdc2, разрушая таким образом комплексы циклин B/Cdc2. В-третьих, р53 репрессирует транскрипцию генов циклина B и Cdc2, что уменьшает синтез их продуктов. Следует заметить, что, как и в случае остановки клеточного цикла в G1, задержка в G2 при повреждениях ДНК наблюдается и в клетках с инактивированным р53: она происходит в результате подавления функции фосфатаз Cdc25 (Cdc25A при остановке в G1 и Cdc25C при остановке в G2), активирующих соответствующие цикдинзависимые киназы. Однако в клетках с нарушенной функцией р53 происходит лишь кратковременная задержка в чекпойнтах, а активация р53 обеспечивает длительную остановку клеточного цикла, предотвращающую размножение вплоть до исправления дефекта.
Выявлено еще несколько десятков генов-мишеней р53. Среди них следует отметить ген каталитической субъединицы теломеразы (TERT), который репрессируется р53 (таким образом, р53 участвует, по-видимому, и в обеспечении репликативного старения клеток. По-видимому, р53 принимает участие и в процессах созревания клеток, так как некоторые из транс-активируемых им генов кодируют белки репертуара той или иной дифференцировки (мышечная креатинкиназа и др.).
3.3.4. Гомологи р53: р63 и р73