Как сделать препарат для микроскопа
Микропрепарат для микроскопа своими руками
Как сделать фиксированный микропрепарат? Самый простой образец – луковая кожица. Чтобы подготовить микропрепарат, очистите луковицу, после чего аккуратно снимите тонкую пленку с нее. На предметное стеклышко капните пару капелек воды и разместите луковую пленку. Далее капните на нее йод и закройте покровным стеклом. Йод нужен для того, чтобы увеличить контрастность получаемого изображения под микроскопом.
Как еще можно сделать фиксированные микропрепараты? Способов предостаточно! Делая тонкие срезы, вы легко сделаете образцы из разных растений, овощей. Обязательно для изучения должно быть достаточно света, иначе картинка будет нечеткой.
Как сделать микропрепарат для микроскопа, вы теперь знаете. Но для исследования объекта могут также понадобиться разнообразные красители. Использовать можно йод, раствор синьки, эозина и другие препараты, которые найдутся в домашней аптечке. Для изучения под микроскопом в домашних условиях подойдут кристаллы сахара и соли, шерсть домашних животных и даже плесень.
4glaza.ru
Апрель 2020
Использование материала полностью для общедоступной публикации на носителях информации и любых форматов запрещено. Разрешено упоминание статьи с активной ссылкой на сайт www.4glaza.ru.
Производитель оставляет за собой право вносить любые изменения в стоимость, модельный ряд и технические характеристики или прекращать производство изделия без предварительного уведомления.
Техника приготовления микропрепаратов
Микроскопы открывают крохотные миры.
С помощью микроскопа можно увидеть невероятный мир, существующий на клеточном уровне. Поразительным свойством микропрепаратов является возможность их длительного хранения и наблюдения распада клеток с течением времени. В любом случае, если не терпится поскорее взглянуть на образец или проводится долгое научное исследование, нужно научиться приготавливать микропрепараты.
Приготовление сухого препарата
Сухие препараты используются для изучения образцов, не требующих для выживания контакта с водой. Для начала потребуется чистое предметное стекло. Осторожно поместите как можно более тонкий срез образца в центр предметного стекла и накройте его покровным стеклом. Если вы в резиновых перчатках, можете слегка придавить покровное стекло, чтобы выровнять препарат.
Приготовление влажного препарата
Влажные препараты используются, если образец не может обходиться без воды, чтобы оставаться живым. Это часто бывает с одноклеточными организмами и мелкими животными. Возьмите чистое предметное стекло. С помощью пипетки, поместите одну-две капли дистиллированной воды в центр стекла. Поместите в воду образец и накройте его покровным стеклом. Опять же, можно немного прижать покровное стекло, если на руках резиновые перчатки. Прикосновение к стеклу без перчаток оставит на нем отпечатки, мешающие наблюдениям препарата под микроскопом.
Влажные препараты сами по себе удерживают покровное стекло на месте и могут храниться некоторое время. Если исследуемые микроорганизмы слишком подвижны, чтобы их можно было изучать, «замедлить» их, добавив в воду связующий компонент, например «Protoslo» (1,5% раствор метилцеллюлозы).
Подкрашивание препаратов
Некоторые организмы трудно увидеть под микроскопом без дополнительного окрашивания. Лучший способ это сделать – добавить капельку раствора Люголя (раствор йода и йодида калия) в воду перед тем, как поместить в нее образец. Также можно использовать растворы «метиленового синего» или «кристаллического фиолетового».
Если требуется окрасить уже готовый препарат, можно попробовать такую хитрость. Поместите с одной стороны покровного стекла краситель, а с другой – бумажную салфетку. Салфетка будет вытягивать влагу из-под стекла с одной стороны и таким образом затягивать под него краситель с другой стороны.
Методы приготовления препаратов для микроскопии, микробиология
Методы приготовления препаратов для микроскопии, микробиология
Микроскопия Изучение морфологии и строения клеток микроорганизмов, величина которых измеряется в большинстве случаев микрометрами (1 мкм = = 10 мм =10 м), возможно только с помощью микроскопов, обеспечивающих увеличение исследуемых объектов в сотни (световая микроскопия) и десятки тысяч (электронная микроскопия) раз. Изображение в световом микроскопе формируется вследствие того, что объект и различные элементы его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст). Световая микроскопия включает в себя обычную просвечивающую микроскопию (светло- и темнопольную), фазово-контрастную и люминесцентную.
Светлопольная микроскопия. Существуют различные модели учебных и исследовательских световых микроскопов, которые позволяют определить форму клеток микроорганизмов, их размер, подвижность, степень морфологической гетерогенности, а также характерную для микроорганизмов способность к дифференцирующему окрашиванию. Правила пользования микроскопом. Строгое соблюдение правил пользования микроскопом является непременным условием для каждого работающего с ним.
При работе необходимо соблюдать следующую последовательность:
При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
| 1 | Прежде чем сменить объектив, рассматриваемый объект (или его участок) ставят в центре поля зрения микроскопа при малом увеличении. Диаметр линзы уменьшается по мере возрастания степени увеличения, вследствие чего объект, если он лежит не в центре, при смене объектива может оказаться за пределами поля зрения. | Before changing the lens, the object in question (or its section) is placed in the center of the field of view of the microscope at low magnification. The diameter of the lens decreases as the magnification increases, as a result of which the object, if it is not in the center, may be out of sight when the lens is changed. |
| 2 | Слегка приподнимают тубус и затем переводят объектив с помо щью револьвера. Это необходимо потому, что объектив большего увели чения всегда бывает длиннее. | Slightly raise the tube and then transfer the lens with a revolver. This is necessary because the lens of higher magnification is always longer. |
| 3 | Для того чтобы в поисках фокусного расстояния не раздавить пре парат или, что еще хуже, не повредить линзу объектива, тубус с подведеннымпод него объективом, глядя для контроля сбоку микроскопа, опускают до самой поверхности препарата и затем, смотря в окуляр, очень медленно (чтобы не пропустить появления очертаний предмета) поднимают. | In order not to crush the preparation or, even worse, to damage the objective lens, while searching for the focal length, the tube with the objective underneath it, looking to control the side of the microscope, is lowered to the surface of the preparation and then, looking into the eyepiece, very slowly (so as not to miss the appearance of the outlines of the subject) raise. |
Рассматривают препарат в микроскоп левым глазом. Правый глаз при этом должен оставаться открытым. Левую руку держат на микрометрическом винте и слегка вращают его (влево и вправо).
Этим достигается возможность рассмотрения поверхностных и более глубоких участков объекта. Правой (свободной) рукой делают зарисовку того, что видно в поле зрения.
Правила работы с иммерсионным объективом. Сухой окрашенный препарат (приготовление см. ниже) помещают на столик микроскопа и, пользуясь объективом 8х, устанавливают свет.
Затем в центр препарата на мазок наносят каплю иммерсионного масла и заменяют сухую систему иммерсионной. С помощью макрометрического винта опускают тубус микроскопа до погружения объектива в масло. Эту операцию нужно проводить очень осторожно, следя сбоку за тем, чтобы фронтальная линза не коснулась предметного стекла и не получила повреждения. После погружения объектива в масло осторожно, также пользуясь макровинтом, поднимают тубус и, наблюдая в окуляр, находят плоскость препарата. Точная фокусировка достигается с помощью микрометрического винта. По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной ксилолом. Оставлять масло на поверхности линзы ни в коем случае нельзя, так как оно способствует фиксированию пыли и может со временем привести к повреждению оптики микроскопа. Изучение микроорганизмов в световом микроскопе.
Выбор методов микроскопического анализа и способов окраски определяется конкретной целью исследования.
Покровные стекла, применяемые для приготовления препаратов микроорганизмов, также должны быть тщательно вымыты и высушены. Толщина покровных стекол не должна превышать 0,15-0,17 мм. Более толстые покровные стекла резко ухудшают качество получаемого изображения. Препараты живых клеток микроорганизмов
2. «Висячая капля». Каплю суспензии микроорганизмов петлей наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна висеть свободно, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят на жидкой питательной среде. Препараты фиксированных окрашенных клеток микроорганизмов
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
Метод раздавленной капли
Метод раздавленной капли можно использовать не только в лабораторных, но и в домашних условиях. Это исследование непременно понравится и взрослым, и детям. Важное условие – под рукой должно быть все самое необходимое. А именно: микроскоп и предметные и покровные стекла. Купить их можно в интернет-магазине «Четыре глаза».
Суть метода заключается в исследовании живых объектов, включая клетки тканей, различных культур, бактерии и так далее. Препарат «Раздавленная капля» давно и успешно применяется в микробиологии. Сам образец можно купить в готовом виде, но куда более интересно приготовить его самостоятельно.
Приготовление препарата «Раздавленная капля»
Раздавленная капля в микробиологии дает возможность изучить жизнь и размножение многих микроорганизмов. Чтобы провести эксперимент, достаточно иметь немного воды из любого природного водоема. Заранее подготовьте также предметное и покровное стекла, а также стерильную пипетку и любое средство для обезжиривания поверхности. Дальше рекомендуется следовать простой инструкции:
Капля будет находиться в специальной герметичной камере, поэтому храниться может на протяжении длительного времени.
Воду стоит наносить пипеткой или специальной петлей. Важно проследить, чтобы в образце не появилось лишнего воздуха. Чтобы предотвратить высыхание, препарат хранят во влажной камере.
4glaza.ru
Апрель 2020
Использование материала полностью для общедоступной публикации на носителях информации и любых форматов запрещено. Разрешено упоминание статьи с активной ссылкой на сайт www.4glaza.ru.
Производитель оставляет за собой право вносить любые изменения в стоимость, модельный ряд и технические характеристики или прекращать производство изделия без предварительного уведомления.
Приготовление микроскопических препаратов
Новые стекла перед употреблением кипятят в 1%-ном растворе соды 10 мин, промывают водой, слабой соляной кислотой и хорошо прополаскивают в дистиллированной воде. Стекла, бывшие в употреблении, необходимо обработать раствором серной кислоты в течение 2 ч, хорошо промыть в воде и прокипятить 10 мин в 4%-ном растворе соды. Ополоснутые затем дистиллированной водой стекла протирают чистой полотняной тряпочкой.
Исследование микроорганизмов в живом виде
Бактерии ввиду их малых размеров чаще рассматривают в мертвом виде на фиксированных окрашенных препаратах. При этом получается более ясное представление о форме и размерах клеток, о способности их к спорообразованию. В живом виде в «раздавленной» капле бактерии рассматривают в том случае, когда выясняют их способность к движению.
Препарат «раздавленная» капля. На обезжиренное предметное стекло прокаленной петлей наносят каплю стерильной воды, в которую той же петлей вносят небольшое количество исследуемой культуры микроорганизма (дрожжей или бактерий), взятой с твердой питательной среды. Из жидкой среды культуру берут вместе с каплей жидкости, а при надобности добавляют каплю стерильной воды. Суспензия культуры микробов на стекле должна давать лишь слабую муть. При микроскопировании дрожжей в каплю жидкости на стекле добавляют петлей небольшое количество метиленовой сини (до голубого окрашивания) и всю эту смесь тщательно размешивают. Прижизненная окраска дрожжей метиленовой синью применяется для того, чтобы выявить мертвые клетки, легко окрашивающиеся в синий цвет. Живые клетки остаются неокрашенными, так как не пропускают краску через свою оболочку.
Приготовленный на предметном стекле препарат дрожжей накрывают покровным стеклом и рассматривают с объективом 40Х. В таком препарате обычно хорошо видны прозрачные овальные или круглые клетки дрожжей с ядрами и оболочками, которые хорошо заметны в клетках живых дрожжей. Мертвые клетки, как правило, более мелкие по сравнению с живыми м окрашены в синий цвет.
Препарат живых бактерий готовится подобно препарату дрожжей, но бактерии можно рассматривать и без добавления краски. На поверхность покровного стекла наносится капля иммерсионного масла, и препарат рассматривается с иммерсионным объективом 90 X, лучше всего в затемненном поле (т.е. с прикрытой диафрагмой). Если культура бактерий подвижная, то хорошо видны быстрые разнохарактерные движения отдельных клеток.
Для приготовления препарата плесневых грибов очень осторожно (чтобы не разрушить органов спороношения) специальной иглой (можно препаровальной) или ботаническим пинцетом снимают кусочек пленки гриба и переносят его в каплю воды, предварительно нанесенную на предметное стекло. Препарат осторожно, слегка придавливая, накрывают покровным стеклом и рассматривают под микроскопом с объективом 8Х. При этом увеличении хорошо различается строение органов спороношения плесневых грибов. Для подробного изучения отдельных деталей строения (гиф, сумок и т.д.) препарат рассматривают с объективом 40X. При этом обязательно следует регулировать освещение с помощью диафрагмы для получения более четкого изображения рассматриваемых деталей.
При приготовлении препаратов в раздавленной капле нужно помнить следующее:
1. При опускании покровного стекла на каплю следует прикоснуться его ребром к краю капли и, постепенно наклоняя, опустить стекло.
2. Капля не должна быть большой, чтобы жидкость не переливалась за края и не попадала на верхнюю сторону покровного стекла. Избыток воды снимают кусочком фильтровальной бумаги.
3. Одиночные пузырьки воздуха, оставшиеся под покровным стеклом, обычно не мешают наблюдению. Но если пузырьков много, препарат следует приготовить заново.
4. Препарат не должен быть слишком густым, чтобы микроорганизмы не заслоняли друг друга.
5. Приготовленные препараты рассматривают немедленно (особенно живых бактерий), так как в противном случае вода высыхает и клетки бактерий теряют подвижность.
6. Бактериологическую петлю (или иглу) перед каждым очередным пассажем и после него (нанесение капли воды на стекло, снятие культуры с агара и ее размешивание, взятие краски и т.д.) следует обязательно докрасна прокаливать в пламени горелки.
После прокаливания петлю быстро охлаждают на воздухе (держат 2-3 сек, ни к чему не прикасаясь) и приступают к выполнению очередного этапа работы.
Исследование микроорганизмов в фиксированном и окрашенном виде
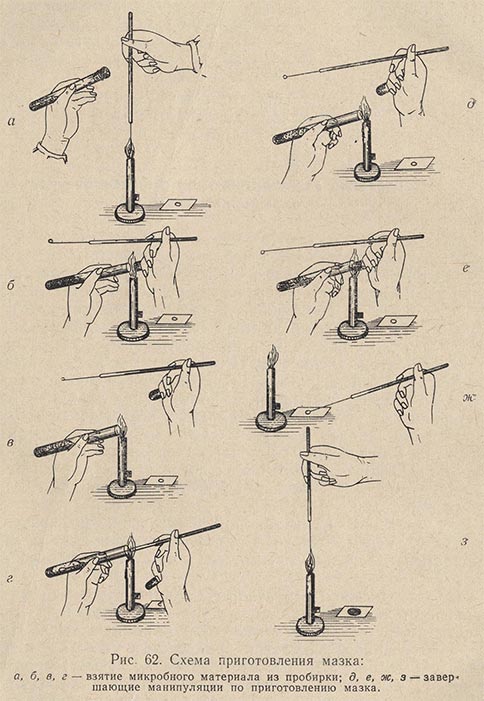
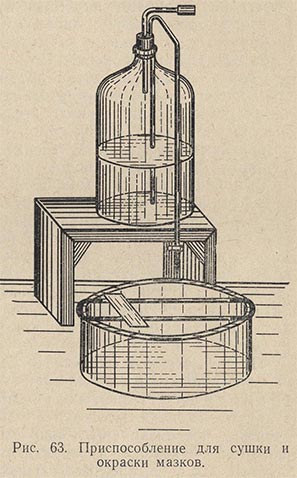
Приготовление мазка. На чистое обезжиренное предметное стекло платиновой петлей наносят материал (рис. 62). Если он жидкий, то каплю, взятую петлей, непосредственно равномерно распределяют по поверхности предметного стекла тонким слоем на площади примерно в 1 см2. Если же изучается агаровая культура, то на предметное стекло предварительно наносят каплю стерильной воды, в которой тонким слоем распределяется исследуемая культура. Получается так называемый мазок. Все манипуляции по приготовлению мазка необходимо выполнять с соблюдением правил асептики (над пламенем горелки стерилизуют петли, концы сосудов с исследуемым материалом, ватные пробки и пр.). Сделав мазок, его сушат при комнатной температуре, поместив на специальный сушильный столик (рис. 63). Хороший мазок после сушки должен давать едва заметный налет. Препарат с густым мазком для наблюдения малопригоден.
Для ускорения высыхания можно осторожно подсушить мазок над пламенем горелки. Предметное стекло в этом случае над пламенем горелки держат так, чтобы мазок был обращен вверх.
Окраска мазков. В лабораторной практике пользуются простыми и сложными методами окраски микробов. Сложные, или дифференциальные, способы окраски, как уже указывалось, применяются для детального изучения структуры клеток. При простой окраске препаратов на фиксированный мазок наливают несколько капель какого-либо красящего раствора (метиленовой сини, разведенного фуксина и пр.). Для получения более чистых препаратов рекомендуется красящий раствор наливать на отрезок фильтровальной бумаги, которой покрывают мазок. Раствор краски в среднем выдерживают на мазке 2-3 мин (в зависимости от вида краски). Фуксин красит интенсивно, причем окрашиваются одинаково хорошо все виды бактерий. Продолжительность окрашивания раствором фуксина вполне достаточна на протяжении 1-2 мин. Щелочную метиленовую синь оставляют для окрашивания мазка на 2-3 мин. Она красит менее сильно, но препарат получается более изящный, к тому же различные бактерии приобретают окраску различной интенсивности. При окраске метиленовой синью у крупных клеток (например, дрожжевых) дифференцируется ядро и цитоплазма. Раствор генцианвиолета держат для окраски 3-5 мин.
По истечении указанного срока краску сливают с предметного стекла. Если на мазок помещалась фильтровальная бумага, ее нужно осторожно снять пинцетом и затем промыть мазок легкой струей дистиллированной воды (можно и водопроводной). Струю воды следует направлять на ребро предметного стекла, а не на мазок. Промытый препарат высушивают на воздухе при комнатной температуре или с помощью полосок фильтровальной бумаги.
На сухой мазок наносят каплю кедрового масла. Не следует кедровое масло наносить на влажный (а тем более на мокрый) мазок. При этом возникает эмульсия воды в кедровом масле и четкость изображения в микроскопе резко снижается.
Сущность сложных методов окраски заключается в том, что препарат окрашивают не одной, а двумя и большим количеством контрастных красок. В микробиологической практике сложный метод окраски микробов по Граму имеет весьма важное значение при дифференциации микробов.
Техника окраски микробов методом Грама состоит в следующем. На фиксированный мазок кладут полоску фильтровальной бумаги и наливают карболовый раствор генцианвиолета на 1-2 мин. Затем краску сливают. Сняв бумажку и не промывая препарат водой, наносят на мазок раствор Люголя также на 1-2 мин (мазок чернеет). По истечении указанного времени раствор Люголя сливают с предметного стекла и погружают стекло в стаканчик со спиртом для обесцвечивания. Предметное стекло слегка покачивают в спирте, выдерживая 30-60 сек. Быстро промывают мазок водой и дополнительно окрашивают разведенным фуксином в течение 1-2 мин. Фуксин сливают, препарат промывают водой, высушивают и микроскопируют.
Выполнить окраску микробов по Граму можно, пользуясь модификацией этого метода, предложенной Синевым. Вместо раствора карболового генцианвиолета используют фильтровальную бумагу, пропитанную этим раствором и высушенную. На фиксированный мазок накладывают полоску такой бумаги, наносят несколько капель стерильной воды, так чтобы бумажка оказалась смоченной, и окрашивают препарат в течение 2 мин. Затем бумажку снимают, на препарат наливают раствор Люголя и далее поступают так же, как указано выше при окраске по Граму.
Приготовление красящих растворов
При бактериологическом исследовании для окраски микробов применяются основные анилиновые краски. Чаще всего употребляются: основной фуксин (красная краска), метиленовая синь (синяя краска), генцианвиолет, кристаллвиолет, метилвиолет (фиолетовые краски). Эти краски продаются в виде аморфных или кристаллических порошков, из которых готовят красящие растворы.
Исходным материалом для приготовления необходимых рабочих красок являются насыщенные спиртовые растворы указанных красителей. Спиртовые растворы готовят впрок и сохраняют в склянках с притертыми пробками. Сами по себе спиртовые растворы для окраски микробов не применяются.
Насыщенный спиртовой раствор красителя получают растворением 1 г его в 10 мл 96%-ного этилового спирта (этанола). Краска обычно полностью не растворяется, и на дне флакона остается небольшой осадок. Полученный спиртовой раствор настаивают 3-5 дней, ежедневно взбалтывая.
Рабочий водно-спиртовой раствор краски получают смешивая 1 мл насыщенного спиртового раствора с 10 мл дистиллированной воды. Для повышения красящей способности в качестве протравы к водно-спиртовым растворам красок добавляют карболовую кислоту.
Рецепты приготовления наиболее употребительных красок.
Карболовый фуксин Циля. 10 мл насыщенного спиртового раствора основного фуксина смешивают со 100 мл 5%-ной карболовой кислоты. Можно приготовить красящий раствор и непосредственно из сухого красителя. Для этого 1 г основного фуксина растирают в ступке с 5 г кристаллической карболовой кислоты. Для лучшего растирания рекомендуется добавить несколько капель глицерина. Затем понемногу приливают 10 мл 96%-ного спирта. К равномерно растертой массе постепенно приливают 100 мл дистиллированной воды, перемешивают и оставляют на 1-2 суток. Затем фильтруют через бумажный фильтр. Фуксин Циля стоек и может сохраняться очень долго. Его употребляют для окраски спор и кислотоустойчивых бактерий, трудно воспринимающих краску.
Фуксин Пфейфера (разведенный фуксин). 1 мл карболового фуксина Циля смешивают с 9 мл дистиллированной воды. Раствор нестоек, поэтому его приготовляют непосредственно перед окраской препаратов. Используют для простой окраски мазков и дополнительной окраски их по методу Грама.
Карболовый генцианвиолет. 10 мл насыщенного спиртового раствора генцианвиолета смешивают со 100 мл 5%-ной карболовой кислоты или 1 г генцианвиолета растирают в ступке с 5 г кристаллической карболовой кислоты, постепенно добавляют 10 мл 96%-ного спирта и 100 мл дистиллированной воды.
Щелочная метиленовая синь (по Лефлеру). К 100 мл дистиллированной воды прибавляют 30 мл насыщенного спиртового раствора краски и 1 мл 1%-ного раствора едкого кали (КОН). Раствор фильтруют. Краска очень прочная, причем красящая способность старой краски выше, чем свежеприготовленной.
Водный раствор метиленовой сини. 1 г метиленовой сини растворяют в 100 мл дистиллированной воды.
Раствор Люголя. 2 г йодистого калия растворяют в 5 мл дистиллированной воды, прибавив 1 г кристаллического йода. Объем доводят водой до 300 мл. Раствор Люголя должен иметь слабощелочную или нейтральную реакцию. При кислой реакции его нейтрализуют (по лакмусу) двууглекислой содой. Раствор следует хранить в склянках из темного стекла, предохраняя от действия света.
Приготовление пропитанной генцианвиолетом фильтровальной бумаги для окраски микробов по Граму в модификации Синева. Раствор карболового генцианвиолета помещают на сутки в термостат при 37 °С, затем фильтруют через бумажный фильтр. Фильтрат выливают в тарелку и погружают в него нарезанную полосками фильтровальную бумагу на 1-2 мин. Пропитанная краской бумага подсушивается, нарезается кусочками (2х4 см) и сохраняется в темных склянках с притертой пробкой. Срок хранения неограниченный.
Примечание. Свежеприготовленные карболовые растворы красок имеют на поверхности пленку с металлическим блеском. Эти растворы стойкие и сохраняются довольно долго. Однако при слишком длительном хранении они могут стать непригодными; в этом случае металлический блеск на поверхности их пропадает, а на дне образуется мелкий порошкообразный осадок.