Как сделать препарат висячая капля
Метод висячей капли
Метод висячей капли в микробиологии часто применяется для изучения препаратов под микроскопом. Такой препарат изготавливают для изучения микроорганизмов в жидкой среде и для изучения жидких микропрепаратов. При помощи этого метода также удобно наблюдать за тем, как прорастают споры. Конечно, в продаже имеется множество готовых микропрепаратов, их удобно использовать не только в школе, но и дома. Однако нет ничего сложного в том, чтобы заняться самостоятельным приготовлением и сделать препарат висячая капля.
Препарат висячая капля
Как уже отмечалось, висячая капля в микробиологии используется для изучения поведения микробов, плесени и так далее. Чтобы сделать препарат, нужно приобрести красители и специальный инструмент. Важно следовать инструкции и выполнять все условия, иначе эксперимент попросту не удастся, а микропрепарат испортится.
Приготовление препарата висячая капля
Алгоритм действий следующий:
Чтобы загерметизировать камеру предварительно смажьте края углубления покровного стеклышка вазелином. После всех проведенных манипуляций можете проводить наблюдения за «подопытными» микроорганизмами.
Приобрести все необходимое оборудование для испытаний можно в интернет-магазине «Четыре глаза».
4glaza.ru
Апрель 2020
Использование материала полностью для общедоступной публикации на носителях информации и любых форматов запрещено. Разрешено упоминание статьи с активной ссылкой на сайт www.4glaza.ru.
Производитель оставляет за собой право вносить любые изменения в стоимость, модельный ряд и технические характеристики или прекращать производство изделия без предварительного уведомления.
Методы приготовления препаратов для микроскопии, микробиология
Методы приготовления препаратов для микроскопии, микробиология
Микроскопия Изучение морфологии и строения клеток микроорганизмов, величина которых измеряется в большинстве случаев микрометрами (1 мкм = = 10 мм =10 м), возможно только с помощью микроскопов, обеспечивающих увеличение исследуемых объектов в сотни (световая микроскопия) и десятки тысяч (электронная микроскопия) раз. Изображение в световом микроскопе формируется вследствие того, что объект и различные элементы его структуры избирательно поглощают свет с различной длиной волны (абсорбционный контраст) или вследствие изменения фазы световой волны при прохождении света через объект (фазовый контраст). Световая микроскопия включает в себя обычную просвечивающую микроскопию (светло- и темнопольную), фазово-контрастную и люминесцентную.
Светлопольная микроскопия. Существуют различные модели учебных и исследовательских световых микроскопов, которые позволяют определить форму клеток микроорганизмов, их размер, подвижность, степень морфологической гетерогенности, а также характерную для микроорганизмов способность к дифференцирующему окрашиванию. Правила пользования микроскопом. Строгое соблюдение правил пользования микроскопом является непременным условием для каждого работающего с ним.
При работе необходимо соблюдать следующую последовательность:
При смене объектива, дающего малое увеличение, на объектив большего увеличения требуется соблюдение следующих правил:
| 1 | Прежде чем сменить объектив, рассматриваемый объект (или его участок) ставят в центре поля зрения микроскопа при малом увеличении. Диаметр линзы уменьшается по мере возрастания степени увеличения, вследствие чего объект, если он лежит не в центре, при смене объектива может оказаться за пределами поля зрения. | Before changing the lens, the object in question (or its section) is placed in the center of the field of view of the microscope at low magnification. The diameter of the lens decreases as the magnification increases, as a result of which the object, if it is not in the center, may be out of sight when the lens is changed. |
| 2 | Слегка приподнимают тубус и затем переводят объектив с помо щью револьвера. Это необходимо потому, что объектив большего увели чения всегда бывает длиннее. | Slightly raise the tube and then transfer the lens with a revolver. This is necessary because the lens of higher magnification is always longer. |
| 3 | Для того чтобы в поисках фокусного расстояния не раздавить пре парат или, что еще хуже, не повредить линзу объектива, тубус с подведеннымпод него объективом, глядя для контроля сбоку микроскопа, опускают до самой поверхности препарата и затем, смотря в окуляр, очень медленно (чтобы не пропустить появления очертаний предмета) поднимают. | In order not to crush the preparation or, even worse, to damage the objective lens, while searching for the focal length, the tube with the objective underneath it, looking to control the side of the microscope, is lowered to the surface of the preparation and then, looking into the eyepiece, very slowly (so as not to miss the appearance of the outlines of the subject) raise. |
Рассматривают препарат в микроскоп левым глазом. Правый глаз при этом должен оставаться открытым. Левую руку держат на микрометрическом винте и слегка вращают его (влево и вправо).
Этим достигается возможность рассмотрения поверхностных и более глубоких участков объекта. Правой (свободной) рукой делают зарисовку того, что видно в поле зрения.
Правила работы с иммерсионным объективом. Сухой окрашенный препарат (приготовление см. ниже) помещают на столик микроскопа и, пользуясь объективом 8х, устанавливают свет.
Затем в центр препарата на мазок наносят каплю иммерсионного масла и заменяют сухую систему иммерсионной. С помощью макрометрического винта опускают тубус микроскопа до погружения объектива в масло. Эту операцию нужно проводить очень осторожно, следя сбоку за тем, чтобы фронтальная линза не коснулась предметного стекла и не получила повреждения. После погружения объектива в масло осторожно, также пользуясь макровинтом, поднимают тубус и, наблюдая в окуляр, находят плоскость препарата. Точная фокусировка достигается с помощью микрометрического винта. По окончании микроскопирования поднимают тубус, снимают препарат и осторожно протирают фронтальную линзу объектива сначала сухой хлопчатобумажной салфеткой, а затем той же салфеткой, но слегка смоченной ксилолом. Оставлять масло на поверхности линзы ни в коем случае нельзя, так как оно способствует фиксированию пыли и может со временем привести к повреждению оптики микроскопа. Изучение микроорганизмов в световом микроскопе.
Выбор методов микроскопического анализа и способов окраски определяется конкретной целью исследования.
Покровные стекла, применяемые для приготовления препаратов микроорганизмов, также должны быть тщательно вымыты и высушены. Толщина покровных стекол не должна превышать 0,15-0,17 мм. Более толстые покровные стекла резко ухудшают качество получаемого изображения. Препараты живых клеток микроорганизмов
2. «Висячая капля». Каплю суспензии микроорганизмов петлей наносят на покровное стекло, которое поворачивают каплей вниз и помещают на специальное предметное стекло с углублением (лункой) в центре. Капля должна висеть свободно, не касаясь краев и дна лунки. Края лунки предварительно смазывают вазелином. Капля оказывается герметизированной во влажной камере, что делает возможным многодневное наблюдение за объектом. Для длительных наблюдений используют стерильные стекла, а суспензию микроорганизмов готовят на жидкой питательной среде. Препараты фиксированных окрашенных клеток микроорганизмов
Приготовление фиксированных окрашенных препаратов включает следующие этапы: приготовление мазка, высушивание, фиксацию и окраску.
4. Окраска. Клетки микроорганизмов окрашивают главным образом анилиновыми красителями. Различают простые и дифференциальные спо собы окрашивания микроорганизмов. При простой окраске прокрашивается вся клетка, так что становятся хорошо видны ее форма и размеры. Дифференциальная окраска предполагает окрашивание не всей клетки, а опре деленных ее структур. С помощью дифференциальной окраски выявляют некоторые клеточные структуры и запасные вещества. Для простого окрашивания клеток микроорганизмов чаще всего пользуются фуксином, генциановым фиолетовым, метиленовым синим. Для получения более чистых препаратов краситель наливают на мазок, покрытый фильтровальной бумагой.
Метод окрашивания в модификации
Синева позволяет использовать вместо растворов красителей фильтровальную бумагу, заранее пропитанную красителем. В правильно окрашенном и хорошо промытом препарате поле зрения светлое и чистое, окрашены только клетки микроорганизмов. Фиксированные, окрашенные препараты могут храниться длительное время. Необходимо помнить, что возраст культуры, состав среды и условия культивирования существенно влияют на морфологию и цитологию микроорганизмов.
Метод раздавленной капли
Метод раздавленной капли можно использовать не только в лабораторных, но и в домашних условиях. Это исследование непременно понравится и взрослым, и детям. Важное условие – под рукой должно быть все самое необходимое. А именно: микроскоп и предметные и покровные стекла. Купить их можно в интернет-магазине «Четыре глаза».
Суть метода заключается в исследовании живых объектов, включая клетки тканей, различных культур, бактерии и так далее. Препарат «Раздавленная капля» давно и успешно применяется в микробиологии. Сам образец можно купить в готовом виде, но куда более интересно приготовить его самостоятельно.
Приготовление препарата «Раздавленная капля»
Раздавленная капля в микробиологии дает возможность изучить жизнь и размножение многих микроорганизмов. Чтобы провести эксперимент, достаточно иметь немного воды из любого природного водоема. Заранее подготовьте также предметное и покровное стекла, а также стерильную пипетку и любое средство для обезжиривания поверхности. Дальше рекомендуется следовать простой инструкции:
Капля будет находиться в специальной герметичной камере, поэтому храниться может на протяжении длительного времени.
Воду стоит наносить пипеткой или специальной петлей. Важно проследить, чтобы в образце не появилось лишнего воздуха. Чтобы предотвратить высыхание, препарат хранят во влажной камере.
4glaza.ru
Апрель 2020
Использование материала полностью для общедоступной публикации на носителях информации и любых форматов запрещено. Разрешено упоминание статьи с активной ссылкой на сайт www.4glaza.ru.
Производитель оставляет за собой право вносить любые изменения в стоимость, модельный ряд и технические характеристики или прекращать производство изделия без предварительного уведомления.
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
3. МИКРОСКОП И ТЕХНИКА МИКРОСКОПИРОВАНИЯ
Микроскопы, дающие увеличение в сотни (световой) или тысячи (электронный) раз, используют для изучения морфологии и строения микроорганизмов. Производственные микробиологические лаборатории снабжены световыми микроскопами различных типов отечественного и импортного производства. Преимущество за бинокулярными микроскопами с автономной подсветкой и полным набором основных и дополнительных оптических систем.
3.1. СВЕТОВОЙ МИКРОСКОП
Микроскоп состоит из механической и оптической частей (см. рис. 2)
К механической части микроскопа относят штатив, который состоит из подставки (башмак) 9, придающей прибору устойчивость, и тубусодержателя.
К тубусодержателю 12 прикреплены:
Тубус 14, имеющий у различных моделей современных микроскопов конструктивные отличия.
В нижней части тубуса находится револьверный механизм 18 – вращающийся диск с гнездами для объективов, состоящий из двух пластин. Верхняя из них закреплена наглухо, а нижняя с отверстиями и резьбой для объективов свободно передвигается, причем центрировка ввинченного в отверстие объектива фиксируется защелкивающейся пружинкой, попадающей в соответствующую прорезь.
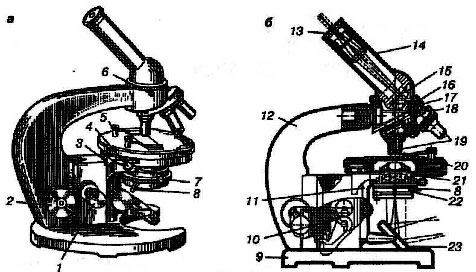
Рис.2
Общий вид (а) и схема (б) микроскопа:
1 – микрометрический винт; 2 – макрометрический винт; 3 – стопорный винт; 4 – центрировочный винт для установки препарата; 5 – пружинные клеммы; 6 – винт для укрепления тубуса; 7 – стопорный винт конденсора; 8 – рукоятка перемещения диафрагмы; 9 – башмак микроскопа; 10 – коробка с микромеханизмом; 11 – кронштейн конденсора; 12 – тубусодержатель; 13 – окуляр;
14 – наклонный тубус; 15 – призма; 16 – головка тубусодержателя; 17 – винт для фиксации револьвера; 18 – револьвер на салазках; 19 – объективы; 20 – предметный столик; 21 – конденсор; 22 – апертурная диафрагма; 23 – зеркало.
Предметный столик 20, круглый или прямоугольный с отверстием в центре для прохождения света. Столик можно передвигать при помощи винтов 4 в двух взаимно перпендикулярных направлениях. Для закрепления препарата на столике имеются специальные зажимы 5 разной конструкции.
Механизм для передвижения тубуса вверх-вниз состоит из двух основных узлов – макро- 2 и микрометрического 1 винтов.
Макрометрический винт (кремальера) служит для быстрого поднятия и опускания тубуса при грубой настройке. Один оборот зубчатого колеса позволяет перемещать тубус на 20 мм вверх или вниз.
Микрометрический винт предназначен для передвижения тубуса при тонкой настройке и просматривания препарата в глубину. Полный оборот ведущего колесика продвигает тубус на 0,1 мм. Барабан винта разделен на 50 делений, каждое деление равно 0,002 мм.
Оптическая часть микроскопа состоит из осветительного устройства, окуляров и объективов.
Осветительное устройство состоит из конденсора, ирис-диафрагмы и осветителя (или плосковогнутого зеркала).
Конденсор 21 применяют для концентрирования отраженных зеркалом лучей света, фокус которых должен находиться в плоскости препарата. Он состоит из двух линз, заключенных вместе с ирис-диафрагмой в общую цилиндрическую оправу. Верхняя линза в конденсоре плосковыпуклая, нижняя – двояковыпуклая. Весь конденсор можно передвигать вверх и вниз при помощи особого винта. При поднятии и опускании конденсора меняется угол сходимости лучей, в результате меняется и интенсивность освещения: при поднятом конденсоре – освещение ярче, при опущенном – слабее.
Под конденсором помещена апертурная (ирисовая) диафрагма 22. Ирис-диафрагма состоит из нескольких подвижных сегментов, сдвигаемых и раздвигаемых при помощи рычажка 8. Диафрагма установлена перед нижней линзой конденсора и позволяет также регулировать освещение. Изменяя диаметр отверстия, через которое проходит пучок света, регулируют интенсивность освещения поля зрения.
Если апертура конденсора меньше апертуры рабочего объектива, то из-за слабого потока света возможности линзы объектива задействованы не полностью. Если апертура конденсора больше апертуры рабочего объектива, что характерно для объективов малого увеличения, то уменьшают диаметр отверстия ирисовой диафрагмы конденсора.
Зеркало 23 подвижно закреплено под конденсором на особом рычажке, при помощи которого оно может быть установлено в любой плоскости. Одна его поверхность плоская, другая – вогнутая. При работе с конденсором используют плоскую, без конденсора – вогнутую поверхность зеркала. При дневном свете пользуются плоской стороной зеркала, при искусственном свете – вогнутой.
При микроскопировании существенное значение имеет освещение исследуемого объекта. Освещение чаще устанавливают по методу Келлера.
При работе со встроенными стационарными осветителями правила настройки подробно изложены в инструкциях по эксплуатации микроскопов.
Окуляр 13 вставляют в верхнюю часть тубуса. Увеличенное объективом изображение дополнительно увеличивается окуляром, но новых деталей структуры при этом не наблюдается. Обычно окуляр состоит из двух плосковыпуклых линз – глазной и собирательной, – обращенных своими выпуклыми поверхностями вниз к объективу. Линзы заключены в общую металлическую трубку, между линзами находится диафрагма поля зрения микроскопа. У современных биологических микроскопов имеются окуляры с увеличениями в 7, 8, 10 и 15 раз. Размер увеличения указан на верхней оправе.
Объектив – основная часть оптической системы микроскопа, дающая увеличенное изображение предмета. Объектив состоит из нескольких линз, помещенных в металлическую трубку и закрепленных канадским бальзамом. На верхней части трубки имеется резьба, при помощи которой объектив ввинчивается в гнездо револьверной пластинки. Самая нижняя плосковыпуклая линза объектива, обращенная к предмету, называется фронтальной; именно она позволяет получать увеличение, а остальные линзы только устраняют оптические недостатки изображения (сферическую и хроматическую аберрацию); чем больше кривизна фронтальной линзы и меньше ее размеры, тем большее увеличение предмета дает объектив. Изображение предмета обратное.
Современные биологические микроскопы обычно снабжены объективами с увеличением в 8, 10, 20, 40, 60 и 90 раз. Эти цифры указаны на объективе. При работе с объективами, увеличивающими в 60, 90 и более раз, фронтальная линза погружается в жидкость.
Важно получить не только увеличенное, но и четкое изображение исследуемого объекта.
Четкость изображения зависит от разрешающей способности микроскопа, которую понимают как минимальное расстояние между двумя точками, при котором они видны раздельно. Разрешающая способность микроскопа зависит от числовой апертуры и длины волны используемого света.
Повысить разрешающую способность микроскопа можно за счет применения более коротких лучей света или, что более доступно, за счет приближения показателя преломления среды, граничащей с линзой, к аналогичному показателю стекла. С этой целью прослойку воздуха между линзой объектива и предметным стеклом замещают специальной жидкостью с показателем преломления, близким к показателю преломления стекла. Особенно это необходимо при использовании объективов большого увеличения (60×, 90×) с фронтальными линзами малой площади.
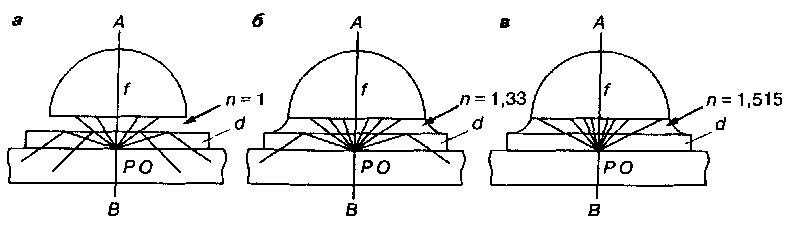
Рис. 3
Ход лучей в сухом (а), водно- (б) и масляно-иммерсионном (в) объективе:
п – показатель преломления; РО – препарат; f – фронтальная линза объектива; d – покровное стекло.
Показатель преломления стекла и воздуха составляет соответственно 1,52 и 1,0, поэтому в качестве иммерсионных жидкостей, создающих оптически однородную среду между предметным стеклом и линзой объектива, чаще всего применяют кедровое масло
(п = 1,5), глицерин (п = 1,4), воду (n = 1,3). Ход лучей света при использовании обычного сухого и иммерсионного объективов показан на рисунке 3.
Объективы для масляной иммерсии обозначают « МИ», водной – «ВИ».
Общее увеличение, даваемое системой объектива и окуляра, равно произведению увеличений окуляра и объектива. Например, при окуляре 15× и объективе 40× увеличение будет: 15 × 40 = 600 раз.
При работе с сильными объективами толщина покровного стекла не должна превышать 0,15– 0,18 мм ввиду малого рабочего расстояния.
Под рабочим расстоянием объектива понимают расстояние от плоскости фронтальной линзы до изучаемого объекта при нахождении последнего в фокусе. Чем больше увеличение объектива, тем меньше рабочее расстояние и поле зрения.
На корпусе объектива обозначена его увеличивающая способность (8×, 20×, 40×, 90×) и числовая апертура.
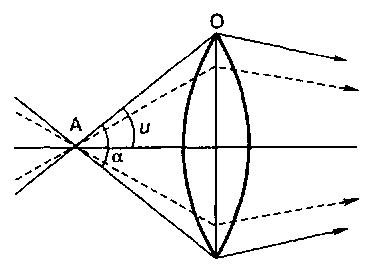
Числовая апертура А отражает количество света (рис. 4), попадающего в линзу.
Величина ее определяется по формуле
где А – числовая апертура линзы; п – показатель преломления среды, граничащей с линзой; и – половина отверстного угла a.
Рис.4
Схема хода лучей при разном значении угла a:
А – объект; О – объектив; и – половина отверстного угла.
Микроскопы необходимо хранить под чехлами или колпаками для защиты от пыли. Удобно пользоваться чехлами из полиэтилена; не следует оставлять микроскоп под солнечными лучами или в теплом месте, так как может размягчиться клей, которым склеены линзы.
В комнате, где установлен микроскоп, не должно быть паров кислот и водяных паров. При переносе микроскоп следует брать только за тубусодержатель и следить за тем, чтобы окуляр не выпал из тубуса.
Для наружной очистки оптики применяют смоченные спиртом мягкие ткани, лучше фланель, не оставляющие после себя волокон. Использование ксилола и бензина для этих целей может привести к расклеиванию линз.
3.1.1. ДОПОЛНИТЕЛЬНЫЕ ОПТИЧЕСКИЕ СИСТЕМЫ
Фазово-контрастное устройство. Устройство включает в себя: а) фазовую пластинку – расположенный в задней фокальной плоскости объектива прозрачный диск, на поверхность которого напылено кольцо из металлов (фазовое кольцо); б) кольцевую диафрагму – помещенную под конденсором светонепроницаемую пластину с прозрачным кольцевидным участком.
Световая волна при прохождении через живую клетку отстает по фазе приблизительно на 1/4 длины волны и дополнительно сдвигается еще на 1/4 после прохождения через фазовую пластинку. Ход лучей в фазово-контрастном устройстве показан на рисунке 5. Сдвинутые по фазе после прохождения через фазовую пластинку лучи либо совпадают и складываются с прямыми лучами, идущими мимо объекта, либо оказываются в противофазе. В первом случае исследуемый объект виден как светлый на темном фоне, а во втором – как темный на светлом фоне.
Рис.5
Схема хода лучей при использовании фазово-контрастного устройства:
1 – кольцевая диафрагма; 2 – конденсор; 3 – объект; 4 – объектив; 5 – фазовая пластинка.
Рис.6
Фазово-контрастное устройство КФ-4:
1 – конденсор; 2 – револьверный диск с набором кольцевых диафрагм; 3 – центрировочные винты; 4 – вспомогательный окуляр; 5 – набор фазовых объективов.
В микробиологии широко применяют фазово-контрастное устройство КФ-4 (рис. 6) (объект виден темным на светлом фоне). Последовательность перехода к работе с фазово-контрастным устройством следующая.
При работе с другими объективами устанавливают соответствующие диафрагмы.
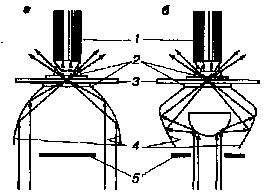
Темнопольный конденсор. При темнопольной микроскопии используют специальный конденсор с затемненной центральной частью, поэтому в плоскость объекта идут только боковые лучи, отраженные от внутренних зеркальных поверхностей конденсора. Лучи направлены под таким углом, что не попадают в линзу объектива, и поэтому поле зрения выглядит темным (рис. 7). Та часть лучей, которая попадает на объект, отражается в линзу объектива, что позволяет видеть светлое изображение объекта на темном фоне.
Рис.7
Ход лучей в темнопольных конденсорах:
а – параболоид-конденсор; б – кардиод-конденсор;
1 – объектив; 2 – иммерсионное масло; 3 – препарат;
4 – зеркальная поверхность; 5 – диафрагма.
Чтобы перейти к методу темнопольной микроскопии, поступают следующим образом.
Приступая к работе с микроскопом, проверяют состояние конденсора: он должен быть поднят до уровня предметного столика, диафрагма открыта. Приподняв тубус микроскопа, устанавливают объектив с наименьшим увеличением (8×, 10×); глядя в окуляр, при помощи зеркала добиваются полного освещения поля зрения. Затем на исследуемый препарат наносят каплю кедрового масла (или его заменителя), помещают препарат на предметный столик, поворотом револьвера устанавливают иммерсионный объектив. (Чтобы избежать соприкосновения объектива со столиком, тубус следует держать приподнятым.) Под контролем глаза (смотреть сбоку) фронтальную линзу объектива легким поворотом макрометрического винта погружают в каплю иммерсионного масла и, наблюдая в окуляр, осторожно поднимают тубус до видимости препарата. Затем легкими поворотами микрометрического винта (вперед-назад) регулируют четкость изображения.
При смене препарата тубус микроскопа поднимают, препарат снимают с предметного столика и, если исследование проводилось с иммерсионной системой, фронтальную линзу объектива тщательно очищают от масла, протерев салфеткой, смоченной спиртом.
В конце работы тубус приподнимают макровинтом, револьвер переводят в нейтральное положение, масло с линзы осторожно снимают мягкой хлопчатобумажной тканью. Микроскоп убирают в деревянный футляр или накрывают стеклянным колпаком (лучше из цветного стекла) для защиты от света.
Микроскопированием определяют морфологические особенности микроорганизмов, их тинкториальные свойства, подвижность, наличие специальных структурных элементов (спора, капсула).
Приготовленные препараты «раздавленная капля» и «висячая капля» просматривают с объективами 20× или 40×.
Фиксированные окрашенные препараты микроскопируют вначале с объективом 40×, потом – с объективом 90×. В правильно окрашенном и хорошо промытом препарате поле зрения остается светлым и чистым, а окрашенными оказываются клетки микроорганизмов.
Чтобы исследовать под микроскопом живые нефиксированные неокрашенные микроорганизмы, используют особые оптические системы: фазово-контрастное устройство и темнопольный конденсор.
3.3. МЕТОДЫ ИССЛЕДОВАНИЯ МИКРООРГАНИЗМОВ В СВЕТЛОПОЛЬНОМ МИКРОСКОПЕ
Микроскопическое исследование микроорганизмов проводят в живых или фиксированных окрашенных препаратах.
3.3.1. ПРИГОТОВЛЕНИЕ ПРЕПАРАТОВ
Приготовление живых препаратов. Микроскопия клеток в живом состоянии применяется главным образом для изучения их размеров, формы, структуры, подвижности, характера размножения, отношения клеток к различным химическим раздражителям. С этой целью наиболее часто готовят препараты «раздавленная капля» и «висячая капля». Микроорганизмы в этих препаратах можно подвергать прижизненной окраске. Так как большинство используемых в микробиологии красителей токсичны, для прижизненного окрашивания микроорганизмов их используют в очень малых концентрациях от 0,001 до 0,0001%. В препарате «висячая капля» микроорганизмы можно наблюдать в течение продолжительного времени – неделю и более.
«Раздавленная капля». Готовят предметные и покровные стекла для микроскопии. Они должны быть чистыми и хорошо обезжиренными, чтобы нанесенная на них капля равномерно растекалась. Достигается это несколькими способами. Стекла можно прокипятить 15 мин в 1%-ном растворе соды или в мыльной воде, сполоснуть водопроводной водой, поместить на 5–10 мин в слабую хлористоводородную кислоту и хорошо промыть дистиллированной водой. Можно также готовить стекла к работе, выдержав их предварительно 2 ч в концентрированной серной кислоте или хромовой смеси. После этого промыть их в проточной воде, прокипятить в 2%-ном растворе щелочи в течение 10 мин, тщательно промыть проточной, а затем дистиллированной водой. Обезжиренные предметные стекла можно приготовить, используя для этой цели кусочек мыла, которым необходимо натереть рабочую поверхность стекла, а затем тщательно вытереть ее сухой салфеткой. Чистые стекла поместить на хранение в сосуды с притертыми пробками в смеси равных объемов спирта и эфира или в 96%-ный спирт.
Затем для приготовления препарата на чистое и обезжиренное предметное стекло бактериологической петлей или пастеровской пипеткой наносят каплю исследуемой культуры. Если микроорганизмы находились в суспензии (в жидкой питательной среде), их наносят непосредственно на предметное стекло. Если же материал взят с плотной питательной среды, тогда его вносят в нанесенную предварительно на предметное стекло каплю стерильной водопроводной воды, стерильного физиологического раствора или какой-либо жидкой питательной среды. Можно также из культуры, выращенной на плотной питательной среде, предварительно приготовить суспензию микроорганизмов. Для этого в пробирку с микроорганизмами, выросшими на агаровой поверхности, вносят 4–5 см 3 стерильного физиологического раствора или водопроводной воды и, вращая пробирку между ладонями, смывают микробные клетки с поверхности среды. Кроме того, можно в пробирку с 4–5 см 3 стерильной воды бактериологической петлей перенести 1–2 колонии исследуемых микроорганизмов, выросших на агаре в чашке Петри.
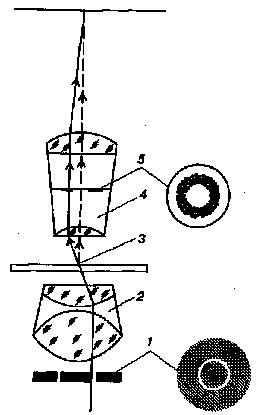
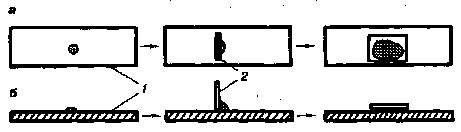
На предметное стекло на край капли опустить ребром под углом 45° покровное стекло и, осторожно наклоняя, накрыть им каплю так, чтобы в ней не образовались пузырьки воздуха (рис. 8).
Каплю нужно брать такой величины, чтобы она заполняла все пространство между покровным и предметным стеклами и не выступала за края покровного стекла. Если жидкость будет нанесена в избытке, ее необходимо удалить при помощи полосок фильтровальной бумаги.
Рис. 8
Схема приготовления препарата «раздавленная капля»:
а – вид сверху; б – вид сбоку; / – предметное стекло; 2 – покровное стекло.
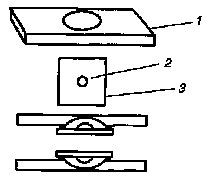
«Висячая капля». Для приготовления препарата «висячая капля» взять стекло со шлифованной лункой. Края лунки смазать вазелиновым маслом. На покровное стекло стерильно в центр нанести каплю исследуемого материала (см. рис. 9). Затем предметное стекло перевернуть лункой вниз и поместить на покровное стекло так, чтобы капля находилась в центре лунки, не соприкасаясь с ее краями. Предметное стекло легонько прижать к покровному и перевернуть. В образовавшейся герметичной камере капля не высыхает, что позволяет наблюдать за микроорганизмами продолжительное время.
Рис.9
Схема приготовления препарата
«висячая капля»:
Приготовление фиксированных препаратов. Фиксированный окрашенный препарат микроорганизмов готовят в несколько этапов: приготовление мазка, высушивание его, фиксация и окрашивание.
Мазки готовят на чистых обезжиренных предметных стеклах из микробных суспензий или из культур, выращенных на плотных питательных средах. Если необходимо изучить естественное расположение микроорганизмов в колониях, выращенных на поверхности плотной питательной среды или естественного субстрата, то готовят препарат-отпечаток.
Высушивают мазки или препараты-отпечатки при комнатной температуре, так как высушивание при высокой температуре нарушает форму клеток.
На следующем этапе мазок фиксируют. При этом клетки прочно прикрепляются к поверхности стекла, повышается их сродство к красителям и, наконец, клетки гибнут. Самый простой и распространенный способ фиксации – фиксация жаром, пригоден для наблюдения морфологии клеток, но не для изучения их строения, так как при воздействии высоких температур структура клеток существенно изменяется. Помимо жара, фиксацию можно проводить химическими веществами (жидкостями и парами). Для этого используют 96%-ный этиловый спирт (время фиксации 5–10 мин), смесь Никифорова, состоящую из абсолютного этилового спирта и эфира в соотношении 1:1 (10–15 мин), безводный метиловый спирт (3–5 мин), ацетон (5 мин), пары параформальдегида и др. Для дрожжей приоритетными являются химические методы фиксации.
Для химической фиксации микроорганизмов чаще всего используют следующие химические растворы:
Ледяная уксусная кислота. 10 см 3
Этиловый спирт, 96°. 60 см 3
Хранить жидкость следует в бутылках с притертой пробкой. Она может храниться длительное время, но лучше пользоваться свежеприготовленным раствором. Жидкость Карнуа является хорошим фиксатором для изучения строения бактерий. Экспозиция фиксации 15 мин.
Этиловый спирт, 96°. 1 часть
Для фиксации препарат погружают в стакан с жидкостью на 15-20 мин, после чего вынимают и дают возможность подсохнуть.
Этиловый спирт, 96°. 95 см 3
Для фиксации препарат погружают в стакан с жидкостью на 15 мин, после чего вынимают и дают возможность подсохнуть.
После фиксации препарат окрашивают. Большинство красок, применяемых в микробиологической практике, представляют собой соединения, чаще всего производные бензола и его гомологов, которые получают либо путем химического синтеза, либо из каменноугольной смолы. Они могут быть основными, кислыми и нейтральными. В лабораторных условиях можно быстро определить, какой характер (кислый или основной) имеет водный раствор того или иного красителя. Для этого на фильтровальную бумагу наносят каплю исследуемой краски. Так как фильтровальная бумага заряжена отрицательно, то при основных свойствах краски вода растекается в виде бесцветной зоны вокруг фиксированного пятна краски, при кислых – краска и вода растекаются одинаково. Основные краски соединяются с веществами клетки, имеющими кислые свойства, а кислые – с веществами с основными свойствами. В практике микробиологических исследований чаще используются основные краски. Это объясняется тем, что большинство микроорганизмов несут на поверхности клетки отрицательный электрический заряд и в их цитоплазме преобладают вещества с кислыми свойствами. Исходя из сродства клеточных веществ к основным, кислым или нейтральным краскам, введены соответственно понятия «базофилия», «ацидофилия» и «нейтрофилия». Такое деление, однако, является относительным, так как большинство клеточных веществ являются амфотерными соединениями и в зависимости от значения рН среды могут приобретать кислые, нейтральные или основные свойства.
В микробиологической практике наиболее употребительными красками являются:
Использование разных красок, их концентрация и продолжительность воздействия на клетки обусловливаются особенностями выявляемых структур и свойствами красителей.
Процедура приготовления фиксированного окрашенного препарата. С помощью стерильной бактериологической петли или пипетки Пастера нанести на тщательно обезжиренное предметное стекло каплю суспензии микроорганизмов. Материал с плотных питательных сред взять бактериологической петлей и внести его в каплю стерильной водопроводной воды, предварительно нанесенную на предметное стекло. Микробный материал равномерно тонким слоем растереть на площади 1,5–2 см 2 и высушить приготовленный мазок при комнатной температуре.
После высушивания мазок зафиксировать в пламени горелки. Держа стекло мазком вверх, трижды провести его через пламя горелки. Во избежание перегрева микроорганизмов время прямого воздействия пламени не должно превышать 3–4 с. Для лучшего сохранения морфологических параметров клетки целесообразно использовать химические методы фиксации.
Препарат поместить мазком вверх на мостик из двух параллельных стеклянных палочек, соединенных резиновыми трубками и находящихся на стенках кюветы или кристаллизатора.
Подготовленный таким образом препарат окрасить по методике, соответствующей поставленной задаче. Высушить его на воздухе или легко промокнуть фильтровальной бумагой. Края стекла и тыльную сторону тщательно протереть салфеткой или фильтровальной бумагой. Таким образом препарат готов к микроскопированию.
3.3.2. ОПРЕДЕЛЕНИЕ РАЗМЕРОВ КЛЕТОК МИКРООРГАНИЗМОВ
Клетки микроорганизмов измеряют под микроскопом с помощью окулярной линейки-микрометра или окулярного винтового микрометра. Для измерения лучше использовать живые, а не фиксированные клетки, так как фиксация и окраска приводят к некоторому изменению истинных размеров клеток. Размеры клетки удобно определять с помощью фазово-контрастного устройства. Если клетки подвижны, препарат слегка подогревают или к капле исследуемой суспензии добавляют каплю 0,1%-ного водного раствора агара. Размеры клеток выражают в микрометрах.
Объективный микрометр (объект-микрометр) – это металлическая пластинка с отверстием в центре. В отверстие вставлено стекло, на которое нанесена линейка длиной 1 мм (рис. 10).
Рис. 10
Объективный микрометр
(вид под микроскопом)
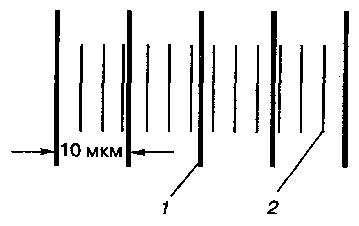
Она разделена на 100 частей, т. е. деление объективного микрометра соответствует 0,01 мм, или 10 мкм. Для определения цены деления окулярного микрометра объективный микрометр помещают на столик микроскопа и фокусируют при малом увеличении. Изображение линейки перемещают в центр поля зрения и только после этого меняют объектив на тот, при котором будут определяться размеры клеток. Перемещая столик микроскопа и поворачивая окуляр устанавливают микрометры так, чтобы их шкалы были параллельны, и одна перекрывала другую. Цену деления окулярного микрометра определяют по принципу нониуса, т. е. совмещают одно из делений шкалы окулярного и объективного микрометров и находят следующее их совмещение (рис. 11). Устанавливают, скольким делениям объективного микрометра соответствует одно деление окулярного микрометра.
Пример. Два деления объект-микрометра (20 мкм) соответствуют пяти делениям окуляр-микрометра. Следовательно, одно деление окуляр-микрометра равно 4 мкм (20:5).
Если теперь на столик микроскопа поместить препарат с клетками микроорганизмов и рассматривать его при том же увеличении, то можно измерить величину клетки. Для этого определяют, какому числу делений окулярной линейки соответствует величина измеряемого объекта, и умножают это число на цену деления окулярного микрометра.
Рис. 11
Совмещение измерительных линеек в микроскопе
(принцип нониуса):
Окулярный микрометр (окуляр-микрометр) представляет собой круглую стеклянную пластинку (рис. 12), в центре которой выгравирована линейка длиной 5 мм. Линейка разделена на 50 частей. Окулярный микрометр вставляют в окуляр. Для этого вывинчивают глазную линзу окуляра, помещают на его диафрагму окулярный микрометр делениями вниз и завинчивают линзу.
Рис. 12
Окулярный микрометр
(в окуляре микроскопа)
Однако только с помощью окуляр-микрометра нельзя непосредственно измерить величину клетки, так как последние рассматриваются через объектив и окуляр, а деления линейки – только через верхнюю линзу окуляра. Поэтому, прежде чем приступить к измерению величины клеток, необходимо определить цену деления окулярного микрометра для данного увеличения микроскопа. Это делают с помощью объективного микрометра.
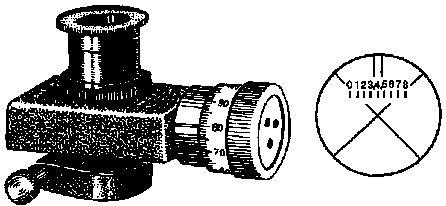
Винтовой окулярный микрометр (рис. 13) закрепляют на тубусе микроскопа, предварительно вынув окуляр. В окуляре винтового микрометра имеется неподвижная шкала с ценой деления 1 мм для определения размеров крупных объектов и подвижная стеклянная пластинка с перекрестием. Пластинка связана с микрометрическим винтом-барабаном и перемещается вместе с перекрестием при его вращении. Для измерения длины клетки вращением микрометрического винта-барабана окулярного микрометра подводят перекрестие к концу клетки и отмечают деление на барабане. Затем, вращая барабан, перемещают перекрестие до другого конца клетки и вновь отмечают деление на барабане. Определяют, скольким делениям микрометрического винта-барабана соответствует длина клетки, и умножают полученное значение на цену деления барабана при данном увеличении микроскопа.
Рис. 13
Винтовой окулярный микрометр
Пример. Одно деление объективного микрометра, т. е. 10 мкм, соответствует X делениям микрометрического винта-барабана; следовательно, одно деление его при данном увеличении микроскопа равно 10:Х (мкм).
Цену деления барабана для каждого объектива определяют с помощью объект-микрометра. С этой целью подводят перекрестие к началу одного деления объективного микрометра и отмечают деление на барабане. Затем, вращая барабан, перемещают перекрестие до конца деления объективного микрометра и вновь отмечают деление на барабане. Определяют, скольким делениям микрометрического винта-барабана соответствует одно деление объективного микрометра.
Для получения достоверных результатов необходимо измерить не менее 20–30 клеток. При определении размеров клеток округлых форм измеряют их диаметр, у клеток других форм – длину и ширину; указывают средние размеры клеток и пределы колебаний, т. е. минимальные и максимальные размеры.