Как сделать укол филграстим видео
Как сделать укол филграстим видео
Результаты контролируемых исследований по профилактике нейтропении свидетельствуют об эффективности дозы 5 мкг/кг Г-КСФ (филграстим и ленограстим), вводимой подкожно 1 раз в сутки. Для ленограстима (граноцит) производители рекомендуют рассчитывать суточную дозу исходя из площади поверхности тела (150 мкг/м 2 раз в сутки).
Миелоцитокины после химиотерапии могут быть эффективны и в более низкой дозе, поэтому считается приемлемым округлять дозу до ближайшей величины содержимого флакона во избежание потери препарата. Филграстим (нейпоген) в стандартном флаконе вместимостью 300 мкг (30 MU) может быть использован у больных с массой тела 50—80 кг. При большей массе тела используют флакон вместимостью 480 мкг (48 MU).
Применение Г-КСФ (филграстима, ленограстима) в дозе 5 мкг/кг в сутки и более у больных острым лимфобластным лейкозом после высокодозной химиотерапии с последующей аутологичной трансплантацией костного мозга значимо укорачивает нейтропению.
Оптимальные доза и схема введения Г-КСФ (филграстима, ленограстима) для мобилизации клеток-предшественниц гемопоэза до настоящего времени не определена. В контролируемых исследованиях доза 10 мкг/кг в сутки в течение 6 дней для филграстима и ленограстима у больных с опухолевыми заболеваниями оказалась высокоэффективной. В некоторых исследованиях выявлено лучшее действие при введении препарата 2 раза в день подкожно.
В одном сравнительном контролируемом исследовании ленограстим, вводимый здоровым донорам в дозе 10 мкг/кг в течение 5 дней, вызывал больший рост содержания клеток-предшественниц гемопоэза в крови, чем филграстим. В аналогичном исследовании общее число клеток-предшественниц гемопоэза в крови в группах получавших филграстим и ленограстим не различалось.
Для лечения миелодиспластического синдрома с успехом использовали дозы Г-КСФ (филграстима, ленограстима) от 0,3 до 10 мкг/кг в сутки, приводившие к адекватному увеличению числа нейтрофилов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Самостоятельное введение Filgrastim (Neupogen®) или Pegfilgrastim (Neulasta®) предварительно заполненным шприцем
Эта информация позволит вам узнать о том, как самостоятельно сделать подкожную инъекцию filgrastim (Neupogen) или pegfilgrastim (Neulasta) предварительно заполненным шприцем. Медсестра/медбрат разъяснят вам эту информацию.
Информация о лекарстве
Название лекарства: ______________________________
Время введения лекарства: ______________________________
Как хранить ваше лекарство
Как самостоятельно сделать инъекцию
Подготовьте все необходимое:
Подготовка к инъекции
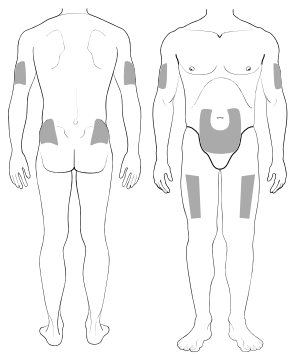
Выбор места инъекции
Рисунок 1. Места инъекции
Введение инъекции
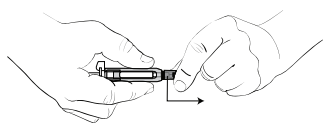
Рисунок 2. Как снять колпачок с иглы
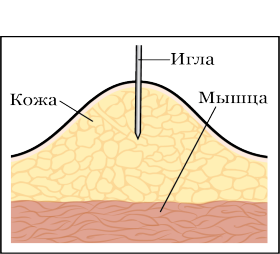
Рисунок 3: Введение иглы
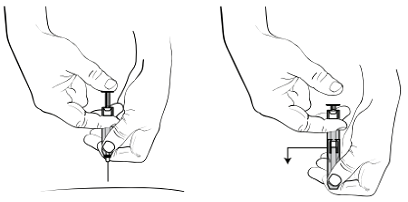
Рисунок 4. Как захватить и надвинуть защитную насадку иглы
Хранение и утилизация использованных шприцев
Для получения информации о безопасном хранении и утилизации использованных шприцев ознакомьтесь с материалом Хранение и утилизация бытовых медицинских игл.
ТеваГрастим (48 МЕ/0,8 мл)
Инструкция
Торговое название
Международное непатентованное название
Раствор для подкожного и внутривенного введения 30 МЕ/0.5 мл и 48 МЕ/0.8 мл
Состав
0,5мл или 0,8 мл раствора содержат
вспомогательные вещества: кислота уксусная ледяная, полисорбат 80,
сорбитол, натрия гидроксид, вода для иньекций.
Прозрачный, бесцветный раствор
Фармакотерапевтическая группа
Иммуномодуляторы. Колониестимулирующие факторы.
Фармакологические свойства
Фармакокинетика
При внутривенном (в/в) и подкожном (п/к) введении филграстима наблюдается положительная линейная зависимость его сывороточной концентрации от дозы. После подкожного введения препарата в рекомендуемых дозах его концентрация в сыворотке крови превышает 10 нг/мл в течение 8-16 часов. Объем распределения в крови составляет около 150 мл/кг. Как после подкожного, так и после внутривенного введения элиминация филграстима из организма протекает в соответствии с кинетикой 1-го порядка. Среднее значение периода полувыведения филграстима из сыворотки как у здоровых людей, так и у больных с опухолями составляет около 3,5 ч. Скорость клиренса приблизительно 0,6 мл/мин/кг. При непрерывных 24-часовых в/в инфузиях филграстима в дозе 20 мкг/кг в течение 11–20 дней достигается равновесная концентрация в крови без признаков кумуляции в течение наблюдаемого периода. Непрерывная инфузия в течение 28 дней больным, выздоравливающим после аутологичной пересадки костного мозга, не сопровождалась признаками кумуляции и увеличения периода полувыведения препарата.
ТеваГрастим значительно уменьшает частоту, тяжесть и продолжительность нейтропении и фебрильной нейтропении после цитотоксической химиотерапии. ТеваГрастим значительно сокращает продолжительность фебрильной нейтропении, длительность антибиотикотерапии и госпитализации после индукционной химиотерапии при остром миелолейкозе, а также после миелоаблативной терапии с последующей трансплантацией костного мозга, не влияя на частоту лихорадки и инфекционных осложнений и не уменьшая продолжительность лихорадочного периода у пациентов после миелоаблативной терапии с последующей трансплантацией костного мозга.
Применение ТеваГрастима как самостоятельно, так и после химиотерапии мобилизует выход гемопоэтических стволовых клеток в периферический кровоток. Аутологичную или аллогенную трансплантацию периферических стволовых клеток крови (ПСКК) можно проводить после высокодозного лечения цитостатиками либо вместо трансплантации костного мозга, либо в дополнение к ней. Трансплантация ПСКК ускоряет восстановление кроветворения, уменьшая опасность геморрагических осложнений и потребность в переливании тромбоцитарной массы.
Применение ТеваГрастима у реципиентов мобилизованных аллогенных ПСКК приводит к более быстрой нормализации гематологических показателей в сравнении с трансплантацией аллогенного костного мозга. Восстанавливается нормальное число тромбоцитов и отпадает необходимость контроля тромбоцитопении.
У детей и взрослых с тяжелой хронической нейтропенией (врожденной, периодической или идиопатической) ТеваГрастим стабильно увеличивает количество нейтрофилов в периферической крови, снижает частоту инфекций и связанных с ними осложнений.
Назначение филграстима пациентам с ВИЧ-инфекцией позволяет поддержать нормальный уровень нейтрофилов, что способствует планомерному проведению противовирусной и/или миелосупрессивной терапии. Не отмечено признаков увеличения репликации ВИЧ при лечении ТеваГрастимом.
Как и другие гемопоэтические факторы роста, ТеваГрастим стимулирует in vitro пролиферацию эндотелиальных клеток человека.
Показания к применению
— для сокращения продолжительности и снижения частоты возникновения нейтропении, сопровождающейся фебрильной реакцией у больных, получающих химиотерапию цитотоксическими средствами, при немиелоидных злокачественных заболеваниях
— для сокращения продолжительности нейтропении и ее клинических последствий у больных, получавших миелоаблативную терапию с последующей пересадкой костного мозга
— для мобилизации аутологичных клеток-предшественников гемоцитов периферической крови (КПГПК), в том числе, после миелосупрессивной терапии, для ускорения восстановления гемопоэза путем введения этих клеток после миелосупрессии или миелоаблации
— при длительной терапии, направленной на увеличение количества нейтрофильных гранулоцитов, для снижения частоты и сокращения продолжительности инфекционных осложнений у детей и взрослых с тяжелой врожденной, периодической или злокачественной нейтропенией (абсолютное число нейтрофильных гранулоцитов 5,0×109/л. Больным, не получавшим интенсивной химиотерапии, бывает достаточно одного лейкафереза. В отдельных случаях рекомендуется проводить дополнительные лейкаферезы.
Мобилизация ПСКК у здоровых доноров для аллогенной трансплантации
Тяжелая хроническая нейтропения (ТХН)
При врожденной нейтропении
Рекомендуемая начальная доза составляет 1.2 млнМЕ (12 мкг)/кг/сут подкожно однократно или разделив на несколько введений
При идиопатической или периодической нейтропении
У пациентов с тяжелыми инфекциями можно применить схему с более быстрым увеличением дозы. У 97% пациентов, положительно отреагировавших на лечение, полный терапевтический эффект наблюдается при назначении доз филграстима до 24 мкг/кг/сут. Суточная доза ТеваГрастима не должна превышать 24 мкг/кг.
Нейтропения при ВИЧ-инфекции
Для восстановления числа нейтрофилов
Рекомендуемая ежедневная начальная доза ТеваГрастима составляет 0.1 млнME (1 мкг)/кг/сутки в виде подкожного введения с титрованием до максимум 0.4 млнME (4 мкг)/кг/сутки, пока не будет достигнуто нормальное число нейтрофилов (АЧН> 2.0 x109/л).
Для поддержания нормального количества нейтрофилов
По окончании нейтропении определяют минимальную эффективную дозу препарата для поддержания нормального количества нейтрофилов. Рекомендуется начинать с введения 30 млнME (300 мкг) (независимо от массы тела) подкожно через день. Необходимо поддерживать количество нейтрофилов более 2,0×109/л, поэтому впоследствии может потребоваться индивидуальная коррекция дозы в зависимости от уровня нейтрофилов у пациента. Обычно эту дозу достаточно вводить 3 раза в неделю, иногда для поддержания количества нейтрофилов >2.0×109/л требуется длительное назначение ТеваГрастима.
Особые указания по дозированию
Не существует специальных рекомендаций по дозированию ТеваГрастима у больных пожилого возраста.
Рекомендации по дозированию для больных детей, начиная с 6-недельного возраста, такие же, как для взрослых, получающих миелосупрессивную цитотоксическую химиотерапию.
Не требуется коррекции дозы у больных с тяжелой почечной недостаточностью и тяжелой печеночной недостаточностью.
Безопасность и эффективность применения препарата у новорожденных с аутоиммунной нейтропенией не установлены.
Побочные действия
Очень часто (более 10%)
— обратимое временное повышение уровней γ–глутамилтрансферазы, щелочной фосфатазы (ЩФ), лактатдегидрогеназы (ЛДГ), мочевой кислоты в сыворотке крови
— утомляемость, слабость, головная боль
— запор, диарея, анорексия
— боль в груди, боль в скелетных мышцах и трубчатых костях
— кашель, боль и сухость в горле
— алопеция, кожная сыпь
— боли различной локализации
Очень редко (менее 0,01%)
— аллергические реакции (сыпь,боль) в месте введения, чаще после первой внутривенной инъекции
— обострение ревматоидного артрита
— легочные инфильтраты, интерстициальная пневмония, отек легких
— синдром Свита (острый фебрильный дерматоз), кожные васкулиты (связь с ТеваГрастимом не установлена)
ВИЧ-инфицированные больные
Очень часто (более 10%)
— боль в мышцах и костях
— увеличение селезенки (связь с ТеваГрастимом не установлена, так как симптом характерен для большинства ВИЧ-инфицированных больных)
Здоровые доноры, при мобилизации КПГПК
— головная боль, боль в мышцах и костях, лейкоцитоз, тромбоцитопения
— повышение ЛДГ, ЩФ в сыворотке крови, спленомегалия,
— серьезные аллергические реакции, гиперурикемия, увеличение слезенки
Очень редко (менее 0,01%)
— кровохарканье, легочные инфильтраты, обострение ревматоидного артрита
Больные с ТХН
Очень часто (более 10%)
— увеличение селезенки, которое у небольшого числа больных может прогрессировать
— боли в костях и генерализованные мышечно-скелетные боли
— преходящее и клинически бессимптомное увеличение сывороточных концентраций мочевой кислоты, лактатдегидрогеназы и щелочной фосфатазы
— снижение концентрации глюкозы в крови после еды
— диарея, увеличение печени
— алопеция, сыпь, кожный васкулит
— боль в месте инъекции
— повышенная чувствительность к препарату или его компонентам
— тяжелая врожденная нейтропения (синдром Костмана) с цитогенетическими нарушениями
— терминальная стадия хронической почечной недостаточности
— одновременное назначение с цитотоксической химио- и лучевой терапией
— беременность и период лактации
— период новорожденности (с момента рождения до 28 дней)
— миело-диспластический синдром и хронический миелолейкоз
Лекарственные взаимодействия
Безопасность и эффективность введения ТеваГрастим в тот же день, что и миелосупрессивных цитотоксических химиопрепаратов, не установлены. Ввиду чувствительности быстро делящихся миелоидных клеток к миелосупрессивной цитотоксической химиотерапии, назначать ТеваГрастим в интервале за 24 ч до или после введения этих препаратов не рекомендуется. Предварительные данные по небольшому числу больных, одновременно получавших ТеваГрастим и 5-фторурацил, показывают, что тяжесть нейтропении может усилиться.
Возможное взаимодействие с другими гемопоэтическими факторами роста и цитокинами в клинических испытаниях еще не исследовалось.
Литий, стимулирующий выход нейтрофилов, может усиливать действие филграстима. Это взаимодействие не исследовано, но сведений о его нежелательных последствиях нет.
Особые указания
Рост злокачественных клеток
Гранулоцитарный колониестимулирующий фактор человека может вызывать рост миелоидных клеток in vitro. Аналогичные эффекты могут наблюдаться in vitro и в отношении некоторых немиелоидных клеток. Безопасность и эффективность ТеваГрастима у больных с миелодиспластическим синдромом и хроническим миелолейкозом не установлены, поэтому при этих заболеваниях его применение не показано. Перед началом лечения требуется проведение тщательного дифференциального диагноза между бласттрансформацией хронического миелолейкоза и острым миелолейкозом.
С осторожностью назначают ТеваГрастим больным острым миелоидным лейкозом (ОМЛ). Эффективность и безопасность ТеваГрастима у больных ОМЛ моложе 55 лет с нормальным цитогенетическим профилем не установлены.
Больные, получающие цитотоксическую химиотерапиюНельзя назначать ТеваГрастим для увеличения доз цитостатиков выше рекомендованных при проведении химиотерапии.
Менее, чем у 5% больных, получавших ТеваГрастим в дозах более 0.3 млнМЕ (3 мкг/кг в сутки), число лейкоцитов увеличивалось до 100 Х 109/л и более. Учитывая возможный риск, связанный с выраженным лейкоцитозом, во время лечения ТеваГрастимом нужно регулярно определять число лейкоцитов. Если после прохождения ожидаемого минимума оно превысит 50 Х 109/л, ТеваГрастим следует немедленно отменить. Если ТеваГрастим применяется для мобилизации КПГПК, его отменяют в том случае, когда число лейкоцитов превысит 70 Х 109/л.
Риск, связанный с высокодозной химиотерапией
Особую осторожность следует проявлять при лечении больных, получающих высокодозную химиотерапию, поскольку улучшения исхода злокачественного новообразования показано не было, в то время как повышенные дозы химиопрепаратов обладают более выраженной токсичностью, включая сердечные, легочные, неврологические и дерматологические реакции (см. инструкции к применению конкретных химиопрепаратов).
Монотерапия ТеваГрастимом не предотвращает тромбоцитопению и анемию, обусловленные действием миелосупрессивной химиотерапии. При проведении высокодозной химиотерапии в соответствии со стандартными схемами, больной может подвергаться большему риску развития тромбоцитопении и анемии. Рекомендуется регулярно контролировать уровень тромбоцитов и гематокрит. Особую осторожность следует проявлять при применении однокомпонентных или комбинированных химиотерапевтических схем, которые часто вызывают тяжелую тромбоцитопению.
Применение КПГПК, мобилизованных с помощью ТеваГрастима, уменьшает выраженность и продолжительность тромбоцитопении после миелосупрессивной или миелоаблативной химиотерапии.
У пациентов, получающих миелосуппрессивную или миелоаблативную терапию с последующей трансплантацией аутологичных КПГПК
Не существует данных сравнительного анализа эффективности двух методов мобилизации КПГПК: ТеваГрастим в сочетании с миелосуппрессивной терапией или только ТеваГрастим. Поэтому при выборе метода мобилизации КПГПК принимают во внимание конечную цель лечения у каждого пациента в отдельности.
Предшествующее лечение цитотоксическими средствами
У больных, которым в прошлом проводилась активная миелосупрессивная терапия, количество мобилизованных КПГПК может не достигать рекомендуемого минимального уровня (> 2,0 х 106 CD34+/кг), а число тромбоцитов не восстанавливаться достаточно быстро.
Некоторые цитостатики обладают особой токсичностью по отношению к КПГПК и могут отрицательно влиять на их мобилизацию. Такие средства, как мелфалан, кармустин (BCNU) и карбоплатин, если они назначались в течение длительного времени до попыток мобилизации КПГПК, могут снижать ее эффективность. Однако применение мелфалана, карбоплатина или кармустина вместе с ТеваГрастимом при активации КПГПК оказалось эффективным. Если планируется пересадка КПГПК, рекомендуется запланировать мобилизацию стволовых клеток на ранней стадии курса лечения. Особое внимание следует обратить на число клеток-предшественников, активированных у таких больных перед проведением высокодозной химиотерапии. Если результаты мобилизации, в соответствии с вышеприведенными критериями, недостаточны, следует рассмотреть альтернативные виды лечения, не требующие использования КПГПК.
Оценка количества мобилизованных («урожая») клеток-предшественников Оценивая число КПГПК, мобилизованных у больных с помощью ТеваГрастима, следует уделить особое внимание методу количественного определения. Результаты проточного цитометрического анализа числа CD34+-клеток различаются в зависимости от методики, поэтому нужно с осторожностью интерпретировать результаты исследований, полученные в разных лабораториях.
Статистический анализ зависимости между количеством введенных CD34+-клеток и темпом нормализации числа тромбоцитов после высокодозной химиотерапии указывает на сложную, но стабильную связь.
Критерий эффективности мобилизации КПГПК – не менее 2,0 Х 106 CD34+-клеток/кг массы тела реципиента – основан на опубликованных данных об адекватном восстановлении картины крови. Получение количества мобилизованных КПГПК, свыше этого значения, по-видимому, сопровождается более быстрой нормализацией картины крови, и наоборот.
При мобилизации КПГПК у здоровых доноров перед аллогенной трансплантацией аутологичных КПГПК
Мобилизация КПГПК не обеспечивает клинического преимущества у здоровых доноров и ее применение возможно только с целью последующей аллогенной аутотрансплантации стволовых клеток.
Мобилизация КПГПК возможна только у доноров, которые соответствуют критериям выбора по клиническим и лабораторным показателям для донации стволовых клеток, в особенности, по гематологическим параметрам и наличию инфекционных заболеваний.
Преходящая тромбоцитопения (количество тромбоцитов менее 100 Х 109 /л) после введения филграстима и лейкафереза наблюдается примерно у 35% пациентов. При необходимости проведения более одной процедуры лейкафереза особое внимание следует уделить донорам, у которых до процедуры уровень тромбоцитов был менее 100 Х 109 /л. Лейкаферез не рекомендуется проводить при уровне тромбоцитов ниже 75 Х 109 /л, а также у доноров с изменениями в показателях противосвертывающей системы или другими дефектами гемостаза.
ТеваГрастим отменяют или снижают дозу, если уровень лейкоцитов превышает 70 Х 109 /л.
Доноры, получающие ТеваГрастим для мобилизации КПГПК, должны находиться под наблюдением врача до нормализации гематологических показателей.
Для доноров, подвергающихся мобилизации КПГПК, рекомендуется длительное наблюдение на предмет выявления отдаленных побочных реакций, среди которых не исключается малигнизация клонов клеток.
Специальные меры предосторожности у реципиентов аллогенных КПГПК, мобилизованных с помощью ТеваГрастима
Существующие в настоящее время данные показывают, что иммунологическое взаимодействие между пересаженными аллогенными КПГПК и реципиентом может иметь более высокий риск острой или хронической реакции «трансплантат против хозяина», чем при пересадке костного мозга.
Больные с ТХН Трансформация в лейкоз или миелодиспластический синдром
Особую осторожность следует проявлять при диагностике тяжелых хронических нейтропений, чтобы дифференцировать их от других расстройств гемопоэза, таких, как апластическая анемия, миелодисплазия и миелолейкоз. До начала лечения следует провести развернутый анализ крови с определением лейкоцитарной формулы и количества тромбоцитов, а также изучить морфологическую картину и кариотип костного мозга.
Следует тщательно контролировать число тромбоцитов, особенно в течение первых нескольких недель лечения ТеваГрастимом. Если у больного появляется тромбоцитопения (число тромбоцитов стабильно ниже 100 Х 109/л), следует рассмотреть вопрос о временной отмене препарата или уменьшении дозы. Наблюдаются также и другие изменения формулы крови, требующие ее тщательного контроля, в том числе анемия и преходящее увеличение количества миелоидных клеток-предшественников.
Требуется исключить другие причины преходящей нейтропении, такие как вирусные инфекции. Увеличение селезенки является прямым следствием лечения ТеваГрастимом. Обычно селезенка резко увеличивается в начале, затем в процессе лечения ее размер стабилизируется. При уменьшении дозы увеличение селезенки замедляется или останавливается. Однако у некоторых больных может потребоваться спленэктомия. Размеры селезенки нужно контролировать регулярно. Для обнаружения чрезмерного увеличения объема селезенки достаточно произвести пальпацию живота.
У небольшого числа больных наблюдались гематурия и протеинурия. Для контроля за ними следует регулярно делать анализ мочи.
Безопасность и эффективность применения препарата у больных с аутоиммунной нейтропенией не установлены.
Меры предосторожности у ВИЧ-инфицированных больных
В первые несколько недель лечения ТеваГрастимом следует контролировать абсолютное число нейтрофилов (АЧН). У некоторых больных может наблюдаться очень быстрое повышение АЧН после начальных доз ТеваГрастима. Поэтому первые 2-3 дня рекомендуется проводить подсчет АЧН ежедневно. В последующие 2 недели подсчет АЧН проводят два раза в неделю, затем один раз в неделю на протяжении всего курса поддерживающей терапии. Так как при интермиттирующем введении дозы 30 МЕ (300 мкг) в сутки значение АЧН может значительно варьировать на протяжении периода между инъекциями, для более точной оценки рекомендуется брать кровь для подсчета АЧН непосредственно перед инъекцией ТеваГрастима.
Риск, связанный с повышенными дозами миелосуппрессивных препаратов
Лечение ТеваГрастимом не исключает и не предотвращает тромбоцитопению и анемию, обусловленные действием миелосупрессивных препаратов. При получении высоких доз или большого количества препаратов в соответствии со стандартными схемами в комбинации с ТеваГрастимом, больной может подвергаться большему риску тромбоцитопении и анемии. Рекомендуется регулярно контролировать клеточный состав крови.
Миелосуппрессия, обусловленная инфекционными заболеваниями и злокачественными опухолями
Нейтропения может развиться вследствие инфильтрации костного мозга при оппортунистических инфекциях, например, вызванной Mycobacterium avium или злокачественных новообразованиях, например, лимфоме. Такие пациенты, кроме терапии ТеваГрастимом, для лечения нейтропении нуждаются в проведении соответствующего специфического лечения.
Другие предупреждения и меры предосторожности
При появлении боли в левом верхнем квадранте живота следует исключить увеличение или разрыв селезенки посредством клинического или ультразвукового исследования.
С осторожностью назначают ТеваГрастим больным серповидноклеточной анемией. Во время лечения ТеваГрастимом следует регулярно контролировать формулу крови и учитывать возможность развития тромбоэмболических осложнений, увеличения селезенки и кризиса основного заболевания.
Больным с сопутствующими костной патологией и остеопорозом, получающим непрерывное лечение ТеваГрастимом более 6 месяцев, необходим контроль за плотностью костного вещества.
Эффективность ТеваГрастима при существенном снижении количества клеток-предшественников миелоидного ростка гемопоэза не изучена. ТеваГрастим увеличивает число нейтрофилов путем воздействия, прежде всего, непосредственно на клетки-предшественники нейтрофилов. Поэтому у больных со сниженным содержанием клеток-предшественников (например, подвергшихся интенсивной лучевой терапии или химиотерапии) степень повышения числа нейтрофилов может быть ниже.
Влияние ТеваГрастима на реакцию “трансплантат против хозяина” (РТПХ) не установлено.
ТеваГрастим содержит сорбитол в качестве эксципиента в концентрации 50 мг/мл. С осторожностью назначают ТеваГрастим при непереносимости фруктозы.
Появление патологических симптомов со стороны легких, таких как кашель, одышка, повышение температуры в сочетании с рентгенологическими признаками инфильтрации и ухудшения функции легких могут быть проявлением острого респираторного дистресс-синдрома взрослых. В таких случаях надо отменить ТеваГрастим и назначить соответствующее лечение.
При интерпретации результатов визуализирующих методов исследования необходимо учитывать повышение активности костного мозга при лечении ТеваГрастимом.
Применение у детей
Эффективность и безопасность ТеваГрастима у детей, начиная с 6-недельного возраста, такая же, как и у взрослых получающих цитотоксическую химиотерапию. Эффективность и безопасность ТеваГрастима у новорожденных с тяжелой хронической нейтропенией не установлена. Длительное лечение ТеваГрастимом показано детям с тяжелой врожденной, периодической или идиопатической нейтропенией при АЧН менее 0,5 Х 109 /л и тяжелыми инфекционными заболеваниями для повышения АЧН и снижения частоты и продолжительности связанных с ними осложнений.
Применение у пожилых
Эффективность и безопасность ТеваГрастима у здоровых доноров старше 60 лет не установлена.
Особенности влияния лекарственного средства на способность управлять автомобилем и потенциально опасными механизмами
ТеваГрастим имеет небольшое влияние на способность управлять автомобилем и потенциально опасными механизмами. Учитывая побочные действия препарата не следует выполнять действия связанные с повышенной концентрацией внимания (управлять транспортным средством и использовать различные механизмы).
Передозировка
Действие ТеваГрастима при передозировке не установлено
Форма выпуска и упаковка
По 0.5 мл или 0.8 мл раствора для подкожного или внутривенного введения помещают в стеклянный шприц одноразового использования с иглой из нержавеющей стали.
По 1 шприцу с иглой помещают в пластиковый контейнер.
По 1 контейнеру, вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона.
Хранить при температуре от 2оС до 8оС.
Хранить в недоступном для детей месте!
Срок хранения
Разведенный раствор ТеваГрастима можно хранить в холодильнике при температуре от 2° до 8°C не более 24 часов.
Не применять по истечении срока хранения.
Условия отпуска из аптек
Производитель
«ТЕВА Фармацевтические Предприятия Лтд», Израиль
Владелец регистрационного удостоверения
ТЕВА Фармацевтические Предприятия Лтд, Израиль
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара):
«ТЕВА Фармацевтические Предприятия Лтд» в РК