Как узнать что основание сильное или слабое
Урок 16. Кислоты и основания
В уроке 16 «Кислоты и основания» из курса «Химия для чайников» дадим определение кислотам и основаниям, рассмотрим процесс их диссоциации в водном растворе и различия слабых кислот и оснований от сильных. Кроме того, вы узнаете самые распространенные кислоты и основания. Основы химии, которые вы должны знать перед прочтением данного урока, содержатся в уроке 9 «Ионы в водном растворе».
Что такое кислота и основание?
Для тех, кто только к нам присоединился напоминаю, что ионы — это все те же атомы веществ, просто с бОльшим или меньшим количеством электронов относительно числа протонов. Для кислот и оснований наиболее популярны следующие определения:
Кислота — это вещество, которое при добавлении к воде повышает концентрацию ионов водорода [H + ].
Основание — это вещество, которое при добавлении к воде повышает концентрацию гидроксидных ионов [OH — ]. Забегая вперед, скажу, что основанием также называют вещество, которое забирает ионы водорода [H + ].
Если данные определения вам не понятны, то скорее всего вам нужно вспомнить, что такое простые и сложные ионы. Дальше все будет проще, ведь сложные лишь определения!
Диссоциация кислот
В дальнейшем не будем указывать сокращение (водн.), означающее что ион гидратирован, поскольку в водном растворе любой ион гидратирован. Кислоты H2CO3, H2SO3 и H2SO4 диссоциируют в водном растворе с высвобождением двух протонов. Это происходит не в одну, а в две стадии:
Каждая фосфорсодержащая кислота высвобождает в водном растворе три протона, и соответственно осуществляется это в 3 стадии:
Органические кислоты, такие как уксусная и муравьиная кислота, дают H + из своих карбоксигрупп –COOH.
Диссоциация оснований
Диссоциация оснований, содержащие OH-группы (гидроксигруппы), например LiOH или Ca(OH)2, дает в водный раствор гидроксидные ионы OH — :
Хотя у аммиака отсутствуют OH — ионы, тем не менее NH3 является основанием, поскольку он образует гидроксидные ионы при реакции с молекулами воды:
Надеюсь урок 16 «Кислоты и основания» был познавательным и понятным. Если у вас возникли вопросы, пишите их в комментарии.
Гидролиз
По катиону, по аниону или нет гидролиза?
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Научная электронная библиотека
Таланов В. М., Житный Г. М.,
1.1.1. рН растворов слабых кислот и оснований
В водном растворе слабой кислоты устанавливается равновесие:
в котором участвуют две кислотно-основные пары: HF/F – и H3O + /H2O. Сила кислоты HF количественно характеризуется ее константой кислотности КА:
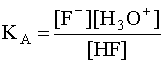
Чем больше численное значение константы кислотности, тем сильнее данная кислота и слабее сопряженное с ней основание. В общем случае константа кислотности может быть записана следующим образом:
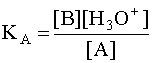
Если в водном растворе присутствует только рассматриваемая кислота A и ее сопряженное основание B, то, учитывая, что в состоянии равновесия [B]=[H3O + ], а также приняв, что равновесная концентрация [A] в первом приближении равна исходной концентрации этой кислоты, то есть [A] » CA, имеем
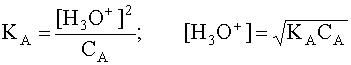
Прологарифмируем это равенство и произведем алгебраические преобразования:
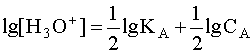
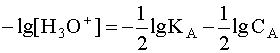
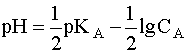
Когда имеем раствор основания B, то в нем устанавливается равновесие:
характеризующееся константой основности
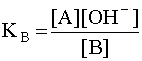
Чем больше численное значение константы основности, тем это основание сильнее и тем слабее сопряженная с ним кислота. В справочной литературе обычно приводятся только константы кислотности, но поскольку для любой сопряженной кислотно-основной пары произведение константы кислотности на константу основности есть величина постоянная, равная ионному произведению воды
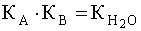
то соотношение (6) можно записать следующим образом:
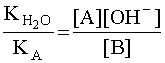
С учетом того, что [A] = [OH – ], а [B] » CB, имеем:
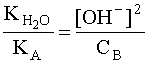
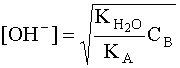
Прологарифмировав это выражение и произведя соответствующие преобразования, получим:
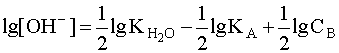
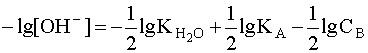
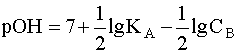
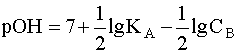
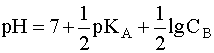
Для расчета рН раствора слабой кислоты или слабого основания можно вывести и другое выражение, в которое не входит исходная концентрация С растворенного вещества. Для этого следует прологарифмировать выражение (4) и выразить рН раствора следующим образом:
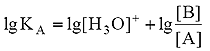
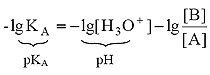
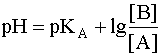
Данное уравнение выведено, исходя из выражения константы кислотности (1), однако оно пригодно и для вычисления рН раствора основания В, сопряженного с кислотой А, в чем Вы можете убедиться, выведя его из выражения константы основности (6). В дальнейшем будем пользоваться только константами кислотности (К) и их показателями (рК).
Гидролиз солей. Часть II
Сильные и слабые электролиты
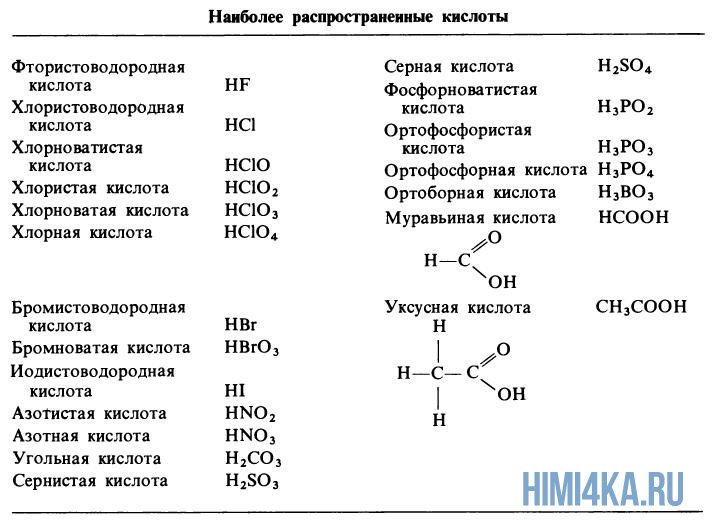
Естественно, невозможно перечислить все существующие в природе кислоты. Приведены лишь наиболее «популярные». Следует также понимать, что разделение кислот на сильные и слабые является достаточно условным.
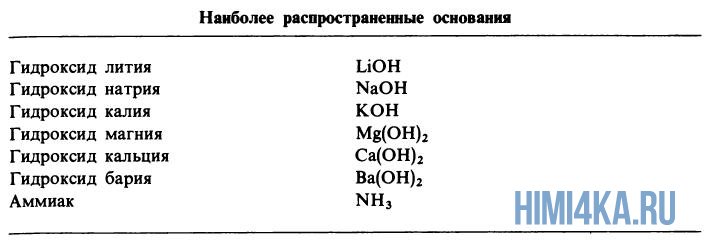
Существенно проще обстоят дела с сильными и слабыми основаниями. Можно воспользоваться таблицей растворимости. К сильным основаниям относятся все растворимые в воде основания, кроме NH 4 OH. Эти вещества называют щелочами (NaOH, KOH, Ca(OH) 2 и т. д.)
Гидролиз солей. Главные факты
Читающим эту статью может показаться, что мы уже забыли об основной теме разговора, и ушли куда-то в сторону. Это не так! Наша беседа о кислотах и основаниях, о сильных и слабых электролитах имеет прямое отношение к гидролизу солей. Сейчас вы в этом убедитесь.
Итак, позвольте изложить вам основные факты:
| Сильная кислота, слабое основание | Слабая кислота, сильное основание | Слабая кислота, слабое основание | Сильная кислота, сильное основание | |
| Направление гидролиза | По катиону | По аниону | По катиону и по аниону | Гидролиз не идет |
| Характер среды | Кислая | Щелочная | Близкая к нейтральной | Нейтральная |
| Продукты реакции | Кислота и основная соль | Основание и кислая соль | Довольно разнообразны | — |
Нам осталось последовательно обсудить 4 группы солей и для каждой из них привести специфический «сценарий» гидролиза. В следующей части мы начнем с солей, образованных слабым основанием и сильной кислотой.
Основания. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
2K 0 + 2 H2 + O → 2 K + OH + H2 0
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Химические свойства щелочей
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O