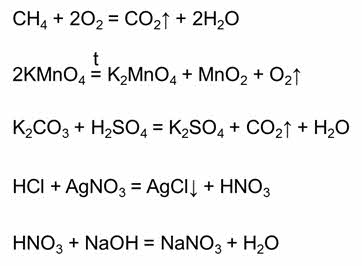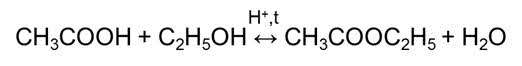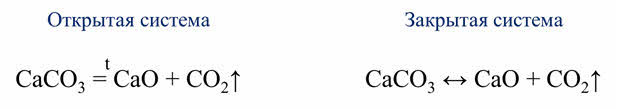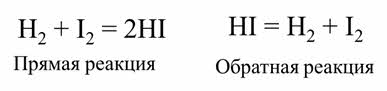Как узнать что реакция обратимая
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
1.4.4. Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов.
Обратимые и необратимые химические реакции
Химические реакции бывают обратимые и необратимые.
Необратимыми реакциями называют такие реакции, которые идут только в одном (прямом →) направлении:
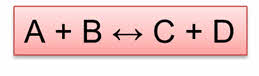
т.е. если некоторая реакция A + B = C + D необратима, это значит, что обратная реакция C + D = A + B не протекает.
Обратимые реакции – это такие реакции, которые идут как в прямом, так и в обратном направлении (⇄):
т.е., например, если некая реакция A + B = C + D обратима, это значит, что одновременно протекает как реакция A + B → C + D (прямая), так и реакция С + D → A + B (обратная).
По сути, т.к. протекают как прямая, так и обратная реакции, реагентами (исходными веществами) в случае обратимых реакций могут быть названы как вещества левой части уравнения, так и вещества правой части уравнения. То же самое касается и продуктов.
Однако, условно принято считать, что реагентами в каждом конкретном уравнении обратимой реакции являются те вещества, которые записаны в его левой части, а продуктами – те, что записаны в правой, т.е.:
Для любой обратимой реакции возможна ситуация, когда скорость прямой и обратной реакций равны. Такое состояние называют состоянием равновесия.
В состоянии равновесия концентрации как всех реагентов, так и всех продуктов неизменны. Концентрации продуктов и реагентов в состоянии равновесия называют равновесными концентрациями.
Смещение химического равновесия под действием различных факторов
Вследствие таких внешних воздействий на систему, как изменение температуры, давления или концентрации исходных веществ или продуктов, равновесие системы может быть нарушено. Однако после прекращения этого внешнего воздействия система через некоторое время перейдет в новое состояние равновесия. Такой переход системы из одного равновесного состояния в другое равновесное состояние называют смещением (сдвигом) химического равновесия.
Для того чтобы уметь определять, каким образом сдвигается химическое равновесие при том или ином типе воздействия, удобно пользоваться принципом Ле Шателье:
Если на систему в состоянии равновесия оказать какое-либо внешнее воздействие, то направление смещения химического равновесия будет совпадать с направлением той реакции, которая ослабляет эффект от оказанного воздействия.
Влияние температуры на состояние равновесия
При изменении температуры равновесие любой химической реакции смещается. Связано это с тем, что любая реакция имеет тепловой эффект. При этом тепловые эффекты прямой и обратной реакции всегда прямо противоположны. Т.е. если прямая реакция является экзотермической и протекает с тепловым эффектом, равным +Q, то обратная реакция всегда эндотермична и имеет тепловой эффект, равный –Q.
Таким образом, в соответствии с принципом Ле Шателье, если мы повысим температуру некоторой системы, находящейся в состоянии равновесия, то равновесие сместится в сторону той реакции, при протекании которой температура понижается, т.е. в сторону эндотермической реакции. И аналогично, в случае, если мы понизим температуру системы в состоянии равновесия, равновесие сместится в сторону той реакции, в результате протекания которой температура будет повышаться, т.е. в сторону экзотермической реакции.
Например, рассмотрим следующую обратимую реакцию и укажем, куда сместится ее равновесие при понижении температуры:
Как видно из уравнения выше, прямая реакция является экзотермической, т.е. в результате ее протекания выделяется тепло. Следовательно, обратная реакция будет эндотермической, то есть протекает с поглощением тепла. По условию температуру понижают, следовательно, смещение равновесия будет происходить вправо, т.е. в сторону прямой реакции.
Влияние концентрации на химическое равновесие
Повышение концентрации реагентов в соответствии с принципом Ле Шателье должно приводить к смещению равновесия в сторону той реакции, в результате которой реагенты расходуются, т.е. в сторону прямой реакции.
И наоборот, если концентрацию реагентов понижают, то равновесие будет смещаться в сторону той реакции, в результате которой реагенты образуются, т.е. сторону обратной реакции (←).
Аналогичным образом влияет и изменение концентрации продуктов реакции. Если повысить концентрацию продуктов, равновесие будет смещаться в сторону той реакции, в результате которой продукты расходуются, т.е. в сторону обратной реакции (←). Если же концентрацию продуктов, наоборот, понизить, то равновесие сместится в сторону прямой реакции (→), для того чтобы концентрация продуктов возросла.
Влияние давления на химическое равновесие
В отличие от температуры и концентрации, изменение давления оказывает влияние на состояние равновесия не каждой реакции. Для того чтобы изменение давления приводило к смещению химического равновесия, суммы коэффициентов перед газообразными веществами в левой и в правой частях уравнения должны быть разными.
Т.е. из двух реакций:
изменение давления способно повлиять на состояние равновесия только в случае второй реакции. Поскольку сумма коэффициентов перед формулами газообразных веществ в случае первого уравнения слева и справа одинаковая (равна 2), а в случае второго уравнения – различна (4 слева и 2 справа).
Отсюда, в частности, следует, что если среди и реагентов, и продуктов отсутствуют газообразные вещества, то изменение давления никак не повлияет на текущее состояние равновесия. Например, давление никак не повлияет на состояние равновесия реакции:
Если же слева и справа количество газообразных веществ различается, то повышение давления будет приводить к смещению равновесия в сторону той реакции, при протекании которой объем газов уменьшается, а понижение давления – в сторону той реакции, в результате которой объем газов увеличивается.
Влияние катализатора на химическое равновесие
Поскольку катализатор в равной мере ускоряет как прямую, так и обратную реакции, то его наличие или отсутствие никак не влияет на состояние равновесия.
Единственное, на что может повлиять катализатор, — это на скорость перехода системы из неравновесного состояния в равновесное.
Воздействие всех указанных выше факторов на химическое равновесие сведено ниже в таблицу-шпаргалку, в которую поначалу можно подглядывать при выполнении заданий на равновесия. Однако же пользоваться на экзамене ей не будет возможности, поэтому после разбора нескольких примеров с ее помощью, ее следует выучить и тренироваться решать задания на равновесия, уже не подглядывая в нее:
Обозначения: T – температура, p – давление, с – концентрация, ↑ — повышение, ↓ — понижение
Обратимые и необратимые химические реакции — признаки, условия химического равновесия и примеры
Реакции в химии имеют много типов классификации, и одна из них базируется на том, возможно или невозможно протекание процессов в разных направлениях, и в зависимости от этого разделяют обратимые и необратимые химические реакции.
Обратимые химические реакции
Большинство известных взаимодействий в химии относятся именно к этому виду. Что же они представляют собой?
Так называются процессы, которые при различных условиях протекают как напрямую (как и написано в уравнении), так и в обратную сторону (это так называемые прямая и обратная реакции).
Здесь можно привести такие примеры как гидратация натрий сульфида. Происходит образование веществ, формулы которых NaHS и NaOH. В таком порядке характерно прохождение первого подтипа (прямая реакция).
Если продукты и реагенты поменяются местами — это будет второй вид этих реакций. Интересно здесь то, что скорости протекания обратного и прямого уравнений равны между собой.
Факторы, влияющие на смещение химического равновесия
На состояние равновесия в уравнениях химии могут влиять такие факторы как концентрация, температура, давление, катализаторы и др. Все эти способы смещения равновесия действуют по-разному.
Рассмотрим главные из них:
Увеличение концентрации приводит к тому, что все растворы, участвующие в процессе, тоже изменяют свои концентрации так, чтобы система вновь возвратилась в состояние баланса.
Температура — при её повышении, в случае обратимой реакции, равновесие смещается в сторону поглощения теплоты, а при понижении — в сторону выделения теплоты. Эти направления называются соответственно эндотермическое и экзотермическое.
Ещё один фактор — давление. Особенность в том, что оно может влиять только на системы, в которых есть хотя бы одно газообразное вещество. В случае обратимой реакции увеличение давления приводит к смещению равновесия в сторону уменьшения объёма (которая ведёт к уменьшению количества газов), а уменьшение — в сторону его увеличения.
Необратимые реакции
Необратимыми называются химические уравнения, происходящие до того, как полностью израсходуется одно из взаимодействующих реагентов, например, окисление фосфора кислородом с образованием оксида.
Как определить обратимую или необратимую реакцию
Различение этих двух типов производится с помощью таких признаков необратимых реакций:
выпадение осадка или выделение газа;
образование малодиссоциированных соединений (часто это вода);
большое высвобождение энергии.
Ещё одним признаком для их распознавания в книгах является то, что для необратимых уравнений между реагентами и продуктами ставятся две стрелки, указывающие на разные направления или знак равенства.
Обратимость химических реакций. Химическое равновесие
Урок 17. Химия 11 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Обратимость химических реакций. Химическое равновесие»
Все химические реакции делятся на обратимые и необратимые. Необратимые реакции – это реакции, которые идут только в одном направлении. Необратимыми являются реакции горения (например, реакция горения метана), большинство реакций тэрмического разложения сложных веществ (например, реакция разложения перманганата калия), необратимыми являются большинство реакций, в результате которых образуется газ (например, реакция карбоната калия с серной кислотой), образуется осадок (например, в реакции соляной кислоты с нитратом серебра один), или если образуется малодиссоциирующее вещество (например, в реакции азотной кислоты и гидроксида натрия).
Обратимыми называются реакции, которые одновременно протекают в прямом и обратном направлении. В уравнениях обратимых реакций используют знак обратимости.
Реакция образования веществ Цэ и Дэ является прямой, а реакция образования А и Бэ является обратной.
Обратимыми являются также реакции этэрификации – это реакции взаимодействия карбоновых кислот со спиртами.
Одни и те же реакции при различных условиях могут быть обратимыми и необратимыми. Например, реакция разложения карбоната кальция. В открытой системе эта реакция является необратимой, так как углекислый газ выходит из зоны реакции, а в замкнутой системе эта реакция является обратимой, так как углекислый газ не уходит из зоны реакции.
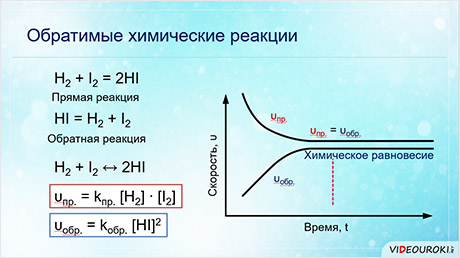
Обратимой является реакции синтеза йодоводорода из водорода и йода.
После некоторого времени после начала реакции в газовой смеси можно обнаружить не только йодоводород, но и исходные вещества – водород и йод. Если взять в качестве исходного вещества йодоводород, то через некоторое время также наряду с образовавшимися водородом и йодом в смеси будет содержаться йодоровород.
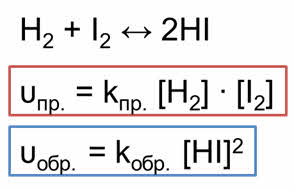
Если в качестве исходных веществ взять водород и йод, то скорость прямой реакции будет равна произведению концентраций водорода и йода.
Скорость обратной реакции будет равна концентрации йодоводорода взятой в квадрате.
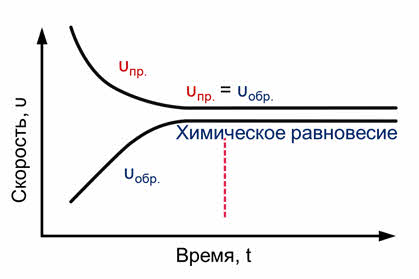
Постепенно скорость прямой реакции уменьшается, потому что водород и йод начинают реагировать и их концентрации уменьшаются.
Скорость же обратной реакции увеличивается, потому что концентрация образующегося йодоводорода увеличивается. Как только скорость прямой реакции окажется равной скорости обратной реакции, наступит химическое равновесие. Это равновесие считается динамическим, так как идут и прямая, и обратная реакции, скорости их также равны, а значит и концентрации веществ не изменяются. То есть их концентрации являются равновесными.
Если рассмотреть реакцию образования веществ Цэ и Дэ из А и Бэ, то скорость прямой реакции будет равна произведению равновесных концентраций А и Бэ с учётом их стехиометрических коэффициентов.
Скорость обратной реакции будет равна произведению равновесных концентраций Цэ и Дэ с учётом их стереохимических коэффициентов.
Так как в состоянии химического равновесия скорость прямой реакции равна скорости обратной реакции, то предыдущие выражения можно приравнять.
Константа скорости прямой и обратной реакции является величиной постоянной. А отношение констант скоростей прямой и обратной реакции является величиной постоянной, которая называется константой равновесия.
Константа равновесия зависит от температуры и давления, но не зависит от концентрации реагирующих веществ. Катализатор также не влияет на константу равновесия, но уменьшает время достижения равновесия.
Химическое равновесие является подвижным. То есть изменения внешних условий ведёт к смещению или сдвигу химического равновесия. Состояние же химического равновесия при неизменных внешних условиях может сохраняться бесконечно долго. Для многих химических производств состояние равновесия является нежелательным, так как не приводит к нужному выходу продукции. И поэтому для таких химических реакций нужно создавать условия, когда равновесие будет смещаться в нужную сторону.
Направление смещения равновесия определяется принципом, который сформулировал французский учёный Ле Шатэлье в 1884 году.
Согласно этому принципу, если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие смещается в сторону той реакции, которая противодействует этому воздействию.
На смещение химического равновесия влияют такие факторы, как концентрация реагирующих веществ, температура и давление.
Рассмотрим влияние концентрации на смещение химического равновесия. Как правило, при увеличении концентрации исходных веществ, равновесие смещается в сторону прямой реакции, при увеличении концентрации продуктов реакции равновесие смещается в сторону обратной реакции.
Так, в реакции получения оксида серы шесть из оксида серы четыре и кислорода, при увеличении концентрации оксида серы четыре равновесие смещается вправо, то есть в сторону прямой реакции.
Аналогично, при увеличении концентрации кислорода, равновесие смещается в сторону прямой реакции, то есть в сторону образования оксида серы шесть. При увеличении концентрации оксида серы шесть равновесие смещается в сторону обратной реакции, то есть влево.
Следовательно, при уменьшении концентрации оксида серы четыре и кислорода равновесие смещается влево, то есть в сторону обратной реакции, при уменьшении концентрации оксида серы шесть равновесие смещается в сторону образования оксида серы шесть, то есть в сторону прямой реакции.
Рассмотрим пример реакции взаимодействия хлорида железа три и роданида калия. В результате реакции образуется роданид железа три и хлорид калия. Эта реакция является обратимой. Если к хлориду железа три добавить роданид калия, то образуется раствор кроваво-красного цвета.
Разделим этот раствор на три равные части. В первую пробирку добавим роданид калия и раствор приобретает ещё более насыщенный кроваво-красный цвет, так как равновесие сместилось в сторону продуктов реакции. К третьей пробирки добавим твёрдый хлорид калия, раствор стал более светлым, то есть равновесие сместилось, в данном случае, в сторону исходных веществ.
Из этого опыта понятно, что при увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции, а при увеличении концентрации продуктов реакции, равновесие смещается в сторону исходных веществ.
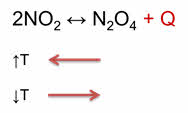
Рассмотрим, как влияет изменение температуры на смещение химического равновесия. Для начала большинства химических реакций необходимо нагреть исходные вещества, чтобы частицы получили необходимую энергию. Однако скорость прямой и обратной реакции зависит от того, являются ли эти реакции экзотэрмическими или эндотэрмическими.
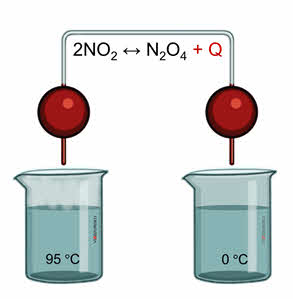
Как правило, увеличение температуры ведёт к увеличению скорости реакции. Для того, чтобы узнать как температура повлияет на смещение равновесия нужно знать тепловой эффект реакции. Так реакция превращения оксида азота четыре в его димер, является экзотэрмической.
При увеличении температуры равновесие смещается в сторону эндотэрмической реакции, а при уменьшении температуры равновесие смещается в сторону экзотэрмической реакции.
Для подтверждения этого проведём следующий эксперимент. В одну ёмкость нальём горячую воду, в другую – холодную. Опустим в две ёмкости колбы с бурым газом – оксидом азота четыре. Во второй колбе, которая опущена в холодную воду, газ бледнеет, так как оксид азота четыре переходит в его димер, который является бесцветным.
Как же влияет давление на смещение химического равновесия? Давление газов в системе при постоянной температуре определяется числом молекул газообразных веществ, или химическим количеством этих веществ. Поэтому для оценки влияния изменения давления необходимо подсчитать число молей газообразных веществ в левой и правой частях уравнения. При увеличении давления увеличивается концентрация газообразных веществ.
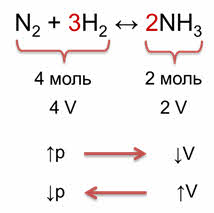
Например, в реакции синтеза аммиака из азота и водорода образуется 2 моль аммиака из исходных четырёх моль азота и водорода. Следовательно, было 4 объёма исходных веществ и образовалось 2 объёма аммиака. При увеличении давления объём уменьшается, поэтому идёт реакция образования аммиака. При уменьшении давления, объём увеличивается, что способствует реакции разложения аммиака на исходные вещества.
Таким образом, при увеличении давления равновесие смещается в сторону той реакции, при которой объём образующихся газообразных веществ уменьшается, и, наоборот, при уменьшении давления равновесие смещается в сторону той реакции, которая приводит к увеличению объёма. То есть, при увеличении давления равновесие смещается в сторону образования аммиака (вправо), а при уменьшении давления равновесие смещается в сторону исходных веществ (влево).
Катализаторы не влияют на смещение химического равновесия, так как они одинаково ускоряют как прямую, так и обратную реакцию. То есть катализаторы только ускоряют наступление химического равновесия. Например, дрова быстрее загораются, если их порубить (то есть увеличить площадь поверхности соприкосновения реагирующих веществ; на сильном огне быстрее закипит вода (потому то увеличивается температура), смазанные маслом детали автомобилей не ржавеют, так как не будет доступа кислорода.