Какая частица имеет большее число протонов чем электронов
Частица, имеющая большее число протонов, чем электронов : Выберите один ответ?
Частица, имеющая большее число протонов, чем электронов : Выберите один ответ.
Частица, имеющая большее число протонов, чем электронов : Выберите один ответ.
Напишите электронные формулы атома и иона фтора?
Напишите электронные формулы атома и иона фтора.
Электронные формулы каких частиц совпадают с электронной конфигурацией иона фтора?
Атом элемента имеет на 2 электрона больше, чем ион фтора?
Атом элемента имеет на 2 электрона больше, чем ион фтора.
Назовите этот элемент, составьте его электронную формулу, укажите формулу, характер и название высшего оксида.
Атом элемента имеет на шесть электронов больше, чем ион магния?
Атом элемента имеет на шесть электронов больше, чем ион магния.
Назовите элемент, составьте электронную формулу его атома и иона.
Какая частица имеет одинаковое число протонов и электронов?
Какая частица имеет одинаковое число протонов и электронов?
Чем отличается атом магния от иона магния?
Чем отличается атом магния от иона магния.
Выберите пары химических элементов между атомами которые образуется ионная химическая связь натрий и магний магний и фтор фосфор и водород калий и кислород?
Выберите пары химических элементов между атомами которые образуется ионная химическая связь натрий и магний магний и фтор фосфор и водород калий и кислород.
Какое число протонов, нейтронов и электронов содержит атом магния?
Какое число протонов, нейтронов и электронов содержит атом магния?
Число электронов больше числа протонов?
Число электронов больше числа протонов.
Что эта за частица : атом, положительный ион или отрицательный ион.
Электронная конфигурация 1s22s22p6 отвечает 1) атому фтора 2) оксид–иону 3) атому натрия 4) сульфид–иону Объясните что значит оксид–ион, сульфид–ион?
Электронная конфигурация 1s22s22p6 отвечает 1) атому фтора 2) оксид–иону 3) атому натрия 4) сульфид–иону Объясните что значит оксид–ион, сульфид–ион.
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Всякое вещество – от самого простого до самого сложного
– имеет три различные, но взаимосвязанные стороны:
свойство, состав, строение … Прогресс науки не останавливается на открытии материальных носителей
свойств; он идёт дальше, к выяснению природы и структуры
найденных носителей, их строения.
Выполнил: учитель химии – биологии Алиев Сагынган Кабирович МБОУ «Фоминская СОШ» Называевского муниципального района Омской области
Число протонов в ядре атома указывает … элемента и записывается в виде нижнего левого индекса у символа элемента. Например, для углерода число протонов у символа элемента можно записать следующим образом:… С.
Верхний индекс у символа элемента указывает суммарное число протонов и нейтронов в ядре атома и называется … Символ углерода, каждый атом которого содержит 6 протонов и 8 нейтронов в ядре, обозначается как … С.
Укажите число протонов, нейтронов и электронов для атомов представленных ниже изотопов:
протонов нейтронов электронов
6. Какое число электронов у иона хрома Cr 3+ ;
7. Какая частица имеет большое число протонов, чем электронов:
8. Даны простые вещества: сажа, озон, графит, карбин, кислород, алмаз, красный
фосфор. Сколько всего химических элементов входит в состав этих веществ:
9. Массовое число изотопа равно:
числу протонов в ядре;
числу нейтронов в ядре;
числу орбитальных электронов;
суммарному числу нейтронов и протонов.
10. Атом элемента имеет порядковый номер 13 и массовое число 27.
11. Октет электронов на внешней электронной оболочке имеет:
12. Электронную конфигурацию благородного газа имеет:
13. Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом ядра, равным:
16. На 3 d – подуровне максимально может находиться:
17. Атом какого элемента имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 :
18. Электронная конфигурация иона Zn 2+ соответствует формуле :
2) 1s 2 2s 2 2p 6 3s 2 3p 6 ;
3) 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 ;
20. Сколько неспаренных электронов имеет ион Со 3+ :
Какие из перечисленных обозначений орбиталей не верны:
Распределение электронов по энергетическим уровням и подуровням у элемента с порядковым номером 79 изображается так: …
Атом какого элемента в невозбужденном состоянии имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ;
Какая из частиц имеет электронную конфигурацию, одинаковую с атомом аргона:
5. На основании анализа электронных конфигураций основного состояния
размеров этих частиц в ряду…
6. Атомом каких элементов соответствуют представленные ниже электронные
Электронная конфигурация Элемент
1s 2 2s 2 2p 6 3s 1 …
7. В каком из приведенных рядов частицы расположены в порядке возрастания их
8. На основании положения элементов в периодической системе сделайте вывод,
какой ион имеет наименьший радиус:
9. Запишите конфигурации внешних электронных слоев для следующих ионов:
Ион Электронная Ион Электронная
10. Какой ион имеет наибольший радиус? Дайте ответ на основании положения
соответствующих элементов в периодической системе:
12. Какой из ионов имеет минимальный радиус:
14. Напишите электронные конфигурации марганца в степенях окисления,
указанных ниже, и формулы оксидов, в которых марганец проявляет эти
степень окисления электронная Оксид
15. Энергия, которая указана в уравнении
является для атома хлора
1) энергией химической связи;
2) энергией ионизации;
4) сродством к электрону.
16. Сродством к электрону называют:
1) энергию, необходимую для отрыва электрона от невозбужденного атома;
2) способность атома данного элемента к оттягиванию на себя электронной
3) переход электрона на более высокий энергетический уровень;
4) выделение энергии при присоединении электрона к атому или иону.
17. Какой из элементов имеет наибольшее значение энергии ионизации:
18. Энергия, затрачиваемая на удаление одного электрона от атома элемента в газообразном состоянии, у магния
меньше, чем у натрия и больше, чем у алюминия;
больше, чем у натрия и меньше, чем у алюминия;
меньше, чем у натрия и алюминия;
больше, чем у натрия и алюминия.
19. Исходя из анализа электронных структур атомов и положения элементов в
периодической системе укажите, какой из каждых двух приведенных ниже
атомов имеет большее сродство к электрону:
20. Химические элементы расположены в порядке возрастания
электроотрицательности в ряду;
Ключ к тестовому заданию- 1 на тему: «Строение атома и структура вещества –1»
1. Протон (р), электрон (е – ) и нейтрон ( n ).
10. 3). Элемент 27 Al 3 валентных электрона, расположен в 3 группе
11. 3). Ион О 2- имеет полностью заполненный внешний электронный
12. 1). Ион Те 2- имеет электронную конфигурацию ксенона.
15. 3). р-Подуровень может иметь максимально 6 электронов.
17. 1). Такую электронную конфигурацию имеет атом калия, находящийся в
основном, невозбуждённом состоянии.
19. 3). У всех трёх частиц число электронов- 10е.
4. 2). В подгруппе с увеличением порядкового номера элемента металлическис
5. 3). Элементы Р и As расположены в одной подгруппе.
6. 2). Элемент Ra расположен в одной подгруппе с барием.
7. 3). Лантан расположен в 3 группе периодической системы элементов; электронная
формула [ Xe 5 d 1 6 s 2 ;наиболее типичная степень окисления +3. Это же характерно
8. 2). Фотоэффект – явление, связанное с освобождением электронов твердого тела под
действием электромагнитного излучения, в частности испусканием электронов
под действием света.
14. 3). Элементы фтор и хлор занимают положение в начале VII группы периодической
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс профессиональной переподготовки
Методическая работа в онлайн-образовании
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-422886
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
В Якутии проведут первую в РФ федеральную олимпиаду по родным языкам
Время чтения: 1 минута
Минпросвещения намерено расширить программу ускоренного обучения рабочим профессиям
Время чтения: 2 минуты
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Международный конгресс-выставка «Молодые профессионалы» пройдет с 12 по 14 декабря в Москве
Время чтения: 1 минута
Госдума приняла закон об использовании онлайн-ресурсов в школах
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.

Сложными веществами называются такие вещества, которые путем химических реакций могут быть разложены на другие, более простые вещества. В отличие от сложных простыми веществами называются такие, которые химическим путем не могут быть разложены на еще более простые вещества.
Примером сложного вещества может служить вода, которая путем химической реакции может быть разложена на два других, более простых вещества — водород и кислород. Что же касается последних двух, то они химическим путем уже не могут быть разложены на более простые вещества, а поэтому являются простыми веществами, или, иначе, химическими элементами.
Изучая свойства химических элементов, Д. И. Менделеев подметил, что свойства их периодически повторяются в зависимости от их атомного веса. Эту периодичность он отобразил в форме таблицы, вошедшей в науку под названием «Периодическая система элементов Менделеева».
Ниже приведена современная периодическая таблица химических элементов Менделеева.
Согласно современным представлениям науки каждый химический элемент состоит из совокупности мельчайших материальных (вещественных) частиц, называемых атомами.
Атомом называется самая малая доля химического элемента, которая уже не может быть разложена химическим путем на другие, более мелкие и простые материальные частицы.
Атомы различных по своей природе химических элементов отличаются друг от друга своими физико-химическими свойствами, структурой, размерами, массой, атомным весом, собственной энергией и некоторыми иными свойствами. Например, атом водорода резко отличается по своим свойствам и структуре от атома кислорода, а последний — от атома урана и т. д.
За условную единицу измерения атомных весов химических элементов принята 1/16 часть веса атома кислорода, В соответствии с этим атомным весом химического элемента называют отвлеченное число, показывающее, во сколько раз вес данного химического элемента больше 1/16 части веса атома кислорода.
В периодической таблице элементов Д. И. Менделеева приведены атомные веса всех химических элементов (см. число, помещенное под названием элемента). Из этой таблицы мы видим, что наиболее легким атомом является атом водорода, имеющий атомный вес 1,008. Атомный вес углерода равен 12, кислорода — 16 и т. д.
Что же касается более тяжелых химических элементов, то их атомный вес превышает атомный вес водорода более чем в двести раз. Так, атомный вер ртути равен 200,6, радия — 226 и т.д.Чем выше порядок номера, занимаемого химическим элементом в периодической системе элементов, тем больше атомный вес.
Большая часть атомных весов химических элементов выражается дробными числами. Это в известной мере объясняется тем, что такие химические элементы состоят из совокупности скольких сортов атомов, обладающих различными атом весами, но одинаковыми химическими свойствами.
Химические элементы, занимающие один вый номер в периодической системе элементов, а следовательно, обладающие одинаковыми химическими свойствами, но различными атомными весами, называются изотопами.
Элементарные частицы вещества
Долгое время считалось, что атомы химических элем являются пределом делимости вещества, т. е. как бы элементарными «кирпичиками» мироздания. Современная наука отвергла эту гипотезу, установив, что атом любого химического эле представляет собой совокупность еще более мелких материальных частиц, чем сам атом.
Чтобы понять строение атомов и физико-химические процессы в них, необходимо хотя бы вкратце ознакомиться с основными характеристиками элементарных частиц, входящих в состав атомов.
Исключительно малая «масса покоя» электрона свидетельствует о том, что инертные свойства электрона проявляются исключительно слабо, а это значит, что электрон под влиянием переменной электрической силы может колебаться в пространстве с частотой во много миллиардов периодов в секунду.
Масса электрона настолько мала, что для получения одного грамма электронов их потребовалось бы взять 1027 единиц. Чтобы иметь хотя бы некоторое физическое представление об этом колоссально большом числе, приведем такой пример. Если бы можно было один грамм электронов расположить на прямой линии вплотную друг к другу, то они образовали бы цепочку длиной в четыре миллиарда километров.
Масса электрона, как и всякой иной вещественной микрочастицы, зависит от скорости его движения. Электрон, находясь в состоянии относительного покоя, обладает «массой покоя», имеющей механическую природу, как и масса всякого физического тела. Что же касается «массы движения» электрона, увеличивающейся с ростом скорости его движения, то она электромагнитного происхождения. Она обусловлена наличием у движущегося электрона электромагнитного поля как некоторого вида материи, обладающего массой и электромагнитной энергией.
Чем быстрее движется электрон, тем больше проявляются инерционные свойства его электромагнитного поля, тем, следовательно, больше масса последнего и соответственно электромагнитная энергия его. Так как электрон со своим электромагнитным полем составляет единую, органически связанную материальную систему, то естественно, что массу движения электромагнитного поля электрона можно непосредственно приписать самому электрону.
Электрон, помимо свойств частицы, обладает и волновыми свойствами. Опытом установлено, что поток электронов, подобно световому потоку, распространяется в форме волнообразного движения. Характер волнового движения электронного потока в пространстве подтверждается явлениями интерференции и дифракции электронных волн.
Интерференция электронов — это явление наложения электронных воли друг на друга, а дифракция электронов — это явление огибания электронными волнами краев узкой щели, сквозь которую проходит электронный поток. Следовательно, электрон — это не просто частица, а «частица-волна», длина которой зависит от массы и скорости движения электрона.
Установлено, что электрон, помимо своего поступательного движения, совершает еще и вращательное движение вокруг своей оси. Этот вид движения электрона получил название «спина» (от английского слова «спин» — веретено). В результате такого движения электрон, кроме электрических свойств, обусловленных электрическим зарядом, приобретает еще и магнитные свойства, напоминая в этом отношении элементарный магнитик.
Протон — это вещественная частица, обладающая положительным электрическим зарядом, равным по абсолютной величине электрическому заряду электрона.
В отличие от электрона и протона, нейтрон не обладает электрическим зарядом, т. е. он является электронейтральной «элементарной» частицей вещества. Масса нейтрона практически равна массе протона.
Электроны, протоны и нейтроны, находясь в составе атомов, взаимодействуют друг с другом. В частности, электроны и протоны взаимно притягиваются друг к другу как частицы, обладающие разноименными электрическими зарядами. Одновременно с этим электрон от электрона и протон от протона отталкиваются как частицы, обладающие одноименными электрическими зарядами.
Взаимодействие всех этих электрически заряженных частиц происходит через их электрические поля. Эти поля представляют собой особый вид материи, состоящей из совокупности элементарных материальных частиц, называемых фотонами. Каждый фотон обладает строго определенным присущим ему количеством энергии (квантом энергии).
Ядерные силы значительно превосходят по своей величине электрические силы взаимного отталкивания протонов в ядре атома. Это приводит к тому, что они в состоянии не только преодолеть внутри ядер атомов силы взаимного отталкивания протонов, но и создать из совокупности протонов и нейтронов весьма прочные системы ядер.
Устойчивость ядра каждого атома зависит от соотношения двух противоречивых сил — ядерных (взаимное притяжение протонов и нейтронов) и электрических (взаимное отталкивание протонов).
Мощные ядерные силы, действующие в ядрах атомов, способствуют превращению нейтронов и протонов друг в друга. Эти взаимопревращения нейтронов и протонов осуществляются в результате выделения или поглощения ими более легких элементарных частиц, например мезонов.
Рассмотренные нами частицы названы элементарными потому, что они не состоят из совокупности других, более простых частиц материи. Но в то же время не надо забывать, что они способны превращаться друг в друга, возникать за счет друг друга. Таким образом, эти частицы являются некоторыми сложными образованиями, т. е. их элементарность условна.
Химическое строение атомов
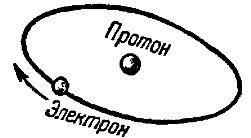
Простейшим по своему устройству атомом является атом водорода. Он состоит из совокупности только двух элементарных частиц — протона и электрона. Протон в системе атома водорода играет роль центрального ядра, вокруг которого по некоторой орбите вращается электрон. На рис. 1 схематически показана модель атома водорода.
Рис. 1. Схема строения атома водорода
Эта модель — только грубое приближение к действительности. Дело в том, что электрон как «частица-волна» не обладает резко отграниченным от внешней среды объемом. А это значит, что следует говорить не о некоторой точной линейной орбите электрона, а о своеобразном электронном облачке. При этом электрон чаще всего занимает некоторую среднюю линию облачке, являющуюся одной из возможных орбит его в атоме.
Надо сказать, что и сама орбита электрона не является строга неизменной и неподвижной в атоме — она тоже в силу изменения массы электрона совершает некоторое вращательное движение. Следовательно, движение электрона в атоме носит относительно сложный характер. Так как ядро атома водорода (протон) и вращающийся вокруг него электрон обладают разноименными электрическими зарядами, то они взаимно притягиваются.
Одновременно с этим стой энергии электрон, вращаясь вокруг ядра атома, развивает центробежную силу, стремящуюся удалить его от ядра. Следовательно, электрическая сила взаимного притяжения ядра атома и электрона и центробежная сила, действующая на электрон, — силы противоречивые.
При равновесии их электрон занимает относительно устойчивое положение на некоторой орбите в атоме. Так как масса электрона очень мала, то для уравновешивания силы притяжения к ядру атома он должен вращаться с громадной скоростью, равной примерно 6 · 10 15 оборотам в секунду. Это значит, что электрон в системе атома водорода, как и всяком ином атоме, движется по своей орбите с линейной скоростью, превышающей тысячу километров в секунду.
В нормальных условиях электрон вращается в атоме рода по наиболее близко расположенной к ядру орбите. При этом он обладает минимальным возможным количеством энергии. Если же по тем или иным причинам, например под воздействием каких-либо иных материальных частиц, вторгнувшихся систему атома, электрон перейдет на более удаленную от атома орбиту, то он уже будет обладать несколько большим количеством энергии.
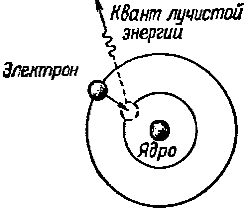
Однако на этой новой орбите электрон но пребывает ничтожно малое время, после чего он снова вращается на ближайшую к ядру атома орбиту. При этом ходе он отдает излишек своей энергии в виде кванта эле магнитного излучения — лучистой энергии (рис. 2).
Рис. 2. Электрон при переходе с далекой орбиты на более близкую к ядру атома излучает квант лучистой энергии
Чем больше получает извне энергии электрон, тем на удаленную от ядра атома орбиту он переходит и тем большее количество электромагнитной энергии он излучает, когда вращается на ближайшую к ядру орбиту.
Измеряя количество энергии, излучаемой электроном при переходе с различных орбит на ближайшую к ядру атома, удалось установить, что электрон в системе атома водорода, как и в системе любого иного атома, может переходить не на любую произвольную орбиту, на строго определенную в соответствии с той энергией, которую он получает под действием внешней силы. Орбиты, которые может занимать электрон в атоме, называются дозволенными орбитами.
Так как положительный заряд ядра атома водорода (заряд протона) и отрицательный заряд электрона численно равны, то суммарный их заряд равен нулю. Это значит, что атом водорода, находясь в нормальном состоянии, является электронейтральной частицей.
Это справедливо для атомов всех химических элементов: атом любого химического элемента, находящийся в нормальном со стоянии, является электронейтральной частицей из-за численного равенства его положи тельных и отрицательных зарядов.
Поскольку в состав ядра атома водорода входит только одна «элементарная» частица — протон, то так называемое массовое число этого ядра равно единице. Массовым числом ядра атома любого химического элемента называется общее число протонов и нейтронов входящих в состав этого ядра.
Природный водород в основном состоит из совокупности атомов с массовым числом, равным единице. Однако в составе его имеется и другой сорт атомов водорода, с массовым числом равным двум. Ядра атомов этого тяжелого водорода называемые дейтонами, состоят из двух частиц — протона и нейтрона. Этот изотоп водорода называется дейтерием.
В природном водороде дейтерия содержится весьма незначительное количество. На каждые шесть тысяч атомов легкого водорода (массовое число равно единице) приходится только один атом дейтерия (тяжелого водорода). Существует еще один изотоп водорода — сверхтяжелый водород получивший название тритий. В ядрах атома этого изотопе водорода имеются три частицы: протон и два нейтрона, связанных друг с другом ядерными силами. Массовое число ядра атома трития равно трем, т. е. атом трития в три раза тяжелей атома легкого водорода.
Хотя атомы изотопов водорода и имеют различные массы но все же они обладают одинаковыми химическими свойствами, Например, легкий водород, вступая в химическое взаимодействие с кислородом, образует с ним сложное вещество — воду. Аналогично этому изотоп водорода — дейтерий, соединяясь с кислородом, образует воду, которая в отличие от обычной воды называется тяжелой водой. Тяжелая вода находит большое применение в процессе производства ядерной (атомной) энергии.
Следовательно, химические свойства атомов зависят не от массы их ядер, а только от строения электронной оболочки атома. Поскольку в атомах легкого водорода, дейтерия и трития имеется одинаковое количество электронов (по одному на каждый атом), эти изотопы имеют одинаковые химические свойства.
Химический элемент водород не случайно занимает первый номер в периодической системе элементов. Дело в том, что между номером любого элемента в периодической системе элементов и величиной заряда ядра атома этого элемента существует некоторая связь. Ее можно сформулировать так: порядковый номер всякого химического элемента в периодической системе элементов численно равен положительному заряду ядра этого элемента, а следовательно, и числу вращающихся вокруг него электронов.
Так как водород занимает первый номер в периодической системе элементов, то это значит, что положительный заряд ядра его атома равен единице и что вокруг ядра вращается один электрон.
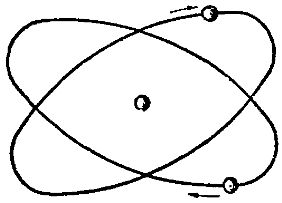
Химический элемент гелий занимает второй номер в периодической системе элементов. Это значит, что он имеет положительный электрический заряд ядра, равный двум единицам, т. е. в составе его ядра должно быть два протона, а в электронной оболочке атома — два электрода.
Природный гелий состоит из двух изотопов — тяжелого и легкого гелия. Массовое число тяжелого гелия равно четырем. Это значит, что в состав ядра атома тяжелого гелия, помимо вышеупомянутых двух протонов, должны входить еще два нейтрона. Что же касается легкого гелия, то его массовое число равно трем, т. е. в состав его ядра, помимо двух протонов, должен входить еще один нейтрон.
Установлено, что в природном гелии число атомов легкого гелия составляет примерно одну миллионную долю атомов тяжелого гения. На рис. 3 показана схематически модель атома гелия.
Рис. 3. Схема строения атома гелия
Дальнейшее усложнение строения атомов химических элементов идет за счет увеличения количества протонов и нейтронов в ядрах этих атомов и одновременно за счет увеличения количества электронов, вращающихся вокруг ядер (рис. 4). Пользуясь периодической системой элементов, легко определить число электронов, протонов и нейтронов входящих в состав различных атомов.
Порядковый номер химического элемента равен числу протонов, находящихся в ядре атома, а одновременно с этим числу электронов, вращающихся вокруг ядра. Что же касается атомного веса, то он приближенно равен массовому числу атома, т. е. числу вместе взятых протонов и нейтронов в ядре. Следовательно, вычитая из атомного веса элемента число, равное порядковому номеру элемента, можно определить, какое количество нейтронов содержится в данном ядре.
Установлено, что ядра легких химических элементов, имеющих в своем составе поровну протонов и нейтронов, отличаются весьма большой прочностью, так как ядерные силы в них относительно велики. Например, ядро атома тяжелого гелия отличается исключительно большой прочностью, так как оно составлено из двух протонов и двух нейтронов, связанных друг с другом мощными ядерными силами.
Ядра атомов более тяжелых химических элементов содержат в своем составе уже неодинаковое количество протонов и нейтронов, поэтому их связь в ядре слабее, чем в ядрах легких химических элементов. Ядра этих элементов могут быть относительно легко расщеплены при бомбардировке их атомными «снарядами» (нейтронами, ядрами атома гелия и т. д.).
Что же касается наиболее тяжелых химических элементов, в частности радиоактивных, то их ядра отличаются настолько малой прочностью, что они самопроизвольно распадаются на составные части. К примеру, атомы радиоактивного элемента радия, состоящего из совокупности 88 протонов и 138 нейтронов, самопроизвольно распадаются, превращаясь в атомы радиоактивного элемента радона. Атомы же последнего в свою очередь распадаются на составные части, переходя в атомы других элементов.
Ознакомившись вкратце с составными частями ядер атомов химических элементов, рассмотрим строение электронных оболочек атомов. Как известно, электроны могут вращаться вокруг ядер атомов только по строго определенным орбитам. При этом они так сгруппированы в электронной оболочке каждого атома, что можно различить отдельные слои электронов.
В каждом слое может находиться количество электронов, не превышающее строго определенного числа. Так, например, в первом, ближайшем к ядру атома электронном слое может находиться максимум два электрона, во втором — не более восьми электронов и т. д.
Те атомы, у которых внешние электронные слои целиком заполнены, имеют наиболее устойчивую электронную оболочку. Это значит, что данный атом прочно держит все свои электроны и не нуждается в получении извне добавочного количества их. Например, атом гелия имеет два электрона, целиком заполняющих первый электронный слой, а атом неона имеет десять электронов, из которых первые два целиком заполняют первый электронный слой, а остальные — второй (рис. 5).
Рис. 5. Схема строения атома неона
Следовательно, атомы гелия и неона имеют вполне устойчивые электронные оболочки, не стремятся их как-нибудь видоизменить количественно. Такие элементы химически инертны, т. е. не вступают в химическое взаимодействие с другими элементами.
Или, например, атом кислорода имеет восемь электронов, из которых два целиком заполняют первый слой, а остальные шесть размещены во втором слое. Таким образом, для полного завершения построения второго электронного слоя в атоме кислорода ему не хватает только двух электронов. Поэтому атом кислорода не только прочно удерживает свои шесть электронов во втором слое, но и обладает возможностью притянуть к себе два недостающих ему электрона для заполнения своего второго электронного слоя. Этого он достигает путем химического соединения с атомами таких элементов, у которых внешние электроны слабо связаны со своими ядрами.
Химические элементы, атомы которых не имеют целиком заполненных электронами внешних электронных слоев, как правило, химически активны, т. е. охотно вступают в химическое взаимодействие.
Итак, электроны в атомах химических элементов располагаются в строго определенном порядке и всякое изменение их пространственного расположения или количества в электронной оболочке атома приводит к изменению физико-химических свойств последнего.
Равенство числа электронов и протонов в системе атома является причиной того, что суммарный электрический заряд его равен нулю. Если равенство числа электронов и протонов в системе атома нарушается, то атом становится электрически заряженной системой.
Атом, в системе которого нарушено равновесие разноименных электрических зарядов вследствие того, что он потерял часть своих электронов или, наоборот, приобрел лишнее количество их, называется ионом.
Способность разноименных ионов взаимно притягиваться друг к другу является причиной того, что они химически соединяются, образуя более сложные частицы вещества — молекулы.
В заключение следует отметить, что размеры атома очень велики по сравнению с размерами тех вещественных частиц, из которых они состоят. Ядро самого сложного атома вместе со всеми электронами занимает миллиардную долю объема атома. Простой подсчет показывает, что если бы удалось один кубический метр платины сжать так крепко, чтобы исчезли внутриатомные и междуатомные пространства, то получился бы объем, равный примерно одному кубическому миллиметру.
Если Вам понравилась эта статья, поделитесь ссылкой на неё в социальных сетях. Это сильно поможет развитию нашего сайта!
Подписывайтесь на наш канал в Telegram!
Просто пройдите по ссылке и подключитесь к каналу.
Не пропустите обновления, подпишитесь на наши соцсети: