Какова химическая природа ферментов в чем состоят специфические особенности
Какова химическая природа ферментов в чем состоят специфические особенности
Подробное решение параграф § 21 по биологии для учащихся 10 класса, авторов Каменский А.А., Криксунов Е.А., Пасечник В.В. 2014
1. Как называются две составные части обмена веществ?
Ответ. Две составные части обмена веществ:
• Пластический (анаболизм, ассимиляция)
• Энергетический (катаболизм, диссимиляция).
2. Что такое метаболизм?
Ответ. Метаболи́зм (от греч. — «превращение, изменение»), или обмен веществ — набор химических реакций, которые возникают в живом организме для поддержания жизни. Эти процессы позволяют организмам расти и размножаться, сохранять свои структуры и отвечать на воздействия окружающей среды.
3. Что такое биологический катализатор?
Биологические катализаторы называют ферментами.
4. Что такое ферменты? Какую функцию они выполняют?
Ответ. Ферменты — белки, являющиеся биологическими катализаторами. Ферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты) Ферменты выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах — ими катализируется около 4000 биологических реакций. Ферменты играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма.
Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Отличительной особенностью ферментов по сравнению с небелковыми катализаторами является их высокая специфичность.
Вопросы после §21
1. Что называют гомеостазом?
Ответ. В любой живой клетке постоянно происходят сложнейшие химические и физические реакции, необходимые для того, чтобы обеспечить постоянство условий внутренней среды как в самой клетке, так и в многоклеточном организме, находящемся под воздействием постоянно меняющихся внешних факторов. Постоянство внутренней среды биологических систем получило название гомеостаза. Если гомеостаз нарушается, это ведёт к тому, что клетки и организм в целом повреждаются или даже могут погибнуть. Все реакции, протекающие в клетке, направлены на поддержание гомеостаза.
2. Как связаны между собой пластический и энергетический обмены?
Ответ. Ассимиляция (пластический обмен) и диссимиляция (энергетический обмен) – противоположные процессы: в первом случае происходит образование веществ, на что тратится энергия, а во втором – распад веществ с выделением и запасанием энергии. Эти процессы невозможны друг без друга, так как если не синтезировать и не запасать органические вещества, то и распадаться будет нечему. А если прекратятся реакции распада, то не будет синтезироваться АТФ, что приведёт к невозможности синтеза веществ из-за нехватки энергии. Таким образом, реакции ассимиляции и диссимиляции – это две стороны единого процесса обмена веществ и энергии в клетке, который называется метаболизмом. Ассимиляция и диссимиляция всегда строго сбалансированы и скоординированы, а нарушение этого баланса всегда приводит к развитию какого-либо заболевания как отдельных клеток, так и целого организма или даже их гибели
3. Какое значение имеют ферменты в метаболизме?
Ответ. Реакции метаболизма в живой клетке протекают при умеренных температурах, нормальном давлении и малых колебаниях кислотности. Вне живых организмов при таких условиях все химические реакции ассимиляции и диссимиляции или вообще не могли бы протекать, или протекали бы медленно. Однако в живых организмах эти реакции проходят очень быстро. Это обусловливается участием в них ферментов.
Так как активность ферментов очень высока, то для обеспечения нормальной скорости метаболических процессов требуется очень малое количество молекул ферментов. Но поскольку ферменты действуют избирательно, клетке необходимо очень много видов ферментов. Например, фермент амилаза катализирует распад в ротовой полости крахмала: без этого фермента реакция не идёт. Фермент уреаза катализирует расщепление мочевины до аммиака и угольной кислоты, но не действует на другие родственные мочевине соединения
4. Какова химическая природа ферментов? В чём состоят специфические особенности их функционирования?
Ответ. Ферменты — сложные органические вещества, которые образуются в живой клетке и играют важную роль катализатора всех процессов, происходящих в организме. Большинство из них состоит из двух компонентов: белкового (апофермент) и небелкового (кофермент). В активную часть входят: железо, марганец, кальций, медь, цинк, а также некоторые витамины. Кофермент становится активным тогда, когда соединяется с апоферментом.
Будучи белковыми веществами, ферменты при нагревании до 54 oС необратимо коагулируют (сворачиваются) и теряют свои каталитические действия. Также они легко разрушаются под действием кислорода и света. Все процессы обмена веществ: белковый, углеводный, жировой, витаминный, минеральный — протекают при содействии ферментов. При нормальном атмосферном давлении и температуре 37 oС в живом организме эти процессы протекают быстро, сберегая большое количество энергии.
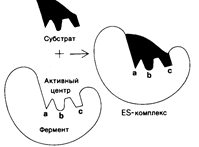
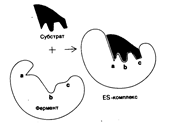
Форма и химическое строение активного центра фермента должны быть таковы, чтобы с ним могло связаться только определённое соединение, которое называется субстратом данного фермента. Например, активный центр фермента лизоцима, содержащегося в слюне, слезах, слизистых верхних дыхательных путей, имеет вид щели, которая по форме и размеру точно соответствует фрагменту муреина – полисахарида оболочки бактерий. Таким образом, лизоцим играет роль одного из защитных барьеров нашего организма, разрушая муреиновую клеточную стенку бактерий и убивая их.
Установлено, что существует связь между ферментами, гормонами и витаминами. Известно, что авитаминозы и болезни, вызванные неправильной внутренней секрецией, объясняются нарушением обменных процессов организма.
С сырой пищей 60—80% ферментов достигают тонких кишок без изменений.
Витамин Е, которым насыщена свежая растительная пища, играет роль защитного фактора ферментов.
Химическая природа ферментов.



По химической природе ферменты являются белками и подразделяются на простые и сложные. Простые ферменты при гидролизе расщепляются до аминокислот. Примеры простых ферментов: трипсин, уреаза, рибонуклеаза.
Кофакторы в процессе катализа выполняют следующие функции:
— изменяют трехмерную структуру фермента или субстрата для улучшения взаимодействия между ними;
— многие из них служат основой для формирования активного центра фермента;
— участвуют в процессе переноса протонов, электронов, атомов и атомных групп;
— могут выступать в реакции в роли дополнительного субстрата.
Изоферменты, их строение и биологическая роль.
Одним из наиболее изученных олигомерных ферментов является лактатдегидрогеназа (ЛДГ), представляющий собой тетрамер (т.е. состоящий из 4-х субъединиц). ЛДГ катализирует обратимое превращение пировиноградной кислоты в молочную.
ЛДГ существует в виде 5 изоферментов, которые образуются в результате различного сочетания субъединиц 2-х типов: H (сердечного) и М (мышечного):
Рис 5.1. Изоферментный спектр лактатдегидрогеназы в различных органах.
Для каждого органа, ткани, биологической жидкости характерен свой изоферментный спектр (рис 5.1), т.е. определенное содержание и соотношение изоферментов, что связано с направленностью обмена веществ в этих органах и тканях.
Активный и аллостерический центры, их роль в процессе ферментативного катализа.
На активный центр приходится относительно малая доля общего объема фермента, большая часть аминокислотных остатков в молекуле фермента не контактирует с субстратом. Активный центр представляет собой трехмерное образование, пространственная структура его стереохимически комплементарна субстрату (рис. 5.2), предопределяя природу химических превращений. Активный центр фермента специфически связывается с субстратом, что обусловлено строго определенным расположением аминокислотных остатков и их функциональных групп, называемых каталитическими.
Активные центры некоторых ферментов представляет собой нежесткую структуру, а форма его становится комплементарной форме субстрата только после связывания этого субстрата (рис. 5.3). Этот процесс называется «индукцией соответствия».
Помимо активного центра в молекуле многих ферментов присутствует также аллостерический центр. Это пространственно удаленный от активного центра участок молекулы, с которым связываются определенные химические вещества, называемые аллостерическими эффекторами. Они могут быть положительными или отрицательными. Присоединение эффектора к аллостерическому центру приводит к изменению пространственной структуры фермента, в том числе и активного центра, что отражается на каталитической активности фермента.
Какова химическая природа ферментов? В чём состоят специфические особенности их функционирования?
Обсуждение вопроса:
Ферменты — сложные органические вещества, которые образуются в живой клетке и играют важную роль катализатора всех процессов, происходящих в организме. Большинство из них состоит из двух компонентов: белкового (апофермент) и небелкового (кофермент). В активную часть входят: железо, марганец, кальций, медь, цинк, а также некоторые витамины. Кофермент становится активным тогда, когда соединяется с апоферментом.
Будучи белковыми веществами, ферменты при нагревании до 54 oС необратимо коагулируют (сворачиваются) и теряют свои каталитические действия. Также они легко разрушаются под действием кислорода и света. Все процессы обмена веществ: белковый, углеводный, жировой, витаминный, минеральный — протекают при содействии ферментов. При нормальном атмосферном давлении и температуре 37 oС в живом организме эти процессы протекают быстро, сберегая большое количество энергии.
Форма и химическое строение активного центра фермента должны быть таковы, чтобы с ним могло связаться только определённое соединение, которое называется субстратом данного фермента. Например, активный центр фермента лизоцима, содержащегося в слюне, слезах, слизистых верхних дыхательных путей, имеет вид щели, которая по форме и размеру точно соответствует фрагменту муреина – полисахарида оболочки бактерий. Таким образом, лизоцим играет роль одного из защитных барьеров нашего организма, разрушая муреиновую клеточную стенку бактерий и убивая их.
Установлено, что существует связь между ферментами, гормонами и витаминами. Известно, что авитаминозы и болезни, вызванные неправильной внутренней секрецией, объясняются нарушением обменных процессов организма.
С сырой пищей 60—80% ферментов достигают тонких кишок без изменений.
Витамин Е, которым насыщена свежая растительная пища, играет роль защитного фактора ферментов.
Какова химическая природа ферментов в чем состоят специфические особенности
Химическая природа ферментов
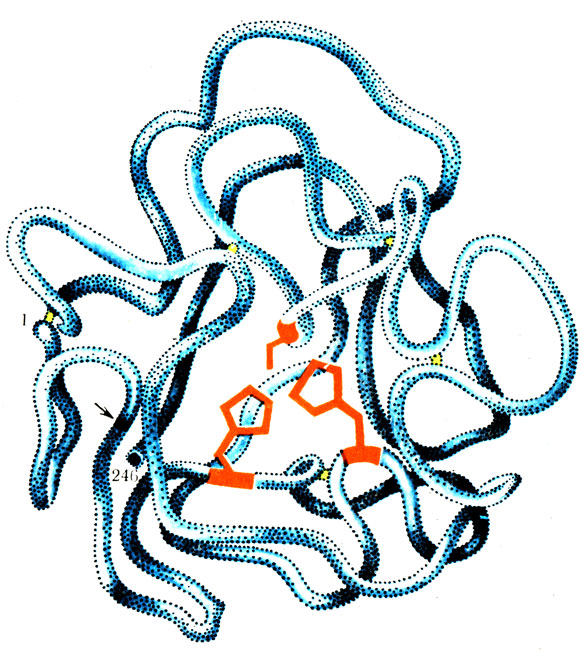
При изучении ферментов было установлено, что все они являются белками и поэтому обладают всеми свойствами белков. Ферменты имеют аналогичную белкам сложную структуру (рис. 39), подвергаются расщеплению под действием протеолитических ферментов, при растворении в воде образуют коллоидные растворы, при кипячении денатурируются и т. д. Молекулярный вес ферментов колеблется в пределах сотен тысяч и миллионов единиц молекулярного веса.
Рис. 39. Гипотетическая модель третичной структуры молекулы химотрипсиногена (по Нейрату). Черное кольцо (обозначено стрелкой) показывает пептидную связь между 15 и 16 аминокислотными остатками. Видны 5 дисульфидных связей (изображены желтым цветом), стягивающим отдельные участки полипептидной цепи% функциональные группы активного центра показаны красным цветом
По структуре все ферменты делятся на простые и сложные.
К ферментам-протеинам относятся, например, гидролитические ферменты желудочно-кишечного тракта, которые расщепляют пищевые продукты с участием воды, к ферментам-протеидам принадлежит большая часть окислительно-восстановительных ферментов.
Ферменты

Этот термин постоянно на слуху, правда, далеко не все понимают, что такое фермент или энзим, какие функции выполняет это вещество, а также чем отличаются ферменты от энзимов и отличаются ли вообще. Все это сейчас и узнаем.
Без этих веществ ни люди, ни животные не смогли бы переваривать пищу. А впервые к применению ферментов в быту человечество прибегло более 5 тысяч лет тому назад, когда наши предки научились хранить молоко в «посуде» из желудков животных. В таких условиях под воздействием сычужного фермента молоко превращалось в сыр. И это только один из примеров работы энзима в качестве катализатора, ускоряющего биологические процессы. Сегодня ферменты незаменимы в промышленности, они важны для производства сахара, маргаринов, йогуртов, пива, кожи, текстиля, спирта и даже бетона. В моющих средствах и стиральных порошках также присутствуют эти полезные вещества – помогают выводить пятна при низких температурах.
История открытия
Энзим в переводе с греческого означает «закваска». А открытию этого вещества человечество обязано голландцу Яну Баптисту Ван-Гельмонту, жившему в XVI веке. В свое время он весьма заинтересовался спиртовым брожением и в ходе исследования нашел неизвестное вещество, ускоряющее этот процесс. Голландец назвал его fermentum, что в переводе означает «брожение». Затем, почти тремя веками позже, француз Луи Пастер, также наблюдая за процессами брожения, пришел к выводу, что ферменты – не что иное, как вещества живой клетки. А через некоторое время немец Эдуард Бухнер добыл фермент из дрожжей и определил, что это вещество не является живым организмом. Он также дал ему свое название – «зимаза». Еще несколькими годами позже другой немец Вилли Кюне предложил все белковые катализаторы разделить на две группы: ферменты и энзимы. Причем вторым термином он предложил называть «закваску», действия которой распространяются вне живых организмов. И лишь 1897 год положил конец всем научным спорам: оба термины (энзим и фермент) решено использовать как абсолютные синонимы.
Структура: цепь из тысяч аминокислот

Каждая аминокислота соединена с другой определенным типом химической связи, а каждый фермент имеет свою уникальную последовательность аминокислот. Для создания большинства из них используются примерно по 20 видов. Даже незначительные изменения последовательности аминокислот могут кардинально менять внешний вид и «таланты» фермента.
Биохимические свойства
Хотя при участии ферментов в природе происходит огромное количество реакций, но все они могут быть разделены на 6 категорий. Соответственно, каждая из этих шести реакций протекает под влиянием определенного типа ферментов.
Реакции при участии энзимов:
Ферменты, участвующие в этих реакциях, называются оксидоредуктазами. В качестве примера можно вспомнить как, алкогольдегидрогеназы преобразуют первичные спирты в альдегид.
Ферменты, благодаря которым происходят эти реакции, называются трансферазами. Они обладают умением перемещать функциональные группы от одной молекулы к другой. Так происходит, например, когда аланинаминотрансферазы перемещают альфа-аминогруппы между аланином и аспартатом. Также трансферазы перемещают фосфатные группы между АТФ и другими соединениями, а из остатков глюкозы создают дисахариды.

Этот вид реакций негидролитическим путем происходит при участии лиазы.
Во многих химических реакциях положение функциональной группы изменяется в пределах молекулы, но сама молекула состоит из того же количества и типов атомов, что были до начала реакции. Иными словами, субстрат и продукт реакции являются изомерами. Такого типа трансформации возможны под влиянием ферментов изомеразы.
Гидролазы разрушают связь, добавляя в молекулу элементы воды. Лиазы осуществляют обратную реакцию, удаляя водную часть из функциональных групп. Таким образом, создают простую связь.
Как работают в организме
Ферменты ускоряют практически все химические реакции, происходящие в клетках. Они имеют жизненно важное значение для человека, облегчают пищеварение и ускоряют метаболизм.
Некоторые из этих веществ помогают разрушать слишком большие молекулы на более мелкие «куски», которые организм сможет переварить. Другие наоборот связывают мелкие молекулы. Но ферменты, говоря научным языком, обладают высокой селективностью. Это значит, что каждое из этих веществ способно ускорять только определенную реакцию. Молекулы, с которыми «работают» ферменты, называются субстратами. Субстраты в свою очередь создают связь с частью фермента, именуемой активным центром.
Существуют два принципа, объясняющие специфику взаимодействия ферментов и субстратов. В так называемой модели «ключ-замок» активный центр фермента занимает в субстрате место строго определенной конфигурации. Согласно другой модели, оба участника реакции, активный центр и субстрат, меняют свои формы, чтобы соединиться.
По какому бы принципу ни происходило взаимодействие результат всегда одинаковый – реакция под воздействием энзима протекает во много раз быстрее. Вследствие такого взаимодействия «рождаются» новые молекулы, которые потом отделяются от фермента. А вещество-катализатор продолжает выполнять свою работу, но уже при участии других частиц.
Гипер- и гипоактивность
Бывают случаи, когда энзимы выполняют свои функции с неправильной интенсивностью. Чрезмерная активность вызывает чрезмерное формирование продукта реакции и дефицит субстрата. В результате – ухудшение самочувствия и серьезные болезни. Причиной гиперактивности энзима может быть как генетическое нарушение, так и избыток витаминов или микроэлементов, используемых в реакции.
Гипоактивность ферментов может даже стать причиной смерти, когда, например, энзимы не выводят из организма токсины либо возникает дефицит АТФ. Причиной такого состояния также могут быть мутированные гены или, наоборот, гиповитаминоз и дефицит других питательных веществ. Кроме того, пониженная температура тела аналогично замедляет функционирование энзимов.
Катализатор и не только

Энзимы – это биологические молекулы, жизненный цикл которых не определяется рамками от рождения и смерти. Они просто работают в организме до тех пор, пока не растворятся. Как правило, это происходит под воздействием других ферментов.
В процессе биохимической реакции они не становятся частью конечного продукта. Когда реакция завершена, фермент покидает субстрат. После этого вещество готово снова приступить к работе, но уже на другой молекуле. И так продолжается столько, сколько необходимо организму.
Уникальность ферментов в том, что каждый из них выполняет только одну, ему отведенную функцию. Биологическая реакция происходит только тогда, когда фермент находит правильный для него субстрат. Это взаимодействие можно сравнить с принципом работы ключа и замка – только правильно подобранные элементы смогут «сработаться». Еще одна особенность: они могут работать при низких температурах и умеренном рН, а в роли катализаторов являются более стабильными, чем любые другие химические вещества.
Ферменты в качестве катализаторов ускоряют процессы метаболизма и другие реакции.
Как правило, эти процессы состоят из определенных этапов, каждый из которых требует работы определенного энзима. Без этого цикл преобразования или ускорения не сможет завершиться.
Пожалуй, из всех функций ферментов наиболее известна – роль катализатора. Это значит, что энзимы комбинируют химические реагенты таким образом, чтобы снизить энергетические затраты, необходимые для более быстрого формирования продукта. Без этих веществ химические реакции протекали бы в сотни раз медленнее. Но на этом способности энзимов не исчерпываются. Все живые организмы содержат энергию, необходимую им для продолжения жизни. Аденозинтрифосфат, или АТФ, это своего рода заряженная батарейка, которая снабжает клетки энергией. Но функционирование АТФ невозможно без ферментов. И главный энзим, производящий АТФ, – синтаза. Для каждой молекулы глюкозы, которая трансформируется в энергию, синтаза производит около 32-34 молекул АТФ.
Помимо этого, энзимы (липаза, амилаза, протеаза) активно применяются в медицине. В частности, служат компонентом ферментативных препаратов, таких как «Фестал», «Мезим», «Панзинорм», «Панкреатин», применяемых для лечения несварения желудка. Но некоторые энзимы способны также влиять на кровеносную систему (растворяют тромбы), ускорять заживление гнойных ран. И даже в противораковой терапии также прибегают к помощи ферментов.
Факторы, определяющие активность энзимов
Поскольку энзим способен ускорять реакции во много раз, его активность определяется так называемым числом оборотов. Этот термин обозначает количество молекул субстрата (реагирующего вещества), которую способна трансформировать 1 молекула фермента за 1 минуту. Однако существует ряд факторов, определяющих скорость реакции:

Обычно повышение температуры ведет к ускорению реакций. Это правило работает для большинства ферментативных реакций, но только до тех пор, пока температура не поднимется выше 40 градусов по Цельсию. После этой отметки скорость реакции, наоборот, начинает резко снижаться. Если температура опустится ниже критической отметки, скорость ферментативных реакций повысится снова. Если температура продолжает расти, ковалентные связи рушатся, а каталитическая активность фермента теряется навсегда.
На скорость ферментативных реакций также влияет показатель рН. Для каждого фермента существует свой оптимальный уровень кислотности, при котором реакция проходит наиболее адекватно. Изменение уровня рН сказывается на активности фермента, а значит, и скорости реакции. Если изменения слишком велики, субстрат теряет способность связываться с активным ядром, а энзим больше не может катализировать реакцию. С восстановлением необходимого уровня рН, активность фермента также восстанавливается.
Ферменты для пищеварения
Ферменты, присутствующие в человеческом организме, можно разделить на 2 группы:
Метаболические «работают» над нейтрализацией токсических веществ, а также способствуют выработке энергии и белков. Ну и, конечно, ускоряют биохимические процессы в организме.
За что отвечают пищеварительные – понятно из названия. Но и здесь срабатывает принцип селективности: определенный тип ферментов влияет только на один вид пищи. Поэтому для улучшения пищеварения можно прибегнуть к маленькой хитрости. Если организм плохо переваривает что-то из еды, значит надо дополнить рацион продуктом, содержащим фермент, который способен расщепить трудно перевариваемую пищу.
Пищевые ферменты – катализаторы, которые расщепляют продукты питания до состояния, в котором организм способен поглощать из них полезные вещества. Пищеварительные энзимы бывают нескольких типов. В человеческом организме разные виды ферментов содержатся на разных участках пищеварительного тракта.
Ротовая полость

Желудок
Здесь пепсин расщепляет белки до состояния пептидов, а желатиназа – желатин и коллаген, содержащиеся в мясе.
Поджелудочная железа
На этом этапе «работают»:
Тонкая кишка
Над пищевыми частицами «колдуют»:
Толстый кишечник

Кроме названных энзимов, существуют еще:
Катализаторы в продуктах
Ферменты имеют решающее значение для здоровья, поскольку помогают организму расщеплять пищевые компоненты до состояния, пригодного для использования питательных веществ. Кишечник и поджелудочная железа производят широкий спектр ферментов. Но кроме этого, многие из полезных веществ, способствующих пищеварению, содержатся также и в некоторых продуктах.
Ферментированные продукты являются практически идеальным источником полезных бактерий, необходимых для правильного пищеварения. И в то время, когда аптечные пробиотики «работают» только в верхнем отделе пищеварительной системы и часто не добираются до кишечника, эффект от ферментативных продуктов ощущается во всем желудочно-кишечном тракте.
Например, абрикосы содержат в себе смесь полезных энзимов, в том числе инвертазу, которая отвечает за расщепление глюкозы и способствует быстрому высвобождению энергии.
Натуральным источником липазы (способствует более быстрому перевариванию липидов) может послужить авокадо. В организме это вещество производит поджелудочная железа. Но дабы облегчить жизнь этому органу, можно побаловать себя, например, салатом с авокадо – вкусно и полезно.
Кроме того, что банан, пожалуй, самый известный источник калия, он также поставляет в организм амилазу и мальтазу. Амилаза содержится также в хлебе, картофеле, крупах. Мальтаза способствует расщеплению мальтозы, так называемого солодового сахара, который в обилии представлен в пиве и кукурузном сиропе.
Другой экзотический фрукт – ананас содержит в себе целый набор энзимов, в том числе и бромелайн. А он, согласно некоторым исследованиям, еще и обладает противораковыми и противовоспалительными свойствами.
Экстремофилы и промышленность
Экстремофилы – это вещества, способны сохранять жизнедеятельность в экстремальных условиях.
Живые организмы, а также ферменты, позволяющие им функционировать, были найдены в гейзерах, где температура близка к точке кипения, и глубоко во льдах, а также в условиях крайней солености (Долина Смерти в США). Кроме того, ученые находили энзимы, для которых уровень рН, как оказалось, также не принципиальное требование для эффективной работы. Исследователи с особым интересом изучают ферменты-экстремофилы, как вещества, которые могут быть широко использованы в промышленности. Хотя и сегодня энзимы уже нашли свое применение в индустрии как биологически и экологически чистые вещества. К применению энзимов прибегают в пищевой промышленности, косметологии, производстве бытовой химии.
Более того, «услуги» ферментов в таких случаях обходятся дешевле, чем синтетических аналогов. Кроме того, натуральные вещества являются биоразлагаемыми, что делает их использование безопасным для экологии. В природе существуют микроорганизмы, способные расщепить ферменты на отдельные аминокислоты, которые затем становятся компонентами новой биологической цепочки. Но это, как говорится, уже совсем другая история.
Больше свежей и актуальной информации о здоровье на нашем канале в Telegram. Подписывайтесь: https://t.me/foodandhealthru