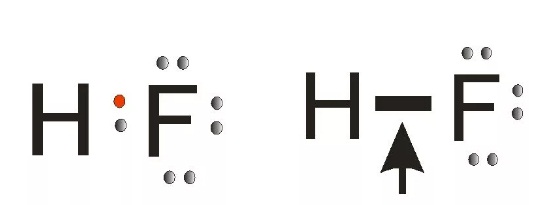Каковы механизмы образования ковалентной связи что такое
Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Содержание:
Химические связи – это приоритетная проблема в современной химии. От полученных знаний зависит выяснение причин разнообразия соединений, также строения и возникновения веществ. Выявленные типы: ионный, ковалентный, металлический, водородный.
Химические вещества состоят из не связанных между собой атомов химических элементов. Такое строение имеют только благородные газы: гелий, неон, аргон, криптон, ксенон и радон. Чаще всего химические вещества состоят не из отдельных атомов, а из их соединений, которые образуют различные группировки. Такие объединения атомов могут состоят из нескольких единиц, сотен, тысяч или даже больше атомов. Сила, которая держит эти атомы в составе таких группировок, называется химическая связь.
Причиной образования химической связи
Например: взаимодействуют атомы А и В. Энергия такого атома выше, чем соединения АВ, потому что при взаимодействии более электроотрицательный атом оттягивает на себя электроотрицательность и происходит смещение электронной плотности, а значит и понижение энергии всей молекулы. Поэтому в молекуле АВ энергия ниже, чем у отдельных атомов А и В.
E(АВ) 
Энергетический минимум идентичен устойчивому состоянию системы – в этой ситуации из пары обособленных водородных частиц получается молекула H2. Во время реакции производится 436 кДж/моль.
Как определить тип связи
Характеристики химических связей между частицами веществ зависят от электроотрицательности – возможности сохранять валентные электроны. Этот показатель зависит от заряженности ядра и радиуса атома. Для количественной оценки применяют шкалу Полинга (Табл. 1).
Определение вида взаимосвязи по разнице электроотрицательност (ЭО):В многообразии источников попадаются разные таблицы. Использовать можно каждую шкалу, потому что важнее разница электроотрицательностей, которая в среднем сходна в изобретённых системах, а не значение.
Ковалентная химическая связь
Между атомами элементов неметаллов возникает ковалентных характер связи. Если атомы неметаллов, образующие ковалентную связь, относятся к разным химическим элементам, такую связь называют ковалентной полярной. Причина такого названия, потому что атомы разных элементов имеют различную способность притягивать к себе общую электронную пару. Это приводит к смещению общей электронной пары в сторону одного из атомов, в результате чего на нем формируется частичный отрицательный заряд. На другом атоме формируется частичный положительный заряд.
Ковалентный тип – это химическая связь, в результате которой возникают общие пары электронов. Два пути появления:
Пример обменного способа – объединение атомов в молекулу водорода. Сближаясь, электронные оболочки перекрываются, а электронная плотность между ядрами повышается. Идёт притяжение, и энергия системы понижается. При близком сближении ядра отталкиваются – появляется расстояние (Рис. 2).
Характеристики ковалентной связи:
Ковалентная связь включает две разновидности по полярности: полярная и неполярная. Определяют по электроотрицательности атомов – одинаковая она или нет.
Характеристика:
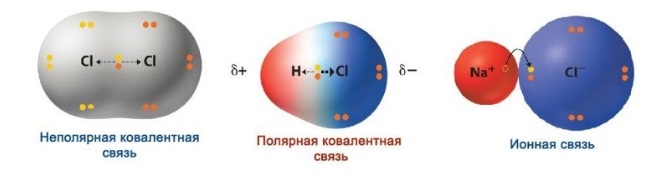
1. Неполярная ковалентная – связь между одинаковыми мелкими частицами (неметаллами) с размеренным распространением электронной плотности и равной электроотрицательностью. Примеры: Cl2, H2, I2, O2, N2 (Рис. 3).
2. Полярная ковалентная – это соединение неравных частиц (неметаллов) с разницей в электроотрицательности и смещением общей пары электронов. Примеры: NH3, HCl, CO2, H2O (Рис. 4).
Полярность – характеристика, определяющая физические или химические свойства вещества. Она влияет на механизм реакций, реакционную способность ближайших связей. Полярность молекулы, температуры плавления и кипения, а также растворимость – показатели, зависящие от полярности связей.
Ионная связь
Ионный тип – тип, при котором разница электроотрицательности атомов больше 1,7–2 по шкале Полинга. Если точнее, то притяжение появляется между ионами с разными зарядами. В возникновении ионного типа участвуют металлы, неметаллы. Примеры: NaCl, LiF, K2O, другие (Рис. 5).
Главные характеристики: ненаправленность и ненасыщаемость. Ионная связь во многом сходна с ковалентной, поэтому считается предельным случаем. Энергия связи (прочность) доходит до 800 кДж/моль.
Металлическая связь
Характеристики металлов: блеск, ковкость, пластичность и сравнительно высокая температура плавления, тепло- и электропроводность. Общность этих качеств объясняется сходством организации атомов:
Металлический тип – это связь сравнительно свободных отрицательно заряженных частиц между ионами металлов с образованием кристаллической решётки. Примеры – Fe, Na, Ca, Sc и Au3Cu, другие (Рис. 6).
Общность металлического и ковалентного вида связей – обобществление валентных электронов в основе. Различия заключаются в меньшей прочности и отсутствии направленности. Прочность (энергия) у металлической связи в 3–4 раза ниже этого же показателя у ковалентного типа. Образование металлической связи между атомами металлов возможна из-за наличия кинетической энергии внутри каждого атома металла, при увеличении центробежной силы электроны последнего электронного слоя вылетают за пределы атома и связывают атомы металлов между собой. Каждый атом, который потерял электрон превращается в положительно заряженную частицу – протон. И происходит взаимное притяжение протона и электрона, который только что покинул атом. Электроны могут притягиваться обратно и таким образом происходит снова образование атома. Существованием свободных электронов объяснятся свойство металлов к электропроводности (электрический ток – направленное движение электронов). Поэтому металлическую кристаллическую решетку химически невозможно разрушить, её можно только механически распилить.
Водородная связь
Водородные соединения с электроотрицательными атомами фтора, хлора, азота, кислорода образуются благодаря водородным связям. В молекуле общая пара электронов движется к более электроотрицательному атому. Классический пример – жидкий фторид водорода (Рис. 7).
Энергия водородной связи составляет до 40 кДж/моль, поэтому этот тип в 10–20 раз слабее ковалентного. Водородные связи возникают между или внутри молекул. От этого зависят физико-химические свойства вещества.
Ковалентная связь. Разбираем задачи, закрепляем тему
История
С момента открытия атомов и молекул исследователи долгое время задумывались над вопросом, какие силы объединяют микрочастицы в молекуле.
В 1897 году Джозеф Джон Томсон выдвинул теорию, что атомы удерживаются рядом благодаря переносу электронов от одного атома к другому и образованию электронных связей. И был прав. Вклад Томсона в науку был отмечен Нобелевской премией в 1906 году за «изучение прохождения электрического тока через газы».
Исследования продолжились, и в 1916 году американский физико-химик Гильберт Ньютон Льюис объяснил это явление, предложив теорию электронной химической связи. В своих опытах ученый заметил, что наиболее устойчивы при взаимодействии электронные оболочки атомов благородных газов. А атомы других веществ стремятся сделать свою энергетическую оболочку похожей на оболочку благородного газа, расположенного в том же периоде. И для этого присоединяют или отдают электроны. Познакомиться с биографией ученого можно в учебнике Химия 8 класс под редакцией В.В. Еремина на странице 218.
Исследователь предложил графическую модель структуры молекулы, в которой электроны обозначены точками, а связи черточками.
Правило октета
Льюис сформулировал принцип «октета». Согласно этому правилу, при создании молекулы атомы стараются достигнуть восьмиэлектронной валентной оболочки, попарно объединяя электроны, находящиеся на внешней орбитали. По важности это открытие сопоставимо с открытием периодического закона Д.И. Менделеевым.
Заглянем в Периодическую таблицу. В первом периоде находятся водород и гелий. Общее у этих двух газов — одна орбиталь. А вот количество электронов различно: у водорода один, у гелия два. Как мы помним, на первой орбитали у любого элемента могут поместиться всего лишь два электрона. И поскольку орбиталь гелия максимально заполнена — это инертный газ, который не вступает в химические реакции. А вот водород ищет себе пару и объединяется в двухатомные молекулы H2 или образует соединения с другими элементами. В остальных периодах на внешней орбитали могут разместиться восемь электронов.
Механизмы образования связи
Взаимодействие, возникающее при образовании общих электронных пар, называется ковалентная химическая связь. При образовании химической связи выделяется энергия в количестве, необходимом для разъединения атомов на расстояние, при котором взаимодействие стало бы невозможным. Такой тип связи характерен для большинства соединений.
Взаимодействие между атомами различных веществ может происходить двумя способами.
От электроотрицательности атомов и их способности притягивать электроны зависит, какая ковалентная связь образуется в молекуле.
В месте перекрывания электронных облаков создается зона повышенной электронной плотности. Если электроотрицательность элементов равна, электронное облако находится на одинаковом расстоянии от центров атомов, входящих в электронную пару, и образуется ковалентная неполярная связь.
Если электроотрицательность различна, происходит сдвиг электронного облака в сторону центра с большей электроотрицательностью, то есть образуются молекула с двумя полюсами (диполь). Самый простой пример диполя — молекула воды. Данный тип связи и есть ковалентная полярная связь.
Ионная связь — вариант крайне полярной ковалентной связи.
Помимо полярности, ковалентная связь соединения характеризуется и другими параметрами:
Химическая связь. Типы химической связи
Диссоциация хлорида натрия в воде
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Основные свойства ковалентных связей
Эти свойства связи влияют на химические и физические свойства веществ.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару ( донор ), а другой атом предоставляет вакантную орбиталь для этой пары ( акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например , в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
+11 Na ) 2 ) 8 ) 1 — 1e = +11 Na + ) 2 ) 8
+17 Cl ) 2 ) 8 ) 7 + 1e = +17 Cl — ) 2 ) 8 ) 8
Обратите внимание:
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.