Калориметр что измеряет в химии
Калориметр
Калориметр, предназначенный для измерения суммарного количества теплоты Q, выделяющейся в процессе от его начала до завершения, называют калориметром-интегратором; калориметр для измерения тепловой мощности L и её изменения на разных стадиях процесса — измерителем мощности или калориметром-осциллографом. По конструкции калориметрической системы и методу измерения различают жидкостные и массивные калориметры, одинарные и двойные (дифференциальные).
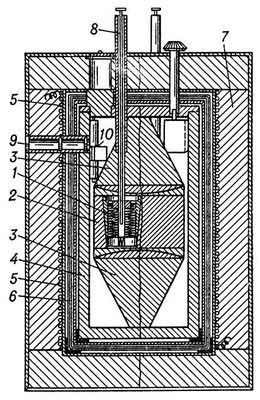
Жидкостный калориметр-интегратор переменной температуры (рис. 1) с изотермической оболочкой применяют для измерений теплот растворения и теплот химических реакций. Он состоит из сосуда с жидкостью (обычно водой), в котором находятся: камера для проведения исследуемого процесса («калориметрическая бомба»), мешалка, нагреватель и термометр. Теплота, выделившаяся в камере, распределяется затем между камерой, жидкостью и др. частями калориметра, совокупность которых называют калориметрической системой прибора. Изменение состояния (например, температуры) калориметрической системы позволяет измерить количество теплоты, введённое в калориметр. Нагрев калориметрической системы фиксируется термометром. Перед проведением измерений калориметр градуируют — определяют изменение температуры калориметрической системы при сообщении ей известного количества теплоты (нагревателем калориметра или в результате проведения в камере химической реакции с известным количеством стандартного вещества). В результате градуировки получают тепловое значение калориметра, т. е. коэффициент, на который следует умножить измеренное термометром изменение температуры калориметра для определения количества введённой в него теплоты. Тепловое значение такого калориметра представляет собой теплоёмкость (с) калориметрической системы. Определение неизвестной теплоты сгорания или др. химической реакции Q сводится к измерению изменения температуры D t калориметрической системы, вызванного исследуемым процессом: Q = c × D t. Обычно значение Q относят к массе вещества, находящегося в камере калориметра.
Калориметрические измерения позволяют непосредственно определить лишь сумму теплот исследуемого процесса и различных побочных процессов, таких как перемешивание, испарение воды, разбивание ампулы с веществом и т.п. Теплота побочных процессов должна быть определена опытным путём или расчётом и исключена из окончательного результата. Одним из неизбежных побочных процессов является теплообмен калориметра с окружающей средой посредством излучения и теплопроводности. В целях учёта побочных процессов и прежде всего теплообмена калориметрическую систему окружают оболочкой, температуру которой регулируют.
У жидкостных калориметров температуру оболочки поддерживают постоянной. При определении теплоты химической реакции наибольшие затруднения часто связаны не с учётом побочных процессов, а с определением полноты протекания реакции и с необходимостью учитывать несколько реакций.
В калориметре-интеграторе другого вида — изотермическом (постоянной температуры) введённая теплота не изменяет температуры калориметрической системы, а вызывает изменение агрегатного состояния тела, составляющего часть этой системы (например, таяние льда в ледяном калориметре Бунзена). Количество введённой теплоты рассчитывается в этом случае по массе вещества, изменившего агрегатное состояние (например, массе растаявшего льда, которую можно измерить по изменению объёма смеси льда и воды), и теплоте фазового перехода.
Массивный калориметр-интегратор чаще всего применяют для определения энтальпии веществ при высоких температурах (до 2500 °С). Калориметрическая система у калориметров этого типа представляет собой блок из металла (обычно из меди или алюминия) с выемками для сосуда, в котором происходит реакция, для термометра и нагревателя. Энтальпию вещества рассчитывают как произведение теплового значения калориметра на разность подъёмов температуры блока, измеряемых после сбрасывания в его гнездо ампулы с определённым количеством вещества, а затем пустой ампулы, нагретой до той же температуры.
Теплоёмкость газов, а иногда и жидкостей, определяют в т. н. проточных лабиринтных калориметрах — по разности температур на входе и выходе стационарного потока жидкости или газа, мощности этого потока и джоулевой теплоте, выделенной электрическим нагревателем калориметра.
Обычные названия калориметров — «для химической реакции», «бомбовый», «изотермический», «ледяной», «низкотемпературный» — имеют историческое происхождение и указывают главным образом на способ и область использования калориметра, не являясь ни полной, ни сравнительной их характеристикой.
Общую классификацию калориметров можно построить на основе рассмотрения трёх главных переменных, определяющих методику измерений: температуры калориметрической системы Tc; температуры оболочки To, окружающей калориметрическую систему количества теплоты L, выделяемой в калориметре в единицу времени (тепловой мощности).
Калориметр с постоянными Tc и To называют изотермическим; с Tc = To — адиабатическим; калориметр, работающий при постоянной разности температур Tc — To, называют калориметром с постоянным теплообменом; у изопериболического калориметра (его ещё называют калориметром с изотермической оболочкой) постоянна To, а Tc является функцией тепловой мощности L.
Важным фактором, влияющим на окончательный результат измерений, является надёжная работа автоматических регуляторов температуры изотермических или адиабатических оболочек. В адиабатическом калориметре температура оболочки регулируется так, чтобы она была всегда близка к меняющейся температуре калориметрической системы. Адиабатическая оболочка — лёгкая металлическая ширма, снабженная нагревателем, — уменьшает теплообмен настолько, что температура калориметра меняется лишь на несколько десятитысячных град/мин. Часто это позволяет снизить теплообмен за время калориметрического опыта до незначительной величины, которой можно пренебречь. В случае необходимости в результаты непосредственных измерений вводится поправка на теплообмен, метод расчёта которой основан на законе теплообмена Ньютона — пропорциональности теплового потока между калориметром и оболочкой разности их температур, если эта разность невелика (до 3—4 ° С).
Для калориметра с изотермической оболочкой теплоты химической реакции могут быть определены с погрешностью до 0,01%. Если размеры калориметра малы, температура его изменяется более чем на 2—3 °С и исследуемый процесс продолжителен, то при изотермической оболочке поправка на теплообмен может составить 15—20% от измеряемой величины и существенно ограничить точность измерений. В этих случаях целесообразнее применять адиабатическую оболочку.
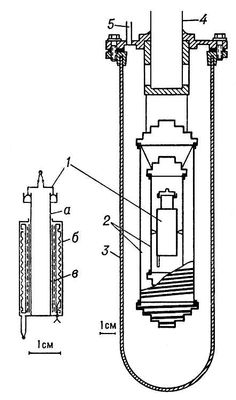
При помощи адиабатического калориметра определяют теплоёмкость твёрдых и жидких веществ в области от 0,1 до 1000 К. При комнатных и более низких температурах адиабатический калориметр, защищенный вакуумной рубашкой, погружают в Дьюара сосуд, заполненный жидким гелием, водородом или азотом (рис. 3). При повышенных температурах (выше 100 °С) калориметр помещают в термостатированную электрическую печь.
Лит.: Попов М. М., Термометрия и калориметрия, 2 изд., М., 1954; Скуратов С. М., Колосов В. П., Воробьев А. Ф., Термохимия, ч. 1—2, М., 1964—66; Кальве Э., Прат А., Микро-калориметрия, пер. с франц., М., 1963; Experimental thermochemistry, v. 1—2 N. Y. — L., 1956-62.
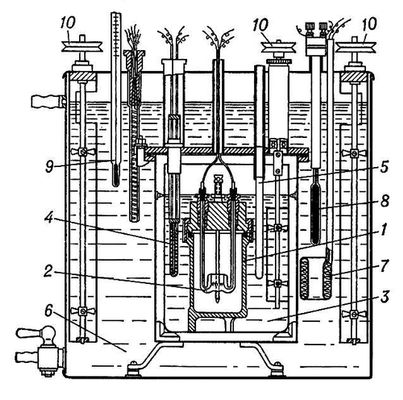
Рис. 2. Калориметр Э. Кальве для измерения тепловой мощности процессов (схема): 1 — калориметрическая ячейка с термопарами; 2 — блок калориметра; 3 — металлические конусы для создания однородного поля температур в блоке; 4 — оболочка; 5 — нагреватель для термостатирования прибора; 6 — тепловые экраны; 7 — тепловая изоляция; 8 — трубка для введения вещества в калориметр; 9 — окно для отсчётов показаний гальванометра 10.
Рис. 3. Адиабатический калориметр для определения теплоёмкости при низких температурах (схема): 1 — калориметр (а — сосуд для вещества, б — термометр сопротивления, в — нагреватель); 2 — адиабатические оболочки (ширмы); 3 — вакуумная рубашка; 4 — труба для откачки; 5 — трубка для электрических проводов.
Рис. 1. Жидкостный калориметр-интегратор с изотермической оболочкой (схема): 1 — «калориметрическая бомба»; 2 — нагреватель для возбуждения реакции; 3 — собственно калориметр (сосуд, заполненный водой); 4 — термометр сопротивления; 5 — холодильник (трубка, через которую можно пропускать холодный воздух); 6 — изотермическая оболочка калориметра, заполненная водой; 7 — нагреватель оболочки; 8 — контактный термометр для регулировки температуры оболочки; 9 — контрольный термометр; 10 — мешалки с приводом.
История калориметра, детали, типы и их характеристики
калориметр представляет собой устройство, которое используется для измерения изменения температуры определенного количества вещества (обычно воды) с известной удельной теплоемкостью. Это изменение температуры связано с поглощением или выделением тепла в исследуемом процессе; химический, если это реакция, или физический, если он состоит из изменения фазы или состояния.
В лаборатории самый простой калориметр, который можно найти, это калориметр. Он используется для измерения тепла, поглощенного или выделенного в реакции при постоянном давлении, в водном растворе. Реакции выбираются так, чтобы избежать вмешательства реагентов или газообразных продуктов..
Количество тепла, которое выделяется в реакции = количество тепла, поглощенного калориметром + количество тепла, поглощенного раствором
Количество тепла, поглощаемое калориметром, называется калориметрической емкостью калориметра. Это определяется подачей известного количества тепла в калориметр с заданной массой воды. Затем измеряют повышение температуры калориметра и содержащегося в нем раствора..
С этими данными и использованием удельной теплоемкости воды (4,18 Дж / г ºC) можно рассчитать калорийность калориметра. Эта емкость также называется постоянной калориметра.
С другой стороны, тепло, получаемое водным раствором, равно m · ce · Δt. В формуле m = масса воды, ce = удельная теплоемкость воды и Δt = изменение температуры. Зная все это, можно рассчитать количество тепла, выделяемое экзотермической реакцией..
История калориметра
В 1780 году французский ученый А. Л. Лавуазье, считающийся одним из отцов химии, использовал морскую свинку, чтобы измерить выработку тепла при дыхании..
Как? Использование устройства, похожего на калориметр. О тепле, производимом морской свинкой, свидетельствует таяние снега, окружавшего аппарат.
Исследователи А. Л. Лавуазье (1743-1794) и П. С. Лаплас (1749-1827) разработали калориметр, который использовался для измерения удельной теплоты тела методом таяния льда.
Калориметр состоял из луженого цилиндрического стакана, покрытого лаком, удерживаемого штативом и внутренне ограниченного воронкой. Внутри было помещено еще одно стекло, похожее на предыдущее, с трубкой, проходящей через внешнюю камеру и снабженной ключом. Внутри второго стекла была сетка.
В эту сетку помещалось существо или объект, удельное тепло которого было желательно определить. Лед был помещен внутри концентрических сосудов, как в корзине.
Тепло, выделяемое телом, поглощалось льдом, вызывая его слияние. И жидкий водный продукт таяния льда собирали, открывая ключ внутреннего стекла.
И, наконец, при взвешивании воды масса расплавленного льда была известна.
части
Изображение показывает части калориметрического насоса; Тем не менее, можно заметить, что он имеет термометр и мешалку, общие элементы в нескольких калориметрах.
Типы и их характеристики
Кофейная чашка
Это тот, который используется для определения тепла, выделяемого экзотермической реакцией, и тепла, поглощаемого в эндотермической реакции..
Калориметрический насос
Это устройство, в котором измеряется количество тепла, которое выделяется или поглощается в реакции, которая происходит при постоянном объеме..
Реакция протекает в прочном стальном сосуде (насосе), который погружается в большой объем воды. Это делает изменения температуры воды небольшими. Следовательно, предполагается, что изменения, связанные с реакцией, измеряются при постоянной температуре и объеме..
Вышесказанное указывает на то, что при проведении реакции в калориметрическом насосе работа не выполняется..
Реакция начинается с подачи электричества через кабели, подключенные к насосу.
Адиабатический калориметр
Он характеризуется наличием изолирующей структуры, называемой экраном. Экран расположен вокруг ячейки, где происходят изменения температуры и тепла. Он также подключен к электронной системе, которая поддерживает свою температуру очень близко к температуре элемента, чтобы избежать передачи тепла.
В адиабатическом калориметре разница температур между калориметром и его окружением сводится к минимуму; а также минимизировать коэффициент теплопередачи и время теплообмена.
Его части состоят из следующего:
-Ячейка (или контейнер), интегрированная в систему изоляции, с помощью которой пытаются избежать потери тепла.
-Термометр, для измерения изменений температуры.
-Нагреватель, подключенный к контролируемому источнику электрического напряжения.
-И щит, уже упоминавшийся.
В калориметре этого типа могут быть определены такие свойства, как энтропия, температура Дебая и плотность электронного состояния..
Изопериболический калориметр
Это устройство, в котором реакционная ячейка и насос погружены в конструкцию, называемую рубашкой. В этом случае так называемая рубашка состоит из воды, поддерживаемой при постоянной температуре.
Температура ячейки и насоса повышается при выделении тепла во время процесса сгорания; но температура водяной рубашки поддерживается на фиксированной температуре.
Микропроцессор контролирует температуру ячейки и кожуха, внося необходимые поправки в тепло утечки, возникающее в результате различий между двумя температурами..
Эти поправки применяются непрерывно и с окончательной поправкой, основанной на измерениях до и после испытания..
Проточный калориметр
Разработанный Caliendar, он имеет устройство для перемещения газа в контейнере с постоянной скоростью. При добавлении тепла измеряется увеличение температуры в жидкости..
Проточный калориметр характеризуется:
— Точное измерение постоянного расхода.
— Точное измерение количества тепла, вводимого в жидкость через нагреватель.
— Точное измерение повышения температуры в газе, вызванное подводом энергии
— Конструкция для измерения емкости газа под давлением.
Калориметр для дифференциальной сканирующей калориметрии
Он характеризуется наличием двух контейнеров: в одном помещается исследуемый образец, в то время как другой остается пустым или используется контрольный материал.
Два сосуда нагреваются с постоянной скоростью энергии с помощью двух независимых нагревателей. Когда начинается нагрев двух емкостей, компьютер будет отображать разницу тепловых потоков нагревателей в зависимости от температуры, что позволяет определить поток тепла..
Кроме того, можно определить изменение температуры как функции времени; и, наконец, калорийность.
приложений
По физикохимии
-Основные калориметры, типа кофейной чашки, позволяют измерять количество тепла, которое организм выделяет или поглощает. Они могут определить, является ли реакция экзотермической или эндотермической. Кроме того, удельная теплоемкость тела может быть определена.
-С помощью адиабатического калориметра удалось определить энтропию химического процесса и электронную плотность состояния.
В биологических системах
-Микрокалориметры используются для изучения биологических систем, которые включают взаимодействия между молекулами, а также происходящие конформационные изменения молекул; например, при развертывании молекулы. Линия включает в себя как дифференциальное сканирование, так и изотермическое титрование.
-Микрокалориметр используется при разработке лекарственных препаратов малых молекул, биотерапевтических средств и вакцин..
Кислородный насос калориметр и калорийность
Сжигание многочисленных веществ происходит в калориметре кислородного насоса, и его калорийность может быть определена. В число веществ, изученных с помощью этого калориметра, входят: уголь и кокс; пищевые масла, как тяжелые, так и легкие; бензин и все моторные топлива.
А также виды топлива для авиационных реакторов; топливные отходы и размещение отходов; пищевые продукты и добавки для питания человека; кормовые культуры и добавки для кормления животных; строительные материалы; ракетное и ракетное топливо.
Аналогично, калорийность была определена с помощью калориметрии в термодинамических исследованиях горючих материалов; в изучении энергетического баланса в экологии; во взрывчатых веществах и термопорошках и в обучении основным термодинамическим методам.
Калориметр
Чтобы найти изменение энтальпии на моль вещества A в реакции между двумя веществами A и B, вещества отдельно добавляются в калориметр и отмечаются начальная и конечная температуры (до начала реакции и после ее завершения). Умножение изменения температуры на массу и удельную теплоемкость веществ дает значение энергии, выделяемой или поглощаемой во время реакции. Разделение изменения энергии на количество присутствующих молей A дает изменение энтальпии реакции.
Содержание
История [ править ]
Адиабатические калориметры [ править ]
Адиабатический калориметр калориметр использовал для изучения неконтролируемой реакции. Поскольку калориметр работает в адиабатической среде, любое тепло, выделяемое исследуемым образцом материала, вызывает повышение температуры образца, тем самым подпитывая реакцию.
Калориметры реакции [ править ]
Калориметр теплового потока [ править ]
Рубашка охлаждения / нагрева контролирует либо температуру процесса, либо температуру рубашки. Тепло измеряется путем отслеживания разницы температур между теплоносителем и технологической жидкостью. Кроме того, для получения правильного значения необходимо определить объемы заполнения (т.е. смачиваемую площадь), удельную теплоемкость и коэффициент теплопередачи. Калориметр этого типа позволяет проводить реакции при кипячении с обратным холодильником, хотя он очень менее точен.
Калориметр теплового баланса [ править ]
Рубашка охлаждения / нагрева контролирует температуру процесса. Тепло измеряется путем отслеживания тепла, полученного или потерянного теплоносителем.
Компенсация мощности [ править ]
Компенсация мощности использует нагреватель, расположенный внутри емкости для поддержания постоянной температуры. Энергия, подводимая к этому нагревателю, может изменяться по мере необходимости, и калориметрический сигнал выводится исключительно из этой электроэнергии.
Постоянный поток [ править ]
Калориметрия постоянного потока (или COFLUX, как ее часто называют) выводится из калориметрии теплового баланса и использует специальные механизмы управления для поддержания постоянного теплового потока (или потока) через стенку сосуда.
Калориметры бомбы [ править ]
По сути, бомбовый калориметр состоит из небольшой чашки, в которой находится образец, кислорода, бомбы из нержавеющей стали, воды, мешалки, термометра, емкости Дьюара или изоляционного контейнера (для предотвращения теплового потока от калориметра в окружающую среду) и цепи зажигания. подключен к бомбе. При использовании в бомбе нержавеющей стали реакция будет происходить без изменения объема.
Поскольку теплообмен между калориметром и окружающей средой отсутствует (Q = 0) (адиабатический), работа не выполняется (W = 0).
Таким образом, полное изменение внутренней энергии
Δ E общий знак равно Q + W знак равно 0 <\ displaystyle \ Delta E _ <\ text
Кроме того, общее изменение внутренней энергии
где теплоемкость бомбы C v <\displaystyle C_
C v ( calorimeter ) = m water ⋅ C v ( water ) + m steel ⋅ C v ( steel ) <\displaystyle C_



В лаборатории определяется, прогоняя состав с известной теплотой сгорания: C v <\displaystyle C_
Обычными соединениями являются бензойная кислота ( ) или п-метилбензойная кислота ( ). H c = 6318 cal/g <\displaystyle H_
Температура ( T ) записывается каждую минуту и Δ T = T final − T initial <\displaystyle \Delta T=T_<\text
Для калибровки бомбы взвешивается небольшое количество (
1 г) бензойной кислоты или п-метилбензойной кислоты. Длина никелевой плавкой проволоки (
10 см) взвешивается как до, так и после процесса горения. Масса сгоревшего провода предохранителя Δ m = m before − m after <\displaystyle \Delta m=m_<\text
Сжигание образца (бензойной кислоты) внутри бомбы
Δ H c = Δ H c ( benzoic acid ) × m benzoic acid + Δ H c ( Ni fuse wire ) × Δ m Ni fuse wire <\displaystyle \Delta H_
Сжигание негорючих веществ [ править ]
Более высокое давление и концентрация O 2 в системе бомбы могут сделать некоторые соединения, которые обычно не воспламеняются, воспламеняются. Некоторые вещества не сгорают полностью, что затрудняет расчеты, поскольку необходимо учитывать оставшуюся массу, что значительно увеличивает возможную ошибку и ставит под угрозу данные.
При работе с негорючими компаундами (которые могут не сгорать полностью) одним из решений может быть смешивание компаунда с некоторыми легковоспламеняющимися составами с известной теплотой сгорания и изготовление поддона из смеси. Как только известна величина бомбы, теплота сгорания горючего соединения ( C FC ), проволоки ( C W ) и массы ( m FC и m W ), а также изменение температуры (Δ T ), теплота сжигания менее горючего соединения ( C LFC ) можно рассчитать с помощью: C v <\displaystyle C_
Калориметры типа Кальве [ править ]
Обнаружение основано на трехмерном датчике флюксметра. Элемент флюксметра состоит из кольца, состоящего из нескольких последовательно соединенных термопар. Соответствующая термобатарея с высокой теплопроводностью окружает экспериментальное пространство внутри калориметрического блока. Радиальное расположение термобатарей гарантирует почти полную интеграцию тепла. Это подтверждается расчетом коэффициента эффективности, который показывает, что среднее значение 94% +/- 1% тепла передается через датчик во всем диапазоне температур калориметра типа Кальве. В этой установке чувствительность калориметра не зависит от тигля, типа продувочного газа или скорости потока. Основным преимуществом установки является увеличение размера экспериментального сосуда и, как следствие, размера образца,без влияния на точность калориметрических измерений.
Калибровка калориметрических детекторов является ключевым параметром и требует очень тщательного выполнения. Для калориметров типа Кальве была разработана специальная калибровка, так называемый эффект Джоуля или электрическая калибровка, чтобы преодолеть все проблемы, возникающие при калибровке, выполняемой со стандартными материалами. Основные преимущества этого типа калибровки:
Примером калориметра типа Кальве является калориметр C80 (реакционный, изотермический и сканирующий калориметр). [7]
Адиабатические и изопериболические калориметры [ править ]
Измерение тепла с помощью простого калориметра, такого как калориметр для кофейной чашки, является примером калориметрии постоянного давления, поскольку давление (атмосферное давление) остается постоянным во время процесса. Калориметрия постоянного давления используется для определения изменений энтальпии, происходящих в растворе. В этих условиях изменение энтальпии равняется теплоте.
Дифференциальный сканирующий калориметр [ править ]
В ДСК теплового потока обе сковороды располагаются на небольшой пластине материала с известным (откалиброванным) тепловым сопротивлением K. Температура калориметра линейно повышается со временем (сканирование), т. Е. Скорость нагрева
остается постоянным. На этот раз линейность требует хорошей конструкции и хорошего (компьютеризированного) контроля температуры. Конечно, также возможны контролируемое охлаждение и изотермические эксперименты.
Δ T = K d q d t = K C p β <\displaystyle \Delta T=K
\,\beta >
Обратите внимание, что эта формула (эквивалентная закону теплового потока Ньютона ) аналогична закону электрического потока Ома и намного старше его :
Когда образец внезапно поглощает тепло (например, когда образец плавится), сигнал отреагирует и покажет пик.
Это дает ряд преимуществ. Он облегчает прямое измерение теплоемкости за одно измерение даже в (квази) изотермических условиях. Он позволяет одновременно измерять тепловые эффекты, которые реагируют на изменение скорости нагрева (реверсивное) и не реагируют на изменение скорости нагрева (нереверсивное). Это позволяет оптимизировать как чувствительность, так и разрешение в одном тесте, обеспечивая медленную среднюю скорость нагрева (оптимизация разрешения) и быстро меняющуюся скорость нагрева (оптимизация чувствительности). [8]
Калориметр изотермического титрования [ править ]
В калориметре изотермического титрования теплота реакции используется для отслеживания эксперимента по титрованию. Это позволяет определять среднюю точку ( стехиометрию ) (N) реакции, а также ее энтальпию (дельта H), энтропию (дельта S) и, что имеет первостепенное значение, аффинность связывания (Ka).