Капельница биология при ковид что это такое
Капельницы для восстановления после COVID-19
Капельницы для восстановления после Ковид — это эффективный и быстрый способ улучшить самочувствие, предотвратить тяжёлые последствия, наладить работу пострадавших от вируса нового типа органов и систем. COVID-19 является серьёзной угрозой для человека не только в период разгара болезни, но и в реабилитационный период, когда он ослаблен и повреждён. Поэтому специалисты Seline разработали и внедрили в практику нашей клиники курс инфузионной терапии, которая направлена на лечение постковидного синдрома и ускорения восстановления функциональных способностей органов дыхания, детоксикации, сердца, сосудов и т. д. Воспользоваться данной услугой полезно будет каждому, кто перенёс это неизвестное ранее заболевание, вне зависимости от его тяжести.
Показания
Инфузии комплекса лекарственных средств, которые проводят наши специалисты пациентам, перенесшим коронавирусную инфекцию, направлены на устранение или облегчение таких распространённых её последствий, как:
Внутривенное введение лекарств в реабилитационный период, особенно в комплексе с физиотерапевтическими мероприятиями, консультацией профильных специалистов и назначенным им лечением, даёт незамедлительный эффект. Однако стоит иметь в виду, что 1-2 капельниц будет недостаточно. Следует пройти курс инфузионной терапии на дому или в комфортных условиях нашей клиники.
Противопоказания
Индивидуальная непереносимость капельниц для восстановления после Ковид — основное противопоказание к инфузионной терапии в период реабилитации. Однако каждый клинический случай уникален, поэтому решение о том, можно ли проводить пациенту такую процедуру или нет, выносит врач. Без предварительной беседы и осмотра специалиста капельницы не ставятся.
Почему необходимо обратиться в Seline?
Наши специалисты владеют всей известной научному сообществу, Министерством здравоохранения информацией на тему COVID-19. При назначении/проведении инфузионной терапии они руководствуются исключительно подтверждёнными данными и утверждёнными рекомендациями государственных и всемирных организаций. Однако мы не лечим людей по шаблону. Поэтому наши капельницы для восстановления после Ковида действительно работают, и, что не менее важно, безопасны для пациентов.
Возможный терапевтический подход к внутривенному введению иммуноглобулина против COVID-19
Интенсивное воспаление при ковиде
Иммуноглобулинотерапия
IVIG обычно используется в качестве эффективного средства лечения первичного иммунодефицита, иммунной тромбоцитопенической пурпуры, болезни Кавасаки, дерматомиозита и синдрома Гийена-Барре, прежде всего в качестве «заместителя антител». IVIG вводят при двух различных типах состояний с определенными дозами. Во-первых, его можно использовать в качестве заместительной терапии с пиковым уровнем сыворотки 12–14 мг / мл для пациентов с иммунодефицитом. Во-вторых, введение высокой дозы IVIG для достижения сывороточного уровня 25–35 мг / мл может применяться у пациентов с воспалительными или аутоиммунными состояниями. Терапия IVIG обычно функционирует как замена недостающих антител при первом типе введения (заместительная терапия). Однако у IVIG есть и другие роли, такие как нормализация дифференцировки моноцитов в сторону DC и индуцирует пролиферацию В-клеток и продукцию антител.
Опыт лечения внутривенным иммуноглобуллином респираторного синдрома
Внутривенное введение иммуноглобулинов при ковиде
Упомянутые выше исследования имеют ограничения, из-за которых трудно убедить врачей использовать IVIG. Двумя основными смешивающими факторами являются небольшой размер выборки и одновременное применение других методов терапии (таких как глюкокортикоиды и плазмаферез).Чтобы добиться более точного результата, Gharebaghi et al. недавно провели рандомизированное плацебо-контролируемое двойное слепое клиническое исследование с участием 59 пациентов. Они обнаружили, что введение 20 г / день IVIG в течение трех дней снижает смертность, несмотря на увеличение продолжительности пребывания в больнице. Пациенты в группе IVIG выживали и оставались в больнице дольше до полного выздоровления, в то время как пациенты в контрольной группе умерли раньше. Они предложили лечение IVIG пациентам, которым не помогли противовирусные препараты и препараты класса хлорохина.
Иммунологические механизмы применения IVIG у пациентов с COVID-19
Пациенты обычно проходят три клинических стадии COVID-19: стадию острой пневмонии, стадию виремии и стадию выздоровления. Возможный патогенез COVID-19 заключается в том, что количество лимфоцитов на ранней стадии заболевания (1–14 дней) нормальное или немного низкое. Однако значительная лимфопения в поздней фазе (через 7–14 дней после появления симптомов) возникает, когда имеет место виремия. Кроме того, уменьшение количества В-лимфоцитов наблюдается на ранней стадии. Одним из методов диагностики COVID-19 является измерение антител в сыворотке крови пациентов. Большинство данных указывает на то, что более высокий уровень SARS-2-COVID-IgG является маркером тяжелого заболевания (хотя на данный момент по неясным причинам), а уровни антител являются более диагностическими, чем терапевтические маркеры.
Проблемы использования внутривенной иммуноглобуллинотерапии у пациентов с COVID-19
Эффективность тоцилизумаба у пациентов с COVID-19, госпитализированных в ОРИТ: ретроспективное когортное исследование
Изучить эффективность более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в отделения реанимации и интенсивной терапии (ОРИТ) для респираторной поддержки.
Материалы и методы
В ретроспективное когортное исследование включали пациентов с тяжелой COVID-19 пневмонией, госпитализированных в связи с ухудшением оксигенации в ОРИТ российских лечебных учреждений с 16 марта по 5 мая 2020 г. Всем пациентам проводилась стандартная терапия, а часть больных получили также тоцилизумаб внутривенно в дозе 400 мг. Госпитальную летальность от любых причин сравнивали между группами пациентов, которым вводили и не вводили тоцилизумаб, с помощью модели логистической регрессии с поправкой на возраст и пол.
В исследование были включены 328 пациентов (57,0% мужчин, медиана возраста 59 лет), 159 из которых получили по крайней мере одну инфузию тоцилизумаба. Препарат применяли у 83 (60,1%) из 137 больных, находившихся на оксигенотерапии или неинвазивной вентиляции легких (более раннее введение), и 76 (39,8%) из 191 интубированного пациента (позднее введение). Ни более раннее, ни позднее введение тоцилизумаба не привело к снижению риска смерти по сравнению с соответствующими контрольными группами больных, не получавших ингибитор интерлейкина-6 (скорректированные по возКЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ И ТЕРАПИЯ, 2020, 29 (4) расту и полу отношения шансов составили 2,370, 95% ДИ 0,969-5,798; р=0,059, и 0,996, 95% ДИ 0,539-1,839; р=0,989, соответственно).
Более раннее введение тоцилизумаба у неинтубированных пациентов с тяжелой COVID-19 пневмонией и поздняя инфузия препарата после начала ИВЛ не привели к снижению летальности от всех причин.
Число пациентов с COVID-19 во многих странах продолжает быстро увеличиваться, а общее число зарегистрированных в мире случаев инфекции в ноября 2020 г. превысило 60 млн. Хотя в большинстве случаев инфекция, вызванная SARSCoV-2, характеризуется благоприятным течением, у 5-10% госпитализированных больных с вирусной пневмонией развивается острый респираторный дистресс синдром (ОРДС), требующий респираторной поддержки в отделении реанимации и интенсивной терапии (ОРИТ) 1. В российских ОРИТ летальность больных с ОРДС, вызванным SARS-CoV-2, составила в среднем около 65%, а основными предикторами неблагоприятного исхода были пожилой возраст, мужской пол и некоторые сопутствующие заболевания, в том числе ожирение, сахарный диабет 2 типа и коронарная болезнь сердца [4]. Летальность была достаточно низкой у пациентов, находившихся на оксигенотерапии (10,1%), и значительно уве личивалась у больных, которых приходилось переводить на неинвазивную (36,8%) и особенно искусственную (76,5%) вентиляцию легких.
Причиной развития быстро прогрессирующего поражения легких при COVID-19 считают гипериммунный воспалительный ответ, сопровождающийся выбросом различных цитокинов [5]. Ранее синдром выделения цитокинов, или «цитокиновый шторм», был описан при первичном и вторичном гемофагоцитарном лимфогистиоцитозе и синдроме активации макрофагов, а также при CAR-T-клеточной терапии онкологических заболеваний [6]. Хотя «цитокиновый шторм» упоминается практически во всех статьях, посвященных COVID-19, общепринятые критерии его диагностики до сих пор отсутствуют. На практике синдром выброса цитокинов предполагают у пациентов с SARS-CoV-2 пневмонией 3-4 стадии (т.е. с поражением более 50% легочной ткани), сопровождающейся снижением SpO2≤93%, стойкой лихорадкой и повышением содержания лабораторных маркеров воспаления, в том числе С-реактивного белка (до 100-400 мг/л и более), ферритина, фибриногена, интерлейкина (ИЛ)-6, а также Dдимера. R. Caricchio и соавт. при анализе лабораторных показателей и клинических проявлений более чем у 500 пациентов c COVID-19 пришли к выводу, что существующие критерии синдрома выброса цитокинов, такие как HScore и др., не позволяют идентифицировать это осложнение SARS-CoV-2 инфекции, и предложили собственные критерии, отражающие (1) воспаление, (2) гибель клеток и повреждение ткани и (3) преренальные электролитные нарушения (табл. 1). Эти критерии позволяли с достаточной точностью предсказать более длительную госпитализацию и летальность [7]. Следует отметить, что к числу критериев синдрома выброса цитокинов авторы отнесли увеличение абсолютного количества нейтрофилов, которое, по-видимому, указывает на важную роль врожденного иммунитета в развитии «цитокинового шторма» при COVID-19 и во многих случаях не является признаком вторичной бактериальной инфекции, требующим назначения антибиотиков.
| Необходимые критерии (все) | Значения |
| Симптомы COVID-19 | + |
| ПЦР на SARS-CoV-2 | ± |
| Матовые стекла на КТ | + |
| Ферритин | >250 нг/мл |
| СРБ | >46 мг/л |
| И (один показатель из каждого кластера) | |
| Кластер I | |
| Альбумин | 11400 в мм 3 |
| Кластер II | |
| АЛТ | >60 Ед/л |
| АСТ | >87 Ед/л |
| D-димер | >4930 нг/мл |
| ЛДГ | >416 Ед/л |
| Тропонин I | >1,09 нг/мл |
| Кластер III | |
| Анионный разрыв | 106 ммоль/л |
| Калий | >4,9 ммоль/л |
| Азот мочевины/креатинин | >29 |
Предполагаемая роль синдрома выброса цитокинов в патогенезе тяжелого поражения легких и других органов при COVID-19 послужила основанием для изучения эффективности различных антицитокиновых средств, в том числе ингибиторов интерлейкина (ИЛ)-6 (тоцилизумаба, сарилумаба, олокизумаба), ИЛ-1 (канакинумаба, анакинры) и янус-киназ (тофацитиниба, барицитиниба). Хотя ни один из перечисленных препаратов официально не зарегистрирован для лечения СOVID-19, во многих странах ингибиторы ИЛ-6 применяют в клинической практике (off-label) у больных с наиболее тяжелым течением этого заболевания. Дополнительным доводом в пользу возможной эффективности ингибиторов ИЛ-6 при COVID-19 послужил и тот факт, что в 2017 г. тоцилизумаб был зарегистрирован для лечения угрожающего жизни синдрома высвобождения цитокинов, вызванного химерным антигенным рецептором (CAR) T-клеток у пациентов с гемобластозами [8].
Первые сообщения об успешном опыте применения тоцилизумаба у больных с тяжелым течением COVID19 были опубликованы китайскими исследователями уже вскоре после начала пандемии SARS-CoV-2 инфекции [14,15]. В последующем эффективность препарата была продемонстрирована в многочисленных наблюдательных исследованиях, которые проводились в разных странах, в том числе России [16,17]. По данным недавно опубликованного мета-анализа 10 исследований (n=1358), введение тоцилизумаба у пациентов с тяжелым течением COVID-19 ассоциировалось со снижением смертности по сравнению с таковой в контрольной группе больных, которым не вводили ингибитор ИЛ-6 [18]. В то же время эффективность тоцилизумаба в профилактике неблагоприятных исходов COVID-19 не была подтверждена в нескольких недавно завершенных рандомизированных контролируемых исследованиях [19].
Результаты терапии у пациентов с COVID-19 могут зависеть от сроков введения противовоспалительных препаратов [20]. Соответственно, целью ретроспективного когортного исследования было изучение эффективности более раннего или позднего применения тоцилизумаба, т.е. до или после начала искусственной вентиляции легких (ИВЛ), в профилактике смерти у больных тяжелой COVID-19 ассоциированной пневмонией, которым потребовалась госпитализация в ОРИТ для респираторной поддержки.
Материал и методы
Дизайн исследования и критерии отбора пациентов. Ретро спективное когортное исследование проводилось в Федеральном дистанционном консультативном центре анестезиологии и реаниматологии для взрослых, созданном по приказу Минздрава РФ 16.03.2020 на базе Первого МГМУ им. И.М. Сеченова (Сеченовский Университет). В центр по интернет поступают заявки на консультацию больных с тяжелым течением COVID-19, госпитализированных в ОРИТ лечебных учреждений Москвы, Московской области и других регионов Российской Федерации. В ретроспективное исследование включали пациентов, которым консультанты центра рекомендовали введение тоцилизумаба, учитывая наличие двусторонней пневмонии, поражающей более 50% легочной ткани (т.е. 3-4 стадии) и требующей респираторной поддержки, особенно при наличии повышенной концентрации СРБ. Окончательное решение о введении тоцилизумаба принимали лечащие врачи. Следует отметить, что консультанты центра не имели информации о доступности ингибиторов ИЛ-6 в соответствующих регионах Российской Федерации и лечебных учреждениях и, соответственно, не могли предсказать, будет ли пациенту введен тоцилизумаб или нет.
Пациенты, включенные в исследование, были распределены на две когорты с учетом уровня респираторной поддержки (оксигенотерапия/неинвазивная вентиляция легких или ИВЛ) на момент инфузии тоцилизумаба или получения заявки на консультацию, если ИЛ-6 в конечном итоге не вводился.
Все пациенты подписывали информированное согласие на применение тоцилизумаба и других «экспериментальных» препаратов для лечения COVID-19 в лечебном учреждении.
Процедуры и исходы. На основании полученных заявок на консультацию регистрировали демографические показатели и сопутствующие заболевания, диагностированные до развития COVID-19 (артериальная гипертония, ишемическая болезнь сердца [ИБС], инсульт в анамнезе, фибрилляция предсердий, ожирение, сахарный диабет, бронхиальная астма, хроническая обструктивная болезнь легких [ХОБЛ], ревматические аутоиммунные заболевания, злокачественные опухоли, диагностированные в течение последних 5 лет, гемобластозы, ВИЧ-инфекция). Критериями диагноза ИБС считали острый инфаркт миокарда и/или вмешательства на коронарных артериях (стентирование или аортокоронарное шунтирование) в анамнезе. Ожирение диагностировали на основании индекса массы тела: 2 – нормальная масса тела, 25,0-29,9 кг/м 2 – избыточная масса тела, ≥30,0 кг/м 2 – ожирение. При анализе частоты ревматических заболеваний учитывали только аутоиммунные заболевания, такие как ревматоидный артрит, системная красная волчанка, системная склеродермия, псориатический артрит, анкилозирующий спондилит, системные васкулиты.
Лечение COVID-19 проводилось в соответствии с временными рекомендациями Минздрава РФ. С марта по май 2020 г. в качестве противовирусных препаратов чаще всего применяли гидроксихлорохин/хлорохин, азитромицин и лопинавир/ритонавир, реже – интерферон-β, в то время как глюкокортикостероиды в начала вспышки инфекции не рекомендовались. Доза тоцилизумаба составляла 400 мг внутривенно. Допускалось введение второй дозы препарата по решению лечащих врачей.
Результаты
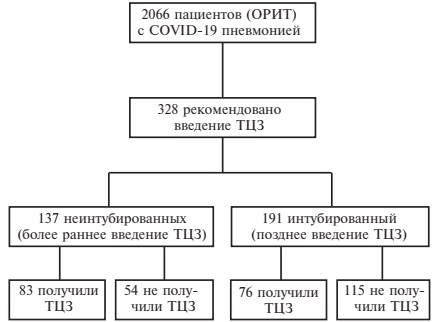
C 16 марта по 5 мая 2020 г. были получены заявки на консультацию 2066 пациентов с COVID-19, которые были госпитализированы в ОРИТ в связи с ухудшением оксигенации (рис. 1). В этой выборке 328 больным (57,0% мужчин, медиана возраста 59 лет) было рекомендовано введение тоцилизумаба. Относительно невысокая частота назначения ингибитора ИЛ-6 объяснялась тем, что в начале вспышки SARS-CoV-2 инфекции в Российской Федерации данных о возможной эффективности препарата было недостаточно.
159 из 328 пациентов получили по крайней мере одну дозу препарата 400 мг (у 21 была выполнена вторая инфузия в той же дозе с интервалом около 24 ч), в то время как оставшимся 169 больных не вводили ингибитор ИЛ-6, как правило, из-за отсутствия препарата в лечебном учреждении. Тоцилизумаб был введен 83 (60,1%) из 137 больных, которым проводились оксигенотерапия или неинвазивная вентиляция легких (НИВЛ) на момент инфузии или отправки заявки лечебным учреждением (более раннее введение тоцили зумаба), и 76 (39,8%) из 191 интубированного пациента (позднее введение тоцилизумаба) (рис. 1). В первой когорте тоцилизумаб был введен через 6 дней (интерквартильный размах 3-9) после госпитализации, а во второй – через 2 дня (интерквартильный размах 1-4) после начала ИВЛ.
Группы больных, получивших или не получивших ингибитор ИЛ-6 на фоне оксигенотерапии или НИВЛ, были сопоставимы по возрасту и полу. У больных, которым вводили тоцилизумаб, частота некоторых заболеваний, которые могут ухудшить течение COVID-19, в том числе коронарной болезни сердца, инсульта в анамнезе и сахарного диабета 2 типа, была несколько выше, чем в группе сравнения, хотя разница не достигла статистической значимости (табл. 1). В когорте интубированных пациентов группы сравнения были сопоставимы как по демографическим показателям, так и по частоте всех сопутствующих заболеваний.
Во всей выборке летальность больных, получивших и не получивших тоцилизумаб, достоверно не отличалась (46,5% и 50,3%, соответственно, p=0,509). В обеих когортах основными причинами смерти были ОРДС (91,9% и 77,6%, соответственно), сердечно-сосудистые осложнения (5,4% и 12,9%) и тромбоэмболия легочной артерии (1,4% и 2,4%). Среди неинтубированных пациентов летальность была примерно в два раза ниже, чем среди больных, находившихся на ИВЛ (32,5% и 61,8%, соответственно; p
Обсуждение
В наблюдательном когортном исследовании у больных с тяжелым течением COVID-19, госпитализированных для респираторной поддержки в ОРИТ, внутривенное введение тоцилизумаба в фиксированной дозе 400 мг не сопровождалось снижением летальности. Тоцилизумаб не увеличивал выживаемость ни у больных, находившихся на оксигенотерапии или НИВЛ, ни у пациентов, которым ингибитор ИЛ-6 вводили после начала ИВЛ. Более того, введение тоцилизумаба у неинтубированных пациентов ассоциировалось с увеличением потребности в ИВЛ. Последний результат мог частично объясняться несколько более высокой частотой некоторых сопутствующих заболеваний, ухудшающих течение COVID-19, в группе тоцилизумаба. В то же время группы интубированных пациентов, получивших и не получивших тоцилизумаб, были сопоставимы по демографическим показателям и частоте сопутствующих заболеваний. Соответственно, различия между группами не могли объяснить негативные результаты исследования в этой выборке.
Наши данные контрастируют с результатами многочисленных наблюдательных исследований, которые показали, что введение тоцилизумаба может привести к снижению потребности в ИВЛ и летальности больных с тяжелым течением COVID-19 ассоциированной пневмонии 23. В ретроспективном исследовании, проводившемся в 13 американских больницах, эффективность тоцилизумаба изучали у 630 больных с COVID-19, госпитализированных в ОРИТ для респираторной поддержки [24]. Основную группу составили 210 пациентов, которым вводили тоцилизумаб в дозе 400 мг внутривенно, контрольную – 420 больных, не получавших ингибитор ИЛ-6 и подобранных по демографическим и клиническим показателям. Во всей когорте, как и в нашем исследовании, преобладали люди пожилого возраста (в основном мужчины), страдавшие различными сопутствующими заболеваниями. Около 45% больных получали глюкокортикостероиды. Летальность в целом составила 57%, в том числе 49% в группе тоцилизумаба и 61% в контрольной группе. По данным регрессионного анализа Кокса, введение тоцилизумаба ассоциировалось с достоверным снижением риска смерти (отношение рисков 0,64, 95% ДИ 0,47-0,87; p=0,0040). Сходная ассоциация была выявлена также в подгруппах больных, находившихся на ИВЛ, и пациентов с исходным уровнем СРБ ≥150 мг/л.
В другом крупном ретроспективном американском исследовании STOP-COVID эффективность тоцилизумаба изучали у 3924 пациентов с COVID-19, поступивших в ОРИТ (62,8% мужчин, медиана возраста 62 года) [25]. 433 (11,0%) из них получили тоцилизумаб в течение первых 2 дней после госпитализации в ОРИТ. Больные группы тоцилизумаба были моложе пациентов группы сравнения (медианы 58 и 63 года, соответственно), чаще получали глюкокортикостероиды (18,7% и 12,6%) и чаще находились на ИВЛ (47,3% и 37,9%). Летальность во всей выборке составила 39,3%, в том числе 28,9% в группе тоцилизумаба и 40,6% в группе сравнения. Лечение ингибитором ИЛ-6 ассоциировалось с достоверным снижением риска смерти по сравнению с контролем (отношение рисков 0,71, 95% ДИ 0,56-0,92).
Статистически значимая ассоциация между введением тоцилизумаба (внутривенно в дозе 8 мг/кг в виде двух инфузий с интервалом 12 ч или подкожно в дозе 324 мг) и снижением риска перевода на ИВЛ или смерти (скорректированное отношение рисков 0,61, 95% ДИ 0,40–0,92; p=0,020) была выявлена и в итальянском исследовании у 544 больных с тяжелой COVID-19 ассоциированной пневмонией, 179 из которых получили ингибитор ИЛ-6 [21]. В этом исследовании доля больных, нуждавшихся в ИВЛ (18% и 16% в группах тоцилизумаба и сравнения, соответственно) и летальность (7% и 20%) были значительно ниже, чем в нашем исследовании, в том числе у пациентов, получивших более раннюю инфузию тоцилизумаба, и в описанных выше исследованиях. Таким образом, данные итальянских авторов позволяют судить об эффективности тоцилизумаба у пациентов с менее тяжелым течением COVID-19.
Заключение
В ретроспективном когортном исследовании у пациентов с тяжелой COVID-19 пневмонией, нуждавшихся в респираторной поддержке в ОРИТ, мы не выявили снижения летальности как при более раннем (до интубации), так и позднем (после начала ИВЛ) внутривенном введении тоцилизумаба в дозе 400 мг по сравнению с контрольными группами больных, получавших только стандартную терапию. Хотя полученные данные не позволяют отвергнуть эффективность тоцилизумаба, они согласуются с результатами нескольких рандомизированных клинических исследований, в которых изучался ингибитор ИЛ-6. В настоящее время продолжаются еще несколько рандомизированных контролируемых исследований, в частности RECOVERY, которые позволят оценить эффективность тоцилизумаба у пациентов с COVID-19 и возможные показания к его применению. Если по мнению врача больной с тяжелой COVID-19 пневмонией нуждается в противовоспалительной терапии, то лечение целесообразно начинать с дексаметазона, в то время как введение тоцилизумаба может обсуждаться при неэффективности глюкокортикостероидов.
Терапия отчаяния при ковиде. Ошибки врачей могут стоить жизни
Борьба с короной: что делать, как распознавать и какие ошибки не допустить?
Помимо того, что заболеваемость коронавирусом растет, медиков — как и мест в больницах — становится все меньше, результатов тестов ждут долго, те, оставшиеся в строю врачи, совершают ряд ошибок при назначении схемы лечения.
Разобраться в ситуации помогла врач-инфекционист и научный сотрудник ПСПбГМУ им. академика И. П. Павлова Оксана Станевич совместно с фондом «Не напрасно».
Мы расскажем о том, какие ошибки совершают врачи, какие обследования, помимо теста на COVID-19, показывают наличие коронавируса, почему не стоит сразу принимать антибиотики и какие лекарства необходимо иметь дома.
Ошибки врачей
На амбулаторном этапе лечения врачи из поликлиник совершают ряд ошибок, последствия которых затем приходится лечить в больничном стационаре, а некоторые из них вообще необратимы. Основные из них:
Игра вслепую
Большинство поликлинических врачей сразу назначает лекарственные препараты, не проведя должного обследования пациента. Самое плохое то, что врач в условиях отсутствия информации не может адекватно сформулировать для себя показания для госпитализации.
«Часто бывает, что люди приезжают в больницу, буквально нарушив все законы, сделав анализы самостоятельно в коммерческой лаборатории, обманув своего врача, обманув лабораторию, сказав, что он не болен ковидом, и самоходом — пешком, на личном транспорте, на такси — прибывает в больницу в тяжелом или среднетяжелом состоянии».
Какое дополнительное обследование необходимо
При заражении коронавирусом необходимо постоянно контролировать показатели сатурации, которые измеряют пульсоксиметром. Этот прибор выглядит как прищепка, которую крепят на палец. Он показывает, насколько кровь насыщена кислородом, т. е. сатурацию. Она измеряется в процентах, и нормой у здорового человека без заболеваний легких и сердечно-сосудистой системы является 98−99%.
При коронавирусной инфекции следует измерять сатурацию не менее 4 раз в день и не менее 30 секунд.
Дополнительное обследование, которое должен назначить лечащий поликлинический врач, может включать в себя исследование органов грудной клетки на компьютерном томографе (КТ), клинический анализ крови, анализ крови на с-реактивный белок* и д-димер*.
Ориентируясь по этим показателям, можно своевременно определить критерии для госпитализации, даже если показатели сатурации не отклоняются сильно от нормы.
Пример: у женщины 49 лет в течение пяти дней была температура выше 38,5, жуткий кашель, одышка. При этом сатурация не падала ниже 95%. Она сдала анализы, и значение по с-реактивному белку было 126. Норма этого показателя — до 5. Такое выраженное повышение можно рассматривать как старт цитокинового шторма*, о котором говорят как об осложнении коронавирусной инфекции. Женщина вызвала скорую помощь, врач ее послушал и ничего не услышал в легких, что бывает очень часто при ковидной пневмонии. Врач сказал ей, что анализы крови вообще ничего не значат, и уехал. Она, нарушив карантин, по знакомству пришла в больницу, где ей провели КТ-исследование, которое показало, что у нее поражено 65% легких. Это соответствует степени третьей степени поражения легких из четырех.
*Цитокиновый шторм — избыточная иммунная реакция организма на инфекцию, которая поражает органы без участия возбудителя.
*С-реактивный белок (СРБ) — высокочувствительный показатель воспалений и инфекций, реагирует на значительные повреждения тканей.
*Д-димер — интенсивности и характера процессов тромбообразования.
Значительное повышение с-реактивного белка начинается с показателя выше 50.
Слишком много лекарств
Назначение антибиотиков и гормональной терапии до госпитализации может привести к исчерпанию ресурса этих препаратов к тому моменту, когда они действительно могут понадобиться — в больнице.
Неправильные лекарства и плохо продуманная тактика лечения
Внезапно разросшаяся пандемия коронавируса не дала времени врачам разобраться, что к чему.
Бесполезные антибиотики
Одной из типовых ошибок является назначение антибиотиков. Но антибиотики никак не действуют на сам коронавирус.
Еще весной были проведены исследования «на скорую руку» и была выработана схема — сочетание азитромицина и гидроксихлорохина. В лабораторных условиях гидроксихлорохин показал положительный эффект, а антибиотик азитромицин использовали как «курьера» гидроксихлорохина внутри клетки.
На практике эта комбинация не сработала. Она не улучшала исход заболевания, и люди умирали так же часто, как и те, кто эти препараты не получал. Более того, эта комбинация не сокращает сроки госпитализации и не укорачивает пребывание вируса в организме.
Медвежья услуга
Сам по себе азитромицин изначально не работал и был просто проводником гидроксихлорохина. Даже без привязки к коронавирусу русские люди привыкли по любой заразе бить антибиотиками. И, что абсурдно, амбулаторные врачи продолжают использовать схему монотерапии азитромицина при лечении коронавирусной инфекции.
Пневмонии, вызванные различными причинами (вирусами или бактериями), по-разному поражают легочную ткань, и по этой причине тактика лечения будет отличаться.
В списке Всемирной организации здравоохранения (ВОЗ) существует 4 линии антибактериальных препаратов, которые стоит применять в тех или иных ситуациях. Пресловутый азитромицин включен во вторую линию и применяется по конкретным показаниям.
Кроме того, есть список антибиотиков, которые не рекомендуется применять в некоторых комбинациях, т. к. они имеют очень выраженные побочные эффекты.
Сейчас самая частая комбинация лечения коронавируса на догоспитальном этапе — это сочетание азитромицина и левофлоксацина. Именно эта комбинация не рекомендована ВОЗ. Она запрещена клиническими фармакологами, в том числе и в России.
Эффектная побочка
Схема гидроксихлорохина и азитромицина, которую изначально рекомендовали, имеет значительный побочный эффект. От гидроксихлорохина страдает сердечная ткань, что чревато нарушением сердечного ритма, в том числе пароксизмом фибрилляции предсердий. Нарушение ритма может вызвать остановку сердца или спровоцировать формирование тромбов.
То, что гидроксихлорохин не только не работает, но и вредит, стало понятно еще летом. Однако врачи амбулаторного и иногда стационарного звена продолжают его назначать.
Более того, он включен в клинические рекомендации и, к примеру, в Петербурге выдается бесплатно людям, которые проходят лечение от ковида дома.
Схема азитромицина и левофлоксацина также является токсичной для сердца и тоже нарушает сердечный ритм.
При приеме антибиотиков на амбулаторном этапе часто возникает антибиотик-ассоциированная диарея. За этим может скрываться более серьезное осложнение — псевдомембранозный колит. Проще говоря, это воспаление толстого кишечника, когда на его стенках возникают бляшкоподобные, похожие на мембраны образования. Проявляется это как учащение стула до 5−10 раз в сутки, но может доходить и до 20 раз.
При размножении бактерий выделяется много токсинов в кровь, что может привести к лихорадке, интоксикации, обезвоживанию и септическому состоянию. При крайней степени обезвоживания начинают страдать почки, сердце и головной мозг.
Кишечник может не работать вплоть до пареза кишки. Такое состояние можно вылечить только оперативным вмешательством, и оно потенциально опасно для жизни.
«У нас было несколько случаев, когда мы доказывали возникновение колита из-за приема антибиотиков на догоспитальном этапе. Есть анализ, который позволяет определить, что это именно псевдомембранозный колит. Это анализ стула на токсины А и Б. Даже если один токсин обнаружен, это уже колит».
К сожалению, коронавирусная инфекция просто не имеет точки приложения для использования антибиотиков. Вылечить ковид антибиотиками невозможно.
«От фатального осложнения коронавирусной инфекции — острый респираторный дистресс-синдром, когда внезапно все легкие выключаются, расширяется зона поражения, развивается дыхательная недостаточность и человек погибает — антибиотики не спасают».
Дефицит, который мы создаем сами
С весны люди в панике начали скупать все, что им казалось необходимым. Сначала это были гречка и туалетная бумага, после — лимоны, чеснок и имбирь, затем медицинские маски, и постепенно очередь дошла до элементарных ртутных термометров и лекарств.
Те, кто столкнулся с коронавирусной инфекцией поближе, могут знать о препарате дексаметазон, его аналог — преднизолон. Сейчас дексаметазон в аптеках найти практически невозможно. Появились слухи, что он якобы может вылечить цитокиновый шторм, эффективен для профилактики коронавируса или может остановить более сложное, фатальное течение ковида.
«Еще летом было проведено исследование в Великобритании, которое показало, что назначение дексаметазона действительно улучшало исход заболевания и давало возможность не развить более тяжелую дыхательную недостаточность. Однако там было одно „но“, которое почему-то опять нигде не учитывается. Преимущество дексаметазона было показано только в сочетании с кислородной поддержкой (назначают при снижении сатурации ниже 95%). При отсутствии кислородной поддержки исход не улучшался, и даже была тенденция к более плохим исходам».
При амбулаторном лечении дексаметазон не может помочь. А если вы решили его приобрести «на всякий случай», то не забудьте купить кислородный концентратор, стоимость которого варьируется в районе 60−70 тысяч рублей.
Время антибиотиков: когда нужно
На ранних сроках — до 8−9-го дня — речи об антибиотиках не может быть вообще. В этом периоде развивается коронавирусная пневмония, которую не остановить назначением антибиотиков.
У некоторых возможно присоединение вторичной бактериальной пневмонии. Это происходит чаще у людей с изначально подавленным иммунным статусом. Например, при декомпенсированном сахарном диабете.
«Когда в крови много глюкозы, у бактериальной микрофлоры больше шансов наложиться на вирусную пневмонию и стимулировать размножение бактерий в легких. У этого есть определенные лабораторные признаки. Мы не можем назначать антибиотики при сахарном диабете и ковиде для профилактики. Потому что для профилактики это не сработает, антибиотики не предотвращают вторичную бактериальную пневмонию, они ее только лечат».
Чтобы предотвратить развитие бактериальной пневмонии, необходимо снижать уровень глюкозы с помощью сахароснижающих препаратов или инсулина под контролем врача.
Признаки вторичной бактериальной пневмонии
При вторичной бактериальной пневмонии клинический анализ крови покажет повышение уровня лейкоцитов, нейтрофилов, в том числе их незрелых форм.
У пациента может появиться гнойная мокрота, окрашенная — с зеленью, ржавая, с прожилками крови. Мокрота может стать обильнее.
Еще одним признаком развития вторичной бактериальной пневмонии является повышение температуры тела до 38,5 градусов и выше на поздних сроках — 12−14 день заболевания ковидом.
Через 2 недели нахождения коронавирусной инфекции в организме и развитии ковидной пневмонии в тканях легких происходят изменения, которые наиболее удобны для присоединения бактерий и развития бактериальной пневмонии.
«Изменения в легких после ковидной пневмонии сохраняются около 8 недель после выздоровления. Это не означает, что постковидную пневмонию надо как-то лечить. Сатурация должна восстановится к концу инфекции до вашей нормы».
Терапия отчаяния
Новый вирус ввел в заблуждение все мировое медицинское сообщество, исследователей и экспертов. Что уж говорить о фельдшерах и врачах, которые приходят по вызову к нам домой. Больным ковидом выписывают и азитромицин, и арбидол, и гидроксихлорохин, и другие бесполезные, ненужные или опасные препараты.
Действительно, бывает, что врачи не знают, что назначить, и выписывают хоть что-то ради того, чтобы назначить, чтобы успокоить пациента и дать ему надежду на то, что он выздоровеет. Не стоит забывать, что они следуют утвержденным Минздравом руководствам, схемы из которых используют только в России.
«У меня начало создаваться впечатление, что амбулаторные доктора делают это не просто, чтобы назначить. Они хотят успокоить не только пациента, но и побороть свой страх перед этой инфекцией и свой страх перед осложнениями, которые могут возникнуть внезапно. Такое ощущение, что они пытаются использовать всё, но уже в качестве терапии отчаяния. Таким образом, они отдаляют момент, по их мнению, осложнений, ну и выигрывают время для себя, давая себе возможность снизить к этому пациенту бдительность. Так врач перекладывает ответственность на тех, кто эти клинические рекомендации создал».
Есть и те, кто не читал клинических исследований, не изучал мнения мировой медицинской общественности. Назначения таких врачей происходят по незнанию.
Терапия коронавируса сейчас [РЕКОМЕНДАЦИИ] Аптечка при ковиде
Эти рекомендации нашего эксперта стоит применять только после консультации с лечащим врачом.
Не забывайте, что врач обязательно должен объяснять пациенту, что и для чего он назначает.
*По материалам эфира Оксаны Станевич для фонда «Не напрасно» и личной консультации для издания «СП».








