Карбонат натрия для чего применяется
E500 Карбонаты натрия
Карбонаты натрия (Sodium carbonates, карбонат натрия, sodium carbonate, гидрокарбонат натрия, sodium bicarbonate, sodium hydrogen carbonate, натрий двууглекислый, бикарбонат натрия, смесь карбоната и гидрокарбоната натрия, sodium sesquicarbonate, Сода, E500)
Карбонаты натрия – группа химических соединений, получивших название сода, имеет несколько разновидностей:
В международной классификации пищевых добавок карбонатам натрия присвоен код Е500, вещества входят в группу эмульгаторов, регуляторов pH и веществ против слёживания. Химическое соединение Na2CO3, натриевая соль угольной кислоты.
Общая характеристика Карбонатов натрия
Карбонат натрия добывали из золы дерева под названием Salsola Soda, откуда и произошло обиходное название соединений (calorizator). По своему химическому составу Карбонат натрия представляет собой натриевую соль угольной кислоты, физические свойства соды – бесцветный кристаллический порошок с кристаллами различной конфигурации (ромбы, квадраты и мелкие круглые гранулы). Вещество хорошо растворяется в воде, спирте и эфире.
Польза и вред Карбонатов натрия
Карбонаты натрия считаются безвредной для здоровья человека добавкой, всем известен старинный способ борьбы с изжогой – размешать в половине стакана воды чайную ложку соды, и «пожар» в пищеводе будет потушен. Однако, помните, что это не способ лечения, а лишь возможность быстро избавиться от изжоги на время, не влияя на ее первопричину. Но переизбыток соды в натуральном виде может привести к резям и болям в желудке, в редких случаях – к аллергическим реакциям.
Применение Е500
Карбонаты натрия используют в пищевой промышленности как разрыхлитель, регулятор кислотности и препятствующий комкованию компонент. Чаще всего Е500 (Карбонаты натрия) встречаются в кондитерских изделиях, входят в состав большой части ассортимента выпечки, смесей для выпечки, некоторых видов колбас и мясной продукции, сухого молока и продуктов, содержащих какао-порошок.
Помимо пищевой отрасли Карбонаты натрия применяются в цветной металлургии, производстве целлюлозы, стекольном производстве, химической промышленности.
Использование Е500 в России
На территории Российской Федерации разрешено применение Е500 Карбонатов натрия в качестве пищевой добавки-эмульгатора, разрыхлителя и регулятора кислотности. Допустимая суточная норма употребления Е500 официально не определена.
Карбонаты натрия (Е500)

Раствор чаще всего применяют при готовке блюд в виде карбоната натрия, гидрокарбоната, их смеси.
Краткие сведения
Название походит из латыни, от наименования растения. В прошлые века ее усердно получали из золы. Кальцинированная сода была создана в конце 18-го века Лебланом, однако пищевая – в 1861 г. Сольвэ.
Карбонат натрия кислота получается несколькими способами. Наиболее распространенный из них – методика Сольве. Так добывают более 90% всех объемов промышленного вещества. Для этого нужен хлорид натрия, аммиак.
Вещество получается в процессе кальцинирования (увеличение температурных значений). От этого оно именуется кальцинированным. Ряд стран получает из месторождений. Также изготавливается промышленным способом в тех регионах, где отсутствуют залежи минералов.
Методики синтеза
Используют «сухой» и «мокрый» способы. В основе процесса – карбонизация (присоединение углекислоты). Отмечают перекристаллизационные преображения. Методики отличаются готовкой раствора. При сухом – кальцинированные элементы растворяются водой, а при мокром применяют технический бикарбонат.
Разложение вещества при постепенном возрастании температуры именуют декарбонизацией.
Содовые элементы раствора под влиянием диоксида углерода осаждаются. Чистая пищевая содовая часть отделяется, а маточные компоненты вновь идут на получение первичного раствора.
Главные свойства
| Систематическое наименование | Карбонат натрия |
|---|---|
| Традиционные наименования | Кальцинированная сода |
| Молекулярная масса | 105,99 г/моль |
| Плотность | 2,53 г/см3 |
| Растворимость | 21,8 г/100 мл |
Масса уникальных характеристик определила ценную роль элемента для человека. Внешний облик являет собой бесцветные кристаллические элементы. Иногда встречаются формы порошкообразного элемента беловатого окраса.
По общеобразовательным качествам пищевой эмульгатор отличается немаленькой температурой плавления (853 градуса).
Вещество не теряет своей способности отменно растворяться в водных структурах (в отличие от этанола). Особенность кроется в способности поглощать углекислоту.
Применение
Массовая доля карбоната натрия довольно весомая в кондитерстве и в кулинарии в целом. Ведь вещество просто незаменимо при приготовлении выпечки. Зачастую Е500 входит как в готовую продукцию, так и в смеси.

Сода также применяется в различных секторах промышленности. Больше всего ее применяют в стекольной промышленности, цветной металлургии, химическом производстве.
Особенности использования в кулинарии
Пищевая сода – незаменимый элемент добавки, который используется в составе изделий в роли разрыхлителя. Обнаружить ее возможно в сгущенном молоке, мармеладе, джеме, маргарине.
Взаимодействие карбоната натрия с продуктами используется во время приготовления брецелей и рулетов. Технология подобной нестандартной обработки разведенным щелочным веществом целиком оправдана. Так можно безопасно изменить кислотность продукции. В итоге это приводит к возникновению необычайно хрусткой корочки на поверхности продукции. Карбонат натрия — незаменимый элемент. Без него никогда не получится идеальная лапша. Все дело в том, что нежность содового элемента в рассоле сохраняет вкусовое качество макарон. Добавка используется при готовке шербета. Так действует карбонат и несильные кислотные элементы. При этом образуется углекислота из-за слюны.
Карбонат натрия серная кислота содержится в большинстве паст по уходу за ротовой полостью и зубными элементами. Это пенообразователь, абразив, который на время минимизирует кислотность во рту. Подобным образом предупреждаются многие недуги.
Влияние
По итогам численных мировых исследований, реакции карбоната натрия не причиняют никакого вреда клеткам организма. То есть вещество числится в категории неопасных добавок. Без передозировки никогда и никому не наносит вред.
Но определенный вред кислота карбоната все же несет.
Существуют доказанные факты, согласно которым чувствительный организм плохо переносит вещество. Возникает затруднение дыхания, обмороки.
В экспериментах показано, что формула данного вещества неблагоприятно влияет на печень и мозг живого организма. Длительное потребление продуктов с Е500 увеличивает риски появления аллергических реакций на руках и голове.
Карбонат натрия и соляная кислота – самые известные антагонисты. Об их противоположном влиянии ведомо давно. Существует даже старинный способ победить изжогу – размешать в воде соду. «Пожар» исчезнет в считанные минуты. Это никак не методика терапии. Методика действенно и скоро позволяет избавиться от изжоги на непродолжительный период. Переизбыток соды способен провоцировать рези, даже аллергические признаки.
На территории многих стран разрешено применение Е500 в качестве пищевой добавки.
Упаковка, транспортировка
Перемещают данное вещество любым транспортом, но исключительно в плотно закрытых объектах. Элемент совершенно безопасен, поскольку лишен даже минимальной токсичности. Сохраняется содовый элемент только в закрытых упаковках. Крайне важно не допустить присутствия влаги в данной структуре. На протяжении года истекает гарантийный срок на сохранение содового раствора. При этом общий срок пригодности не лимитирован.
Содовый элемент можно по праву назвать главным разрыхлителем при выпечке. Данное вещество при нагревании выделяет углекислоту. За счет этого тесто становится мягким, пушистым. Сода выступает как самостоятельное вещество для разрыхления либо в комплексном составе пекарского порошка. При этом важно не переусердствовать с дозировкой. Содовый элемент оставляет в готовом продукте довольно неприятный, но безвкусный привкус. Соду важно добавлять в муку, кислые компоненты – только в жидкость.
Карбонат натрия, характеристика, свойства и получение, химические реакции
Карбонат натрия, характеристика, свойства и получение, химические реакции.
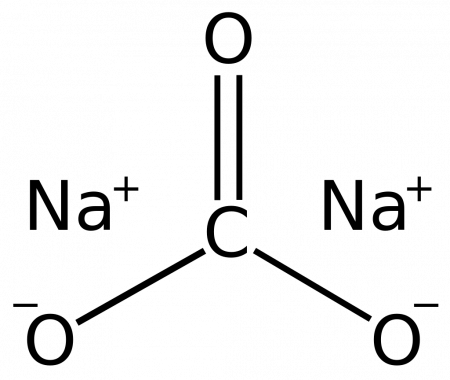
Карбонат натрия – неорганическое вещество, имеет химическую формулу Na2CO3.
Краткая характеристика карбоната натрия:
Карбонат натрия (кальцинированная сода) – неорганическое вещество белого цвета.
Химическая формула карбоната кальция Na2CO3.
Карбонат натрия (кальцинированная сода) – неорганическое соединение, натриевая соль угольной кислоты.
Карбонат натрия не следует путать с гидрокарбонатом натрия (пищевой содой) NaHCO3 и с гидроксидом натрия (каустической содой) NaOH.
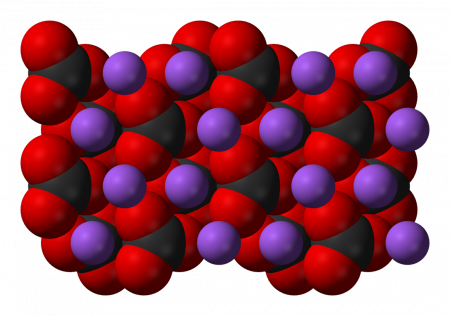
Карбонат натрия – бесцветные кристаллы, в обычных условиях представляет собой порошок белого цвета, которые плавятся при температуре 854 °C без разложения и разлагаются при дальнейшем нагревании – при температуре свыше 1000 °C.
Карбонат натрия имеет три модификации:
– α-модификация. Имеет моноклинную кристаллическую решетку, образуется при температуре до 350 °C;
– β-модификация. Образуется при нагреве свыше 350 °C и до 479 °C. Также имеет моноклинную кристаллическую решетку;
– γ-модификация. Образуется при нагреве свыше 479 °C. Имеет гексагональную кристаллическую решетку.
В природе карбонат натрия встречается в виде минералов:
– нахколита, имеющего химическую формулу NaHCO3. Нахколит – минерал подкласса карбонатов, кристаллическая форма бикарбоната натрия. Название образовано по первым буквам символов химических элементов, входящих в его состав: Na, H, C и О;
– трона, имеющего химическую формулу Na2CO3·NaHCO3·2H2O. Название трон происходит от арабского названия природной соли. Другое название трона – египетская соль;
– натрита, имеющего химическую формулу Na2CO3·10H2O. Натрит – это декагидрат карбоната натрия. Другое название натрита – натрон, кристаллическая сода или сода;
– термонатрита, имеющего химическую формулу Na2CO3·Н2O. Термонатрит – моногидрат карбоната натрия. Образуется при дегидратации декагидрата карбоната натрия Na2CO3·10H2O. Другое название термонатрита – сода или кристаллическая сода.
Карбонат натрия также встречается в золе некоторых морских водорослей.
В пищевой промышленности используется 3 типа карбоната натрия:
– добавка Е500(i) – карбонат натрия (Sodium Carbonate) с химической формулой Na2CO3;
– добавка Е500(ii) – гидрокарбонат натрия (Sodium bicarbonate, Sodium hydrogen carbonate) с химической формулой NaHCO3. Гидрокарбонат натрия именуется также питьевой содой, пищевой содой, двууглекислой содой, натрием двууглекислым, бикарбонатом натрия.
– добавка Е500(iii) – смесь карбоната и гидрокарбоната натрия (Sodium Sesquicarbonate).
Физические свойства карбоната натрия:
Получение карбоната натрия:
В промышленности карбонат натрия получают несколькими способами:
Образовавшийся CO2 возвращают в производственный цикл.
Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Способ Хоу отличается от процесса Сольве тем, что не используется гидроксид кальция.
В лаборатории карбонат натрия получают:
Химические свойства карбоната натрия. Химические реакции карбоната натрия:
Карбонат натрия – это средняя соль, образованная слабой кислотой – угольной (H2CO3) и сильным основанием – гидроксидом натрия (NaOH).
Водные растворы Na2CO3 имеют щелочную реакцию.
Для карбоната натрия характерны следующие химические реакции:
1. реакция карбоната натрия и углерода:
Na2CO3 + 2C → 2Na + 3CO (t = 900-1000 o С).
В результате реакции образуются оксид углерода и натрий.
2. реакция карбоната натрия и брома:
В результате реакции образуются бромид натрия, бромат натрия и углекислый газ. В ходе реакции карбонат натрия используется в виде концентрированного горячего раствора.
3. реакция карбоната натрия и йода:
В результате реакции образуются йодид натрия, йодат натрия и углекислый газ. В ходе реакции карбонат натрия используется в виде концентрированного горячего раствора.
4. реакция карбоната натрия и хлора:
В результате реакции образуются хлорид натрия, хлорат натрия и углекислый газ. В ходе реакции карбонат натрия используется в виде концентрированного горячего раствора.
5. реакция карбоната натрия и азотной кислоты:
6. реакция карбоната натрия и угольной кислоты:
В результате реакции образуется гидрокарбонат натрия.
7. реакция карбоната натрия и ортофосфорной кислоты:
Аналогичные реакции протекают и с другими кислотами.
8. реакция карбоната натрия и фтороводорода:
9. реакция карбоната натрия и оксида кремния:
10. реакция карбоната натрия и оксида серы:
В первом случае в результате реакции образуются углекислый газ и дисульфит натрия. В ходе реакции карбонат натрия используется в виде концентрированного раствора. Реакция протекает при температуре 40-60 o С.
11. реакция карбоната натрия и оксида алюминия:
12. реакция карбоната натрия и оксида железа:
В результате реакции образуются углекислый газ и феррит натрия.
13. реакция карбоната натрия и воды (гидролиза карбоната натрия):
В результате реакции образуются гидрокарбонат натрия и гидроксид натрия. Реакция носит обратимый характер.
14. реакция карбоната натрия, оксида кальция и воды:
В результате реакции образуются карбонат кальция и гидроксид натрия.
15. реакция карбоната натрия, оксида углерода и воды:
В результате реакции образуется гидрокарбонат натрия. Данная реакция представляет собой способ получения питьевой соды путем пропускания оксида углерода через холодный раствор карбоната натрия.
16. реакция карбоната натрия и гидроксида кальция (каустификации соды):
17. реакция термического разложения карбоната натрия:
Применение и использование карбоната натрия:
Карбонат натрия используется во множестве отраслей промышленности и для бытовых нужд:
– в бытовой химии: в стиральных и чистящих порошках;
– в производстве эмалей для получения ультрамарина;
– для смягчения воды паровых котлов;
– для уменьшения жёсткости воды ;
– для обезжиривания металлов и десульфатизации доменного чугуна;
– в пищевой промышленности в качестве пищевой добавки E500 – регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию;
– в нефтяной промышленности в сочетании с поверхностно-активными веществами для снижения межфазного натяжения между водой и нефтью ;
– в химической промышленности как исходный продукт для получения NaOH, Na2B4O7, Na2HPO4;
– в табачной промышленности (в сигаретных фильтрах);
– в фотографии в составе проявителей как ускоряющее средство;
– в моторном масле для предотвращения полимеризации (концентрация 2 г на 1 л масла).
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карбонат натрия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие карбоната натрия
реакции
Карбонат натрия
| Карбонат натрия | |||
|---|---|---|---|
| |||
| Систематическое наименование | Карбонат натрия | ||
| Традиционные названия | кальцинированная сода, углекислый натрий | ||
| Хим. формула | Na 2 CO 3 | ||
| Молярная масса | 105,99 г/моль | ||
| Плотность | 2,53 г/см³ | ||
| Температура | |||
| • плавления | 854 °C | ||
| • разложения | 1000 °C | ||
| Константа диссоциации кислоты pKa | 10,33 | ||
| Растворимость | |||
| • в воде при 20 °C | 21,8 г/100 мл | ||
| ГОСТ | ГОСТ 5100-85 | ||
| Рег. номер CAS | 497-19-8 | ||
| PubChem | 10340 | ||
| Рег. номер EINECS | 207-838-8 | ||
| SMILES | |||
| Кодекс Алиментариус | E500(i) | ||
| RTECS | VZ4050000 | ||
| ChEBI | 29377 | ||
| ChemSpider | 9916 | ||
| ЛД50 | 4 г/кг (крысы, орально) | ||
| Пиктограммы СГС |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Карбонат натрия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na 2 CO 3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Содержание
Свойства
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода.
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na2CO3·H2O. В интервале 100—120 °C моногидрат теряет воду.
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| Стандартная энтальпия образования ΔH | −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 120 | 140 |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
Нахождение в природе
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
Получение
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
Сульфид натрия реагирует с карбонатом кальция:
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)
В 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год).
Применение
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах.
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство.
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.
Безопасность
Тривиальные названия
Сода — общее название технических натриевых солей угольной кислоты.
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.