Карбонильный никель что это
Карбонил никеля
В 80-х годах прошлого века в лаборатории Людвига Монда — крупного инженера-химика и промышленника, одного из основателей химической индустрии Англии — шла работа по очистке газов от примеси окиси углерода. Окись углерода пропускали над накаленным никелем. Случайно заметили, что по окончании опыта, когда никель почти остыл, пламя отходящей окиси углерода из бесцветного сделалось белым. Непонятный факт стал интригующим, когда выяснилось, что это белое пламя на холодном фарфоре оставляет металлический налет. Казалось совершенно невероятным, чтобы такой металл, как никель, давал летучее соединение с окисью углерода. Опыты были повторены еще и еще раз. Когда избыток окиси углерода был поглощен аммиачным раствором хлористой меди и исследователям — Монду, Лангеру и Квинке — удалось сконденсировать в смеси снега с солью первые капли тяжелой бесцветной жидкости, они окончательно уверовали, что никель дает соединение с окисью углерода. Новое вещество — одно из самых интересных соединений элемента № 28 — назвали карбонил никеля. Карбонил никеля потряс воображение химиков мира. Соединение тяжелого металла с газом — жидкое, текучее, летучее, как эфир! Формула NiC4O4, не укладывающаяся ни в какие представления о валентности.
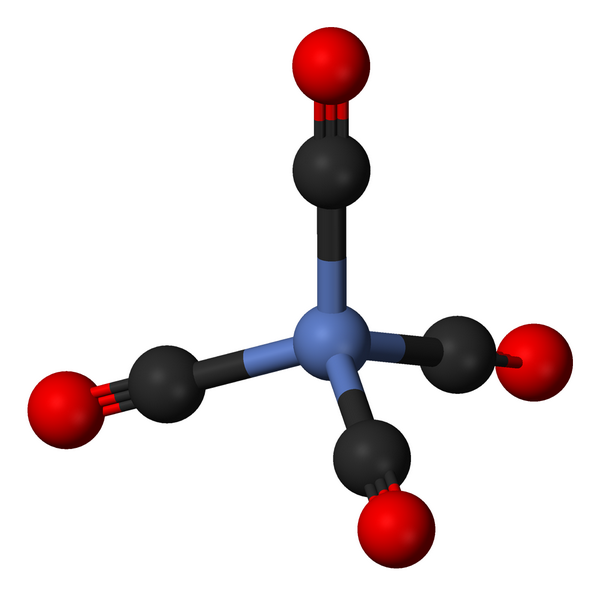
Карбонилу никеля сначала приписывали формулу
но многим химикам она казалась недостоверной. Менделеев писал: «Мне кажется, что ныне еще рановременно судить о строении столь необыкновенного вещества, как Ni(CO)4». Лишь когда развились физические методы исследования молекул (рентгеновский, электронографический, спектроскопический), удалось установить, что на самом деле молекула карбонила никеля — тетраэдр с атомом никеля в центре. Природа химических связей в карбониле никеля и сейчас остается интереснейшим объектом и для теоретиков, и для экспериментаторов.
Задолго до того, как прояснилась природа удивительной молекулы и были изучены ее химические реакции, Монд разгадал практическую ценность открытого в его лаборатории вещества; раз реакция синтеза карбонила никеля обратима, можно, действуя окисью углерода на никельсодержащий материал, «испарять» никель в виде карбонила, а затем, нагревая карбонил, получать чистый металл. Через несколько лет Монд и Лангер построили металлургический завод нового типа, где пышущие жаром металлургические печи впервые были заменены химическими реакторами.
На заводе Монда в Южном Уэльсе (он действует и ныне, являясь одним из крупнейших никелевых заводов мира) синтез карбонила никеля ведут при атмосферном давлении, а пары карбонила разлагают на движущихся — чтобы не срастались — горячих никелевых шариках. На них оседает никель из карбонила. Шарики «растут». Позже был найден другой вариант карбонил-процесса, более интенсивный: синтез карбонила никеля происходит при высоком давлении окиси углерода (до 250 атм), а разложение — в горячих полых трубах, установленных вертикально. Сверху в них подают пары или брызги карбонила, а внизу собирают выпавший никелевый «снег» — порошок из сросшихся между собой мельчайших кристаллов никеля, которые возникли при распаде молекул Ni(CO)4.
Применение карбонила никеля
«Карбонильный никель», особенно порошковый, отличается рекордной чистотой; он незаменим в производстве металлокерамики.
Термическое разложение карбонила никеля — способ получения не только металлического никеля как такового, но и никелевых покрытий. Этот способ может быть оформлен весьма элегантно. Например, нить расплавленного стекла выпускается из фильеры в камеру, содержащую пары карбонила никеля, и там покрывается блестящей пленкой. Никелированные стеклянные нити — перспективный материал для специального приборостроения и радиотехники. Редкое изящество карбонильного способа получения никеля, пожалуй, лучше всего выражено фразой Кельвина: «Монд дал крылья тяжелым металлам».
Подведем итог. Во-первых, никель и его сплавы — важные конструкционные материалы. Во-вторых, огромно значение никеля и его соединений для современной химии и химической технологии. В-третьих, он стал уже и элементом энергетики. Значит, есть все основания назвать никель трижды современным элементом.
Никель и его карбонил
Химические и физические свойства никеля и методы его применения в промышленности и технике. Свойства тетракарбонила никеля, методы синтеза этого вещества в лаборатории. Технологические процессы, которые базируются на использовании карбонила никеля.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ХАРКІВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
Кафедра неорганічної хімії
Нікель та його карбоніл
КОЛІСНИК ОЛЕКСІЯ ВАСИЛЬОВИЧА
к. н. х. доцент С. М. Кийко
1.1 Распространение в природе
1.2 Физические свойства
1.3 Химические свойства
1.5 Применение чистого никеля
2. Экспериментальная часть
2.1 Карбонил никеля: получение и свойства
2.2 Применение карбонила никеля в промышленности
2.3 Получение тетракарбонила никеля в лаборатории
3. Техника безопасности
Обсяг курсової роботи складає 35 сторінок. Робота має три розділи і 9 джерел.
Об’єктом дослідження є хімічний елемент Нікель та його карбоніл. Метою даної роботи є розгляд і вивчення основних фізичних і хімічних властивостей нікелю та методи його застосування в промисловості і техніці. Також розглянуто властивості тетракарбонілу нікелю, метод синтезу цієї речовини в лабораторії і технологічні процеси, які базуються на використанні карбонілу нікелю.
Для синтезу тетракарбонілу нікелю потрібні такі речовини як форміат нікелю, оксид ртуті, а також джерела водню і оксиду вуглецю (ІІ). Прилади і посуд, необхідні для проведення роботи, описані в експериментальній частині роботи.
Описаний метод синтезу карбонілу нікелю використовується у промисловості для отримання хімічно чистого нікелю і в інших технологічних процесах.
НІКЕЛЬ, ВЛАСТИВОСТІ НІКЕЛЯ, ВИКОРИСТАННЯ НІКЕЛЯ, АКУМУЛЯТОР ЕДІСОНА, СПЛАВИ НІКЕЛЯ, ТЕТРАКАРБОНІЛ НІКЕЛЯ, ПРОЦЕС МОНДА
Объем курсовой работы составляет 35 страниц. Работа имеет три раздела и 9 источников.
Объектом исследования есть химический элемент Никель и его карбонил. Целью данной работы есть рассмотрение и изучение основных химических и физических свойств никеля и методы его применения в промышленности и технике. Также рассмотрено свойства тетракарбонила никеля, метод его синтеза этого вещества в лаборатории и технологические процессы, которые базируются на использовании карбонила никеля.
Для синтеза тетракарбонила никеля нужны такие вещества как формиат никеля, оксид ртути, а также источники водорода и оксида углерода (ІІ). Приборы и посуда, необходимые для проведения работы, описаны в экспериментальной части работы.
Описанный метод синтеза карбонила никеля используется в промышленности для получения химического чистого никеля и в других технологических процессах.
НИКЕЛЬ, СВОЙСТВА НИКЕЛЯ, ИСПОЛЬЗОВАНИЕ НИКЕЛЯ, АККУМУЛЯТОР ЭДИСОНА, СПЛАВЫ НИКЕЛЯ, ТЕТРАКАРБОНИЛ НИКЕЛЯ, ПРОЦЕСС МОНДА
Основой современной техники являются металлы и металлические сплавы. Разнообразные требования к металлическим материалам возрастают по мере развития новых отраслей техники.
Благодаря хорошей пластичности из никеля можно получать разнообразные изделия методом деформации в горячем и холодном состоянии. Основным объектом применения никеля являются металлические сплавы. В этих сплавах никель является или основой, или одним из важных легирующих элементов, придающих сплавам те или иные необходимые свойства. Не случайно, что в течение многих лет в общем потреблении никеля расход его в качестве сплавов или легирующего элемента составляет более 80%. Остальная часть никеля применяется в чистом виде (8%) и для никелевых защитных покрытий (около 10%).
Важное значение имеют некоторые соединения никеля. Например, оксид никеля(Ш) применяется для изготовления железоникелевых и кадмиево-никелевых аккумуляторов, а карбонил используют для получения чистого металла.
В качестве сплавов никель нашел широкое применение в виде жаропрочных, кислотостойких, магнитных материалов, сплавов с особыми физическими свойствами. Особенно большое значение имеет применение никеля в качестве легирующего элемента в специальных сталях и сплавах.
Важной задачей является получение чистого никеля, не содержащего примесей. Конечное отделение никеля от других металлов часто осуществляют в виде карбонила Ni(CO)4. Это довольно простой способ, при котором получают никель высокой чистоты (до 99,99%). Полученный таким способом металл не требует дополнительной очистки электролизом. В промышленности таким методом отделяют никель от меди из конверторного пека (процесс Монда). Полученный продукт содержит 99,8% Ni.
В даной работе мы рассмотрели физические и химические свойства никеля, промышленные способы его добычи и очистки, свойства и применение химически чистого металлического никеля и его сплавов с другими металлами. Также мы изучили и описали свойства и метод получения тетракарбонила никеля, который является веществом, с помощью которого получают никель очень высокой чистоты.
1.1 Распространение в природе
1.2 Физические свойства
1.3 Химические свойства
Нагретый мелкораздробленный никель соединяется с хлором и бромом (реакция сопровождается появлением пламени):
Он реагирует также с мышьяком, сурьмой и фосфором:
Никель, содержащий большое количество фосфора, хрупок; однако небольшое содержание фосфора (около 0,3%) повышает способность металла к ковке и отливке. Под действием паров фосфора при высокой температуре образуется фосфид Ni3P2 в виде серой массы. В расплавленном состоянии никель легко поглощает углерод (до 6,25%). Соединение никеля с углеродом в твердом состоянии неустойчиво. Тем не менее при термическом разложении СО на мелкораздробленном никеле можно получить метастабильное соединение Ni3C (существование вещества установлено рентгенографически). Особенно энергично Ni реагирует с алюминием. При нагревании до 1300 0 С образуется соединение AlNi (реакция может протекать со взрывом). Кроме того, существуют соединения Al2Ni и Al3Ni, разлагающиеся при плавлении.
Металлический никель при умеренном нагревании разлагает газообразный аммиак на водород и азот. С последним никель непосредственно не соединяется. Порошкообразный металл в значительных количествах поглощает водород, особенно при повышенных температурах. Но даже при обычных условиях наблюдается значительное поглощение Н2. Несмотря на это, вопрос о существовании гидрида никеля определённого состава не решен до сих пор. На склонности никеля к окклюдированию водорода и активации его путём перехода в атомарное состояние основана способность Ni служить переносчиком водорода при гидрировании непредельных соединений, то есть его применение в качестве катализатора.
концентрированная HNO3 пассивирует металл, однако в меньшей степени, чем железо. При взаимодействии с кислотами образуются соли 2-валентного Ni.
1.5 Применение чистого никеля
Есть некоторые области техники, где чистый никель применяется или непосредственно в порошкообразном виде или в виде различных изделий, получаемых из порошков чистого никеля. Одной из областей применения порошкообразного никеля являются каталитические процессы в реакциях гидрогенизации непредельных углеводородов, циклических альдегидов, спиртов, ароматических углеводородов. Каталитические свойства никеля аналогичны тем же свойствам платины и палладия. Таким образом, химическая аналогия элементов одной и той же группы периодической системы находит отражение и здесь. Никель, как металл более дешевый, чем палладий и платина, широко применяется в качестве катализатора при гидрогенизационных процессах.
На основе применения порошков чистого никеля было освоено производство пористых фильтров для фильтрования газов, топлива и в различных областях химической промышленности.
Никель широко применяется в качестве электродов для щелочных аккумуляторов. В Германии еще в годы войны был разработан метод изготовления этих электродов из прессованных и спеченных при определенных условиях порошков чистого никеля. Этот способ стал широко применяться в Германии и других странах. Имеются сообщения о том, что пластинки для щелочных аккумуляторов, изготовленные из тонкого порошка чистейшего никеля, полученного через карбонил никеля, имеющие 80% пористости и большую поверхность, показывают высокую производительность. Подобные аккумуляторы сохраняются без разрядки при длительном хранении (примерно до одного года).
Некоторое применение никель находит в виде неорганических соединений в керамической промышленности для различных покрытий, эмалирования и других целей.
Одним из способов добычи чистого никеля является карбонильный метод, основанный на разложении тетракарбонила никеля Ni(CO)4. Это вещество и его применение описано в следующем разделе.
2. Экспериментальная часть
2.1 Карбонил никеля: получение и свойства
обработкой соединения K2[Ni(CO)(CN)3] кислотами:
или действием угарного газа и фенилмагнийбромида на хлорид никеля(ІІ):
Тетракарбонил никеля плохо растворим в воде, растворяется в эфире, бензоле, хлороформе, толуоле. Не взаимодействует с разбавленными кислотами и щелочами.
При действии хлора, брома или иода на Ni(CO)4 образуются дигалогениды никеля, например:
Кислород или воздух окисляют карбонил никеля до NiO и CO2:
Реакция сопровождается воспламенением. Смесь паров Ni(CO)4 с воздухом взрывчата.
Концентрированная серная кислота бурно (со взрывом) реагирует с карбонилом:
Сильные окислители, например, азотная кислота, царская водка или газообразный хлор превращают Ni(CO)4 в соли никеля(ІІ):
Карбонил никеля при температуре 180-200 о разлагается на свободный металл и оксид углерода(ІІ):
Эта реакция нашла применение в промышленности при производстве чистого никеля. В результате получается металл, не требующий какой-либо другой очистки. Таким способом отделяют черновой никель от примесей других металлов, в особенности при разделении меди и никеля.
Ni(CO)4 также служит для никелирования стекол и для приготовления коллоидных растворов никеля путём растворения в толуоле и последующим нагреванием.
2.2 Применение карбонила никеля в промышленности
2.3 Получение тетракарбонила никеля в лаборатории
В лабораторных условиях наиболее целесообразно получать карбонил никеля из металлического никеля и оксида углерода (ІІ) при атмосферном давлении и комнатой температуре. Однако никель должен быть в очень активном состоянии. Эта активность значительно повышается в присутствии очень небольшого количества ртути в качестве катализатора. Следы кислорода заметно подавляют активность, но небольшое количество сероводорода нарушает влияние кислорода. Для описываемого метода приготовления тетракабонила никеля сероводород не требуется.
Прибор для приготовления и хранения состоит из стеклянной трубки (Б), которая суживается с одного края и переходит в тонкую длинную трубочку (А). К концу трубочки припаян стеклянный приемник (Д) с трубкой (Г) для отвода газов и выливания Ni(CO)4 из приёмника. Другой, толстый конец трубки Б закрывают резиновой пробкой (В), в которую вставлен тройник для впуска водорода и окиси углерода. Трубку А помещают в печь поворотного типа.
Активный никель приготовляют из формиата никеля. Для этого формиат никеля смешивают с небольшим количеством оксида ртути (1% от веса формиата), и помещают в трубку Б. В трубочку А вставляют пробку из стеклянной ваты, служащей в качестве фильтра. Источники водорода и окиси углерода присоединяют к реакционной трубке посредством толстостенных резиновых шлангов достаточной длинны, необходимой для перемещения прибора. К концу стеклянной трубки Г присоединяют резиновую трубку, ведущую через ртутный клапан к стеклянному капилляру, вставленному в нижнюю часть лабораторной горелки. Горелка должна находиться в вытяжном шкафу. Пламя вызывает разрушение ядовитого карбонила никеля, сопровождающееся появлением ярко-серой окраски, являющейся чрезвычайно чувствительным индикатором этого вещества.
После охлаждения трубки до комнатной температуры её помещают в вытяжной шкаф в вертикальном положении так, чтобы газ поступал сверху. Приемник Д погружают в охладительную смесь из твёрдой углекислоты и спирта в сосуде Дьюара и дают свободно поступать оксиду углерода (ІІ). При этом необходимо наличие клапана для предотвращения засасывания воздуха в прибор через отводную трубку. После удаления водорода отводную трубку почти совсем или полностью закрывают, и угарному газу дают поступать с такой скоростью, с какой он может вступать в реакцию. Жидкий тетракарбонил никеля, как и его пары, будет поступать в приемник и замерзать, образуя белое твёрдое вещество.
После того как весь Ni(CO)4 перейдёт в приемник, отводную трубку можно закрыть и твёрдому веществу в приемнике дать расплавиться; жидкость оставляем в атмосфере оксида углерода (ІІ) до переливания её в ампулу. Карбонил никеля следует хранить в запаянных ампулах. Удобно применять следующий способ наполнения. Тетракарбонил никеля в приемнике Д замораживают. С трубки Г снимают резиновую трубку и при медленном токе окиси углерода присоединяют переходник с краном. До переходника припаивают ампулу для перелива. Ампулу переворачивают вверх и дают окиси углерода медленно проходить через кран, пока из ампулы не будет удалён воздух. Ni(CO)4 настолько подвижен, что его можно переливать из приемника в ампулу через капилляр. Ампулу следует наполнять не более чем на две трети. Жидкость в обеих емкостях замораживают, спускают давление через кран и запаивают капилляр. К крану можно припаивать другие ампулы и таким же образом собирать несколько порций препарата.
3. Техника безопасности
Основными требованиями при работе с тетракарбонилом никеля нужно:
1) Все опыты проводить в вытяжном шкафу с хорошей тягой;
2) Недопускать попадание препарата на открытые участки кожи, по возможности работать в перчатках;
3) Следить за тем, чтобы препарат случайно не смешался с другими реактивами;
4) При синтезе и опытах с карбонилом никеля осторожно и бережно работать с оборудованием;
5) Сообщать учителю или лаборанту о всех замеченных неполадках и недостатках; при плохом самочувствии обращаться в медпункт.
Применение никеля в современной технике весьма разнообразно. Он применяется в чистом виде как химически стойкий, ферромагнитный материал в аппаратостроении, как катализатор и как материал для аккумуляторов. Чистый никель применяется в значительных масштабах для защитных поверхностных покрытий: так называемое никелирование имеет большое значение для придания поверхности металлических материалов высокой химической стойкости. Большое развитие получило применение никеля в виде различных сплавов на его основе. Следует особо отметить широкое применение сплавов никеля с хромом и железом (нихромы и ферронихромы), коррозионно- и кислотостойких никелевых сплавов, жаропрочных сплавов, сплавов никеля с медью, бериллием, кобальтом, твердых сплавов, где никель необходим как связующий материал.
1. В. И. Смирнов. Металлургия никеля. Металургиздат, 1947
2. Р. А. Лидин, В.А. Молочко, Л. Л. Андреева. Химические свойства неорганических веществ. «Химия», Москва, 2000, 480 с.
3. Неорганические синтезы (сборник ІІ). Издательство иностранной литературы. Москва, 1951
4. Г. Реми. Курс неорганической химии, том II. Издательство «Мир». Москва, 1966, 837 с.
5. М. Х. Карапетьянц, С. И. Дракин. Общая и неорганическая химия. «Химия». Москва, 1993,
6. Б. В. Некрасов. Основы общей химии, том 2. «Химия». Москва, 1973, 690 с.
7. Н. С. Ахметов. Общая и неорганическая химия. Издательство «Высшая школа». Москва, 2001, 743 с.
8. Ю. Ю Лурье. Справочник по аналитической химии. «Химия». Москва, 1989, 448 с.
9. Р. Рипан, И. Четяну. Неорганическая химия, т. 2. Издательство «Мир», Москва, 1972,
Подобные документы
История открытия и технология получения никеля, места его нахождения в природе. Основные физические, химические и механические свойства никеля. Характеристика органических и неорганических соединений никеля, сферы его применения и биологическое действие.
курсовая работа [1,2 M], добавлен 16.01.2012
История происхождения никеля. Степень распространенности элемента в природе, содержание его в месторождениях руд. Получение, химические и физические свойства металла. Виды никелевых сплавов. Использование соединений и чистого никеля в современной технике.
реферат [44,0 K], добавлен 24.10.2011
Краткая характеристика суперконденсаторов. Принцип действия ионисторов различного типа, суперконденсаторов на основе гидроксида никеля. Физико-химические свойства гидроокиси никеля, способы синтеза. Получение химическим способом в лабораторных условиях.
дипломная работа [864,4 K], добавлен 13.10.2015
Общая сравнительная характеристика металлов. Кобальт и никель: получение, химические свойства. Сравнение оксидов и гидроксидов кобальта и никеля, хлориды, сульфид. Нахождение количества вещества сульфата кобальта, массы раствора по уравнению реакции.
курсовая работа [27,3 K], добавлен 14.11.2011
Изучение и анализ производства никеля сернокислого (сульфат никеля, никелевый купорос), основанного на переработке маточного раствора медного отделения ОАО «Уралэлектромедь». Характеристика основного оборудования производства никеля сернокислого.
дипломная работа [846,0 K], добавлен 19.06.2011
презентация [73,6 K], добавлен 02.05.2013
Влияния ионов титана, алюминия и углерода на микроструктуру, элементно-фазовый состав и физико-механические свойства поверхностного ионно-легированного слоя никеля. Изучение физико-химических процессов формирования ультрадисперсных интерметаллидов.
дипломная работа [1,9 M], добавлен 03.12.2012
Физические и химические методы получения наночастиц. Формирование низкоразмерных систем никеля при конденсации в сверхчистой инертной среде. Расчет изменения пресыщения в процессе наращивания конденсата. Охрана труда при выполнении эксперимента.
дипломная работа [9,1 M], добавлен 18.01.2013
Методы получения ароматических аминов: первичные, вторичные, третичные. Физические и химические свойства ароматических аминов. Галогенирование анилина свободными галогенами. Гидрирование анилина в присутствии никеля. Отдельные представители аминов.
реферат [278,6 K], добавлен 05.10.2011
статья [860,6 K], добавлен 03.03.2010
Обзор карбонильных и электролитических никелевых порошков
| В статье рассматриваются электролитические и карбонильные порошки никеля. Описаны способы производства, марки, химический состав и применение указанной продукции. |
Никель (Ni) наиболее высокой степени чистоты с содержанием металла до 99,5-99,9% производится промышленностью в виде порошка, который получают электролитическим либо карбонильным способом.
| Наименование | Цифровой индекс |
|---|---|
| Молярный (атомный) вес, г/моль | 58,68 |
| Атомный номер | 28 |
| Плотность металла Ni, г/см 3 | 8,93 |
| Т плавления, °С | 1456 |
| Степень окисляемости | 3, 2, 0 |
| Теплопроводность, Вт/(м·К) | 90,92 |
| Молярный объем, см 3 /моль | 6,62 |
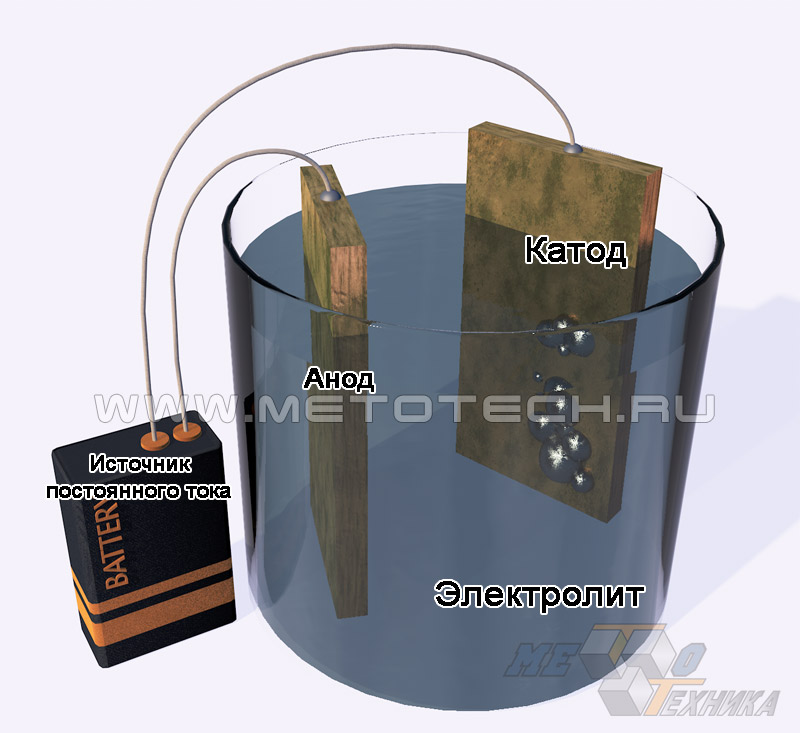
Способы изготовления
Порошок никеля электролитический, или электролизный, маркируемый как ПНЭ, получают методом электролитической диссоциации. Сущность процесса заключается в том, что сквозь насыщенный водный электролит соединения Ni или расплав его солей в течение определенного времени пропускают заряд постоянного тока. В итоге на катоде происходит выделение чистого металла, преобразуемого в порошок при дальнейшей сушке и восстановительной обработке в необходимом температурном диапазоне.
Рисунок 1. Получение никеля электролитическим методом.
Порошок никеля карбонильный, маркируемый аббревиатурой ПНК получают методом диссоциации карбонилов. Технология получения включает в себя два этапа.
На первом этапе синтезируется исходный материал – карбонил никеля Ni(CO)4 – соединение, получаемое в результате т. наз. способа Монда, когда на мелкодробленое никельсодержащее сырье воздействуют монооксидом углерода CO.
Вторая стадия заключается непосредственно в диссоциации (термическом разложении при определенной температуре) Ni(CO)4 на никелевый порошок высокой чистоты и высвобождающийся газообразный монооксид углерода.
Определение химического состава и насыпной плотности
Химический состав никелевых порошков типа ПНК и ПНЭ регламентирован ГОСТ 9722-97 «Порошок никелевый. Технические условия». Этим же документом определяются значения насыпной плотности, размеров зерен, меры безопасности, контроля, транспортировки, другие важнейшие параметры.
Следует отметить, что требования данного стандарта не относятся к порошкам Ni, которые получают путем восстановления.
Карбонильный порошок никеля (ПНК) по химическому составу разделяют на четыре категории – У, 0, 1, 2. При этом в ПНК категорий У и 0 содержится минимум 99,9%, а категорий 1 и 2 – минимум 99,7% чистого никеля (Ni).
Маркировка никелевых порошков
Промышленностью выпускаются никелевые порошки множества различных марок, отражающие такие важнейшие параметры, как химический состав, а также показатели насыпной плотности (группы и подгруппы).
Среди карбонильных порошков никеля наиболее востребованными считаются марки ПНК-УТ1, ПНК-УТ2, ПНК-УТ3, ПНК-1Л5, ПНК-1Л6. Востребованность электролизных марок ПНЭ-1 и ПНЭ-2 примерно одинакова, но в целом выше по сравнению с порошками ПНК.
Размеры зерен и значения насыпной плотности
Порошки ПНК и ПНЭ, в зависимости от марки, могут состоять из зерен различных размерных параметров, оговоренных ГОСТ 9722-97.
Диаметр зерен порошка ПНЭ-1 электролизного не может превышать значения 71,1 мкм, причем минимум 31% массы каждой партии должен быть представлен зернами диаметром ниже 45,1 мкм. В свою очередь, величина зерен ПНЭ-2 не должна превышать 251 мкм, при содержании в массе каждой из партий не менее 3% порошка с зернами размером ниже 71,1 мкм. При этом количественная доля зерен с размерными параметрами, отличающимися от требуемых, не может превышать 4% для ПНЭ-1 и 3% для ПНЭ-2.
Формы упаковки
Практическое применение
Привлекательный блеск никеля позволяет использовать его и в декоративных целях, в частности, для имитации серебра.
Очевидно, что сферы практического использования никелевых электролитических и карбонильных порошков чрезвычайно разнообразны и распространяются на электронную, электротехническую, химическую, аэрокосмическую, судостроительную, станкостроительную, металлургическую, нефтегазовую, ювелирную и множество иных производственных отраслей.
Кроме того, промышленностью, с целью расширения сферы применения, помимо «чисто никелевых» выпускаются порошки, обогащенные легирующими добавками вольфрама, железа, меди, карбида хрома, кобальта, других металлов и их соединений, в зависимости от того, какие дополнительные свойства планируется получить.
телефоны:
8 (800) 200-52-75
(495) 366-00-24
(495) 504-95-54
(495) 642-41-95