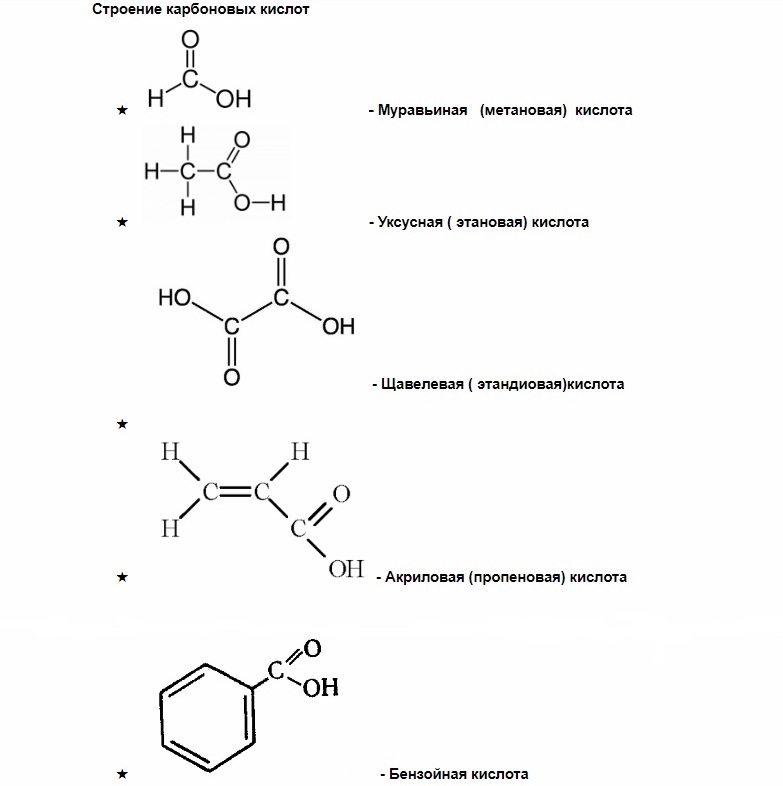
Карбоновые кислоты что это
Карбоновые кислоты
Карбоксильная группа, в свою очередь, делится на карбонильную группу С=О и гидроксильную группу О-Н.
Карбоновые кислоты — группа органических веществ, в состав которых входят одна или несколько карбоксильных групп и углеводородный радикал (алкил).
Как вы можете заметить, у муравьиной кислоты одна группа СООН, у щавелевой две, а у лимонной – целых три.
По количеству карбоксильных групп карбоновые кислоты делятся на
В зависимости от структуры углеводородного радикала карбоновые кислоты делятся на
насыщенные — (муравьиная, щавелевая) — все связи углерода одинарные.
ненасыщенные (олеиновая, линолевая) — в составе радикала, между атомами углерода есть двойные связи.
ароматические (бензойная) — в составе радикала есть бензольное кольцо. Хотя имеют специфический запах все карбоновые кислоты, эта группа особенно ароматна.
Номенклатура карбоновых кислот.
Некоторые карбоновые кислоты имеют свои народные или тривиальные названия: муравьиная, уксусная, лимонная и т.д.
Также есть официальное название кислоты в зависимости от углеводородного радикала.
Для того, чтобы правильно назвать карбоновую кислоту, нужно:
1.Определить и пронумеровать самую длинную (главную) углеродную цепочку, считая от атома карбоксильной группы.
2. Назвать согласно номенклатуре углеводород (как это сделать, можно посмотреть в учебнике Химия.10 класс под редакцией Габриеляна на портале LECTA)
Получение карбоновых кислот
Первой открыли и начали использовать уксусную кислоту. Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
На языке науки эта несложная реакция называется окислением спиртов.
Поскольку большинство из карбоновых кислот входят в состав природных продуктов, до сих пор около 30% получают из биологических объектов.
Однако карбоновые кислоты активно используются в фармацевтической, кожевенной, металлообрабатывающей промышленности и получать их химическим путем быстрее и дешевле. Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
Муравьиная кислота — в ряду карбоновых кислот эта самая скромная кислота с единственным атомом углерода в структуре обладает уникальными свойствами за счет одновременного присутствия в структуре карбонильной и карбоксильной групп.
При реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется блестящий осадок — реакция серебряного зеркала.
HCOOH + Ag2O (аммиачный раствор) 
Больше интересных материалов:
Способы получения карбоновых кислот в химической промышленности
1. При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
2 RCHO + O2 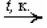
2. При помощи катализатора провести реакцию окисления спиртов
RCH2OH + O2 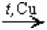
3. При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
2 C4H10 + 5O2 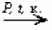
Физические свойства карбоновых кислот
Поскольку, карбоновые кислоты довольно разнородная группа веществ, говорить об общих физических свойствах, характерных для всех представителей группы неправомерно.
По количеству атомов углерода, входящих в состав вещества, карбоновые кислоты делятся на:
низшие — количество атомов от 1 до 3 — (муравьиная кислота) прозрачные жидкости с характерным запахом, отлично растворяются в воде
средние — количество атомов от 4 до 9 — ( валериановая кислота) жидкости с резким, неприятным запахом. маслянистые на ощупь.
высшие — количество атомов превышает 9 — (олеиновая кислота) — твердые вещества, нерастворяются в воде.
Молекулярная масса кислоты влияет на температуры плавления и кипения.
Плотность карбоновых кислот (за исключением муравьиной и уксусной кислот) меньше единицы.
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обратимо диссоциируют. Проверить это можно с помощью лакмусовой бумажки. Она покраснеет, как в растворе любой кислоты.
Чем длиннее радикал, тем меньше степень диссоциации, и тем меньше проявляются кислотные свойства.
2. Карбоновые кислоты по своей природе являются слабыми кислотами, и участвуют во всех реакциях, характерных для неорганических кислот. Реагируют с солями, металлами, оксидами и гидроксидами металлов. В результате образуются соли карбоновых соединений и вода.
Карбоновые кислоты.
Карбоновыми кислотами называют соединения, в которых содержится карбоксильная группа:

Карбоновые кислоты различают:
В зависимости от строения карбоновые кислоты различают:
Примеры карбоновых кислот.
Если в радикале водород поменять на любую функциональную группу, то такие кислоты называются гетерофункциональными. Среди них: аминокислоты (протон замещен на амино-группу), нитрокислоты (атом водорода замещен на нитро-группу) и т.д.
Если число атомов углерода в кислоте больше 6, то такая кислота называется жирной.
Строение карбоновых кислот.
Карбоксильная группа состоит из С=О и ОН группы. На свойства кислоты влияют оба эти показателя. В группе С=О атом углерода обладает частично положительным зарядом и притягивает неподеленную пару атома кислорода из гидроксильной группы. При этом на кислороде электронная плотность понижается и связь О-Н ослабляется:
Группа ОН «нейтрализует» положительный заряд на группе С=О, которая перестает вступать в реакции присоединения, которые так характерны для карбонильных кислот.
Как называть карбоновых кислот?
Наличие СООН группы обозначается окончанием –овая кислота.
Нумеровать цепь начинают с атома углерода карбоксильной группы, например:
Карбоксильную группу рассматривают в качестве заместителя. Например,
Изомерия карбоновых кислот.
Для карбоновых кислот характерна изомерия углеродного скелета, положение кратной связи, межклассовая изомерия, пространственная изомерия и изомерия положения функциональной группы:
Физические свойства карбоновых кислот.
Общая формула кислот CnH2n+1COOH. Низшие кислоты в нормальных условиях представляют собой жидкости, которые обладают характерным запахом. Начиная с С10 – твердые вещества.
Твердые кислоты нерастворимы в воде, а кислоты с 1-3 количеством атомов углерода неограниченно смешиваются с водой.
1. Окисление первичных спиртов перманганатом калия и дихроматом калия:
2. Гибролиз галогензамещенных углеводородов, содержащих 3 атома галогена у одного атома углерода:
3. Получение карбоновых кислот из цианидов:
При нагревании нитрил гидролизуется с образованием ацетата аммония:
При подкисления которого выпадает кислота:
4. Использование реактивов Гриньяра:
5. Гидролиз сложных эфиров:
6. Гидролиз ангидридов кислот:
7. Специфические способы получения карбоновых кислот:
Муравьиная кислота получается при нагревании оксида углерода (II) с порошкообразным гидроксидом натрия под давлением:
Уксусную кислоту получают каталитическим окислением бутана кислородом воздуха:
Бензойную кислоту получают окислением монозамещенных гомологов раствором перманганата калия:
Реакция Каннициаро. Бензальдегид обрабатывают 40-60% раствором гидроксида натрия при комнатной температуре.
Химические свойства карбоновых кислот.
В водном растворе карбоновые кислоты диссоциируют:
Равновесие сдвинуто сильно влево, т.к. карбоновые кислоты являются слабыми.
Заместители влияют на кислотность вследствие индуктивного эффекта. Такие заместители оттягивают электронную плотность на себя и на них возникает отрицательный индуктивный эффект (-I). Оттягивание электронной плотности приводит к повышению кислотности кислоты. Электронодонорные заместители создают положительный индуктивный заряд.
1. Образование солей. Реагирование с основными оксидами, солями слабых кислот и активными металлами:
Карбоновые кислоты – слабые, т.к. минеральные кислоты вытесняют их из соответствующих солей:
2. Образование функциональных производных карбоновых кислот:
3. Сложные эфиры при нагревании кислоты со спиртом в присутствие серной кислоты – реакция этерификации:
4. Образование амидов, нитрилов:
3. Свойства кислот обуславливаются наличием углеводородного радикала. Если протекает реакция в присутствие красного фосфора, то образует следующий продукт:
4. Реакция присоединения.
5. Окислительно-восстановительные реакции. При восстановлении в присутствие катализаторов:
Исключение: муравьиная кислота:
6. Реакция серебряного зеркала:
8. Декарбоксилирование. Реакцию проводят сплавлением щелочи с солью щелочного металла карбоновой кислоты:
9. Двухосновная кислота легко отщепляет СО2 при нагревании:
Карбоновые кислоты
Неспелые фрукты, щавель, барбарис, клюква, лимон… Что общего между ними? даже дошкольник, не задумываясь, ответит: они кислые. А вот обусловлен кислый вкус плодов и листьев многих растений различными карбоновыми кислотами — веществами, в состав которых входит одна или несколько карбоксильных групп —СООН.

Уксусная кислота относится к гомологическому ряду одноосновных карбоновых кислот. Низшие члены ряда при комнатной температуре представляют собой бесцветные жидкости с резким запахом. Простейшую из них — муравьиную кислоту НСООН, впервые получил в 1670 г. английский естествоиспытатель Джон Рей, нагревая муравьев в перегонной колбе. В природе широко распространены и более сложные по составу кислоты. Такова, например, масляная кислота СН3(СН2)2СООН, которая образуется при прогоркании сливочного масла — это из-за нее испорченное масло так неприятно пахнет и горчит. Она обусловливает и запах пота. Родственная ей капроновая кислота СН3(СН2)4СООН входит в состав козьего масла. В корнях растения валерианы содержится некоторое количество изовалериановой кислоты(СН3)2СН – СН2СООН— ее можно выделить, обработав высушенные корни растения перегретым водяным паром.
Высшие кислоты, например стеариновая СН3(СН2)16СООН и пальмитиновая CН3(CH2)14COOH, впервые выделенная из пальмового масла, представляют собой бесцветные твёрдые вещества, не растворимые в воде. Долгое время основным их источником были природные жиры, например свиное сало или говяжий жир. Сейчас эти кислоты получают и синтетически — каталитическим окислением углеводородов нефти. Практическое значение имеют главным образом натриевые соли этих кислот — стеарат натрия C17H35COONa и пальмитат натрия C15H31COONa: они являются основными компонентами мыла.
В щавеле, а также в ревене, кислице, шпинате содержится щавелевая кислота НООС—СООН. Эта простейшая двухосновная кислота продукт распада некоторых аминокислот, например глицина. При нарушениях обмена веществ (в частности, при недостатке витамина В12) в организме человека откладывается её малорастворимая кальциевая соль — оксалат кальция, это и есть так называемое оксалатное отложение солей. Янтарная кислота НООС—СН2СН2 – СООН впервые была выделена алхимиками. Ещё Агрикола наблюдал при прокаливании янтаря образование похожего на соль белого налета янтарной кислоты (лат sal succini volatile — «летучая янтарная соль»).
Многие карбоновые кислоты — например, яблочная, винная, лимонная, хинная — образуются в вакуолях клеток плодов при частичном окислении глюкозы и в результате некоторых других биохимических процессов. Плоды цитрусовых богаты лимонной кислотой: в мякоти апельсина её около 2%, в грейпфруте — до 3%, а в лимоне — 6%. Поэтому неудивительно, что впервые она была выделена Шееле в 1784 г. именно из лимонов. Подобный эксперимент можно проделать и в школьной лаборатории: нужно лимонный сок обработать известью, а продукт этой реакции — кальциевую соль отфильтровать и разложить серной кислотой. Образующаяся в результате лимонная кислота переходит в раствор, который упаривают до начала кристаллизации. В зелёных яблоках, крыжовнике, плодах рябины содержатся не только яблочная, хинная, но и другие органические кислоты.
В 1769 г. Шееле при действии серной кислотой на винный камень впервые получил винную кислоту НООС – СН(ОН)СН(ОН) – СООН.
Впоследствии выяснилось, что винная кислота существует в виде трёх стереоизомеров. Два из них обладают одинаковыми физическими свойствами, а их молекулы представляют собой зеркальные отражения друг друга (оптические антиподы, или энантиомеры). Это так называемые D- и L-винные кислоты, а винный камень — соль D-формы.
Интересно, что энантиомерные винные кислоты образуют кристаллы, которые также являются зеркальными отражениями друг друга. Смесь равных количеств D- и L-винных кислот (рацемат) называется виноградной кислотой. А вот третья из винных кислот – мезовинная не относится к числу оптически активных веществ.
Гомологом щавелевой кислоты является адипиновая кислота НООС(СН2)4СООН, которая получается окислением некоторых циклических соединений. Она входит в состав чистящих средств для удаления ржавчины, а также служит исходным веществом для производства полиамидных волокон.
Карбоновые кислоты — это производные УВ, содержащие функциональную карбоксильную группу —СООН.
Карбоксильная группа (карбоксил) — сложная функциональная группа, состоящая из карбонильной и гидроксильной групп:
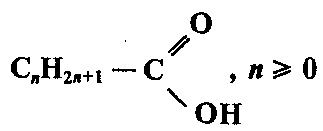
Общая формула карбоновых кислот:
где m — число карбоксильных групп, он определяющее основностъ кислоты.
По основности кислоты делятся на:
— одноосновные (монокарбоновые), m = 1;
— двухосновные (дикарбоновые), m = 2;
— трехосновные (трикарбоновые), m = 3 и т. д.
Примерами дикарбоновых кислот являются:
В зависимости от строения углеводородного радикала R карбоновые кислоты делятся на:
— предельные (насыщенные), R = алкил;
— непредельные (ненасыщенные) — производные непредельных УВ;
— ароматические — производные ароматических УВ.
Насыщенные монокарбоновые кислоты
Наибольшее значение имеют насыщенные монокарбоновые кислоты, их общая формула:
Важнейшие представители гомологического ряда этих кислот представлены в таблице. В этой таблице приведены названия кислот RCOOH и кислотных остатков RCOO-.
В структуре карбоновых кислот часто выделяют также кислотные радикалы, или ацилы. Названия некоторых ацилов:
Номенклатура и изомерия
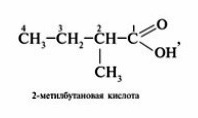
При составлении названий кислот, имеющих сложное строение, иногда также используют тривиальные названия кислот, соответствующие наиболее длинной прямой цепи. В этом случае атомы углерода в прямой цепи обозначают греческими буквами, начиная с атома углерода, соседнего с карбоксильной группой: α (альфа),β (бета), γ (гамма), δ (дельта) и т. д., например:
Внутри класса предельных монокарбоновых кислот возможна только изомерия углеродной цепи. Первые три члена гомологического ряда (НСООН, СН3СООН, С2Н5СООН) изомеров не имеют. Четвертый член ряда существует в виде двух изомеров:
Пятый член ряда существует в виде четырех изомеров:
Монокарбоновые кислоты изомерны сложным эфирам карбоновых кислот:
Физические свойства
В твердом и жидком состояниях молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей:
Водородная связь в кислотах сильнее, чем в спиртах, поэтому температуры кипения кислот больше температур кипения соответствующих спиртов.
В водных растворах кислоты образуют линейные димеры:
Химические свойства
Для насыщенных монокарбоновых кислот характерна высокая реакционная способность. Это определяется главным образом реакциями карбоксильной группы (разрыв связей О—Н и С—О), а также реакциями замещения атомов «Н» у α-углеродного атома:
Реакции с разрывом связи О—Н (кислотные свойства, обусловленные подвижностью атома водорода карбоксильной группы)
Предельные монокарбоновые кислоты обладают всеми свойствами обычных кислот.
1.Диссоциация
В водных растворах монокарбоновые кислоты ведут себя как одноосновные кислоты: происходит их ионизация с образованием иона водорода и карбоксилат-иона:
Карбоксилат-ион построен симметрично, отрицательный заряд делокализован между атомами кислорода карбоксильной группы:
Делокализация стабилизирует карбоксилат-ион.
Карбоновые кислоты являются слабыми кислотами. Наиболее сильной в гомологическом ряду насыщенных кислот является муравьиная кислота, в которой группа —СООН связана с атомом водорода. Алкильные радикалы в молекулах следующих членов гомологического ряда обладают положительным индукционным эффектом (+1) и уменьшают положительный заряд на атоме углерода карбоксильной группы. Это в свою очередь ослабляет полярность связи О—Н и тем в большей степени, чем больше УВ радикал. Поэтому в гомологическом ряду кислот их сила уменьшается с ростом числа атомов углерода в молекуле:
2.Образование солей:
а) взаимодействие с активными металлами:
в) взаимодействие со щелочами (реакция нейтрализации):
д) взаимодействие с солями более слабых кислот (карбонатами и гидрокарбонатами):
II. Реакции с разрывом связи С—О (замещение ОН-группы)
1.Взаимодействие со спиртами с образованием сложных эфиров (реакция этерификации):
2.Взаимодействие с аммиаком с образованием амидов кислот:
Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли, которую затем нагревают:
3.Взаимодействие с галогенидами фосфора (РСl5, РСl3) или тионилхлоридом SOCl2 с образованием галогенангидридов карбоновых кислот:
4.Межмолекулярная дегидратация карбоновых кислот с образованием ангидридов:
Ангидриды представляют собой производные кислот, состоящие из двух соединенных через кислород кислотных радикалов (ацилов).
Ангидриды получают при пропускании паров кислот над водоотнимающим средством (Р2О5):
Смешанные ангидриды карбоновых кислот можно получить при взаимодействии хлорангидрида одной кислоты и соли другой кислоты:
Аналогично можно получать ангидриды, содержащие остатки одной кислоты.
III. Реакции с разрывом связей С—Н у α-углеродного атома (реакции с участием радикала)
Атомы водорода у α-углеродного атома более подвижны, чем другие атомы водорода в радикале кислоты, и могут замещаться на атомы галогена с образованием α-галогенкарбоновых кислот:
Особенности строения и свойств муравьиной кислоты
Муравьиная (метановая) кислота НСООН по своему строению и свойствам отличается от остальных членов гомологического ряда предельных монокарбоновых кислот.
1.В отличие от других карбоновых кислот в молекуле муравьиной кислоты функциональная карбоксильная группа связана не с углеводородным радикалом, а с атомом водорода. По этой причине, как уже было отмечено выше, муравьиная кислота является наиболее сильной кислотой по сравнению с другими членами своего гомологического ряда.
2.В молекуле муравьиной кислоты наряду с карбоксильной группой можно выделить также альдегидную группу:
Поэтому муравьиная кислота вступает в реакции, характерные как для кислот (см. свойства предельных монокарбоновых кислот), так и для альдегидов. В частности, как и альдегиды, НСООН проявляет восстановительные свойства. Муравьиная кислота легко окисляется до угольной кислоты:
В роли окислителей молт выступать аммиачный раствор оксида серебра (I) Аg2О и гидроксид меди (II) Cu(OH)2. Таким образом, особенностью муравьиной кислоты является то, что для нее характерны качественные реакции на альдегиды:
а) реакция «серебряного зеркала»:
б) реакция с гидроксидом меди (II):
Специфическим свойством муравьиной кислоты является также ее способность разлагаться на оксид углерода (II) и воду под действием концентрированной серной кислоты (эта реакция — еще одно доказательство того, что H2SО4 является хорошим водоотнимающим агентом):
Способы получения предельных монокарбоновых кислот
I. Общие способы получения
1.Окисление первичных спиртов и альдегидов под действием различных окислителей:
2.Окисление алканов кислородом воздуха (в присутствии катализаторов — солей марганца или при нагревании под давлением).
Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:
3. Омыление сложных эфиров (т. е. их щелочной гидролиз):
4.Гидролиз галогенангидридов кислот:
II. Способы получения важнейших кислот
НСООН
Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) и подкислением образующегося формиата натрия серной кислотой:
Муравьиная кислота образуется также при нагревании щавелевой кислоты:
СН3СООН
1.Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино, пиво):
2.Синтетическую уксусную кислоту для химической промышленности получают различными методами:
а) окислением бутана (см. выше);
б) окислением ацетальдегида:
в) синтезом из метанола и оксида углерода (II):
Применение важнейших насыщенных монокарбоновых кислот
Ненасыщенные (непредельные) монокарбоновые кислоты
Непредельные монокарбоновые кислоты – это производные алкенов, алкинов, алкадиенов и других ненасыщенных УВ. Наибольшее значение имеют непредельные кислоты с двойными связями.
Важнейшие представители
Для ненасыщенных монокарбоновых кислот чаще всего используют тривиальные названия:
Важнейшими высшими непредельными карбоновыми кислотами являются:
Олеиновая кислота С17Н33СООН
Линолевая кислота С17Н31СООН
Линоленовая кислота С17Н29СООН
Изомерия
Для ненасыщенных кислот характерны такие же типы изомерии, как для непредельных УВ: изомерия цепи, изомерия положения двойных связей, цис-транс-изомерия:
Химические свойства
Химические свойства ненасыщенных монокарбоновых кислот обусловлены наличием в их молекулах карбоксильной группы и двойной связи. Реакции с участием карбоксильной группы — это реакции, характерные для всех карбоновых кислот: замещение атомов водорода в ОН-группе (кислотные свойства), замещение ОН-группы (этерификация, образование галогенангидридов и др.).
Реакции с участием двойных связей — это реакции углеводородного радикала.
Для УВ радикала ненасыщенных карбоновых кислот характерны реакции присоединения, окисления, полимеризации. Наиболее важными из реакций присоединения являются гидрирование и присоединение галогенов:
Скачать:
Скачать бесплатно реферат на тему: «Ангидриды карбоновых кислот» Ангидриды-карбоновых-кислот.docx (212 Загрузок)
Скачать бесплатно реферат на тему: «Уксусная кислота» Уксусная-кислота.doc (209 Загрузок)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42