Кардиопротективное действие что это
КАРДИОПРОТЕКТОРЫ В ЛЕЧЕНИИ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Кардиопротекторы — это препараты, устраняющие дисфункцию сердечной мышцы и предупреждающие ее необратимые поражения. Их защитный, или протекторный эффект связан со способностью снижать артериальное давление, уменьшать пульс и потребность миокарда в кислороде, улучшать проходимость сосудов, питающих сердце, препятствовать прогрессированию атеросклероза и уменьшать риск тромбоза в коронарных артериях.
В группе прямых кардиопротекторовявляется разделение по основным точкам приложения их действия: моделирующие функцию клеточной мембраны, стабилизирующие клеточные мембраны, влияющие на обмен веществ в миокарде. Примером лекарственных средств, моделирующих функцию клеточных мембран, являются препараты группы антагонистов кальция. Стабилизация клеточных мембран происходит за счет уменьшения интенсивности перекисного окисления липидов, что способствует более эффективному использованию углеводов в качестве источника энергии, стабилизации мембран митохондрий, лизосом. Перечень препаратов данной группы включает: мельдоний, токоферол, препараты супероксиддисмутазы, церулоплазмин, триметазидин, фосфокреатинин.
Лекарственные средства, влияющие на обмен веществ в миокарде, проявляют свое влияние за счет сохранения в миокарде пула креатинфосфата, повышения содержания АТФ вследствие угнетения окисления жирных кислот и использования в качестве источника энергии глюкозы. Примерами таких препаратов могут служить: мельдоний, триметазидин, L–карнитин, никотиновая кислота, инсулин.
Наиболее известным представителем кардиопротекторовявляется мельдоний, который способен оказывать положительное влияние на дисфункцию эндотелия и приводить к нормализации сосудистого тонуса. Исследования показали целесообразность включения этого препарата в комплексное лечение пациентов с ИБС.
Мельдоний является структурным синтетическим аналогом гамма-бутиробетаина. Снижает синтез карнитина и транспорт длинноцепочечных жирных кислот через клеточные мембраны, препятствует накоплению в клетках активированных форм неокисленных жирных кислот. При ишемии предупреждает нарушение транспорта АТФ и активирует гликолиз. В результате снижения синтеза карнитина повышается содержание гамма-бутиробетаина, оказывающего вазодилатирующее действие.
Таким образом, кардиопротекторы, действие которых направлено на стабилизацию метаболизма миокарда, должны являться обязательным компонентом терапии ИБС.
Кардиопротекция у пациентов с высоким сердечно-сосудистым риском
Определение и виды кардиопротекторов, критерии кардиозащитного действия, ишемическая болезнь сердца, применение антигипоксантов (триметазидин, мельдоний).
Эта статья в формате видеолекции здесь.
Данная статья посвящена теме метаболической терапии при различных ишемических состояниях и также широко рассматривается на наших курсах повышения квалификации по терапии, кардиологии и функциональной диагностике.
В соответствии с рекомендациями Европейского общества кардиологов (ESC) к категории пациентов высокого и очень высокого суммарного риска развития смертельных сердечно-сосудистых событий относятся:
— пациенты с систолическим артериальным давлением (САД) более 180 мм.рт.ст. и/или диастолическим артериальным давлением (ДАД) более 110 мм.рт.ст.;
— пациенты с САД более 160 мм.рт.ст. и низким ДАД (менее 70 мм.рт.ст.); больные с сахарным диабетом (СД) 2-го типа; больные метаболическим синдромом;
— пациенты с тремя факторами риска и более;
— лица с одним или более субклиническим органным повреждением (гипертрофия левого желудочка (ГЛЖ), подтвержденная на ЭКГ и ЭхоКГ, утолщение комплекса интима-медиа или атеросклеротическая бляшка по данным ультрасонографии, повышение уровня сывороточного креатинина, снижение клубочковой фильтрации (СКФ) или клиренса креатинина, микроальбуминурия (МАУ) или протеинурия);
— пациенты с уже имеющимся подтвержденным сердечно-сосудистым
заболеванием, в том числе с анамнезом перенесенного острого коронарного синдрома (ОКС).
В течение первых 9-12 месяцев после перенесенного ОКС у больных сохраняется:
— высокий уровень активности тромбоцитов, выделяющих тромбоксан А, что способствует повышенному образованию тромбина;
— инфильтрация атеросклеротических бляшек воспалительными клетками (макрофагами, Т-лимфоцитами);
— повышенное разрушение коллагена и других компонентов соединительной ткани в месте разрыва атеросклеротической бляшки (длительное незаживление дефекта);
— усиленная констрикторная активность сосуда в области стеноза.
Все это обуславливает наиболее высокий риск повторного ОКС и острого инфаркта миокарда или инсульта именно в этот период времени!
Дополнительное повышение риска ишемических осложнений ассоциировано с:
— пожилым возрастом;
— привычными интоксикациями;
— ранее перенесенными сосудистыми катастрофами;
— тяжестью сопутствующей патологии: сахарный диабет (СД), анемия, хроническая болезнь почек (ХБП).
Согласно точкам приложения, КПр делятся на:
1. моделирующие функцию клеточной мембраны: антагонисты кальция.
2. стабилизирующие клеточные мембраны митохондрий, лизосом: мельдоний, токоферол, препараты супероксиддисмутазы, церулоплазмин, триметазидин, фосфокреатин.
3. влияющие на обмен веществ за счет сохранения пула креатинфосфата (КФ), увеличения содержания АТФ, вследствие угнетения окисления жирных кислот и использования в качестве источника энергии глюкозы: мельдоний, триметазидин, L-карнитин, фосфокреатин, никотиновая кислота, инсулин.
Источником энергии в организме является глюкоза (гликоген) и жирные кислоты. Существует прямая зависимость между концентрацией жирных кислот в организме и развитием внезапной смерти. Высокие концентрации жирных кислот блокируют в клетках кальциевый, натриевый и калиевый насосы, а также АТФ насос.
Триметазидин безопасен у подавляющего большинства больных, не влияет на гемодинамику и при этом значимо улучшает переносимость ишемии, способствует уменьшению частоты ангинозных приступов; повышает толерантность к физическим нагрузкам, улучшает сократительную способность миокарда. Имеются данные положительного влияния данного препарата после перенесенного инфаркта миокарда на снижение смертности и предупреждение сердечно-сосудистых осложнений, в том числе повторных ОКС, реваскуляризаций и госпитализаций.
Все перечисленное отразилось на включении триметазидина в международные и отечественные рекомендации по ведению больных: стабильной ишемической болезнью сердца (класс рекомендации IIb, уровень доказательности – В); хронической сердечной недостаточностью (класс рекомендации IIb, уровень доказательности – А); подвергшихся коронарному шунтированию; перенесенным инфарктом миокарда.
В качестве вторичной профилактики сердечно-сосудистых заболеваний в список препаратов метаболического действия включен мельдоний, обладающий антиангинальными и вазопротекторными эффектами, а также способностью улучшать когнитивные функции.
Согласно официальным инструкциям, к лекарственным препаратам, содержащим в своем составе мельдония дигидрат, он может применяться при стенокардии, инфаркте миокарда, хронической сердечной недостаточности, дисгормональной кардиомиопатии, при острых и хронических нарушениях мозгового кровообращения (инсульты и цереброваскулярная недостаточность), при пониженной работоспособности и физическом перенапряжении (в том числе у спортсменов), в послеоперационный период для ускорения реабилитации, при синдроме абстиненции при хроническом алкоголизме (в комбинации со специфической терапией алкоголизма).
В клинической практике длительное использование мельдония показало, что он обладает выраженным антиишемическим и антиангинальным действием у широкого круга пациентов с ИБС.
Мельдоний оказывает кардиопротективное действие как в условиях острой, так и при хронической ишемии. Оптимизируя метаболизм кардиомиоцитов, мельдоний обладает не только антиангинальным действием, но и способствует жизнеспособности и функциональной активности хронически ишемизированного миокарда. Его прием в комплексном лечении ИБС уменьшает частоту приступов стенокардии в среднем на 55,6%, а потребность в нитроглицерине на 55,1%, достоверно увеличивая толерантность пациентов к физической нагрузке на 28,7%, с улучшением качества жизни на 27,8%. Это может быть отнесено к лицам молодого и пожилого возраста, а также пациентам, страдающим СД и имеющим болевую и безболевую ишемию.
Включение мельдония в период постгоспитальной реабилитации острого инфаркта миокарда ускоряет восстановление физической толерантности и оказывает позитивное влияние на состояние параметров систолодиастолической функции левого желудочка. Мельдоний обладает антитромбоцитарным действием: ингибируя агрегацию и адгезивную активность тромбоцитов, препятствует росту внутрикоронарного тромбоцитарного тромба, ингибирует вход кальция в тромбоциты и подавляет высвобождение серотонина из тромбоцитов, частично принимает участие в ингибировании образования из каскада арахидоновой кислоты тромбоксана А2, изменяет текучесть мембраны эритроцитов и тромбоцитов.
Мельдоний не влияет на параметры гемодинамики, его механизм действия в корне отличается от механизмов, на которые воздействуют антиангинальные препараты с гемодинамическими эффектами. Это позволяет эффективно использовать комбинацию мельдония с другими антиангинальными препаратами и получать синергистические защитные эффекты.
Принимая во внимание результаты проведенных исследований, а также различные точки приложения и механизмы действия данных кардиопротекторов, рационально использовать комбинированную кардиопротекцию с целью увеличения эффективности общего действия терапии.
Выводы:
У коморбидных пациентов высокого сердечно-сосудистого риска, перенесших острый коронарный синдром, раннее добавление к триметазидину вспомогательных кардиопротекторов с их последующим курсовым приемом (предпочтительнее мельдоний) в дополнение к комплексной терапии ишемической болезни сердца безопасно в отношении гемодинамических параметров и способствует:
— улучшению прогноза больных, потенциированию снижения частоты рецидива коронарных событий и госпитализаций по поводу декомпенсации кардиоваскулярной патологии в первый год после пересенной коронарной «катастрофы»;
— улучшению качества жизни больных, облегчению клинического течения ИБС, снижению частоты развития эпизодов стенокардии и ее эквивалентов, снижению потребности в органических нитратах;
— повышению результативности медицинской реабилитации, профилактике хронической сердечной недостаточности и уменьшению частоты осложнений (в том числе аритмий) в постинфарктном периоде.
Кардиопротективные свойства антигипертензивных лекарственных средств
Всовременных рекомендациях по диагностике и лечению артериальной гипертензии (АГ) основная цель лечения определена как достижение максимального снижения долгосрочного риска сердечно-сосудистых осложнений (ССО).
Всовременных рекомендациях по диагностике и лечению артериальной гипертензии (АГ) основная цель лечения определена как достижение максимального снижения долгосрочного риска сердечно-сосудистых осложнений (ССО). Достичь этой цели возможно как за счет снижения повышенного артериального давления (АД), так и путем коррекции сопутствующих факторов риска. У всех пациентов с АГ следует снижать АД по меньшей мере до уровня 140/90 мм рт. ст. и ниже при хорошей переносимости.
В настоящее время основной концепцией антигипертензивной терапии является органопротекция, которая предполагает, с одной стороны, защиту органов-мишеней от повреждений, с другой — восстановление уже имеющихся в них структурных и функциональных изменений.
Если говорить о сердце как органе-мишени, то последствиями негативного воздействия на него повышенного АД являются гипертрофия миокарда левого желудочка (ЛЖ), развитие фиброза, различные варианты ремоделирования, апоптоз, что в конечном итоге повышает риск развития ССО.
На ранних стадиях артериальной гипертонии развитие гипертрофии миокарда является результатом структурной адаптации ЛЖ к повышенной нагрузке давлением. По результатам Фремингемского исследования эхокардиографические признаки гипертрофии миокарда ЛЖ были отмечены у 5–49% женщин и у 8–33% мужчин в возрасте от 30 до 70 лет. Степень гипертрофии ЛЖ определяют наследственные и конституциональные факторы (пол, возраст), факторы питания (избыточный вес, чувствительность к соли), а также состояние симпатической нервной и ренин-ангиотензин-альдостероновой (РААС) систем. Результаты многочисленных клинических исследований показали, что гипертрофия миокарда является независимым фактором риска развития ССО, таких как стенокардия напряжения, аритмия, инфаркт миокарда и сердечная недостаточность.
Гипертрофия миокарда ЛЖ (ГМЛЖ) приводит к нарушению функциональных свойств миокарда, причем в первую очередь нарушается его диастолическое наполнение, а затем и систолическая функция. При ГМЛЖ нарушается коронарное кровообращение, что проявляется снижением коронарного резерва и недостаточной перфузией субэндокардиальных слоев миокарда. При наличии ГМЛЖ частота желудочковых аритмий также повышается.
Риск развития коронарной недостаточности, желудочковых нарушений ритма сердца при увеличении массы миокарда левого желудочка на 50% возрастает по меньшей мере вдвое.
Было отмечено, что в группе с выраженной гипертрофией ЛЖ риск сердечной недостаточности возрастает в 5 раз. У 30–40% больных с признаками сердечной недостаточности отмечается нормальное состояние систолической функции, т. к. на ранних стадиях гипертрофического ремоделирования возникают прежде всего нарушения диастолического наполнения ЛЖ и признаки диастолической дисфункции. Таким образом, у больных АГ диастолическая дисфункция является самостоятельным фактором развития сердечной недостаточности. Говоря о кардиопротективных свойствах лекарственных средств (ЛС), мы в первую очередь оцениваем их влияние на ГМЛЖ.
Ретроспективный анализ клинических исследований показал, что антигипертензивная терапия, уменьшающая ГМЛЖ, позволяет добиться снижения риска ССО.
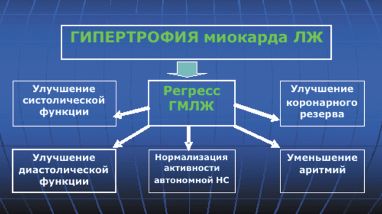
К чему приведет снижение массы миокарда ЛЖ в результате приема антигипертензивных ЛС? В настоящее время доказано, что регресс ГМЛЖ сопровождается улучшением систолической функции, уменьшением миокардиального фиброза и улучшением диастолической функции ЛЖ, увеличением коронарного резерва, нормализацией локальной нервной системы и уменьшением аритмий, что в конечном счете может снизить риск ССО и улучшить прогноз (рис. 1).
Поэтому, говоря о «кардиопротективности» применительно к антигипертензивным ЛС, мы предполагаем не только способность ЛС снижать ГМЛЖ, но и их способность влиять на жесткие конечные точки, такие как сердечно-сосудистая смертность и другие показатели сердечно-сосудистого риска.
Поскольку пусковым фактором развития ГМЛЖ является повышенное АД, следует предположить, что любой антигипертензивный препарат способен вызывать регресс ГМЛЖ.
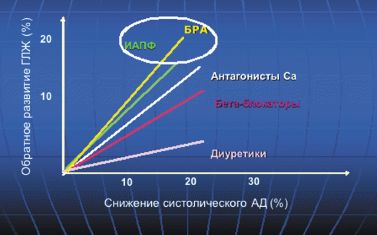
В настоящее время вопрос о влиянии различных антигипертензивных ЛС на процессы гипертрофического ремоделирования миокарда ЛЖ остается в центре внимания. В 90-х годах был опубликован ряд обзоров клинических исследований, сравнивающих эффективность различных групп антигипертензивных препаратов на степень регресса ГМЛЖ. Авторы четырех наиболее крупных метаанализов, в которых проводилось сравнение разных групп препаратов по способности вызывать регресс гипертрофии ЛЖ, пришли к согласованному заключению — наиболее эффективно уменьшают ГМЛЖ препараты, снижающие активность РААС, — на 11,8–15% от исходного уровня.
В работе Klingbeil и соавт. (метаанализ 80 двойных слепых клинических исследований) также показано, что наибольшая степень снижения индекса массы миокарда ЛЖ на 13% была отмечена у больных, получавших терапию блокаторами рецепторов ангиотензина (БРА), на 11% — антагонистами кальция пролонгированного действия (АК), на 10% — ингибиторами ангиотензин-превращающего фермента (АПФ), на 8% — диуретиками, на 6% — бета-адреноблокаторами (БАБ) (рис. 2).
Таким образом, лидирующие позиции в этом списке также занимают блокаторы ренин-ангиотензиновой системы — ингибиторы АПФ и БРА, что свидетельствует о высокой роли активации ангиотензиновых рецепторов 1 типа в процессах развития гипертрофии миокарда ЛЖ.
Ингибиторы АПФ и блокаторы рецепторов ангиотензина
Кардиопротективные свойства ингибиторов АПФ и БРА заключаются не только в их способности вызывать регресс гипертрофии миокарда ЛЖ за счет блокады компонентов циркулирующей и тканевой РААС. Потенциальные кардиопротективные эффекты, такие как антиишемическое и антиаритмическое действие, связаны с возможностью этих препаратов восстанавливать нарушенную функцию эндотелия, стимулировать высвобождение оксида азота и простациклина за счет снижения деградации брадикинина, уменьшать потребность миокарда в кислороде за счет регрессии гипертрофии миокарда, снижать активность симпато-адреналовой системы, обусловленной стимуляцией ангиотензина II.
Нами были изучены долгосрочные эффекты различных ингибиторов АПФ и БРА на процессы ремоделирования у больных АГ. Было выявлено достоверное снижение показателей ГМЛЖ на фоне длительной (до трех лет) терапии ингибиторами АПФ эналаприлом, рамиприлом и каптоприлом и БРА ирбесартаном и телмисартаном (рис. 3). Динамика снижения показателей суточного мониторирования АД за период наблюдения была однонаправленной и достоверно значимой при лечении всеми препаратами. При анализе динамики снижения индекса массы миокарда ЛЖ было отмечено более выраженное достоверно значимое снижение данного показателя в группе больных, получавших терапию БРА, что согласуется с данными ряда других исследований.
Особого внимания заслуживают антиишемические свойства ингибиторов АПФ, которые были подтверждены рядом клинических исследований. Так, в исследовании HOPE (Heart Outcomes prevention evaluation study) с рамиприлом (ингибитор АПФ с высокой аффинностью к тканевой АПФ) было включено 9297 больных старше 55 лет с высоким риском ССО. Через 4,5 года наблюдения было отмечено достоверное снижение риска развития острого инфаркта миокарда, инсульта и коронарных событий, требующих проведения реваскуляризации, — то есть тех осложнений, которые являются привычными «спутниками» прогрессирующего атеросклеротического процесса. Результаты этого исследования еще раз подтвердили обоснованность и правомочность концепции, согласно которой предупреждение сердечно-сосудистой заболеваемости и смертности возможно путем блокады РААС на тканевом уровне.
Клиническое изучение антиишемических свойств ингибиторов АПФ у больных АГ в сочетании с ишемической болезнью сердца (ИБС), стабильной стенокардией напряжения было проведено на нашей кафедре. Под влиянием лечения периндоприлом и эналаприлом у больных АГ в сочетании с ИБС, стабильной стенокардией напряжения хорошая антигипертензивная эффективность сочеталась с антиангинальным эффектом и положительной динамикой показателей теста с физической нагрузкой. У больных, получавших терапию периндоприлом, отмечено также снижение суммарной продолжительности эпизодов ишемии миокарда (по результатам Холтеровского мониторования ЭКГ), уменьшение проявлений дисфункции эндотелия, улучшение диастолической функции миокарда у больных с нарушениями релаксации, а также улучшение локальной сократимости миокарда в виде уменьшения количества гипокинетичных сегментов как в покое, так и на высоте физической нагрузки (в условиях проведения стресс-ЭХО-КГ).
В последние годы стали широко доступны результаты крупных многоцентровых клинических исследований, посвященных изучению различных аспектов кардиопротекции относительно нового класса антигипертензивных ЛС — блокаторов рецепторов ангиотензина II. Так, в клиническом исследовании LIFE (Losartan Intervention For Endpoint reduction in hypertension) кардиопротективные свойства лозартана оценивались у 9193 больных АГ с ГМЛЖ по амплитудным критериям ЭКГ. Больные были разделены на группы лечения лозартаном или атенололом. В случае недостаточного контроля АД к терапии добавляли гидрохлортиазид. Длительность лечения составила в среднем 4,8 года. Между группами не было различий по исходным показателям АД и степени снижения АД на фоне активного лечения. В группе больных, получавших лозартан, было отмечено более выраженное снижение количественных признаков гипертрофии миокарда, чем в группе атенолола. Риск развития ССО был на 13% меньше в группе лозартана (23,8 событий на 1000 больных в год), чем в группе атенолола (27,9 событий на 1000 больных в год). Смертность ССО в группе лозартана была недостоверно ниже.
В рандомизированном двойном слепом исследовании CATCH (Candesartan Assessment in the Treatment of Cardiac Hypertrophy) было проведено сравнение эффективности кандесартана (8–16 мг/сут) и эналаприла (10–20 мг/сут) у больных АГ с ГМЛЖ (по данным ЭХО-КГ — индекс массы миокарда ЛЖ (ИММЛЖ) > 100 г/м 2 у женщин и > 120 г/м2 у мужчин). Длительность наблюдения составила 1 год. В обеих группах отмечалось достоверное снижение ИММЛЖ (10,9 ± 15,5% и 8,4 ± 17,4%, p 2 у больных, получавших комбинированную терапию. У больных, получавших монотерапию эналаприлом, снижение данного показателя составило 3,9 ± 23,9 г/м 2 (p
Кардиопротекция в работе врача общей практики: важно или некогда?
Рассмотрено применение кардиопротекторов, являющихся вспомогательными (адъювантными) лекарственными препаратами, которые можно использовать как в острых ургентных ситуациях, так и в длительной плановой терапии коморбидных больных.
Application of cardioprotectors which are additional (adjuvant) preparations which can be used both in acute urgent situations, and in long-term planned therapy of comorbid patients, was considered.
Медикаментозные средства, обладающие кардиопротективным эффектом, должны влиять на клеточный метаболизм, ионный гомеостаз, структуру и функцию мембран. В связи с этим все препараты, обладающие кардиопротективными свойствами, можно разделить на кардиопротекторы прямого действия, которые уменьшают воздействие экзо- и эндогенных факторов на кардиомиоциты и кардиопротекторы непрямого действия, опосредованно уменьшающие нагрузку на сердечную мышцу.
К миокардиальным цитопротекторам (кардиопротекторам) прямого действия относятся препараты, влияющие на энергетические процессы в клетке (триметазидин, мельдоний, АТФ); анаболические средства (нандролон, калия оротат, инозин, метандиенон); противоаритмические средства (амиодарон, аймалин, дизопирамид, лидокаин, пропафенон); средства, уменьшающие потребность миокарда в кислороде (органические нитраты, молсидомин); α- и β-адреноблокаторы (метопролола сукцинат, карведилол, бисопролол), селективные блокаторы медленных кальциевых каналов (верапамил, амлодипин, фелодипин); антиоксиданты (токоферол, эмоксипин, витамин С); электроноакцепторы (цитохром С, рибофлавин); ингибиторы Na-H-каналов (амилорид); средства, открывающие АТФ-зависимые K-каналы (никорандил).
Кардиопротективный эффект антиаритмиков обусловлен, прежде всего, их антиангинальным, коронарорасширяющим и антиадренергическим действием, приводящим к уменьшению потребности миокарда в кислороде. При этом антиадренергические свойства, например, амиодарона в отличие от β-блокаторов связаны не только с блокадой, но и с уменьшением количества рецепторов на поверхности кардиомицитов. Кроме того, основной эффект данного класса лекарственных препаратов, заключающийся в снижении практически на треть случаев аритмической смерти, является свидетельством как косвенной опосредованной кардиопротекции, так и прямого влияния на калиевые и натриевые каналы в мембране кардиомиоцитов.
Все бета-адреноблокаторы (БАБ) посредством отрицательного ино-, хроно, батмо- и дромотромпного эффектов обладают антиишемическими свойствами, что в условиях гипоксии может быть расценено в качестве кардиопротекции. Однако истинной миокардиальной цитопротекцией обладают далеко не все представители данного класса сосудистых препаратов, а лишь липофильные β-адреноблокаторы. Благодаря липофильности метапролола сукцината, бисопролола, карведилола они способны проникать через клеточные мембраны и обеспечивать цитопротекцию в отношении кардиомиоцитов. С другой стороны, липофильность обеспечивает проникновение этих препаратов через гематоэнцефалический барьер, приводя к блокаде центральных β-адренорецепторов и повышая тонус nervus vagus, что имеет важное значение в механизме антифибрилляторного действия. Превентивное кардиопротективное действие, в частности снижение внезапной смерти в отдаленном постинфарктном периоде, в значительной мере обусловлено именно этим эффектом БАБ. Кроме того, в литературе имеются сведения о благоприятном влиянии БАБ на ранние стадии развития атеросклероза [1].
Кардиопротективный эффект блокаторов кальциевых каналов (БКК) (антагонистов кальция) заключается в препятствии входу кальция в кардиомиоциты и гладкомышечные клетки и уменьшении потребности миокарда в кислороде из-за снижения его сократимости. Кроме того, антагонисты кальция уменьшают постнагрузку на сердце вследствие дилатации периферических артерий, уменьшения артериального давления (АД). Расширяя коронарные сосуды и способствуя замедлению прогрессирования атеросклероза, данный класс лекарственных препаратов является предпочтительным при подтвержденном спазме венечных артерий с позиции вторичной профилактики ишемической болезни сердца (ИБС) [2]. Важным аспектом кардиопротективного действия БКК является снижение жесткости сосудистой стенки, улучшение эндотелийзависимой вазодилатации за счет увеличения продукции оксида азота, торможение окислительного стресса и ослабление коронаровазоконстрикторного действия эндотелина-1 [3].
Снижение повышенного АД является наиболее важным кардиопротективным механизмом основных классов антигипертензивных препаратов. Однако результаты многочисленных исследований ингибиторов ангиотензинпревращающего фермента (иАПФ) позволяют смело утверждать о существовании кардиопротекции, независимой от снижения АД. К миокардиальным цитопротективным эффектам иАПФ относят обратное развитие гипертрофии миокарда левого желудочка и миокардиофиброза, замедление дилатации левого желудочка и ремоделирования сердца, предотвращение развития толерантности к нитратам, выработку эндотелием оксида азота, а также уменьшение ишемии при остром коронарном синдроме, реперфузионном повреждении миокарда, в условиях «оглушенного миокарда» и при кардиоплегии [4].
Метаанализ 23 рандомизированных плацебо-контролируемых исследований, включавших в себя более 87 тысяч пациентов, показал, что блокада ренин-ангиотензин-альдостероновой системы (РААС) на 33% снижает общий риск развития фибрилляции предсердий. Данный факт может быть объяснен свойством блокаторов рецепторов ангиотензина II (БРА) уменьшать активность таких мощных проаритмогенных веществ, как ренин, ангиотензин II и альдостерон, повышенные концентрации которых у «сосудистых» больных тесно коррелируют с высокой вероятностью рецидивирования пароксизмов мерцательной аритмии, мощным триггером для возникновения которых является хроническая сердечная недостаточность (ХСН) и системное воспаление. Кроме того, под влиянием БРА снижается концентрация специфических пептидов, которые стимулируют образование коллагена в левом желудочке, а, следовательно, сартаны обладают способностью тормозить фибротические процессы в миокарде, что выражается в снижении эхоплотности последнего.
БРА (сартаны), являясь хорошими антиоксидантами, селективно блокируя рецепторы первого типа и частично возбуждая рецепторы клеточных мембран, в т. ч. ангиотензиновые рецепторы второго типа кардиомиоцитов, нормализуют апоптоз и приводят к усилению синтеза оксида азота. Кардиопротекция, обусловленная эффектами сартанов, связана также с подавлением пролиферации гладких миоцитов сосудов. Блокада ангиотензиновых рецепторов первого типа нарушает стимулирующее влияние ангиотензина II на пролиферацию гладкомышечных клеток, что может использоваться в качестве потенциального подхода к профилактике и снижению риска развития ИБС. Большинство БРА обладает урикозурической активностью — способностью понижать уровень мочевой кислоты в сыворотке крови, увеличивая ее экскрецию почками. Согласно нашим данным гиперурикемия наблюдается у 25–50% «сосудистых» больных и является самостоятельным фактором риска прогрессирования артериальной гипертензии, ишемической болезни сердца, нарушения толерантности к глюкозе и дислипидемии. И, наконец, стимуляция ангиотензиновых рецепторов первого типа ангиотензином II неминуемо, посредством активации НАДФ-оксидазы, приводит к оксидативному стрессу во всех органах, тканях и клетках сердечно-сосудистой системы. Именно БРА, блокируя эти рецепторы, уменьшают оксидативный стресс, способствуя нормализации клеточного и тканевого метаболизма [5].
Препаратами, опосредованно влияющими на функцию сердечной мышцы, также являются средства, влияющие на реологические свойства крови (ацетилсалициловая кислота (Аспирин), клопидогрел, тикагрелор, гепарины, фениндион), а также вещества, влияющие на липидный обмен (статины, фибраты, эссенциальные фосфолипиды).
Лекарственные препараты, влияющие на первичный (сосудисто-тромбоцитарный) и вторичный (коагуляционный) гемостаз, уменьшая риск тромбообразования, также являются опосредованными кардиопротекторами. Ацетилсалициловая кислота замедляет производство в тромбоцитах простагландинов и тромбоксана A2, что обусловливает ее антитромботическое и кардиопротективное действие, убедительно доказанное впоследствии во многих крупных исследованиях и метаанализах. Различные антикоагулянты, воздействуя на разные звенья каскада тромбообразования, уменьшают риск тромботических событий и улучшают реологические свойства крови, тем самым играя одну из ведущих ролей во вторичной вазо- и кардиопротекции [6].
За последние годы проведено большое количество исследований, показавших наличие у статинов ряда кардиопротективных эффектов. Доказано, что под влиянием статинов происходит снижение синтеза ангиотензина II и уменьшение активности эндотелина-1, что приводит к восстановлению барьерной функции эндотелия и минимизации эндотелиальной дисфункции. На фоне лечения статинами отмечается уменьшение гипертрофии и фиброза кардиомиоцитов, наблюдается уменьшение частоты рецидивирования фибрилляции желудочков, желудочковых тахикардий и пароксизмов мерцательной аритмии [7]. Статины обладают свойством улучшать сократительную способность миокарда, улучшая его перфузию и снижая внутриклеточную концентрацию ионов кальция [8]. Одним из самых распространенных плейотропных эффектов статинов является их способность уменьшать продукцию провоспалительных цитокинов, а также снижать уровни супероксидазы и малонового диальдегида, которые являются основными маркерами оксидативного стресса у «сосудистых» больных [9].
Таким образом, проанализировав прямые и косвенные кардиопротективные свойства основных классов фармакологических средств, используемых в терапии социально значимых заболеваний, можно сделать вывод об отсутствии у них специфического влияния на метаболические процессы, происходящие в кардиомиоците в целом и в митохондриях в частности. В основе современной концепции кардиопротективной метаболической терапии должны лежать достаточно агрессивное воздействие на свободные жирные кислоты (СЖК), своевременная профилактика их повреждающих воздействий и нормализация обменных процессов в сердечной мышце. При столь широком выборе медикаментозных средств для кардиопротективной терапии целенаправленным метаболическим эффектом, нацеленным именно на устранение митохондриальной дисфункции, утилизацию миокардом СЖК и восстановление гликолитического расщепления углеводов, обладают лишь некоторые из них — препараты, блокирующие парциальное окисление СЖК, так называемые p-FOX-ингибиторы (partial fatty and oxidation inhibitors).
Среди представителей этого нового класса лекарственных средств выделяют препараты первого (карнитин, триметазидин, ранолазин) и второго поколений (этомоксир, мельдоний).
Механизм действия карнитина связан с усилением метаболизма глюкозы, ограничением токсического влияния недоокисленных СЖК, длинноцепочечных ацетил-КоА и ацетил-карнитина на кардиомиоциты, а также с интенсификацией кровотока в венечных сосудах [10]. Комбинированный метаболический препарат, содержащий в себе L-карнитин и пропионат в условиях клеточной и тканевой гипоксии, вызванной ишемией миокарда, помогает осуществлению энергетических процессов цикла Кребса за счет легко метаболизируемого пропионата, который быстро трансформируется в сукцинат, не требуя дополнительного энергообеспечения [11]. Другим производным пиперазина, обладающим самой большой доказательной базой среди всех p-FOX-ингибиторов первого поколения, является триметазидин. Широкомасштабные многоцентровые клинические исследования TRIMPOL II [12] и TRIUMPH [13] продемонстрировали его влияние на угнетение β-окисления СЖК внутри митохондрий, что способствовало частичному переключению биоэнергетических процессов биосинтеза АТФ с окисления жирных кислот обратно на окисление глюкозы, тем самым рационализируя путь обеспечения энергией кардиомиоцитов при дефиците кислорода [14].
Ранолазин является ингибитором натриевых каналов, приводит к снижению концентрации внутриклеточного натрия, профилактируя механическую дисфункцию миокарда. Кроме того, препарат оказывает метаболическое влияние на миокард через стимулирование окисления глюкозы и частичное ингибирование окисления СЖК [15]. В рандомизированных исследованиях MARISA [16] и CARISA [17], которые включали большое число больных со стабильной стенокардией, были подтверждены антиангинальный и антиишемический эффекты ранолазина, при отсутствии негативного влияния препарата на выживаемость пациентов на протяжении года [18]. Также в исследовании MERLIN ранолазин продемонстрировал антиаритмическую активность в отношении желудочковой тахикардии, суправентрикулярной тахикардии, пароксизмов фибрилляции предсердий [19].
p-FOX-ингибитор второго поколения этомоксир имеет очень ограниченные экспериментальные свидетельства своего ингибирующего влияния на потребление кислорода в условиях ишемии миокарда, посредством воздействия на карнитино-пальмитиновый ферментный комплекс [20]. Клинические проявления эффективности этомоксира по данным небольших исследований заключаются в улучшении функциональной активности левого желудочка и уменьшении его ремоделирования [21].
Следующим широко изученным кардиопротективным препаратом, считающимся в настоящее время универсальным (ИБС, ХСН, АГ, СД, дислипидемии, хирургическая практика и т. д.) корректором метаболизма, является другой p-FOX-ингибитор второго поколения — мельдоний, механизм действия которого принципиально отличается от всех вышеописанных способов воздействия на обменные процессы в миокарде. Мельдоний регулирует интенсивность β-окисления СЖК вне митохондрии, посредством влияния на их транспорт. Невозможность поступления внутрь митохондрий длинноцепочечных СЖК при продолжающемся проникновении в митохондрии и окислении там короткоцепочечных СЖК, с одной стороны, способствует поддержанию энергетических процессов, использующих в качестве субстрата СЖК, а с другой стороны — защищает кардиомиоциты от пагубного воздействия продуктов распада недоокисленных жирных кислот [22].
Исследования MILSS [23], MILSS I [24], MILSS II [25] показали мощные лечебные антиишемические и антиаритмические эффекты мельдония у коморбидных пациентов с инфарктом миокарда (в т. ч. при остром коронарном синдроме (ОКС) [26]), артериальной гипертензией, хронической сердечной недостаточностью, фибрилляцией предсердий, а также у больных, перенесших аортокоронарное шунтирование.
Таким образом, из всего перечня препаратов, способных оказать положительный метаболический эффект на кардиомиоциты, непререкаемые доказательства эффективности имеют триметазидин и мельдоний. Эффективность применения триметазидина и мельдония в отношении, в том числе, перекисного окисления липидов, липидного состава крови, маркеров воспаления достаточно широко подтверждена рядом клинических исследований. Полученные исследователями данные показывают сопоставимое достоверное снижение в крови продуктов перекисного окисления липидов и СЖК [27]. Однако триметазидин не мешает накоплению активированных ЖК в митохондриях, что в условиях активации свободно-радикальных процессов при ишемии может стать причиной образования дополнительных токсических пероксидов [28]. Основные биохимические различия триметазидина и мельдония закономерно отражаются на выборе практического врача в конкретной клинической ситуации. Как было сказано выше, все парциальные ингибиторы окисления свободных жирных кислот частично ограничивают скорость их окисления, но делают это по-разному. p-FOX ингибиторы 1-го поколения (триметазидин) тормозят скорость окисления жирных кислот внутри митохондрий, а p-FOX ингибиторы 2-го поколения (мельдоний) ограничивает транспорт СЖК через мембраны кардиомиоцитов.
Таким образом, задумываясь о необходимости миокардиальной цитопротекции и коррекции митохондриальной дисфункции кардиомиоцитов, практикующий врач должен помнить, что в его арсенале есть перечень кардиопротекторов, являющихся вспомогательными (адьювантными) лекарственными препаратами, которые можно использовать как в острых ургентных ситуациях, так и в длительной плановой терапии коморбидных больных.
Литература
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва