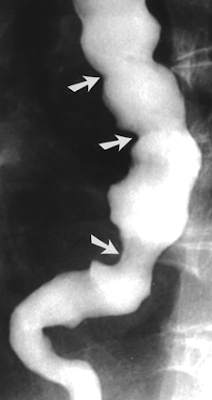
Кардия пищевода зияет что это значит
gormed.su
Недостаточность кардии
Заказать звонок
Часто наличие рефлюкса – заброса пищи из желудка в пищевод – является следствием недостаточности кардии или слабости соответствующего сфинктера. Если вас мучает изжога, отрыжка и неприятный вкус во рту после еды, непременно запишитесь на консультацию к гастроэнтерологу в Клинику профессора Горбакова. Мы сможем вам помочь!
Недостаточность кардии желудка – заболевание, обусловленное несостоятельностью гастро-эзофагеального сфинктера. Сфинктер – это мышечное кольцо, расположенное между абдоминальной частью пищевода и кардиальным отделом желудка. Его роль заключается в предотвращении обратного заброса желудочного содержимого в пищевод. При функциональной недостаточности сфинктера барьер между этими двумя органами нарушается. Из-за слабости мышечного кольца возникают рефлюксы химуса в пищевод, эпителий которого не защищен от агрессивных воздействий соляной кислоты и желудочных ферментов. Это приводит к повреждению слизистой оболочки пищевода, возникновению эзофагита, язв, эрозий и рака.
Недостаточность кардии желудка бывает первичной и вторичной:
Симптомы недостаточности кардии
Как и для большинства заболеваний, симптомы недостаточности кардии делят на общие и местные.
Местными симптомами являются:
Данная патология не является первостепенной и чаще всего сопровождает гастрит, эзофагит, грыжу пищеводного отверстия диафрагмы и другие патологии органов пищеварения, которые и являются главной причиной недостаточности кардии.
К общим симптомам относят:
Все эти симптомы формируются на фоне нарушения функций желудочно-кишечного тракта.


Если пациент полный и страдает ожирением, то необходимо обязательно снизить вес до нормальных показателей, так как это значительно уменьшит внутрибрюшное давление и нагрузку на сфинктер.
Стоит также отказаться от курения, употребления алкогольных напитков и газировок. Это в значительной степени снимет раздражающее действие агрессивных веществ на слизистую пищевода.
Необходимо соблюдение строгой диеты, включающей в себя продукты легко усвояемые и быстро перевариваемые, чтобы разгрузить желудок. Необходимо также избавиться от привычки есть на ночь, а лучше всего полностью сменить образ жизни. Основу нового режима должно составлять регулярное занятие спортом, раздельное питание и уход за собой. Необходимо избавиться от сжимающей одежды: тугих поясов, ремней и корсетов.
Стоимость лечения недостаточности кардии с использованием средств зависит от основного заболевания и его стадии. Из фармпрепаратов могут применять следующие группы лекарств:
и другие лекарственные препараты, спектр которых определяется доктором после обследования пациента.
Специалисты Клиники профессора Горбакова рады видеть вас на приеме!
Патология кардии характеризуется медленно прогрессирующим течением. Наилучшие прогнозы лечения делаются тогда, когда моторика пищевода не успевает подвергнуться необратимым изменениям, поэтому очень важно своевременно посетить гастроэнтеролога. С такой проблемой, как патология кардии можно обратиться в клинику НЕОМЕД, в которой ведет прием опытный специалист.
В клинике эксплуатируется современное диагностическое оборудование. Часто патология является следствием какой-либо болезни, поэтому точная диагностика особенно важна. Врач назначает комплексное лечение, включающее устранение причины болезни, саму патологию и ее следствия.
Описание
Симптомы
Причины
Болезнь приводит к нарушению проходимости пищевода, проявляется нарушениями глотания, болью за грудиной, приступами изжоги и другими симптомами, зависящими от стадии болезни.
Также в итоге нарушаются пищеводный тонус и перистальтика, процесс попадания из пищевода в желудок пищевых масс. Расстройства перистальтики проявляются в хаотичных беспорядочных сокращениях гладкой мускулатуры дистальных и средних отделов пищевода. Амплитуда сокращений бывает увеличенной или резко сниженной.
Патология кардии может развиться практически в любом возрасте, однако наиболее часто наблюдается в 20-50 лет (пол не имеет значения). Принято выделять четыре стадии развития болезни, которые при отсутствии лечения медленно переходят одна в другую. При отсутствии своевременного лечения могут развиться такие осложнения как общее истощение, медиастинит, прободение стенки пищевода, кровотечение и даже рак пищевода. Поэтому заметив у себя тревожные симптомы, человек должен немедленно пройти обследование в хорошей клинике у гастроэнтеролога.
Клиническая картина патологии кардии отличается постепенным и неуклонным прогрессированием признаков болезни. Современной медицине известны следующие симптомы:
Принято считать, что главная причина появления патологии кардии – поражение парасимпатической нервной системы. Также патология может стать следствием:
Полностью причины развития патологии кардии установлены и подтверждены не были.
Диффузный спазм пищевода (эзофагоспазм). Дискинезия пищевода (K22.4)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
В зависимости от механизмов нарушения двигательной активности пищевода различают два варианта эзофагоспазма:
— первичный (идиопатический) эзофагоспазм;
— вторичный (рефлекторный) эзофагоспазм.
Отдельные авторы, кроме того, выделяют гиперкинетические и гипокинетические варианты заболевания, представленные в следующей классификации (Трухманов А.С., 1997):
1. Нарушения перистальтики грудного отдела пищевода:
Этиология и патогенез
Этиология диффузного спазма пищевода неизвестна.
В зависимости от механизмов нарушения двигательной активности пищевода различают два варианта эзофагоспазма.
Гиперкинетические варианты дискинезий пищевода сопровождаются усилением тонуса и моторики пищевода как во время глотания, так и вне его.
Эпидемиология
Возраст: преимущественно от 30 до 70 лет
Признак распространенности: Распространено
Соотношение полов(м/ж): 0.3
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Изжога встречается у 20% пациентов.
Диагностика
Автор. Nevit Dilmen 1994
Эзофагоманометрия (манометрия пищевода)
У определенного процента больных результаты исследования могут не отличаться от нормы, у других при проведении манометрии пищевода обнаруживаются:
— спастические сокращения стенок пищевода в виде волн различной формы и амплитуды, во время которых давление в пищеводе превышает 30 мм.рт.ст.;
-эпизоды нормальной перистальтики, позволяющие дифференцировать эзофагоспазм от ахалазии;
— рефлекторное расслабление нижнего пищеводного сфинктера, неполная его релаксация.
Суточный мониторинг рН в нижней трети пищевода выявляет эпизоды ГЭР, о чем говорит падение показателей рН ниже 4. Регистрируется общее количество рефлюксов, число эпизодов продолжительностью более 5 минут, длительность самого большого эпизода, средняя продолжительность рефлюкса, общее время исследования, в течение которого значение рН было ниже 4.
Возможно применение метода внутрипищеводной импедансометрической диагностики моторной функции пищевода.
Лабораторная диагностика
Обязательные исследования: общий анализ крови.
Дополнительные исследования: биохимический анализ крови (общий белок, глюкоза, АлАТ, АсАТ, амилаза, ЩФ).
Дифференциальный диагноз
Осложнения
Лечение
Немедикаментозное лечение подразумевает профилактику повышения внутрибрюшного давления: больные должны избегать выполнения частых наклонов туловища, подъема тяжестей, переедания.
Медикаментозное лечение
Комплексное лечение должно быть направлено на устранение спазма гладкой мускулатуры и восстановления нормальной перистальтики пищевода.
Назначают прием за 30-40 минут до еды блокаторов медленных кальциевых каналов; антихолинергических средств (атропин, платифиллин и др) или нитратов (изосорбида ди- и мононитраты).
Для большинства больных (эмоционально лабильных пациентов), целесобразно применение седативных средств и антидепрессантов.
Вопрос о применении прокинетиков остается спорным. Осуществляется лечение осложнений, в частности рефлюкс-эзофагита (антисекреторные средства, антациды, цитопротекторы).
Хирургическое лечение
Проводится лишь у некоторых больных с тяжелым течением заболевания и при неэффективности комплексной диетомедикаментозной терапии.
У эмоционально стабильных пациентов наблюдаются лучшие результаты оперативного лечения.
Актуальность проблемы
Дуодено-гастральный рефлюкс (ДГР) — одна из самых распространенных патологий верхних отделов желудочно-кишечного тракта, по данным разных источников, данное нарушение занимает 50-90% от всех заболеваний ЖКТ. Более того, за последние годы прослеживается рост количества заболевших. У пациентов с дуоденогастральным рефлюксом нередко также диагностируется хронический гастрит, в том числе рефлюкс-гастрит типа С, щелочной гастрит, язвенная болезнь желудка, функциональная диспепсия, грыжа пищеводного отверстия диафрагмы и ГЭРБ, пищевод Барретта, дуоденостаз, дисфункция сфинктера Одди, постхолецистэктомический синдром, рак желудка и целый ряд других заболеваний.
Следует знать, что ДГР способен привести к тяжелому гастриту и эзофагиту, стать причиной метаплазии желудка и пищевода, а также плоскоклеточного рака пищевода, который развивается на фоне метаплазии; это подтверждено клиническими исследованиями.
Таким образом, в результате патологического рефлюкса дуоденального содержимого в желудок течение многих органических и функциональных патологий ЖКТ может осложняться. Поэтому огромное значение должно уделяться своевременной диагностике, правильной клинической интерпретации и адекватной медикаментозной терапии.
При неэффективности консервативной коррекции показано хирургическое вмешательство, целью которого является укрепление пилорического жома, а также снижение количества забрасываемой желчи в желудок.
Есть данные о том, что на фоне ДГР желудка часто развиваются симптомы поражения системы дыхания, появляется синдром боли в грудной клетке, который не связан с коронарной патологией. Кроме того, у некоторых пациентов дуоденогастральный рефлюкс может вызвать рецидивирующий катаральный фарингит и пароксизмальный ларингоспазм. Однако у трети больных диагностируется «чистый» дуодено-гастральный рефлюкс, в этом случае можно говорить об изолированном диагнозе.
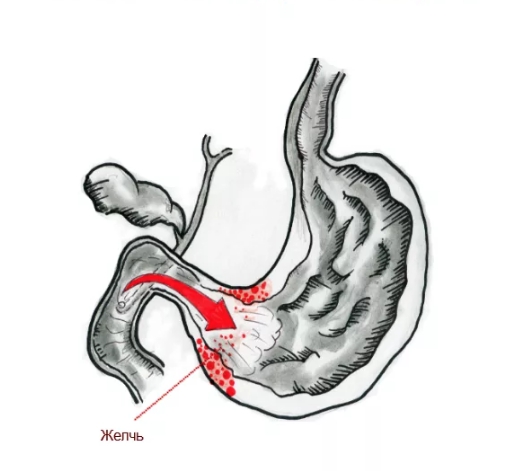
Причины дуодено-гастрального рефлюкса
Патогенетический механизм развития осложнений при ДГР
Желчь в составе рефлюксата при патологическом дуодено-гастральном рефлюксе ретроградно поступает из ДПК в органы, расположенные выше — желудок с пищеводом. Желчные кислоты, трипсин, лизолецитин — составляющие дуоденального содержимого — повреждают слизистую оболочку. Наиболее агрессивным действием при забросе дуоденального содержимого обладают желчные кислоты. Сегодня уже доказано, что при кислом рН среды лизолецитин и конъюгированные желчные кислоты (прежде всего тауриновые конъюгаты) сильнее повреждают слизистую желудка и пищевода, что определяет синергизм этих компонентов с соляной кислотой в развитии эзофагита и гастрита.
Неконъюгированные желчные кислоты и трипсин обладают более токсичным действием при слабощелочном и нейтральном рН, повреждающий эффект при дуодено-гастральном рефлюксе увеличивается при медикаментозном подавлении кислого рефлюкса. Их токсичность большей частью вызвана ионизированной формой, благодаря чему кислоты легко проникают через слизистую пищевода и желудка. Исходя из этого вполне объяснимо отсутствие адекватного ответа у 15-20% пациентов при монотерапии антисекреторными препаратами, если не будет учтен имеющийся дуодено-гастральный рефлюкс.
В результате действия на слизистую желудка желчных кислот, содержащихся в желчи, в течение длительного времени возникают изменения поверхностного эпителия желудка дистрофического и некробиотического характера, что ведет к развитию рефлюксгастрита — гастрита С. При имеющейся инфекции Нelicobacter pylori повреждающее действие рефлюксата на слизистую желудка возрастает. При наличии ДГР происходит заброс агрессивного содержимого в вышележащие отделы, что становится причиной нарушений в работе пищеварительной системы, воздействию подвергается мембранное и полостное пищеварение, возможность всасывания пищевых ингредиентов с микроэлементами и витаминами, изменяется водный баланс.
Признаком негативного воздействия ДГР являются признаки атрофии, метаплазии и дисплазии, это представляет опасность из-за риска развития рака желудка или пищевода. Кроме того, желчь в сочетании с панкреатическим соком из-за своей агрессивности разрушающе действует на слизистый барьер в желудке, при этом обратная диффузия водородных ионов усиливается. В результате этих процессов возникают эрозивные и язвенные поражения слизистой оболочки желудка.
Клинические проявления и диагностика дуодено-гастрального рефлюкса
Для ДГР характерно преобладание диспептических проявлений, пациента беспокоит отрыжка кислым содержимым или воздухом, изжога, тошнота, возможна рвота желчью, также появляется горечь во рту, которая не исчезает и даже усиливается при приеме ингибиторов протонной помпы.
Периодические боли в животе чаще схваткообразного характера, они могут возникать вследствие стресса или физической нагрузки.
Чаще дуоденогастральный рефлюкс сочетается с другими заболеваниями ЖКТ, в первую очередь с язвой желудка и ДПК, ГПОД, хроническим холециститом, панкреатитом и др. Соответственно, это отражается на симптоматике рефлюкса, существенно ее маскируя. В «чистом» виде ДГР появляется не так часто.
Дуодено-гастральный рефлюкс, в отличие от «классического» — желудочно-пищеводного рефлюкса кислой природы с изжогой, дисфагией и регургитацией — сопровождается не столь яркими клиническими проявлениями, но чаще проявляются признаки диспепсии. Кроме того, больных беспокоит боль в эпигастральной области, которая становится сильнее после приема пищи.
Диагностика основывается на результатах инструментальных методов обследования.
Лечение дуодено-гастрального рефлюкса
Консервативное лечение ДГР желудка отличается сложностью, целью терапии является нейтрализация агрессивного воздействия дуоденального содержимого на слизистую желудка и пищевода. Также в задачи лечения входит нормализация пропульсивной способности пищеварительного тракта. Назначения включают прокинетики, антациды, сорбенты, препараты урсодезоксихолевой кислоты (УДХК). При желчном рефлюксе терапия сочетается с базисным лечением основного заболевания. При этом огромное значение уделяется соблюдению диеты.
Медикаменты, используемые для устранения ДГР и восстановления моторики ЖКТ:
Следует учесть, что эритромицин в качестве прокинетика не рекомендован из-за побочных эффектов, цизаприд — не показан в клинической практике из-за вероятности нарушения сердечной проводимости, тегасерод — увеличивает вероятность инфаркта миокарда.
Фармакологическое действие домперидона (D2 антагонист) и метоклопрамида (5 НТ4 агонист и D2 антагонист) связано с блокадой рецепторов дофамина, антагонисты которых вызывают повышение тонуса нижнего сфинктера пищевода, увеличивают сократительную функцию желудка, а также препятствуют релаксации. Кроме того, благодаря антагонистам дофаминовых рецепторов улучшаются эвакуаторная способность желудка и антродуоденальная координация, что способствует устранению дуодено-гастрального рефлюкса.
Важно учесть, что клинические проявления рефлюкса с использованием медикаментозных препаратов уменьшаются, однако носят симптоматический характер. Добиться хороших результатов можно только при функциональных нарушениях, которые привели к ДГР. В остальных случаях консервативная терапия должна сочетаться с хирургическим лечением, способным устранить причину рефлюкса и укрепить пилорический клапан.
Хирургическое лечение дуодено-гастрального рефлюкса
При неэффективности консервативной терапии рекомендовано оперативное лечение, операция при этом проводится в нескольких направлениях:
При всех вышеперечисленных методиках используется лапароскопический доступ — через несколько (3-4) проколов на брюшной стенке.
Техника лапароскопической пилоропликации для уменьшения дуодено-гастрального рефлюкса
Прежде всего проводится ревизия пилородуодальной зоны, и оценивается выраженность спаечного процесса в зоне луковицы ДПК и привратника. Затем необходимо осмотреть связку Трейца, в случае необходимости она пересекается, тем самым улучшается прохождение пищи по двенадцатиперстной кишке. После ее мобилизации по Кохеру, что сделает ее более подвижной и снизит напряжение, накладываются швы в области привратника, что служит для профилактики несостоятельности.
Для пилоропликации поочередно накладываются серозно-мышечные швы симметрично к осе привратника, благодаря подобной методике передняя стенка луковицы ДПК сдвигается в проксимальном направлении, передняя полуокружность привратника погружается в просвет луковицы ДПК. Обычно четырех швов достаточно. Созданный антирефлюксный механизм способен препятствовать ДГР, не нарушая при этом эвакуации из желудка.
При необходимости проводится коррекция ГПОД или выполняется вмешательство на билиарном тракте. Следует помнить, что при лапароскопии возможно выполнение нескольких симультанных операций при наличии патологий в брюшной полости, малого таза или в забрюшинном пространстве, требующих оперативного лечения (киста почки, яичника, нефроптоз, миома и др.).
К настоящему времени нашими специалистами проведено более чем 600 оперативных вмешательств по поводу ГПОД и рефлюкс-эзофагита, а также связанных с хроническим нарушением дуоденальной проходимости. Накопленный опыт обобщен в 4-х монографиях: «Симультанные лапароскопические оперативные вмешательства в хирургии и гинекологии», «Грыжи пищеводного отверстия диафрагмы», «Ручной шов в эндоскопической хирургии» и «Технология дозированного лигирующего– электротермического воздействия на этапах лапароскопий». Кроме того, информация опубликована в многочисленных научных публикациях в разных профессиональных рецензируемых научных изданиях — российских и зарубежных.
После вмешательства на коже живота останется лишь несколько разрезов, длина которых не превышает 10 мм. Уже в день операции пациенты могут вставать, разрешается пить, на следующий день можно принимать теплую пищу в жидком виде. Клинику можно покинуть на 1-3 день — возможность выписки зависит от тяжести состояния. Но уже спустя 2-3 недели человек может вернуться к привычному образу жизни. Соблюдение строгой диеты необходимо в ближайшие два месяца, более мягкая разрешена через полгода после вмешательства. В дальнейшем человек, перенесший операцию, может обходится без медикаментов и не нуждается в строгом соблюдении диеты.
По желанию наши пациенты могут перед оперативным лечением пройти полное обследование, по результатам которого будет подобрана оптимальная тактика лечения и метод хирургического вмешательства.
На все ваши письма я отвечаю всегда только сам. Я помню, что вы доверяете мне самое ценное — свое здоровье, свою судьбу, свою семью, своих близких и делаю все возможное, чтобы оправдать ваше доверие. Каждый день я по нескольку часов отвечаю на ваши письма. Направляя мне письмо с вопросом, вы можете быть уверены, что я внимательно изучу вашу ситуацию, при необходимости запрошу дополнительные медицинские документы. Огромный клинический опыт и десятки тысяч успешных операций помогут мне разобраться в вашей проблеме даже на расстоянии.
Многим пациентам требуется не хирургическая помощь, а правильно подобранное консервативное лечение, в то время как другие нуждаются в срочной операции. И в том, и в другом случае я намечаю тактику действий и при необходимости порекомендую прохождение дополнительных обследований или неотложную госпитализацию. Важно помнить, что некоторым больным для успешной операции требуется предварительное лечение сопутствующих заболеваний и правильная предоперационная подготовка.
В письме обязательно (!) укажите возраст, основные жалобы, место проживания, контактный телефон и адрес электронной почты для прямой связи. Чтобы я мог детально ответить на все ваши вопросы, прошу высылать вместе с вашим запросом сканированные заключения УЗИ, КТ, МРТ и консультаций других специалистов. После изучения вашего случая, я направлю вам либо подробный ответ, либо письмо с дополнительными вопросами.
В любом случае я постараюсь вам помочь и оправдать ваше доверие, которое является для меня наивысшей ценностью.
Ахалазия кардии и кардиоспазм
Общая информация
Краткое описание
Этиология и патогенез
Несмотря на многовековую историю изучения ахалазии кардии, ее этиология до сих пор неизвестна. В настоящее время рассматриваются три основные гипотезы: генетическая, аутоиммунная и инфекционная.
Кроме NO, нейротрансмиттером тормозящих нейронов является ВИП. Один из его рецепторов — рецептор 1, который принадлежит к семейству секретиновых и экспрессируется различными иммунными клетками, такими как Т-лимфоциты, макрофаги и дендритные клетки. Полиморфизм этого гена (VIPR1) также может играть роль в развитии идиопатической ахалазии. VIPR1 локализуется в хромосоме 3p22. В некоторых исследованиях были установлены пять его простых нуклеотидных полиморфизмов: (rs421558) Intron‑1, (rs437876) Intron‑4, (rs417387) Intron‑6, rs896 и rs9677 (3’UTR).
Рассматривая аутоиммунную природу заболевания, необходимо напомнить о циркулирующих аутоантителах. У пациентов с ахалазией кардии чаще всего обнаруживают следующие нейрональные аутоантитела: антитела к никотиновым рецепторам ацетилхолина — ганглионарного и мышечного типа, к кальциевым каналам — P/Q- и N-типа, к декарбоксилазе глутаминовой кислоты, к скелетным мышцам и антинейрональные нуклеарные антитела, известные также под названием anti-Hu. Так, в одном из последних крупных исследований, проведенном в клинике Mayo, установлено, что у 26% больных с идиопатической ахалазией кардии выявляют антитела к скелетным мышцам, а у 21% — к декарбоксилазе глутаминовой кислоты.
Эпидемиология
Клиническая картина
Cимптомы, течение
Основные симптомы заболевания — прогрессирующая дисфагия, регургитация и загрудинные боли, связанные с неполным опорожнением пищевода и хроническим эзофагитом [21, 22, 30, 34, 35, 45, 71 и др.].
Пациент может самостоятельно уменьшить выраженность дисфагии, используя различные приемы: запивание пищи большим количеством жидкости, заглатывание воздуха, повторные глотательные движения, ходьба. Немаловажное значение имеет и температура принимаемой пищи: большинство больных отмечают, что лучше проходит теплая и горячая пища.
Ярким симптомом заболевания является активная и пассивная регургитация, которая отмечается у 84 и 68% больных соответственно. Активная регургитация представляет собой срыгивание только что съеденной пищи или слизи и более характерна для начальных стадий болезни. Она возникает при незначительной дилатации пищевода, тогда как значительное расширение пищевода может привести к отсроченной регургитации, объем которой значительно больше. Пассивная регургитация возникает вне приема пищи, обычно в горизонтальном положении пациента или при наклоне туловища вперед, чаще наблюдается при ахалазии кардии. Регургитация, особенно пассивная, может сопровождаться аспирацией пищи в дыхательные пути, которая может привести к нарушению функции органов дыхания, сопровождающемуся одышкой и кашлем, и маскировать основное заболевание. Необходимо отметить, что ночной кашель наряду с симптомом «мокрой подушки» свидетельствуют о декомпенсации заболевания и служат абсолютным показанием к проведению пневмокардиодилатации.
Еще одна характерная жалоба больных — боли в груди, которые наблюдаются примерно у 59% из них, чаще в молодом возрасте. При повышении давления в НПС и грудном отделе пищевода возникает интенсивная спастическая загрудинная боль, тогда как при атонии грудного отдела пищевода отмечаются умеренно выраженные боли за грудиной распирающего характера. Боли могут возникать во время приема пищи вследствие перерастяжения стенок пищевода и проходить после срыгивания или «проваливания» пищи в желудок. Они также могут быть вызваны спазмом гладкой мускулатуры пищевода и возникать как во время приема пищи, так и без четкой связи с ним. Для 1/3 больных с ахалазией кардии характерна жгучая боль по ходу пищевода, возникающая вследствие прямого раздражающего действия на пищевод остатков задержавшихся в нем пищи и лактата, продукция которого повышена при избыточной бактериальной ферментации сохраняющихся в пищеводе углеводов.
Диагностика
Для подтверждения диагноза идиопатической ахалазии необходимо использовать инструментальные методы обследования, такие как рентгенография пищевода с контрастированием, ЭГДС и манометрия, которая признана «золотым стандартом» диагностики. Некоторые авторы рекомендуют перед проведением рентгеноконтрастного исследования выполнить обзорную рентгенографию грудной клетки, по результатам которой можно определить наличие уровня жидкости в средостении, обусловленного застоем пищевых масс в пищеводе, а также выявить расширение средостения и отсутствие газового пузыря желудка. Рентгеноконтрастное исследование выполняют с бариевой взвесью, при этом оценивают степень расширения пищевода, его деформацию (S-образный пищевод), длительность задержки контрастной массы в пищеводе, рельеф абдоминального отдела пищевода и области пищеводно-желудочного перехода в момент открытия кардиоэзофагеального сфинктера, наличие или отсутствие газового пузыря желудка и некоторые другие параметры (рис. 1).
При II стадии определяется умеренное (до 3–4 см) расширение просвета пищевода; остатков пищи в пищеводе, как правило, нет, может быть небольшое количество прозрачной жидкости или слизи; слизистая оболочка гладкая, ровная, блестящая, ее складки расположены продольно; перистальтика усилена; кардия расположена по центру, обычно плотно сомкнута, но достаточно легко раскрывается при избыточной (по сравнению с обычным эндоскопическим исследованием) инсуффляции воздуха (рис. 2). При ретроградном осмотре складки в области пищеводно-желудочного перехода плотно обхватывают эндоскоп, слизистая оболочка мягкая, эластичная.
Как правило, каждой клинико-рентгенологической стадии кардиоспазма и ахалазии кардии соответствует определенная эндоскопическая картина, на основании которой стадия болезни может быть установлена и без предшествующего рентгенологического исследования, если оно не может быть выполнено по каким-либо причинам (рис. 3–5).
Рис. 3. Кардиоспазм II стадии.
а — рентгенограмма; б — эндофото (данные ФГБНУ «РНЦХ им. акад. Б.В. Петровского»).
Рис. 4. Кардиоспазм III стадии.
а — рентгенограмма; б — эндофото (данные ФГБНУ «РНЦХ им. акад. Б.В. Петровского»)
«Золотым стандартом» обследования пациентов при подозрении на ахалазию кардии является манометрия. В настоящее время для исследования двигательной функции пищевода можно использовать как метод открытых катетеров (водно-перфузионная манометрия), так и современные высокотехнологичные методы — манометрию высокой разрешающей способности (high resolution manometry — HRM) и объемную 3D-манометрию, которые имеют явные преимущества по сравнению с манометрией, выполняемой с помощью 4- или 8-канального водно-перфузионного катетера. При расположении датчиков давления на расстоянии 5 см друг от друга большие участки перистальтической волны грудного отдела пищевода «выпадают» из анализа. Так, подтягивание НПС и укорочение грудного отдела пищевода у больных с ахалазией кардии часто принимают за истинное, хотя и недостаточное, расслабление сфинктера («псевдорелаксация»). Использование многоканальных катетеров при манометрии высокой разрешающей способности позволяет избежать подобных ошибок (рис. 6).
При анализе результатов обследования пациентов с ахалазией кардии, проведенного с использованием манометрии высокого разрешения, следует учитывать Чикагскую классификацию нарушений моторики пищевода, созданную в 2008 г. Применение этого метода исследования позволило выделить три типа ахалазии кардии в зависимости от выявленных изменений двигательной активности грудного отдела пищевода, что дает возможность более точно прогнозировать эффективность лечения с помощью пневмокардиодилатации (рис. 7).
Дифференциальный диагноз
– кардиоэзофагеальным раком, для которого характерна прогрессирующая дисфагия, как и для истинной ахалазии. Однако быстрое уменьшение массы тела, короткий анамнез, часто пожилой возраст пациентов к моменту появления дисфагии свидетельствуют о злокачественном поражении. При физикальном осмотре можно выявить пальпируемое образование в брюшной полости и лимфаденопатию. При рентгенологическом исследовании с бариевой взвесью просвет пищевода может быть умеренно дилатирован, но степень расширения не коррелирует с выраженностью дисфагии. В дистальном отделе имеется сужение, но в отличие от такового при ахалазии оно не имеет характерного вида птичьего клюва или мышиного хвостика с постепенным симметричным сужением просвета и гладкими стенками, а чаще эксцентрично, с обрывом по типу ступеньки и неровными бугристыми контурами. Для установления точного диагноза необходимо проведение эзофагогастродуоденоскопии (ЭГДС). При малейшем подозрении на наличие злокачественного процесса в области кардии обязательным является получение материала для гистологического и цитологического исследований, поскольку рак развивается у 3–8% больных с ахалазией [30]. Необходимо помнить о возможности развития рака не только в области пищеводно-желудочного перехода, но и в стенке воспаленного расширенного пищевода;
– пептической стриктурой, являющейся осложнением длительно текущей гастроэзофагеальной рефлюксной болезни (ГЭРБ). Для нее также характерна дисфагия: в начальных стадиях отмечается затрудненное прохождение по пищеводу только твердой пищи, тогда как в более поздних стадиях присоединяется нарушение пассажа кашицеобразной пищи и жидкостей. Дисфагии, как правило, предшествует длительно существующая изжога, часто возникающая в ночное время, однако к моменту формирования стриктуры изжога прекращается. Для дифференциальной диагностики важно проведение манометрии и рентгенографии пищевода с контрастированием, результаты которого свидетельствуют об отсутствии значимого расширения просвета пищевода, а в вертикальном положении больного контрастное вещество (взвесь сульфата бария) в отличие от ахалазии кардии длительно в пищеводе не задерживается. При ЭГДС могут быть выявлены эрозии;
– ишемической болезни сердца (ИБС), основное клиническое проявление которой — боли в груди. Этот симптом практически невозможно отличить от такового при ахалазии кардии, особенно если ИБС провоцируется приемом пищи. Не помогает в плане дифференциальной диагностики и эффект от приема нитроглицерина, так как боли при ахалазии, как и при ИБС, купируются после его приема. ЭКГ также не всегда позволяет уточнить диагноз, так как ишемия миокарда очень часто имеет скрытый характер и выявляется лишь при физической нагрузке. В связи с этим в спорных ситуациях необходимо проводить комплексное кардиологическое обследование, включающее велоэргометрию или тредмил-тест, эхокардиографию и комбинированное исследование — суточное холтеровское мониторирование и 24-часовую pH-метрию;
Лечение
Существующие методы лечения кардиоспазма и ахалазии кардии (консервативные, эндоскопические, хирургические) направлены на расширение кардии тем или иным способом либо снижение ее тонуса, для того чтобы улучшить прохождение пищи через область пищеводно-желудочного перехода.
Пациентам с ахалазией кардии необходимо назначить диету по типу пищеводного стола с исключением острых и кислых продуктов; пища должна быть теплой, принимать ее нужно медленно, тщательно пережевывая. Оптимальным считается 4- или 5-разовое питание небольшими по объему порциями. Следует также отметить, что существует индивидуальный набор продуктов, усиливающих дисфагию у конкретных пациентов, которые целесообразно исключить из рациона. После приема пищи не следует принимать горизонтальное положение во избежание ее регургитации. Во время сна пациент не должен находиться в строго горизонтальном положении, так как пища может задерживаться в пищеводе до нескольких часов, а верхний пищеводный сфинктер расслабляется во время сна, что приводит к пассивной регургитации и возможной аспирации дыхательных путей.
Для консервативного лечения пациентов с ахалазией кардии используют две группы препаратов: блокаторы кальциевых каналов и нитраты. Чаще всего применяют нифедипин и изосорбида мононитрат в дозе 5–10 мг, которые следует принимать за 20—30 мин до приема пищи. Эти лекарственные средства снижают давление НПС в среднем на 47–63%, однако полностью купировать симптомы ахалазии удается редко. Необходимо также помнить о возможных побочных эффектах этих препаратов, из которых наиболее часто возникают головная боль, артериальная гипотензия, головокружение. В связи с этим лекарственную терапию применяют в случае невозможности использовать альтернативные методы при лечении пациентов, ожидающих выполнения пневмокардиодилатации или хирургического лечения, и как сопутствующую терапию у больных с ахалазией кардии, сопровождающейся рефрактерной болью в груди.
Процедура основана на расширении суженного участка пищеводно-желудочного перехода с помощью кардиодилататора, в результате чего снижается давление НПС и улучшается пассаж пищи по пищеводу. Для этого используют пневмодилататоры, смонтированные на желудочном зонде, которые имеют форму гантели для лучшей фиксации в зоне пищеводно-желудочного перехода (ЗАО «МедСил», Россия). Дилатацию выполняют под рентгенологическим контролем, однако в случаях выраженного расширения, удлинения и деформации пищевода, проявляющейся в значительном отклонении его от продольной оси (С- или S-образный пищевод), проведение пневмодилататора под рентгенологическим контролем затруднено или невозможно. Использование эндоскопической техники позволяет выполнить дилатацию под контролем зрения при заболевании в любой стадии, а также оценить состояние слизистой оболочки в зоне пищеводно-желудочного перехода непосредственно после окончания вмешательства и немедленно диагностировать возникшие осложнения. Эндоскопические вмешательства являются методом выбора при поздних стадиях кардиоспазма и ахалазии кардии у пациентов, у которых высок операционно-анестезиологический риск.
Лечебную процедуру выполняют с помощью кардиодилататора, который надевают на дистальную часть эндоскопа. Диаметр баллона для дилатации кардии в широкой части составляет 30 и 40 мм, в области «талии» — 25 и 30 мм, длина — 12–15 см. Баллон укреплен на полой трубке, внутренний диаметр которой соответствует наружному диаметру эндоскопа и составляет 9–10 мм, длина — 17–20 см. К проксимальному концу баллона присоединена трубка диаметром около 3 мм для инсуффляции воздуха или введения воды в баллон. «Талия» в средней части баллона облегчает его фиксацию в кардии.
Давление при кардиодилатации повышают постепенно — от 120–160 мм рт. ст. в начале лечения до 300–320 мм рт. ст. в конце курса. Экспозиция составляет 1–2 мин, для достижения эффекта требуется в среднем 4–5 сеансов. Уровень давления контролируют с помощью манометра.
Для проведения дилатации кардии применяют также дилататоры «Rigiflex» («Boston Scientific», MA, США), представляющие собой полиэтиленовые баллоны трех диаметров — 30, 35 и 40 мм. Аналогичные баллоны диаметром 30 и 35 мм производит фирма «Cook Medical» (США).
ПД можно проводить как под рентгенологическим контролем, так и с помощью эндоскопической техники по введенной в желудок через канал эндоскопа направляющей струне. Процедура заключается в установке баллона точно в месте перехода пищевода в желудок. При извитом пищеводе для правильного позиционирования баллона в кардии необходим визуальный контроль, для чего параллельно баллону вводят эндоскоп. Для предупреждения осложнений (перфорация, кровотечение) очень важно избегать форсированной дилатации и повышать давление в баллоне постепенно в течение нескольких сеансов от 160 до 300 мм рт. ст. в течение 40–60 с. Баллон может быть заполнен не только воздухом, но и жидкостью — водой или водорастворимым контрастным веществом для лучшей визуализации. Такая процедура называется гидродилатацией кардии, ее выполняют, как правило, при давлении 0,5–2 атм в течение 2 мин. Уровень давления контролируют с помощью манометра.
Эффективность терапии достаточно высокая, зависит от диаметра кардиодилататора и через 3 года составляет в среднем 74, 86 и 90% при использовании баллонов диаметром 30, 35 и 40 мм соответственно.
После дилатации и для мониторирования состояния после лечения, которое необходимо проводить 1 раз в год, жалобы пациентов могут быть оценены по шкале Eckardt.
Шкала Eckardt
| Симптомы | Баллы* | |||
| 0 | 1 | 2 | 3 | |
| Дисфагия | Никогда | Периодически | 1 раз в день | Каждый прием пищи |
| Регургитация | Никогда | Периодически | 1 раз в день | Каждый прием пищи |
| Боли в груди | Никогда | Периодически | 1 раз в день | Каждый прием пищи |
| Уменьшение массы тела, кг | Нет | 5–10 | >10 | |
* 0–3 балла — ремиссия, более 4 баллов — неэффективность ПД.
Кроме улучшения клинического течения заболевания, предиктором длительной ремиссии после ПД является давление НПС
На эффективность ПД оказывают положительное влияние ряд факторов, такие как возраст пациентов более 40 лет, II тип ахалазии кардии по данным HRM, начальная стадия заболевания, давление НПС 15 мм рт. ст. после ранее выполненной ПД, эвакуация из пищевода менее 50% бариевой взвеси через 1 мин от начала рентгеноскопии пищевода, однократно проведенная ПД с использованием баллона диаметром 30 мм.
Необходимо помнить, что самым тяжелым осложнением ПД, которое наблюдается в 1,5–3% случаев, является перфорация стенки пищевода. Однако использование современных дилататоров и опыт специалистов, выполняющих ПД, позволяют значительно снизить риск ее возникновения. После ПД могут отмечаться также боли в груди, повреждение слизистой оболочки пищевода и гематома, повышение температуры тела и аспирационная пневмония, однако риск их развития очень мал. Достаточно редко после процедуры развивается ГЭРБ.
Еще в 1994 г. в зарубежной литературе появились сообщения об использовании ботулинового токсина А для эндоскопического лечения кардиоспазма и ахалазии кардии [42, 43, 49, 60, 79 и др.]. Ботулиновый токсин оказывает расслабляющее действие на гладкую мускулатуру путем блокирования выброса медиатора парасимпатической нервной системы ацетилхолина холинергическими нейронами и нарушения нервно-мышечной передачи. При этом процесс синтеза и депонирования ацетилхолина в пресинаптической терминали синапса не нарушается [20, 55]. Введение ботулинового токсина А в зону кардии приводит к снижению базального и остаточного давления НПС.
Процедура основана на интрамуральном эндоскопическом введении ботулинового токсина А в НПС в дозе 80–100 ЕД, при этом 1 мл препарата (20–25 ЕД) вводят с помощью иглы диаметром 5 мм для склеротерапии в каждый из четырех квадрантов НПС под визуальным контролем.
Эффективность терапии составляет около 80% в течение 1-го месяца наблюдения, 70% после 3 мес, 50% через 6 мес и около 40% через 1 год, в связи с чем иногда требуется повторная инъекция ботулинового токсина.
Несмотря на безопасность и простоту выполнения, этот метод можно рассматривать в качестве альтернативного варианта только при лечении пациентов, имеющих абсолютные противопоказания к пневмокардиодилатации, эндоскопическому и оперативному вмешательству, особенно если речь идет о лицах старшей возрастной группы, наличии тяжелой сопутствующей патологии сердечно-сосудистой и бронхолегочной систем, а также при наличии S-образного пищевода [9].
К факторам, оказывающим негативное влияние на эффективность этого метода, относят: молодой возраст пациентов, мужской пол, высокое давление покоя НПС, отсутствие эффекта от предыдущих инъекций ботулинового токсина, а наиболее выраженный эффект от лечения можно ожидать у людей пожилого возраста и пациентов с ахалазией и выраженной гипермоторной дискинезией грудного отдела пищевода. Следует также отметить, что до настоящего времени в Российской Федерации препарат «Диспорт» не зарегистрирован в качестве средства для применения в гастроэнтерологии, его разрешено использовать лишь в неврологии и косметологии. Для лечения ахалазии кардии препарат применяют в Республике Татарстан по специальному разрешению Министерства здравоохранения этого субъекта РФ.
При неэффективности нехирургических методов лечения решают вопрос о необходимости выполнения оперативного вмешательства. Следует отметить, что выполняемая в ряде лечебных учреждений эзофагокардиомиотомия по Геллеру, заключающаяся в рассечении мышечной оболочки нижнего конца расширенного сегмента пищевода и кардиальной части желудка по передней и задней стенкам, у 15% больных осложняется развитием ГЭРБ. В связи с этим основным оперативным вмешательством является эзофагокардиомиотомия с неполной фундопликацией для предупреждения рефлюкса. Согласно отдаленным результатам, по эффективности она превосходит ПД, однако из-за травматичности любого оперативного вмешательства, необходимости анестезиологического пособия и вероятности развития послеоперационных осложнений этот метод лечения применяют при неэффективности повторных ПД.
В настоящее время для лечения кардиоспазма широко применяют лапаро- и торакоскопические операции, из которых предпочтение отдают лапароскопической миотомии с частичной фундопликацией в различных модификациях, обеспечивающей беспрепятственное прохождение пищи у пациентов с ослабленной моторикой пищевода, с одной стороны, и предупреждающей рефлюкс — с другой [1, 71, 92, 101 и др.]. Эффективность минимально инвазивных вмешательств не уступает таковой открытых хирургических операций — 94 и 84% соответственно, а частота послеоперационных осложнений ниже. К сожалению, после хирургического лечения также в ряде случаев возникает рецидив дисфагии, в связи с чем требуется повторное проведение консервативного, в том числе с использованием эндоскопических методов, или хирургического лечения.
В терминальной стадии заболевания выполняют экстирпацию или субтотальную резекцию пищевода с одномоментной пластикой желудочной трубкой, в том числе с применением лапарои торакоскопической техники. Показания к выбору метода оперативного вмешательства определяют индивидуально [1, 36 и др.].
В 2007 г. был предложен и апробирован на живых свиньях новый метод лечения ахалазии, заключающийся в обеспечении прямого доступа к мышечному слою пищевода через туннель, созданный в подслизистом слое (один из вариантов NOTES — внутрипросветной эндоскопической хирургии через естественные отверстия) [80]. У человека эта операция, получившая название «пероральная эндоскопическая миотомия» (POEM), впервые выполнена в 2008 г. [62]. С этого времени операцию стали быстро внедрять в клиническую практику, и к настоящему времени она выполнена уже нескольким сотням пациентов [52, 63, 86, 87, 96, 109, 111 и др.].
Авторы рассматривают эту методику в качестве альтернативы баллонной кардиодилатации и эзофагокардиомиотомии по Геллеру. Суть ее состоит в следующем: с помощью специальных инструментов, введенных по инструментальному каналу гибкого эндоскопа, делают продольный надрез слизистой оболочки пищевода на протяжении 1,5–3 см примерно на 10–12 см выше пищеводно-желудочного перехода, через который в подслизистый слой вводят эндоскоп. Вместо воздуха инсуффлируют углекислый газ для предупреждения развития пневмомедиастинума и пневмоперитонеума. Под визуальным контролем на всем протяжении вплоть до малой кривизны желудка как минимум на 3 см ниже пищеводно-желудочного перехода создают туннель между слизистой оболочкой и мышечным слоем путем последовательного пересечения соединительнотканных волокон и сосудов после порционного введения изотонического раствора натрия хлорида с добавлением, как правило, раствора высокой вязкости, чаще всего на основе глицерола и гиалуроновой кислоты, подкрашенного индигокармином или метиленовым синим для лучшей визуализации. Рассечение волокон выполняют специальными ножами различной формы разных производителей («Olympus», «Fujifilm», «ERBE» и др.). Затем постепенно рассекают циркулярные мышечные волокна в направлении сверху вниз. Дефект в слизистой оболочке клипируют.
POEM — эффективная и достаточно безопасная процедура. Исследователи сообщают об уменьшении выраженности симптомов дисфагии с 10 баллов до 1,3 балла, снижении давления НПС с 52,4 (14,2–80,5) до 19,8 (9,3–42,7) мм рт. ст. в течение в среднем 5 мес. При оценке жалоб пациентов по шкале Eckardt отмечается значительное улучшение состояния: если до операции средняя оценка составляла 7–8 баллов, то после нее у всех пациентов она была ниже 3 баллов, в основном 0–1 балл. Частота развития ГЭРБ варьирует, согласно данным разных авторов, от 0 до 37% [109].
Прогноз
Информация
Источники и литература
Информация
3 ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А. И. Евдокимова» Минздрава России, Москва, Российская Федерация