Кетонал уколы или кеторол уколы что лучше
Послеоперационное обезболивание. Часть 4. Современные средства обеспечения послеоперационной анальгезии
Основными задачами применения анальгетических средств в послеоперационном периоде являются: устранение страдания, причиняемого болью, создание психологического комфорта и повышение качества жизни пациентов в послеоперационном периоде; ускорение послеоперационной функциональной реабилитации; снижение частоты послеоперационных осложнений; сокращение сроков госпитализации и стоимости лечения.
Нужно отметить, что в настоящее время в большинстве развитых стран неадекватное послеоперационное обезболивание рассматривается как нарушение прав человека и осуществляется в соответствии с принятыми национальными и международными стандартами. В нашей стране во многих клиниках внедрена формулярная система использования лечебных препаратов тех или иных групп, целесообразность применения которых подтверждена данными доказательной медицины, а также обусловлена потребностями и особенностями конкретного лечебного учреждения. Многие авторы полагают, что все хирургические подразделения, а также отделения анестезиологии, реанимации и интенсивной терапии должны иметь в своем арсенале только те анальгетики и анестетики, эффективность и безопасность назначения которых подтверждена доказательствами I (систематизированные обзоры и метаанализы) и II (рандомизированные контролируемые исследования с определенными результатами) уровня (табл. 1).
Таблица 1. Препараты, применение которых для послеоперационного обезболивания обосновано данными доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005).
Группа
Препараты
Дозы, путь введения
Неопиоидные анальгетики, НПВП
Диклофенак
Кетопрофен (Кетонал ®)
Кеторолак (Кеторол ®)
75 мг (150 мг суточная), в/м
50 мг (200 мг), в/м
30 мг (90 мг), в/м
Неопиоидные анальгетики, прочие
1 г (4 г), в/в инфузия в течение 15 минут
Опиоидные анальгетики, сильные
5-10 мг (50 мг), в/в, в/м
20 мг (160 мг), в/в, в/м
Опиоидные анальгетики, слабые
100 мг (400 мг), в/в, в/м
Лидокаин 2%
Бупивакаин (Маркаин®) 0, 25%, 0, 5%
Ропивакаин (Наропин®0, 2%, 0, 75%, 1%
(800 мг суточная) *
(400 мг суточная) *
(670 мг суточная) *
*инфильтрация краев раны, интраплевральное введение, продленная блокада периферических нервов и сплетений, продленная эпидуральная анальгезия.
Мировой опыт послеоперационного обезболивания позволяет выделить следующие основные современные тенденции в борьбе с ПБС:
— широкое применение неопиоидных анальгетиков – нестероидных противовоспалительных препаратов (НПВП) и парацетамола; в различных европейских клиниках частота назначения данных препаратов в качестве базиса послеоперационного обезболивания составляет от 45 до 99%;
— ограничение использования опиоидных анальгетиков, особенно внутримышечного варианта их введения, что обусловлено низкой эффективностью и значительным количеством побочных эффектов данной методики;
— мультимодальный характер послеоперационного обезболивания, т. е. одновременное назначение нескольких препаратов или методов обезболивания, способных воздействовать на различные механизмы формирования болевого синдрома.
Длительность проведения послеоперационного обезболивания является достаточно вариабельной величиной и зависит как от интенсивности болевой афферентации и, следовательно, от травматичности хирургического вмешателсьтва, так и от индивидуальной толерантности пациента к боли. Необходимость целенаправленного купирования ПБС возникает, как правило, в течение первых 4 суток послеоперационного периода (табл. 2).
Таблица 2. Потребность в обезболивании после различных по объему операций.
Хирургическое вмешательство
Продолжительность обезболивания, часы
Вмешательства на верхнем этаже брюшной полости и диафрагме
Вмешательства на нижнем этаже брюшной полости
Операции на тазобедренном суставе
Операции на конечностях
Лапароскопические операции среднего объема
Таблица 3. Методы и средства послеоперационного обезболивания.
1. Традиционное введение опиоидов: внутримышечные инъекции по требованию.
2. Опиоидные препараты агонисты/антагонисты:
а) парентеральное введение опиоидов: внутривенно болюсно, длительная внутривенная инфузия, контролируемая пациентом анальгезия.
б) непарентеральное введение опиоидов: щечное/подъязычное, пероральное, трансдермальное, назальное, ингаляционное, внутрисуставное
3. Неопиоидные анальгетики с системным введением:
а) нестероидные противоспалительные препараты
б) ацетаминофен (парацетамол)
4. Методы регионарной анестезии:
а) эпидуральное введение опиоидов;
б) нестероидные противовоспалительные препараты;
5. Нефармакологические методы:
6. Сочетанное использование представленных методов
Ниже приводятся основные используемые в современной хирургической клинике средства и методы обезболивания с позиций баланса их эффективности и безопасности.
Опиоидные анальгетики.
Данная группа лекарственных препаратов десятилетиями считалась средством выбора для купирования ПБС. Однако в настоящее время опиоидные анальгетики отнюдь не являются «золотым стандартом» в лечени пациентов с острой болью. Тем не менее, по оценкам целого ряда отечественных и зарубежных специалистов, эффективность обезболивания при традиционном назначении опиоидов в качестве монотерапии не превышает 25-30%. Однако постепенное отчуждение от чрезмерной приверженности опиоидам в послеоперационном периоде связана не столько с их недостаточной эффективностью, сколько с целым рядом серьезных побочных эффектов, возникающих при их использовании (табл. 4).
С точки зрения фармакодинамики опиоидные анальгетики являются агонистами или антагонистами различных видов опиоидных рецепторов ЦНС (мю-, дельта-, каппа-). Препараты опиоидной группы активируют эндогенную антиноцицептивную систему (центральная анальгезия), однако не влияют на периферические и сегментарные неопиоидные механизмы ноцицепции и не предотвращают центральную сенситизацию и гиперальгезию. Попытки увеличения эффективности обезболивания и снижения частоты побочных эффектов опиоидных анальгетиков основаны на варьировании способов их введения (в том числе и у одного пациента): внутривенный, внутримышечный, эпидуральный, трансдермальный, сублингвальный, ректальный. Наиболее распространенным, но при этом наиболее небезопасным и наименее эффективным способом введения опиоидов является внутримышечная инъекция. Данная методика наиболее часто приводит к неадекватному обезболиванию – более 60% пациентов отмечают неудовлетворительное качество послеоперационной анальгезии. Причины этого кроются в том, что всем пациентам вводятся фиксированные дозы через стандартные временные интервалы, без учета индивидуальной вариабельности фармакокинетики; часто инъекции опиоидов производятся с большими перерывами, то есть тогда, когда болевой синдром уже выражен и его купирование по определению становится малоэффективным. Именно при внутримышечном введении опиоидов наиболее часто развивается депрессия дыхания, связанная, возможно, с кумуляцией препарата.
Таблица 4. Опиоидные анальгетики при купировании послеоперационного болевого синдрома.
Препарат
Дозировка и пути введения
Относительная анальгетическая активность
Побочные эффекты
Возможны выраженные угнетение дыхания, тошнота, рвота, высокая степень привыкания и максимальный наркогенный потенциал
Угнетение дыхания, тошнота, рвота, высокая степень привыкания и наркогенный потенциал
Угнетение дыхания, тошнота, рвота, наличие привыкания и наркогенного потенциала
Необходимо отметить еще один важный аспект, ограничивающий применение опиоидных анальгетиков в отечественной клинической практике. Использование опиоидных анальгетиков для послеоперационного обезболивания в Российской Федерации строго регламентировано существующими приказами руководящих органов здравоозранения. Например, приказом № 257 Департамента здравоохранения г. Москвы от 2004 г. определяется, в частности, норматив потребления опиоидных препаратов в ампулах на 1 койку различных отделений хирургического профиля в год. Назначение опиоидного препарата как в хирургическом отделении, так и в отделении интенсивной терапии в большинстве ЛПУ сопровождается колоссальным количеством формальных сложностей, что нередко приводит к отказу медперсонала от использования ланных препаратов даже при необходимости назначения опиоидов. По тем же причинам самый современный метод применения опиоидов – контролируемая пациентом аналгезия, в наибольшей степени ориентированная на индивидуальные потребности пациента в обезболивании – в России не получила широкого распространения.
Неопиоидные анальгетики.
Термином «неопиоидные анальгетики» обозначается группа различных по химическому строению, фармакодинамике и, соответственно, механизму обезболивания лекарственных препаратов, применяемых для купирования ПБС с парентеральным, реже пероральным путем введения. Препараты данной группы, используемые как в моноварианте, так и в качестве средства адъювантной терапии, обладают различными анальгетическим потенциалом и совокупностью побочных эффектов (табл. 5).
Таблица 5. Неопиоидные анальгетики для купирования послеоперационной боли.
Класс
Препараты
Особенности терапии
Побочные эффекты
Антагонисты NMDA-рецепторов
Применяется как адъювант при введении опиоидов.
Малые дозы кетамина характеризуются опиоидсберегающим эффектом, повышением качества обезболивания
При использовании в малых дозах – не выражены. Сохраняют побочные эффекты опиоидов.
Антиконвульсанты
Используется как адъювантный препарат в комплексной терапии острой послеоперационной боли. Снижает потребность как в опиоидных, так и внеопиоидных анальгетиках.
Головокружение, сонливость, периферические отеки.
Ингибиторы протеаз
Ингибирование синтеза медиаторов боли на этапе трансдукции, используются как средство адъювантной терапии ПБС
Нерушения в системе гемостаза (гипокоагуляция) – послеоперационные кровотечения.
Центральные α-адреномиметики
Воздействие на трансмиссию и модуляцию боли. Адъювант при опиоидной анальгезии.
Гипотензия, брадикардия, психические нарушения.
Бензодиазепины
Комбинированная терапия с применением феназепама и тизанидина снижает выраженность фантомных болей.
Сонливость, головокружение, психические расстройства
Из приведенных данных становится очевидным, что перечисленные в таблице неопиоидные анальгетики используются лишь как возможное дополнение к базисной терапии опиоидами, использование данных препаратов для купирования ПБС в моноварианте не практикуется.
Формально к группе неопиоидных анальгетиков относятся также нестероидные противовоспалительные препараты (НПВП) и ацетаминофен (парацетамол). Однако вследствие значительной востребованности в современной хирургической клинике данные препараты рассматриваются сейчас как отдельные подклассы средств для купирования ПБС.
Парацетамол.
Несмотря на то, что ацетаминофен (парацетамол) имеет более чем полувековую историю применения в качестве анальгетика и антипиретика, точный механизм действия этого препарата до сих пор не известен. Предполагается наличие центрального механизма действия парацетамола, включающего: подавление активности циклооксигеназы 2 типа в ЦНС, с чем связана профилактика развития вторичной гиперальгезии; подавление активности циклооксигеназы 3 типа, существование которой предполагается и которая, видимо, обладает селективной чувствительностью к парацетамолу; усиление активности нисходящих тормозных серотонинергических путей на этапе модуляции боли.
Потенциально опасным побочным свойством парацетамола является гепатотоксическое и нефротоксическое действие, которое может проявляться при превышении дозы 4 г/сут, особенно при наличии у пациента исходного нарушения функции печени и почек. Ограничениями к применению парацетамола являются: печеночно-клеточная недостаточность с лабораторными проявлениями (повышение уровня трансаминаз), почечная недостаточность, алкоголизм, алиментарная недостаточность, дегидратация.
Местные анестетики.
Важнейшей задачей мультимодальной анальгезии является прерывание афферентного потока ноцицептивных стимулов от периферических болевых рецепторов в органах и тканях к сегментарным структурам ЦНС (задним рогам спинного мозга). Эта задача может быть успешно решена при помощи различных методов регионарной и местной анальгезии. Важную роль в расширении применения методов региональной анальгезии сыграло появление современных местных анестетиков (бупивокаин, ропивокаин), а также детальная отработка методики регионарных блокад.
Эпидуральная анальгезия занимает ключевую позицию среди всех регионарных методов послеоперационного обезболивания. В ходе данной процедуры в эпидуральное пространство на уровне грудного или поясничного отделов позвоночника устанавливается катетер, через который болюсно или путем непрерывной инфузии вводятся местные анестетики. Эпидуральная анестезия является как средством обеспечения анальгезии в ходе операции (в том числе и в моноварианте), так и средством купирования ПБС. Многочисленными исследованиями была доказана принципиально более высокая эффективность продленной послеоперационной эпидуральной анальгезии по сравнению с системным введением опиоидных анальгетиков. Как указывалось выше сами опиоидные анальгетики также могут быть использованы для проведения эпидуральной анестезии. Известно, что эпидуральное введение местных анестетиков и опиоидов достоверно превышает анальгетический эффект использования данных препаратов в отдельности. Тем не менее само по себе эпидуральное введение опиоидов чревато возникновением серьезных побочных эффектов от угнетения дыхания до выраженного кожного зуда. На сегодняшний день принято считать, что преимущества эпидурального введения опиоидных анальгетиков в абдоминальной хирургии не перевешивают риска осложнений самой методики эпидуральной анестезии по сравнению с парентеральным назначением аналогичных препаратов.
Помимо собственно анальгетического эффекта позитивное влияние прослеоперационной продленной эпидуральной анальгезии заключается в прерывании нисходящих симпатических эфферентных импульсов, следствием чего являются улучшение висцерального кровотока (активизация репаративных процессов в зоне вмешательства), повышение активности парасимпатической нервной системы (разрешение пареза пищеварительной трубки).
С точки зрения доказательной медицины (Acute Pain Management: Scientific Evidence, 2-nd edition, 2005) преимущества продленной эпидуралной анальгезии включают: более высокое качество обезболивания в сравнении с парентеральным введением опиоидов; улучшение показателей газообмена и снижение частоты послеоперационных легочных осложнений по сравнению с опиоидной анальгезией; ускорение восстановления функции желудочно-кишечного тракта после абдоминальных операций и снижение частоты местных осложнений.
Тем не менее и у эпидуральной анестезии есть ряд существенных ограничений. Сама по себе эпидуральная анестезия является сложной инвазивной процедурой, потенциально опасной в плане развития как местных (инфекционный процесс, повреждение нервных корешков, сосудов паутинной оболочки, твердой мозговой оболочки), так и системных осложнений (депрессия дыхания, кардиотоксические эффекты, артериальная гипотензия). В этой связи проведение эпидуральной анестезии требует наличия специальных навыков у врача-анестезиолога и постоянного мониторинга состояния пациента в отделении интенсивной терапии, реже – в хирургическом отделении.
В последние годы все большую популярность получает методика длительной инфузии местных анестетиков в полость операционной раны. В ходе ряда исследований было показано, что длительная инфузия местных анестетиков в течение 24-48 часов через катетер, установленный в ране, способна повысить качество обезболивания и снизить потребность в опиоидных анальгетиках. Работами отечественных авторов показано, что пролонгированная местная анестезия операционной раны за счет резорбции местного анестетика и присутствия его в плазме в низких концентрациях способна оказывать системный противовоспалительный эффект. Как и в случае эпидуральной анальгезии эффект местных анестетиков при этом обусловлен блокадой не только ноцицептивных путей, но и симпатической иннервации. Говоря о применении пролонгированной местной анестезии операционной раны, следует заметить, что данная методика в настоящее время находится на стадии клинической апробации и ее широкое внедрение изначально ограничивают очевидный риск экзогенного инфицирования раны и реальная опасность системных токсических эффектов местных анестетиков (артериальная гипотензия, аритмии, угнетение дыхания) вследствие их резорбции тканями.
Мультимодальная периоперационная анальгезия.
Из приведенных выше характеристик и, что важнее, недостатков средств и методов купирования ПБС следует очевидное заключение о том, что в настоящее время не существует идеального анальгетика или метода лечения острой послеоперационной боли. Однако приблизиться к решению проблемы адекватности послеоперационного обезболивания вполне возможно, реализуя в клинике концепцию мультимодальной периоперационной анальгезии, предусматривающей одновременное назначение двух и более анальгетиков и/или методов обезболивания, обладающих различными механизмами действия и позволяющих достичь адекватной анальгезии при минимизации побочных эффектов до, во время и после хирургического вмешательства (см. рис. ).
Таблица 6. Варианты схем мультимодальной периоперационной анальгезии, ориентированных на травматичность хирургических вмешательств.
Кетонал уколы – эффективный препарат для снятия болевого синдрома
Популярным медикаментозным средством в комплексной терапии заболеваний опорно-двигательного аппарата являются кетонал уколы. Лекарство относится к группе нестероидных противовоспалительных препаратов. Раствор в ампулах используется для внутримышечного и внутривенного введения.
Состав и показания
Основным действующим веществом в препарате является кетопрофен. Кетонал ампулы содержат 2 мл раствора со 100 мг действующего вещества. Жидкость для инъекций может быть прозрачным или иметь слегка желтоватый оттенок.
Кетопрофен обладает противовоспалительными, анальгезирующими и жаропонижающими свойствами. Он быстро абсорбируется из ЖКТ, что обуславливает быстрый результат.
Кетонал уколы показаны при лечении различных заболеваний с целью для симптоматического лечения болезненных процессов. Они наиболее эффективны для снятия болей, которые сопровождают болезни опорно-двигательного аппарата воспалительного и дегеративного характера.
Кетонал уколы, инструкция по применению это подтверждает, улучшают состояние при ревматоидных и серонегативных артритах при обострении заболеваний, когда возникают сильные боли.
Для симптоматического лечения препарат назначают также:
При подагре. При развитии этого заболевания соли мочевой кислоты откладываются в суставах, что вызывает их видоизменение и сильные боли. Кетонал уколы показаны для купирования приступа подагры, который характеризуется отеком в области одного из суставов и давящей болью в нем.
При остеоартрозе. Как правило, причиной патологии является повреждение сустава или воспалительный процесс в нем. Кетонал уколы позволяют снять боль и сохранить подвижность сустава.
Кетонал уколы назначают для снятия посттравматического и послеоперационного болевого синдрома. Благодаря выраженным обезболивающим свойствам препарат улучшает состояние при онкозаболеваниях, альгодисминорее, воспалениях органов малого таза. Допускается его использование для снятия выраженной головной боли, спровоцированной разными причинами, а также при других патологических состояниях:
Противопоказания
Противопоказанием к кетонал уколам является повышенная чувствительность к активному действующему веществу или другим нестероидным противовоспалительным препаратам, а также салицилатам.
Запрещено использовать кетонал уколы и во многих других случаях. Все они указаны в инструкции по применению препарата. Не назначают инъекции препаратом до достижения возраста 15 лет, в третьем триместре беременности и в период лактации.
Основные противопоказания препарата:
Обострение язвенной болезни желудка и двенадцатиперстной кишки.
Сердечная, печеночная и почечная недостаточность.
Нарушения свертываемости крови.
Отказаться от использования препарата следует при диагностировании болезни Крона и неспецифического язвенного колита, при подозрениях на желудочно-кишечные и другие кровотечения. Не назначают кетонал уколы, инструкция об этом предупреждает после проведения аортокоронарного шунтирования.
Применение при беременности
Согласно проведенным исследованиям кетапрофен может оказывать негативное влияние на общее течение беременности и спровоцировать самопроизвольный аборт. Кроме того при приеме препарата возникают риски развития внутриутробных патологий плода. При этом вероятность негативных последствий для матери и будущего ребенка повышается в зависимости от дозы и длительности приема средства.
Назначают кетанол уколы в I и II триместре исключительно в случаях, когда польза для женщины превышает возможные риски для плода. При этом показана минимальная эффективная доза, которая принимается коротким курсом.
Абсолютные противопоказания к приему препарата в третьем триместре объясняются тем, что кетанол уколы могут привести к возможному развитию слабости родовой деятельности матки и другим патологическим состояниям. Кроме того даже малые дозы лекарства в этот период беременности могут увеличить длительность кровотечений и оказать негативное влияние на плод, Использование кетанол уколов в период лактации относят по причине того, что исследования на предмет попадания в грудное молоко кетапрофена и его влияние на ребенка не проводились.
Побочные эффекты и передозировка
Кетонал уколы, инструкция по применению предупреждает об этом, могут вызывать серьезные негативные побочные реакции организма со стороны различных систем человеческого организма. Внимательно ознакомиться с предупреждениями производителя следует перед началом использования средства для симптоматического лечения.
Наиболее часто побочные эффекты проявляются бессонницей, депрессией, астенией. Сопровождаться расстройства нервной системы могут головными болями и повышенной слабостью. Также после приема лекарства часто возникают диспепсические расстройства.
Передозировка кетопрофена несет угрозу для здоровья. Повышенные дозы могут спровоцировать стильную рвоту и боли в животе. Препарат, использованный однократно в большом количестве может привести к угнетению дыхания, судорогам, потери сознания. Возникают риски развития нарушения функции почек. При подтверждении передозировки срочно нужно промыть желудок и принять абсорбенты. Дальше рекомендовано симптоматическое лечение.
Кетонал уколы, цена которых доступна, взаимодействуют со многими другими лекарственными препаратами. Поэтому для самолечения их категорически запрещено использовать. Дозировки назначаются доктором в зависимости от состояния пациента и в соответствии с рекомендациями инструкции по применению.
Все представленные на сайте материалы предназначены исключительно для образовательных целей и не предназначены для медицинских консультаций, диагностики или лечения. Администрация сайта, редакторы и авторы статей не несут ответственности за любые последствия и убытки, которые могут возникнуть при использовании материалов сайта.
Сравнительная эффективность нестероидных противовоспалительных препаратов при болях в спине
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В настоящее время боли в спине (БС) широко распространены, а в развитых странах, по данным экспертов ВОЗ, сравнимы с неинфекционной эпидемией, что в большинстве случаев связано с возрастающими нагрузками на человека [4]. Высокая инвалидизация лиц трудоспособного возраста вследствие поражений опорно-двигательного аппарата возводит проблему лечения БС в ранг актуальной. Популяционные исследования выявили ассоциацию болей в нижней части спины (БНС) с такими факторами, как пол и возраст, осанка, мышечная сила, подвижность позвоночника. В недавно проведенном в Швеции популяционном исследовании спинальных болей среди лиц в возрасте 35-45 лет установлено, что частота возникновения болей за последний год составила 66,3%, причем данный показатель среди женщин был незначительно выше, чем среди мужчин. У 25% респондентов возникли существенные проблемы с трудоспособностью, степенью нарушения функционального статуса. В Великобритании вследствие болей в спине в 1992 г. было потеряно 90 миллионов рабочих дней, что уступало только заболеваниям органов дыхания и кровообращения. При этом 75% больных составили пациенты от 30 до 59 лет, то есть в период максимальной трудоспособности.
Все случаи болей в спине делятся на первичные и вторичные.
Вторичный синдром БС может быть связан с врожденными аномалиями, травматическими поражениями позвоночника, опухолевыми и инфекционными процессами, остеопорозом, заболеваниями внутренних органов.
БС чаще всего развивается в возрасте от 20 до 50 лет (пик заболеваемости в возрасте от 35 до 45 лет). Именно в этой возрастной группе обычно диагностируют первичный (механический) синдром БС, тогда как у больных моложе 20 лет и старше 50 лет преобладает вторичный синдром БС (табл. 1).
Диагностика БС требует участия врачей разных специальностей: терапевта, ревматолога, невропатолога, ортопеда и хирурга, задачей которых, в частности, является исключение вторичного характера болей в нижней части спины.
Провоцирующими факторами острого течения БС могут быть травма, подъем непосильного груза, неподготовленные движения, длительное пребывание в нефизиологической позе, переохлаждения. Хроническая боль может возникать как после регресса острой боли, так и независимо от нее.
Лечение проводится с учетом формы заболевания и варианта его течения с использованием консервативного и хирургического подходов.
В настоящее время показания к хирургическому лечению сужены, поскольку накопились факты о том, что даже при очень хорошей методике хирургической декомпрессии и стабилизации заболевание склонно рецидивировать.
При обострении клинических проявлений БС ранее рекомендовался отдых в течение нескольких недель. Однако во всех исследованиях последних лет подчеркивается, что не постельный режим, а ранняя активизация больных должна быть главным компонентом программы лечения, что способствует улучшению питания межпозвонкового диска, в связи с чем постельный режим при остром течении ограничивается несколькими днями.
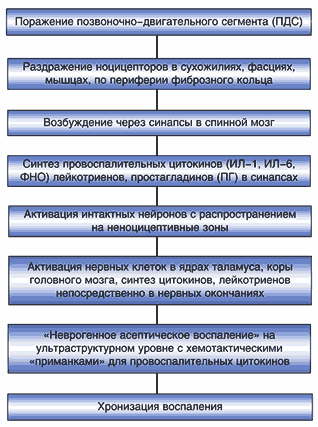
Дегенеративный процесс в межпозвонковом диске активирует ноцицепторы по периферии фиброзного кольца, в сухожилиях, фасциях, мышцах с последующей передачей импульсов в спинной мозг. При этом запускаются иммунные и биохимические реакции, завершающиеся формированием асептического нейрогенного воспаления. В связи с этим целесообразность назначения НПВП обоснована (схема 1) [3].
Схема 1. Механизмы асептического неврогенного воспаления при спондилоартрозе (Borenstein D., 2000).
В настоящее время появилась возможность применения такого НПВП, как кетопрофен (Кетонал) при остеоартрозе, а также при лечении болей в спине. Кетопрофен является производным пропионовой кислоты. Особенностью его противовоспалительного действия является не только ингибирование синтеза простагландинов на уровне циклооксигеназы; он также ингибирует липооксигеназу, обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны. При приеме внутрь препарат быстро и максимально полно абсорбируется из желудочно-кишечного тракта. Максимальная концентрация в крови достигается через 1-2 часа. Кетонал хорошо проникает в синовиальную жидкость и соединительную ткань. Значимые уровни концентраций достигаются уже через 15 минут после однократного внутримышечного введения 100 мг кетопрофена. Важным преимуществом препарата является то, что он представлен различными лекарственными формами: капсулами, таблетками форте и ретард, раствором для внутримышечных инъекций, кремом и суппозиториями.
Кетонал обладает «сбалансированной» активностью в отношении ингибиции ЦОГ-1 и ЦОГ-2, что позволяет оптимально сочетать высокую эффективность с хорошей переносимостью, сравнимой, по данным ряда авторов, с переносимостью селективных НПВП [3,5]. Исследователи связывают мощный болеутоляющий эффект Кетонала с его доказанным центральным воздействием, которое реализуется на уровне задних рогов спинного мозга, а также за счет непосредственного влияния на таламические центры болевой чувствительности, что, по-видимому, связано с угнетением синтеза простагландинов в ЦНС [4,5].
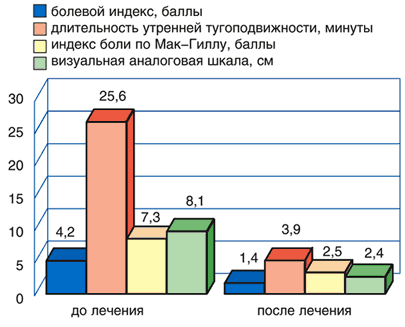
Рис. 1. Динамика клинических показателей у пациентов с болями в спине до и после лечения Кетоналом форте
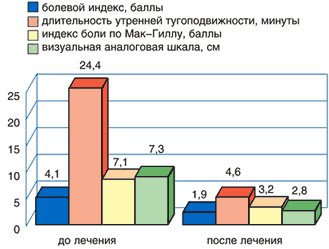
Рис. 2. Динамика клинических показателей у пациентов с болями в спине до и после лечения диклофенаком
Оценки эффективности лечения больным и врачом практически не отличались друг от друга и свидетельствовали о выраженной клинической эффективности препаратов. Высокая эффективность отмечена у 93,3% пациентов, принимавших Кетонал форте, у 73,3% пациентов, принимавших диклофенак.
Переносимость препарата «хорошая» или «очень хорошая» была отмечена у 80% больных, принимавших Кетонал, и у 64% принимавших диклофенак. Основными побочными эффектами при приеме как диклофенака, так и Кетонала были изжога, дискомфорт в эпигастральной области. Прекращение лечения потребовалось лишь в 1 случае, когда у пациента развилась крапивница на фоне приема диклофенака, которая была расценена, как побочный эффект средней степени тяжести.
Таким образом, в настоящее время лечение болей в спине оптимизировано использованием препаратов группы НПВП, в частности, Кетонала, в силу его высокой эффективности, проявляющейся отчетливо выраженной положительной динамикой с регрессом болевых проявлений у пациентов с БС.
1. Клинические рекомендации для практических врачей, основанные на доказательной медицине. Изд. дом «ГЭОТАР-МЕД», 2001, с. 606-611.
2. Насонов Е.Л. Нестероидные противовоспалительные препараты (перспективы применения в медицине). М., 2000, 262.
3. Насонов Е.Л., Чичасова Н.В., Шмидт Е.И. Перспективы применения неселективных нестероидных противовоспалительных препаратов (на примере кетопрофена) и селективных ингибиторов ЦОГ-2 в клинической практике. Русский медицинский журнал, том 10, №22, 2002, с 1014-1017.
4. Ветшев П.С., Ветшева М.С. Принципы аналгезии в раннем послеоперационном периоде. Хирургия, 2002, №12, с. 49-52.
5. Чичасова Н.В., Насонов Е.Л., Имаметдинова Г.Р. Применение кетопрофена (кетонал) в медицинской практике. Фарматека, 2003, №5, с. 30-32.
6. Borenstein D. «Эпидемиология, этиология, диагностическая оценка и лечение поясничной боли». Междун. Медиц. Журнал, 2000, №35, с. 36-42.
7. WHO. Department of noncomunicable disease menagement. Low back pain iniciative. Geneve.1999.