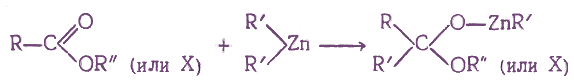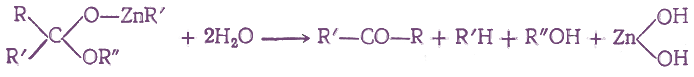Кетоны что это в химии
Кетон
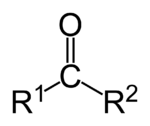
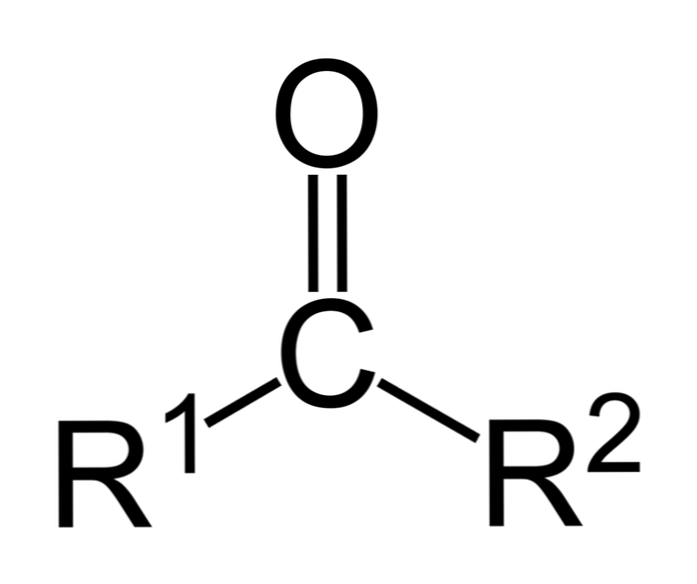
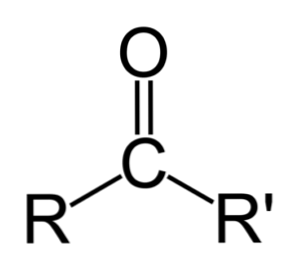
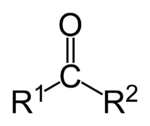
Кетоны это органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Среди других карбонильных соединений, наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а так же альдегидов.
Содержание
Физические свойства
Методы синтеза
Химические свойства
Существует три основных типа реакций кетонов.
Первый связан с нуклеофильной атакой по атому углерода карбонильной группы. Например взаимодействие кетонов с цианид-анионом или металлорганическими соединениями. К этому же типу (нуклеофильного присоединения) относится взаимодействие карбонильной группы со спиртами, приводящее к ацеталям и полуацеталям.
Взаимодействие со спиртами:
c реактивами Гриньяра:
Также кетоны реагируют с азотистыми основаниями, например, с аммиаком и первичными аминами с образованием иминов:
Второй тип реакций — депротонирование бета-углеродного атома, по отношению к карбонильной группе. Образующийся карбанион стабилизирован за счёт сопряжения с карбонильной группой, лёгкость удаления протона возрастает, поэтому карбонильные соединения являются сравнительно сильными С-Н кислотами.
Третий — координация электрофилов по неподеленной паре атома кислорода, например, таких кислот Льюиса, как AlCl3
Важнейшие кетоны
| Название | Формула | Температура плавления | Температура кипения |
|---|---|---|---|
| Диметилкетон | CH3COCH3 | -95°C | 56,1°C |
| Метилэтилкетон | CH3CH2COCH3 | −86°C | 80°C |
| Диэтилкетон | CH3CH2COCH2CH3 | -40°C | 102°C |
| Ацетофенон | 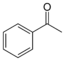 | 19°C | 202°C |
| Бензофенон | 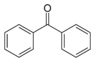 | 47.9°C | 305.4°C |
| Циклогексанон | 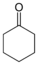 | −16.4°C | 155.65°C |
| Диацетил | CH3COCOCH3 | -3°C | 88°C |
| Ацетилацетон | CH3COCH2COCH3 | −23°C | 140°C |
| Парабензохинон |  | 115 °C | — |
Биологическое действие
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Типы кетонов, свойства, номенклатура, использование и примеры
Наконец, выведение кетонов из организма человека обычно связано с низким уровнем сахара (в случаях диабета и / или чрезмерного голодания), что может вызвать серьезные проблемы со здоровьем у пациента.
Общая формула кетонов
Кетоны представляют собой карбонильные соединения, в которых эта группа связана с двумя углеводородными группами; это могут быть алкильные группы, бензольные кольцевые группы или оба.
Существует множество методов получения кетонов в промышленных и лабораторных условиях; Кроме того, важно отметить, что кетоны могут синтезироваться различными организмами, включая человека.
В промышленности наиболее распространенный метод синтеза кетонов включает окисление углеводородов, как правило, с использованием воздуха. В небольших масштабах кетоны обычно получают путем окисления вторичных спиртов, что дает в качестве продуктов кетон и воду..
Помимо этих наиболее распространенных методов, кетоны можно синтезировать с помощью алкенов, алкинов, солей азотных соединений, сложных эфиров и многих других соединений, что облегчает их получение..
Типы кетонов
Существует несколько классификаций кетонов, зависящих в основном от заместителей в их цепях R. Ниже приведены наиболее распространенные классификации для этих веществ:
По структуре вашей сети
В этом случае кетон классифицируется по способу структурирования его цепи: алифатическими кетонами являются те, которые имеют два радикала R и R ‘, которые имеют форму алкильных радикалов (алканы, алкены, алкины и циклоалканы).
По симметрии его радикалов
В этом случае изучаются радикалы R и R ‘заместителей карбонильной группы; когда они равны (идентичны), кетон называется симметричным; но когда они разные (как и большинство кетонов), это называется асимметричным.
По насыщенности его радикалами
Кетоны также могут быть классифицированы в соответствии с насыщенностью их углеродных цепей; Если они находятся в форме алканов, кетон называется насыщенным кетоном. Напротив, если цепочки находятся в виде алкенов или алкинов, кетон называется ненасыщенным кетоном..
дикетонов
Это отдельный класс кетонов, так как цепи этого кетона имеют две карбонильные группы в своей структуре. Некоторые из этих кетонов имеют уникальные характеристики, такие как более длинная длина связи между атомами углерода.
Например, дикетоны, полученные из циклогексана, известны как хиноны, которых всего два: орто-бензохинон и пара-бензохинон.
Физико-химические свойства кетонов
Кетоны, как и большинство альдегидов, представляют собой жидкие молекулы и обладают рядом физических и химических свойств, которые варьируются в зависимости от длины их цепей. Его свойства описаны ниже:
Точка кипения
Кетоны обладают высокой летучестью, высокой полярностью и не могут отдавать водороды для водородных связей (они не имеют атомов водорода, связанных с их карбонильной группой), поэтому они имеют более высокие точки кипения, чем алкены и простые эфиры, но ниже, чем те спирты с одинаковой молекулярной массой.
Температура кипения кетона увеличивается с увеличением размера молекулы. Это связано с вмешательством ван-дер-ваальсовых сил и диполь-дипольных сил, которые требуют большего количества энергии для разделения атомов и электронов, привлеченных к молекуле..
растворимость
Растворимость кетонов оказывает сильное влияние частично на способность этих молекул принимать водород в своем атоме кислорода и, таким образом, образовывать водородную связь с водой. Кроме того, между кетонами и водой образуются притягивающие, рассеивающие и диполь-дипольные силы, которые усиливают их растворимый эффект..
Кетоны теряют растворимость по мере увеличения их молекулы, так как они начинают требовать больше энергии для растворения в воде. Они также растворимы в органических соединениях.
кислотность
Благодаря своей карбонильной группе кетоны имеют кислотную природу; это происходит из-за резонансной стабилизационной способности этой функциональной группы, которая может переносить протоны из своей двойной связи с образованием сопряженного основания, называемого енолом.
реактивность
Кетоны являются частью большого количества органических реакций; это происходит из-за чувствительности его карбонильного углерода к нуклеофильному присоединению, в дополнение к полярности этого.
Как указано выше, высокая реакционная способность кетонов делает их признанным промежуточным продуктом, который служит основой для синтеза других соединений..
номенклатура
Кетоны названы в соответствии с приоритетом или важностью карбонильной группы во всей молекуле, поэтому, когда у вас есть молекула, управляемая карбонильной группой, кетон назван путем добавления суффикса «-one» к названию углеводорода..
Самая длинная цепь с карбонильной группой берется в качестве главной цепи, а затем молекула называется. Если карбонильная группа не имеет приоритета над другими функциональными группами молекулы, то она идентифицируется как «-oxo».
Для более сложных кетонов положение функциональной группы может быть идентифицировано числом, а в случае дикетонов (кетонов с двумя одинаковыми заместителями R и R ‘) указывается молекула с суффиксом «-дион»..
Наконец, слово «кетон» также можно использовать после идентификации цепей радикалов, связанных с карбонильной функциональной группой..
Разница между альдегидами и кетонами
Самое большое различие между альдегидами и кетонами заключается в наличии атома водорода, присоединенного к карбонильной группе в альдегидах.
Этот атом оказывает важное влияние, когда речь идет о вовлечении молекулы в реакцию окисления: альдегид образует карбоновую кислоту или соль карбоновой кислоты, в зависимости от того, происходит ли окисление в кислотных или основных условиях..
Напротив, кетон не имеет этого водорода, поэтому минимальные шаги, необходимые для окисления, не происходят.
Существуют методы окисления кетона (с окислителями, намного более сильными, чем обычно используемые), но они разбивают молекулу кетона, разделяя ее сначала на две или более частей..
Промышленное и повседневное использование
В промышленности кетоны часто встречаются в парфюмерии и красках, выполняя роль стабилизаторов и консервантов, которые препятствуют разложению других компонентов смеси; они также имеют широкий спектр применения в качестве растворителей в тех отраслях, которые производят взрывчатые вещества, краски и текстиль в дополнение к фармацевтическим препаратам..
Ацетон (самый маленький и самый простой кетон) является растворителем, признанным во всем мире, и используется в качестве растворителя и растворителя..
Биосинтез жирных кислот, который происходит в цитоплазме клеток животных, также происходит под действием кетонов. Наконец, как уже упоминалось выше, может наблюдаться повышение кетонов в крови после голодания или в случаях диабета..
Примеры кетонов
Бутанон (C4H8O)
Также известная как MEK (или MEC), эта жидкость производится в промышленных масштабах и используется в качестве растворителя..
Циклогексанон (С6H10O)
Произведенный в больших масштабах, этот кетон используется в качестве предшественника синтетического нейлонового материала..
Тестостерон (С19H22О2)
Это основной гормон мужского пола и анаболический стероид, встречающийся у большинства позвоночных..
Прогестерон (С21H30О2)
Эндогенные стероиды и половые гормоны, участвующие в менструальном цикле, беременности и эмбриогенезе у людей и других видов.
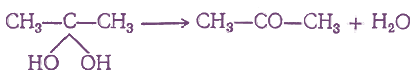
1. Окисление спиртов
Кетоны могут быть получены окислением вторичных спиртов. Окислителем, обычно применяемым для этой цели в лабораториях, является хромовая кислота, употребляемая чаще всего в виде «хромовой смеси» (смесь бихромата калия или натрия с серной кислотой). Иногда применяются также перманганаты различных металлов или перекись марганца и серная кислота.
2. Дегидрогенизация (дегидрирование) вторичных спиртов
3. Из одноосновных карбоновых кислот
Кетоны могут быть получены сухой перегонкой кальциевых и бариевых солей одноосновных кислот. Для всех кислот, кроме муравьиной, реакция идет следующим образом:
Чаще восстанавливают не самые кислоты, а их производные, например хлорангидриды:
т. е. образуется кетон с двумя одинаковыми радикалами и карбонат кальция.
Если взять смесь солей двух кислот или смешанную соль, то наряду с предыдущей реакцией происходит также реакция между молекулами разных солей:
Вместо сухой перегонки готовых солей используют также контактный способ, так называемую реакцию кетонизации кислот, состоящую в том, что пары кислот пропускают при повышенной температуре над катализаторами, в качестве которых применяют углекислые соли кальция или бария, закись марганца, окись тория, окись алюминия и др.
Здесь сначала образуются соли органических кислот, которые затем разлагаются, регенерируя вещества, являющиеся катализаторами. В результате реакция идет, например, для уксусной кислоты по следующему уравнению:
4. Действие воды на дигалоидные соединения
Кетоны могут получаться при взаимодействии с водой дигалоидных соединений, содержащих оба атома галоида при одном и том же атоме углерода. При этом можно было бы ожидать обмена атомов галоида на гидроксилы и получения двухатомных спиртов, у которых обе гидроксильные группы находятся при одном и том же атоме углерода, например:
Но такие двухатомные спирты в обычных условиях не существуют, они отщепляют молекулу воды, образуя кетоны:
5. Действие воды на ацетиленовые углеводороды (реакция Кучерова)
При действии воды на гомологи ацетилена в присутствии солей окиси ртути, получаются кетоны:
6. Получение с помощью магний- и цинкорганических соединений
При взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме:
Если на полученные соединения подействовать водой, то они реагируют с ней с образованием в кетонов:
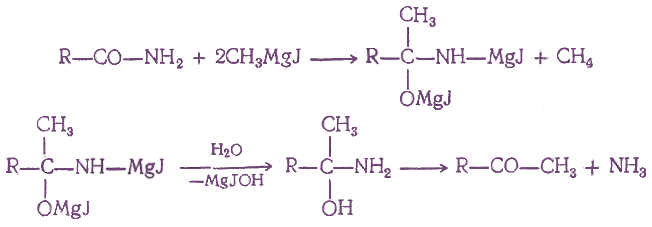
При действии на амид кислоты двух молекул магнийорганического соединения, а затем воды получаются кетоны без образования третичных спиртов:
7. Действие кадмийорганических соединений на хлорангидриды кислот
Кадмийорганические соединения взаимодействуют с хлорангидридами кислот иначе, чем магний- или цинкорганические:
Поскольку кадмийорганические соединения не вступают в реакцию с кетонами, здесь не могут получаться третичные спирты.
Применение кетонов
В промышленности кетоны используют как растворители, фармацевтические препараты и для изготовления различных полимеров. Важнейшими кетонами являются ацетон, метилэтиловый кетон и циклогексанон.
Физиологическое действие
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Кетоны играют важную роль в метаболизме веществ в живых организмах. Так, убихинон участвует в окислительно-восстановительных реакциях тканевого дыхания. К соединениям, содержащим кетонную группу, относятся некоторые важные моносахариды (фруктоза и др.), терпены (ментон, карвон), компоненты эфирных масел (камфора, жасмон), природные красители (индиго, ализарин, флавоны), стероидные гормоны (кортизон, прогестерон), мускус (мускон), антибиотик тетрациклин.
Наличие в моче и крови человека кетонов говорит о гипогликемии, различных расстройствах метаболизма или кетоацидозе.
Кетоны
Кетоны — это органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами.
Среди других карбонильных соединений наличие в кетонах именно двух атомов углерода, непосредственно связанных с карбонильной группой, отличает их от карбоновых кислот и их производных, а также альдегидов.
Содержание
Физические свойства
Кетоны — летучие жидкости или легкоплавкие твёрдые вещества, низшие представители хорошо растворимы в воде и смешиваются с органическими растворителями, некоторые (ацетон) смешиваются с водой в любых отношениях. Невозможность образования межмолекулярных водородных связей обуславливает несколько бо́льшую их летучесть, чем у спиртов и карбоновых кислот с той же молекулярной массой.
Методы синтеза
Химические свойства
Существует три основных типа реакций кетонов.
Первый связан с нуклеофильной атакой по атому углерода карбонильной группы. Например, взаимодействие кетонов с цианид-анионом или металлорганическими соединениями. К этому же типу (нуклеофильного присоединения) относится взаимодействие карбонильной группы со спиртами, приводящее к ацеталям и полуацеталям.
Взаимодействие со спиртами:
C2H5—C(O)—C2H5 + C2H5MgI → (C2H5)3—COMgI → (C2H5)3—COH, третичный спирт. Реакции с альдегидами, и особенно с метаналем идут заметно активнее, при этом с альдегидами образуются вторичные спирты, а с метаналем — первичные.
Также кетоны реагируют с азотистыми основаниями, например, с аммиаком и первичными аминами с образованием иминов:
Второй тип реакций — депротонирование бета-углеродного атома, по отношению к карбонильной группе. Образующийся карбанион стабилизирован за счёт сопряжения с карбонильной группой, лёгкость удаления протона возрастает, поэтому карбонильные соединения являются сравнительно сильными С—Н кислотами.
Третий — координация электрофилов по неподелённой паре атома кислорода, например, таких кислот Льюиса, как AlCl3.
К отдельному типу реакций можно отнести восстановление кетонов — восстановление по Лейкарту с выходами близкими к количественным.
Важнейшие кетоны
| Название | Формула | Температура плавления | Температура кипения |
|---|---|---|---|
| Диметилкетон | CH3COCH3 | −95 °C | 56,1 °C |
| Метилэтилкетон | CH3CH2COCH3 | −86 °C | 80 °C |
| Диэтилкетон | CH3CH2COCH2CH3 | −40 °C | 102 °C |
| Ацетофенон |  | 19 °C | 202 °C |
| Бензофенон | 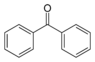 | 47.9 °C | 305.4 °C |
| Циклогексанон | 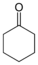 | −16.4 °C | 155.65 °C |
| Диацетил | CH3COCOCH3 | −3 °C | 88 °C |
| Ацетилацетон | CH3COCH2COCH3 | −23 °C | 140 °C |
| Парабензохинон |  | 115 °C | — |
Биологическое действие
Токсичны. Обладают раздражающим и местным действием, проникают через кожу, особенно хорошо ненасыщенные алифатические. Отдельные вещества обладают канцерогенным и мутагенным эффектом. Галогенпроизводные кетонов вызывают сильное раздражение слизистых оболочек и ожоги при контакте с кожей. Алициклические кетоны обладают наркотическим действием.
Литература
 Органические вещества Органические вещества | |
|---|---|
| Углеводороды | Алканы · Алкены · Арены · Алкины · Диены · Циклоалканы |
| Кислородсодержащие | Спирты · Простые эфиры · Альдегиды · Кетоны · Кетены · Карбоновые кислоты · Сложные эфиры · Ортоэфиры · Углеводы · Жиры · Хиноны · Фенолы · Енолы · Оксикислоты · Оксокислоты |
| Азотсодержащие | Амины · Окиси аминов · Амиды · Гидразиды · Нитросоединения · Нитрозосоединения · Оксимы · Нитрилы · Изонитрилы · Аминокислоты · Белки · Пептиды |
| Серосодержащие | Меркаптаны · Тиоэфиры · Сложные тиоэфиры · Дисульфиды · Сульфокислоты · Тиоальдегиды · Тиокетоны · Тиокарбоновые кислоты |
| Фосфорсодержащие | Фосфины · Фосфонистые кислоты · Фосфиновые кислоты · Фосфоновые кислоты · Нуклеиновая кислота · Нуклеотиды |
| Галогенорганические | Фторорганические соединения · Хлорорганические соединения · Броморганические соединения · Иодорганические соединения |
| Кремнийорганические | Силаны · Силазаны · Силтианы · Силоксаны · Силиконы |
| Элементоорганические | Германийорганические · Борорганические · Оловоорганические · Свинецорганические · Алюминийорганические · Ртутьорганические · Другие металлоорганические |
| Другие важные классы | Галогенуглеводороды · Гетероциклические соединения · Перфторуглеводороды |
Полезное
Смотреть что такое «Кетоны» в других словарях:
КЕТОНЫ — КЕТОНЫ, органические соединения, содержащие карбонильную группу (С=О), присоединенную к двум углеводородным группировкам. Кетоны жидкости или низкоплавкие твердые тела. Например, пропанон (ацетон, СН3СОСН3) и бутанон (метилэтил кетон, СН3СОС2Н5) … Научно-технический энциклопедический словарь
КЕТОНЫ — RCOR?, органические соединения, содержащие карбонильную группу С=О, связанную с двумя (одинаковыми или разными) углеводородными радикалами R и R?. Получаются окислением вторичных спиртов и др. методами. Кетоны полупродукты в органическом синтезе … Большой Энциклопедический словарь
КЕТОНЫ — класс органических соединений, содержащих карбонильную группу >С=0 в сочетании с двумя органическими радикалами R. Общая формула кетонов: R СО R. Низшие представители К. жидкости, растворимые в воде, высшие твёрдые вещества, в воде не растворимые … Большая политехническая энциклопедия
КЕТОНЫ — карбонильные соед., в к рых группа С=О связана с двумя атомами С. По номенклатуре ИЮПАК, назв. К. образуют путем присоединения к назв. соответствующих углеводородов суффикса он или к назв. радикалов, связанных с кетогруппой С=О, слова кетон ; при … Химическая энциклопедия
кетоны — класс органических соединений, содержащих карбонильную группу, соединенную с двумя атомами углерода; к К. относится ряд биологически активных веществ стероидные гормоны, кетоновые тела и др … Большой медицинский словарь
Кетоны — класс органических соединений, содержащих карбонильную группу 3СОСН3, ароматического ряда бензофенон С6Н5СОС6Н5. В отличие от приведённых симметричных, существуют и несимметричные (смешанные) К., содержащие разные радикалы R и R’,… … Большая советская энциклопедия