Кеторолак или кетопрофен в чем разница
Нестероидные противовоспалительные препараты: список и цены
Нестероидные противовоспалительные препараты используются достаточно широко для подавления воспалительных процессов в организме. НПВП доступны в различных формах выпуска: таблетки, капсулы, мази. Они обладают тремя основными свойствами: жаропонижающими, противовоспалительными и болеутоляющими.
Лучший нестероидный противовоспалительный препарат может подобрать только врач, отталкиваясь от индивидуальных особенностей пациента. Самолечение в данном случае может быть чревато развитие серьезных побочных реакций или же передозировки. Предлагаем ознакомиться со списком препаратов. Рейтинг разработан на основании соотношения цена-качество, отзывов пациентов и мнения специалистов.
Как работают НПВП?
Нестероиды ингибируют агрегацию тромбоцитов. Терапевтические свойства объясняются блокадой фермента циклооксигеназы (ЦОГ-2), а также снижением синтеза простагландина. По мнению специалистов они оказывают влияние на симптомы заболевания, но не устраняют причину его возникновения. Поэтому не следует забывать о средствах, с помощью которых должны быть устранены первичные механизмы развития патологии.
Если у пациента обнаружена непереносимость НПВП, тогда они заменяются лекарствами других категорий. Часто в таких случаях применяют комбинацию противовоспалительного и болеутоляющего средства.
Как показывает практика, нецелесообразно заменять одно лекарство другим той же группы, если при приеме обнаруживается недостаточный терапевтический эффект. Удвоение дозы может привести только к клинически незначительному увеличению воздействия.
Классификация НПВП
Нестероидные противовоспалительные средства классифицируются в зависимости от того, являются ли они селективными для ЦОГ-2 или нет. Таким образом, с одной стороны, есть неселективные НПВП, а с другой – селективные ЦОГ-2.
Одинаковая безопасность применения кеторолака, диклофенака и кетопрофена для купирования боли после обширных хирургических операций
Опубликовано в журнале:
British Journal of Anaesthesia »» 2002, Vol. 88, No. 2 227-233 2002
1 Department of Anaesthesia, McMaster University, Hamilton, Canada.
2 Department of Anaesthesia, Vrije Universiteit, Brussels, Belgium.
3 Department of Obstetrics and Gynaecology, University of Glasgow, Glasgow, UK.
4 Department of Surgical Gastroenterology, University of Copenhagen, Hvidovre, Denmark.
5 Department of Medical Statistics, London School of Hygiene and Tropical Medicine, London, UK.
6 Department of Anaesthesia, Hôpital Tenon, Paris, France.
7 Department of Primary Care and Population Sciences and Department of Social Medicine, University of Bristol, Bristol, UK.
8 Department of Haematology, University of Barcelona, Barcelona, Spain.
9 Department of Anaesthesia, Universität Mainz, Mainz, Germany.
10 Department of Pharmacology, University of Verona, Verona, Italy.
11 Department of Medicine, Birmingham University, Birmingham, UK.
12 Department of Gastroenterology, L.Sacco University Hospital, Milan, Italy.
13 Department of Haematology, University Hôpital-Dieu de Paris, Paris, France.
14 Ckdt Communications Ltd, Allschwil, Switzerland
*Corresponding author: Department of Anaesthesia, HSC 2U4, McMaster University, Hamilton, Canada L8N 3Z5
Принято к публикации: 12.10.2001
Реферат
ВВЕДЕНИЕ. Кеторолак разрешен к применению для купирования послеоперационной боли, однако до сих пор не возникало серьезных вопросов по поводу возможного риска развития серьезных побочных эффектов или смерти. Два регулятивных обзора по безопасности кеторолака, проведенные в Европе, показали, что представленные данные неубедительны и что отсутствует информация по сравнению с другими нестероидными противовоспалительными препаратами. Целью настоящего исследования было сравнение риска развития серьезных побочных эффектов при применении кеторолака в равнении с диклофенаком или кетопрофеном у взрослых пациентов после плановых обширных хирургических операций.
МЕТОДЫ: Проведено проспективное рандомизированное мультицентровое исследование для оценки риска смерти, увеличения риска кровотечения из места вмешательства, желудочно-кишечного кровотечения, острой почечной недостаточности и аллергических реакций при применении кеторолака в сравнении с диклофенаком или кетопрофеном. Длительность терапии, а также дозы препаратов для перорального и парентерального введения соответствовали официально разрешенным. Пациенты наблюдались в течение 30 дней после операции.
ЗАКЛЮЧЕНИЕ: применение кеторолака так же безопасно для лечения боли после обширных хирургических вмешательств, как и применение кетопрофена и диклофенака.
Введение.
Кеторолака трометамин – инъекционный нестероидный противовоспалительный препарат, разрешенный в 1990 году к применению в качестве послеоперационного обезболивающего средства. Несмотря на широкое применение его в последнее десятилетие, постоянно поднимается вопрос о возможности повышенного риска развития серьезных побочных эффектов. [1, 2] Летальные исходы, различные геморрагические осложнения, острая почечная недостаточность описывались вследствие назначения кеторолака.[3,5] В Европе группой фармацевтического надзора Комитета по патентам медицинских продуктов (the PharmacovigilanceGroup of the Committee on Proprietary Medicinal Products (CPMP)) были проведены два формальных исследования безопасности кеторолака, однако, доступные результаты неубедительны и требуют сравнения с другими препаратами группы НСПВС, применяемыми в послеоперационном периоде.[6] CPMP рекомендовал проведение больших популяционных исследований, которые должны определить риски развития серьезных осложнений вследствие применения кеторолака и сравнить их с другими инъекционными НСПВС. Мы провели мультицентровое проспективное рандомизированное исследование безопасности кеторолака в сравнении с диклофенаком и кетопрофеном у взрослых пациентов при лечении боли в послеоперационном периоде. Оценивались риски развития летальных исходов, увеличения частоты развития хирургических кровотечений, кровотечений из желудочно-кишечного тракта, острой почечной недостаточности, а также разнообразных аллергических осложнений.
Пациенты и методы.
В исследование были включены пациенты 49 госпиталей в 8 странах Европы (Бельгия, Великобритания, Ирландия, Испания, Италия, Португалия, Финляндия, Швейцария). Исследование проводилось в соответствии с требованиями дополненной Хельсинской декларацией (1996 и 1989 гг.) Информированное письменное согласие на участие в исследовании было получено у всех пациентов перед рандомизацией. Одобрение Этического комитета было получено в каждом госпитале, включенном в исследование, и соответствовало законодательству своей страны.
Популяционная характеристика.
Дизайн исследования.
Исследование было выполнено в форме проспективного рандомизированного мультицентрового сравнения кеторолака относительно диклофенака и кетопрофена, определяющего риски развития пяти первичных серьезных осложнений, таких как летальный исход, увеличение частоты развития эпизодов хирургических кровотечений, желудочно-кишечное кровотечение, острая почечная недостаточность, различные аллергические реакции. Они диагностировались в соответствии со стандартными диагностическими критериями (Приложение 1). Наблюдение за пациентами продолжалось в течение 30 дней от момента выполнения оперативного вмешательства. Все пациенты, прошедшие рандомизацию и, о конечных точках которых, имелись сообщения, включались в анализ (intention-to-treat).
Каждый исследованный препарат назначался в соответствии с апробированными терапевтическими дозами. Максимальные суточные дозы и длительность лечения были следующими: кеторолак 90 мг парентерально в сутки в течение 2 дней, далее 7 дней по 40 мг per os; диклофенак парентерально 150 мг в течение 2 дней, далее перорально по 150 мг в течение 7 дней; кетопрофен парентарально 200 мг в течение 2 дней, затем 200 мг в течение 7 дней per os. В случае необходимости дополнительной аналгезии было возможно применение опиатов. Абстрактные данные подвергались случайному аудиту и тестировались на предмет достоверности.
Результаты.
Таблица 1.
Основные характеристики 11302 пациентов, прошедших рандомизацию в группы кеторолака и сравнительных НСПВС, данные 57 пациентов были исключены, а сведения о 11245 включены в базу данных.
Признак
Кеторолак в сравнении с другим НСПВСn=5658, n=5644
Кеторолак в сравнении с диклофенаком n=2585, n=2582
Кеторолак в сравнении с кетопрофеном n=3073, n=3062
Когда назначают препарат Кеторол
Группа нестероидных противовоспалительных препаратов насчитывает множество наименований, среди которых и Кеторол. Он позволяет снять болевой синдром умеренной выраженности и уменьшить воспаление.
Форма выпуска Кеторола
Кеторол можно встретить в трех лекарственных формах. Таблетки для системного лечения болей. Чаще всего их используют при зубной боли. Гель для наружного применения подходит в качестве местного обезболивания при боли в суставах. Инъекции для внутримышечного введения назначают при ревматоидных артритах и болях в поясничном отделе при радикулитах.
Состав препарата Кеторол
В качестве активного вещества таблетированной формы выступает кеторолака трометамин, а основными вспомогательными элементами являются: лактоза, микрокристаллическая целлюлоза, кукурузный крахмал.
Раствор в ампулах также основан на кеторолаке. А вот вспомогательные вещества здесь иные: натрия хлорид, этиловый спирт, пропиленгликоль и октоксинол. Около 1 мл приходится на очищенную воду для инъекций.
Гель для наружного применения снимает болевой синдром благодаря такому же основному веществу, что используется и в других лекарственных формах – кеторолаку. Дополнительными элементами в составе отмечаются: диметилсульфоксид, метилпарагидроксибензоат натрия, карбомер, трометамин и вода.
Фармакологическая группа
Кеторол относится к группе нестероидных противовоспалительных препаратов, которая насчитывает множество средств разного состава, отличающихся механизмами действия, но схожими фармакологическими эффектами. Основное отличие такой группы – отсутствие влияния на надпочечники, то есть это группа медикаментов не является гормональной.
Три основных направления, в которых действуют нестероидные противовоспалительные средства:
нормализация температуры тела.
Кеторол, являясь представителем НВПС, выполняет все три функции.
Когда назначают Кеторол
Три главных направления препарата формируют показания, которые становятся поводом для назначения Кеторола:
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
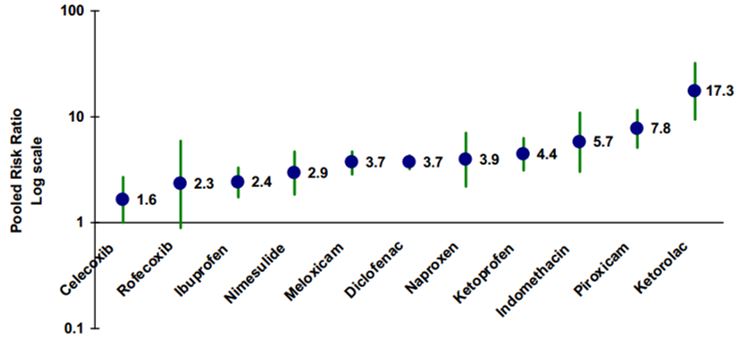
Как выбрать лекарство
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
Существуют ли различия между нестероидными противовоспалительными препаратами? В центре внимания нимесулид
В данной работе представлены различия нестероидных противовоспалительных препаратов, применяемых для лечения заболеваний, сопровождающихся острой болью.
This paper describes different non-steroid anti-inflammatory preparations used for treatment of diseases accompanied with acute pain.
Распространенность заболеваний, сопровождающихся острой болью и требующих применения обезболивающих препаратов, в современном мире постоянно растет. К ним относятся, в частности, ревматические болезни, воспалительные и дегенеративные заболевания опорно-двигательного аппарата, головная боль. Примерно 40% визитов к врачу общей практики обусловлены слабой и умеренной острой болью, а более 70% посещений отделений неотложной помощи происходит из-за наличия у пациента интенсивной острой боли [1]. В структуре общей заболеваемости населения Российской Федерации болезни костно-мышечной системы и соединительной ткани (БКМС) занимают 3-е место после болезней системы кровообращения и органов дыхания [2]. Агентство National Health Interview Survey демонстрирует следующие данные: в 2011 г. 28,4% взрослых американцев сообщали о боли в нижней части спины (БНС) в течение предыдущих опросу 3 месяцев [3].
Эффективность нестероидных противовоспалительных препаратов (НПВП) при острой боли не подвергается сомнению. НПВП обладают противовоспалительной, обезболивающей и жаропонижающей активностью. Входящие в состав НПВП вещества относятся к различным химическим классам, поэтому обладают разными фармакокинетическими и фармакодинамическими свойствами.
Обзор клинической эффективности НПВП показывает, что различные препараты данной группы обладают примерно схожей терапевтической активностью. В данной работе будут представлены различия НПВП и особое внимание будет уделено представителю НПВП нимесулиду.
Фармакологические свойства НПВП
Ингибирование синтеза простагландинов
В начале 70-х годов Vane высказал предположение, что в основе противовоспалительного действия Аспирина и аналогичных ему препаратов лежит способность ингибировать биосинтез простагладинов, путем ингибирования ответственного за их синтез фермента циклооксигеназы (ЦОГ). Лишь 20 лет спустя эта гипотеза получила свое подтверждение, и стало известно, что за синтез простагландинов отвечают две изоформы ЦОГ (ЦОГ-1 и ЦОГ-2), а НПВП можно разделять с учетом селективности в отношении разных изоформ ЦОГ.
ЦОГ-1 отвечает в основном за синтез простагландинов, участвующих в процессах гомеостаза в жизненно важных органах. Именно с ингибированием ЦОГ-1 связывают хорошо известные желудочно-кишечные побочные эффекты традиционных неселективных НПВП.
Ингибирование ЦОГ-2 обеспечивает противовоспалительный эффект НПВП, так как она участвует в синтезе воспалительных простагландинов.
Неселективные НПВП ингибируют обратимо или необратимо как ЦОГ-1, так и ЦОГ-2. Большинство токсических эффектов этих препаратов связано с их способностью блокировать синтез физиологических простагландинов, необходимых для обеспечения гомеостаза в почках, желудке и тромбоцитах за счет ингибирования ЦОГ-1.
Появление на рынке в конце 90-х годов селективных ингибиторов ЦОГ-2 (коксибов) давало клиницистам надежду на то, что эта группа НПВП обеспечит высокую фармакологическую эффективность при более низком уровне желудочно-кишечных осложнений. Однако ожидания были оправданы не в полной мере, в частности, получены доказательства того, что применение коксибов сопровождается увеличением частоты тромбоэмболических осложнений, что привело к выводу с рынка во всем мире таких препаратов, как рпсиофекоксиб и валдекоксиб. Кроме того, применение валдекоксиба связывают с частым развитием нежелательных кожных реакций. Кардиотоксичность коксибов объясняют блокированием синтеза простациклинов, опосредованного ЦОГ-2, что нивелирует их защитные эффекты в отношении тромбогенеза, гипертензии и атерогенеза in vivo.
НПВП классифицируют по степени селективности в отношении изоформ ЦОГ (рис. 1). Селективность в отношении ЦОГ определяется химической структурой НПВП. Аминокислотная структура ЦОГ-1 и ЦОГ-2 является достаточно стабильной, однако рентгеновские кристаллографические исследования ЦОГ показали, что активная область связывания с НПВП у ЦОГ-2 позволяет связываться с большим количеством субстратов, чем центр связывания у ЦОГ-1. Этот активный канал является гидрофобным, у ЦОГ-2 возможно открытие бокового гидрофильного кармана, который у ЦОГ-1 закрыт изолейцином.
Так, флурбипрофен, который относят к неселективным НПВП, взаимодействует с ЦОГ-1 посредством связывания фенильной группы с гидрофобным каналом и карбоксильной группы с аргинином в 120-м положении. Взаимодействие флурбипрофена с ЦОГ-2 сходно с вышеописанным, однако, связываясь с аргинином в 120-м положении, карбоксильная группа блокирует активный центр ЦОГ-2, не позволяя ему взаимодействовать с субстратом. Напротив, селективные ингибиторы ЦОГ-2 не могут войти в активный канал ЦОГ-1 и не имеют карбоксильной группы для связывания с аргинином в 120-м положении.
Нимесулид — единственный представитель класса сульфонанилидов, преимущественно ингибирующим ЦОГ-2. Активность нимесулида в отношении ЦОГ-2 в 5–50 раз превосходит активность в отношении ЦОГ-1. В исследованиях in vivo использование нимесулида в терапевтической дозе (100 мг 2 раза в сутки) продемонстрировало значительное снижение концентрации простагландина E2 в плазме крови. Нимесулид не оказывает влияния на агрегацию тромбоцитов, что было доказано при оценке индуцированной активности ЦОГ-1, и не влияет на образование в желудке простагландина E2 и простагландина I2, а также ЦОГ-1 зависимых эффектов.
Фармакокинетический профиль
На основании периода полувыведения НПВП могут быть разделены на две большие группы: с коротким периодом полувыведения (менее 6 часов) и с длительным периодом полувыведения (более 10 часов). Группа НПВП с коротким периодом полувыведения включает Аспирин, диклофенак, ибупрофен, флурбипрофен, индометацин, лумиракоксиб* и нимесулид. Группа препаратов с длительным периодом полувыведения включает целекоксиб, напроксен, сулиндак, рофекоксиб, оксапрозин*, пироксикам. Достижение равновесной концентрации препарата в плазме крови происходит после его применения в течение периода, превосходящего период полувыведения в 3–5 раз, поэтому достижение пиковой концентрации в плазме крови и максимального клинического эффекта НПВП с коротким периодом полувыведения происходит быстрее, чем препаратов с длительным периодом полувыведения.
Нимесулид: фармакологический профиль
Нимесулид оказывает быстрое обезболивающее действие, что подтверждают следующие исследования. Применение нимесулида у пациентов с острым артритом характеризуется быстрым началом действия и ранним ингибированием образования простагландина E2 (маркера активности ЦОГ-2). В клинических исследованиях у пациентов с остеоартритом коленных суставов были получены доказательства быстрого начала действия нимесулида. У данной категории больных нимесулид вызывал достоверно более значимое облегчение боли, связанной с ходьбой, и эффект наступал быстрее, чем при применении целекоксиба и рофекоксиба. Начало обезболивающего действия нимесулида фиксировалось уже через 15 минут после приема. Согласно недавним исследованиям, эффективные концентрации нимесулида в плазме крови и синовиальной жидкости обнаруживаются уже через 30 минут после его приема.
НПВП могут обладать противовоспалительными свойствами, которые не зависят от ЦОГ. Было показано, что нимесулид, помимо периферического ингибирующего воздействия на ЦОГ, может ингибировать высвобождение фактора некроза опухолей (ФНО), гистамина, образования активных форм кислорода (АФК), высвобождения матриксных металлопротеаз (ММП) и гибели хондроцитов (рис. 2).
 Влияние нимесулида на медиаторы воспаления
Влияние нимесулида на медиаторы воспаления
ФНО-α играет ведущую роль в воспалительном процессе, что делает его идеальной целью при терапии ревматоидного артрита. В исследованиях на крысах, которым вводили липополисахариды для увеличения уровня ФНО-α, нимесулид эффективно ингибировал его высвобождение.
Выработка фагоцитами супероксида и высвобождение лактоферрина из нейтрофилов были исследованы у восьми добровольцев до и после приема нимесулида внутрь. В качестве активирующих стимулов были использованы фактор хемотаксиса N-формил-метионил-лейцил-фенилаланин и частицы опсонизированного зимозана. Нимесулид значимо ингибировал образование АФК N-формил-метионил-лейцил-фенилаланином и активированными за счет воздействия опсонизированных частиц зимозана фагоцитами (ингибирование до 67,6% и 36,8% соответственно) (рис. 3). Он не оказывал влияния на высвобождение лактоферрина нейтрофилами, что позволило авторам предположить, что нимесулид не оказывает влияния на механизмы, происходящие при экзоцитозе специфичных гранул.
В ходе воспалительной реакции для предупреждения повреждения тканей требуется поддержание баланса между протеиназами (преимущественно эластазами, выделяемыми мигрировавшими в очаг нейтрофилами) и антипротеазами (в основном эластаз-специфическим альфа-1-ингибитором протеиназ; A1PI). Нейтрофильные клетки способны инактивировать A1PI с помощью серии окислительных реакций с участием хлорноватистой кислоты, что позволяет эластазе свободно разрушать соединительную ткань. Возможным способом регулирования активности нейтрофильной эластазы является фармакологическая защита A1PI от окислительной инактивации под действием хлорноватистой кислоты нейтрофилов. В доклинических исследованиях было показано, что нимесулид предотвращал инактивацию A1PI под действием выделяемой нейтрофилами хлорноватистой кислоты, что позволяет осуществлять опосредованный A1PI контроль гистотоксической функции эластазы. Полученные данные позволяют предполагать, что защитное влияние нимесулида на A1PI может иметь значение в реализации его противовоспалительного действия.
В другом исследовании морским свинкам предварительно вводили нимесулид или индометацин, после чего ацетальдегидом провоцировали выброс гистамина и бронхоспазм (рис. 4). В контрольной группе, получавшей только ацетальдегид, концентрация гистамина в крови была равна 195 ± 12 мг/л, в группе, получавшей нимесулид, при использовании дозы 0,1 мг/кг она была равна 154 ± 10 мг/л (p
О. В. Котова, кандидат медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва




.gif)
.gif)
.gif) Влияние нимесулида на медиаторы воспаления
Влияние нимесулида на медиаторы воспаления