Кетоз что это такое у человека
Что надо знать о кето-диете, прежде чем пробовать
Материал проверила и прокомментировала Евгения Маевская, кандидат медицинских наук, врач гастроэнтеролог, диетолог клиники GMS Сlinic.
Что такое кето-диета
Кето-диета, или кетогенная диета — режим питания с низким содержанием углеводов и высоким процентом жиров. Кето-диета помогает снизить уровень сахара в крови, повысить чувствительность к инсулину, улучшить самочувствие и похудеть за счет изменения метаболизма. [1]
Смена питания вызывает состояние кетоза — режима обмена веществ, при котором организм получает топливо из животной пищи [2]. Основным источником энергии становятся кетоновые тела: ацетон, ацетоацетат и бета-оксимасляная кислота. Это вещества, которые образуются в печени из жировых тканей организма и потребляемых жиров. Кетоновые тела питают внутренние органы, мышечную ткань и мозг вместо глюкозы [3], [4].
Процесс кетоза можно запустить с помощью голодания, но кето-диета позволяет войти в это состояние и постоянно его придерживаться без риска для здоровья.
Признаки кетоза:
Кетоз — естественное метаболическое состояние организма, при котором основным источником энергии вместо глюкозы становятся жиры и жировые ткани организма [4].
Виды кето-диеты:
Большинство исследований и экспертных статей посвящены стандартному и высокобелковому режимам [5]. Циклический и целевой варианты меньше изучены и рекомендованы атлетам и бодибилдерам.
Кето-диета — режим питания с высоким процентом жиров и минимумом углеводов. Организм получает энергию из животной пищи вместо глюкозы. Такой рацион может помочь снизить уровень сахара и инсулина в крови и похудеть.
Продукты, которых стоит избегать на кетогенной диете
Кето-диету нельзя назвать безуглеводной: их ежедневное количество составляет 5% рациона или 20-50 гр продукта.
Но чтобы запустить и поддерживать состояние кетоза нужно убрать из меню или уменьшить количество высокоуглеводной пищи:
Продукты, которые нужно включить в рацион
Основные продукты, которые входят в кето-питание [6]:
Продукты с низким уровнем углеводов, которые подходят для кето-диеты [7]:
В качестве перекуса эксперты советуют есть морепродукты, сыр, оливки, мясо, яйца вкрутую, орехи, ягоды, темный шоколад и небольшие порции еды, оставшиеся от завтрака, обеда и ужина.
Меню на неделю по дням
Понедельник
Вторник
Среда
Четверг
Пятница
Суббота
Воскресенье
Эффективность похудения на кето-диете
Ни одна диета сама по себе не дает долгосрочного эффекта похудения и может быть вредна для здоровья. После временного снижения веса люди возвращаются в прежнее состояние, а иногда поправляются сильнее, чем до смены режима питания. Безопасный и эффективный способ добиться нужного веса и поддерживать здоровье и хорошую физическую форму — с помощью специалистов подобрать подходящий образ жизни и схему питания, которые вы сможете соблюдать постоянно [8].
Эксперты подтверждают, что кето-диета в 2,2 раза эффективнее для похудения, чем рацион с низким содержанием жиров [9], [10]. Снижение веса происходит за счет [11]:
Кето-режим не требует постоянного подсчета калорий, создает ощущение сытости, ускоряет процесс сжигания жиров и препятствует их образованию [12], [13].
Вред кето-диеты
В 2018 году польский профессор Мацей Банах представил доклад о вреде низкоуглеводных диет на Конгрессе Европейского общества кардиологов. Исследования показали, что в контрольной группе из 24 тыс. участников риск умереть от сердечных заболеваний, инсульта и онкологии был на 50%, 51% и 35% выше среди тех, кто придерживался рациона с высоким содержанием жиров и минимумом углеводов [14].
В январе 2020 года международная организация Комитет врачей за ответственную медицину рекомендовала исключить низкоуглеводные диеты, включая кето-диету из руководства «Диетологические рекомендации для американцев 2020-2025». Врачи указали, что такой рацион увеличивает риск сердечных заболеваний [15].
Кроме того, у состояния кетоза есть побочные эффекты, о которых нужно знать [2],[16].
Кето-грипп
Общее ухудшение состояния, которое возникает при смене диеты и длится несколько дней [17]. Симптомы:
В первые недели необходимо строго соблюдать диету, чтобы приучить тело к новому режиму. При симптомах кето-гриппа важно есть досыта и ежедневно пить не меньше 2 л жидкости, желательно содержащей электролиты. Специалисты рекомендуют добавить в рацион СЦТ масла (жирные кислоты, которые получают из кокосового и пальмового масла), минералы (соль, сода, магний), кофеин, креатин, сывороточный белок и продукты, содержащие клетчатку. Кроме того, нужно снизить физическую нагрузку.
Группа риска: любой, кто переходит на кето-диету.
Кетоацидоз
Кетоз — естественный физиологический режим, при котором вырабатывается нужное организму количество кетоновых тел. Кетоацидоз — патологическое состояние, когда уровень глюкозы и кетоновых тел избыточен, что может привести к коме и смерти. Причиной кетоацидоза может быть диабет, длительное голодание либо реакция на увеличения количества жиров в рационе [18], [19].
Группа риска: люди с диабетом I типа и II типа, дети в возрасте 1-13 лет, кормящие матери.
Камни в почках
Согласно исследованиям, кетогенная диета может спровоцировать образование камней в почках у 6,7% пациентов [20].
Группа риска: дети, страдающие эпилепсией.
Кето-диета при диабете
Ученые подтвердили пользу кето-режима для людей, страдающих диабетом II типа. В одном случае 95% пациентов сократили или отказались от лекарств по сравнению с 62% участников, которые соблюдали высокоуглеводную диету[21], [22]. В другом — у 75% участников исследования повысилась чувствительность к инсулину.
Кроме того, проводятся исследования о возможном применении кетоза для борьбы с образованием раковых клеток, лечения акне, детской эпилепсии, болезней сердца и мозга, синдромов Паркинсона и Альцгеймера. Но собранного научного материала пока недостаточно для обоснованного заключения [23], [24].
Кето-диета эффективно используется в терапии диабета II типа. В остальных случаях польза низкоуглеводного питания в медицине требует дополнительных исследований.
Отзыв врача о кето-диете
Мы задали несколько вопросов Евгении Маевской, кандидату медицинских наук, врачу-гастроэнтерологу, диетологу клиники GMS Clinic.
Полезна или вредна кето-диета?
«Все дело в дозе». На сегодня эта стратегия питания не признана ни одним мировым диетологическим сообществом, а соответственно, не может быть рекомендована официальной медициной.
При таком типе питания энергоемкость рациона более чем на 80% обеспечивается жирами, а потребление углеводов при этом ограничиваются до 20 г в сутки или до 50 г, что более щадяще и несколько лучше переносится. По сути, чаще всего кето-диета является низкоуглеводной (и с этим связан переход в кетоз) и часто высокобелковой. При таком типе питания в организме в изобилии преобладают насыщенные жиры, включая трансжиры, а также белок.
Часто бывает, что у большинства последователей кето-диеты на первоначальном этапе нет четкого понимания, какие продукты допустимы при кетогенной диете, но более или менее понятно, чего следует избегать. Поэтому в ход идут мясные продукты, что имеет свои последствия.
Это может спровоцировать дефицит пищевых волокон, которые содержатся как раз в углеводистой пище, возможен дефицит водорастворимых витаминов, например С, минералов. Такое питание вряд ли можно считать безопасным. И его крайне сложно придерживаться всю жизнь, а ведь только такой вариант позволяет обеспечить стабильный вес, если говорить о похудении.
Какие последствия и опасности есть у кето-диеты?
Потеря веса на первоначальном этапе действительно может впечатлять, еще до того как организм перешел на кетоз и не началось собственно жиросжигание за счет воды. 1 г углеводов удерживает в организме в четыре раза больше жидкости, чем белок, и первое, что можно заметить, это уменьшение объемов тела. Если лишнего веса действительно много, то результат первоначально воодушевляет.
Но стоит помнить, что все вернется, если рацион станет прежним. И не все так радужно. Вот некоторые негативные последствия:
Также эту стратегию пищевого поведения я связываю с увеличением риска остеопороза, ухудшения мозговой деятельности.
Есть ряд авторитетных зарубежных исследований, с которыми больше знакомы кардиологи, указывающие на то, что при замещении в питании углеводов жирами и белком с целью снижения веса, значительно увеличиваются риски возникновения сердечно-сосудистых заболеваний, примерно на 3,5-5%. То есть риск инсульта и инфаркта может возрастать, если всего лишь изменить тип питания.
Соответственно, если у человека нет вышеперечисленных нарушений, то при желании можно пробовать кето-диету и оценить эффект.
Похожую стратегию, но только без введения в кетоз, а со значимым ограничением доли углеводов (именно за счет сокращения простых углеводов), целесообразно использовать для старта у пациентов с нарушением углеводного обмена, когда, например, повышена норма глюкозы или инсулина. Воодушевившись первыми результатами в уменьшении объемов тела, всегда проще продолжать.
Может, просто не есть сладкое и простые углеводы? Это также помогает снизить сахар и похудеть без кетоза?
Учитывая данные о долгосрочных и максимально результативных диетологических стратегиях, а также собственный опыт, могу сказать, что при отказе от сладкого похудеть действительно можно: сладкая еда не только высококалорийна, но и стимулирует аппетит.
Вот только у большинства вряд ли удержится эффект и потерянные килограммы вернутся. Человеку всегда хочется того, что ему запрещают, и в порыве минутной слабости он себе это позволяет и переедает.
Но такая диета, отнюдь не низкая по углеводам, но с лимитом по простым сахарам, также способна приводить к снижению веса и, соответственно, к нормализации уровня глюкозы в крови.
Как и почему организм входит в состояние кетоза
Кетоз — естественный процесс, запускающий организм для выживания при уменьшении поступления пищи. Организм при этом вырабатывает кетоны в печени из свободных жирных кислот, которые поступают из жировых запасов. Кетоны выступают альтернативным «топливом» для организма.
Состояние кетоза наступает у человека при соблюдении низкоуглеводной диеты для похудения.
Кетоновый обмен веществ в организме
Поскольку центральная нервная система не может использовать жирные кислоты для своей энергии, она обычно использует глюкозу. Низкое потребление углеводов заставляет мозг находить альтернативный источник энергии, полученный из-за перепроизводства ацетил-кофермента A. Вырабатывается кетоновое тело в процессе, называемом кетогенезом.
Термин «кетоновые тела» относится к трем конкретным соединениям:
Уровни циркулирующих кетоновых тел зависят как от скорости их производства (кетогенеза), так и от степени их использования (например, кетолиза). Они имеют важное значение для мозга, который не может получать энергию из других источников при низком уровне глюкозы в крови.
У здоровых взрослых печень способна производить 185 г кетоновых тел каждый день. Основным производимым кетоновым телом является ацетоацетат, но основным циркулирующим кетоном является бета-гидроксибутират.
Большинство кетоновых тел образуются в процессе кетогенеза
Это когда жирные кислоты, выделяющиеся из жировой ткани, разрушаются во время голодания или адренергического стресса.
Во время голодания уровни кетоновых тел увеличиваются с третьего дня и достигают плато в 8 ммоль/л после 5-6 недель голодания. В то время как свободные жирные кислоты становятся основным источником энергии для скелетных мышц и, следовательно, использование кетонового тела снижается, мозг увеличивает их использование.
Влияние метаболизма кетонового тела свидетельствует о том, что умеренный кетоз может иметь терапевтический потенциал при ряде различных болезненных состояний. Следовательно, кетоновые тела могут оказывать терапевтическое воздействие на заболевания недостаточности субстрата или резистентности к инсулину, а также недуги, возникающие в результате повреждения свободными радикалами, и заболевания, вызванные гипоксией.
Измерение кетоновых тел
В последние годы стали доступны количественные анализы крови на бета-гидроксибутират для определения уровней этого кетонового тела в образцах венозной или капиллярной крови. При диабетическом кетоацидозе отношение бета-гидроксибутирата к ацетоацетату первоначально превышает 3:1. При обработке это соотношение изменяется и происходит превращение бета-гидроксибутирата в ацетоацетат.
Знание физиологии кетоза и способов измерения кетоновых тел важно для применения кетогенной диеты.
В самых общих чертах, кетогенная диета представляет собой любую диету, которая заставляет печень производить кетоновые тела, смещая метаболизм тела от глюкозы к утилизации жира.
Отказ от ответственности: этот контент, включая советы, предоставляет только общую информацию. Это никоим образом не заменяет квалифицированное медицинское заключение. Для получения дополнительной информации всегда консультируйтесь со специалистом или вашим лечащим врачом.
Добавьте «Правду.Ру» в свои источники в Яндекс.Новости или News.Google, либо Яндекс.Дзен
Быстрые новости в Telegram-канале Правды.Ру. Не забудьте подписаться, чтоб быть в курсе событий.
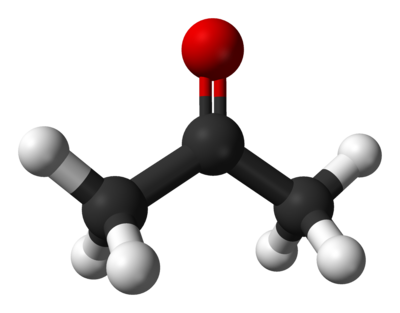
Причины появления запаха ацетона изо рта
Кетоновые тела образуются в организме при активизации альтернативных механизмов получения энергии, а именно, кетогенеза. Этот путь в норме обычно активизируется только при голодании, когда организм испытывает дефицит углеводов.
Кетоновые тела представлены ацетоуксусной и бета-оксимасляной кислотами, а также ацетоном. Это продукты метаболизма ацетил-коэнзима А (ацетил-КоА). Вещество образуется при распаде белков или жиров. Кетоновые тела синтезируются в печени и утилизируются в периферических тканях. Дисбаланс между выработкой и распадом кетоновых тел ведет к накоплению последних. Причинами могут быть особенности функционирования организма, специфический образ жизни или патологические состояния.
Диета
Питание с выраженным дефицитом углеводов, а также преобладанием белков и жиров в рационе заставляет организм получать энергию из кетоновых тел. Запах ацетона может появиться уже на 3-4-й день малоуглеводного питания. Кетогенная диета обычно применяется по медицинским показаниям и под контролем врача. О появлении специфического запаха ацетона необходимо сообщить доктору.
Высокие нагрузки при неполноценном питании

Запах ацетона изо рта у ребенка может быть обусловлен лихорадкой на фоне вирусного заболевания. Такое состояние часто сопровождается снижением аппетита, что еще больше усугубляет проблему. Достаточно быстро запасы гликогена в организме истощаются, поэтому запускается синтез кетоновых тел.
Спровоцировать ацетоновый запах также может сильный стресс. Эмоциональное потрясение сопровождается возбуждением нервной системы и быстрым использованием углеводных резервов. Гормоны надпочечников стимулируют распад белков и жиров. В результате возникают благоприятные условия для повышения концентрации кетонов в крови.
Хроническое отравление алкоголем
При частом и длительном употреблении спиртных напитков метаболизм перестраивается. Переработка спирта в печени стимулирует образование кетоновых тел. Гипогликемия способствует разрушению мышц и запуску кетогенеза. Однако организм не в состоянии утилизировать такое большое количество кетонов, что ведет к существенному повышению уровня ацетона в крови. Если у человека, злоупотребляющего алкоголем, изо рта пахнет ацетоном, необходимо срочно обратиться за помощью. Такой симптом является предвестником опасных нарушений в организме.
Сахарный диабет
Если обнаруживается, что у взрослого пахнет ацетоном изо рта, врачи в первую очередь подозревают сахарный диабет первого типа. При этом состоянии организм страдает от дефицита инсулина, в результате чего метаболизм углеводов замедляется и начинается активный распад жиров (липолиз), который должен покрыть потребности в энергии. Одновременно с этим окисление жирных кислот сопровождается выработкой кетоновых тел. Достаточно быстро уровень ацетона в крови повышается, что проявляется соответствующим запахом.
Другие причины
Другими заболеваниями, при которых может возникать запах ацетона изо рта, являются:
Запах ацетона – опасно или нет?
Запах ацетона изо рта тяжело не заметить, поскольку он похож на аромат моченых яблок и сильно привлекает внимание. Состояние всегда указывает на то, что обмен веществ протекает с некоторыми особенностями. Как вариант нормы такая ситуация допустима только при соблюдении кетогенной диеты и обязательно под контролем врача, которого необходимо информировать о любых изменениях в самочувствии. Иногда запах ацетона говорит о том, что пациенту требуется скорректировать режим питания, увеличить количество жидкости или вовсе отменить диету, поскольку организм не справляется с утилизацией кетоновых тел.
Во всех остальных случаях запах ацетона рассматривают как симптом ацетонемического синдрома. Состояние сопровождается множественными нарушениями в организме, проявляется отсутствием аппетита, слабостью, сонливостью и головными болями. В результате интоксикации ацетоном развивается ацетонемический криз. Состояние проявляется неукротимой рвотой, отсутствием возможности принимать пищу, спазмами в животе и повышением температуры тела. Обезвоживание опасно полиорганной недостаточностью. Чтобы предотвратить неблагоприятные последствия, необходимо вовремя обратиться за медицинской помощью.
Что делать, если изо рта пахнет ацетоном?
При подтверждении ацетонемического синдрома необходимо установить причины кетоза. Первично этим занимается терапевт или педиатр. При наличии специфических симптомов заболевания пациента направляют к профильному специалисту (эндокринологу, неврологу, гастроэнтерологу и др.).
Лечение при запахе ацетона изо рта
Симптоматическое лечение кетоза подразумевает следующие мероприятия:
В комплексной медикаментозной терапии применяют противорвотные препараты, гепатопротекторы, кофакторы углеводного обмена и ферменты поджелудочной железы. Параллельно проводится этиотропная терапия. Лечение подбирается в персональном порядке с учетом общего состояния пациента и сопутствующих заболеваний.
При появлении характерного запаха ацетона изо рта обращайтесь в многопрофильный медицинский центр «МедПросвет». В клинике можно проконсультироваться с врачами общей практики (терапевт или педиатр) и узкопрофильными специалистами. Врачи центра составят для Вас индивидуальную программу диагностики причины кетоза и подберут лечения, которая включает симптоматическую терапию и мероприятия по лечению основного заболевания.
Записаться на первичный прием к врачу общей практики можно по телефону +7(812)374-84-00 или оставив заявку предварительной записи на сайте.
Синдром гиперкетонемии у детей и подростков: патогенез, причины, диагностика
В статье представлены современные данные о физиологии энергетического обмена и роли в нем кетоновых тел. Рассмотрены основные причины избыточного образования кетонов, методы диагностики, подходы к лечению.
The article presents modern data on the physiology of energy metabolism and the role of ketone bodies in it. The main causes of excessive ketone formation, diagnostic methods, approaches to treatment are considered.
Часть 1
Кетоновые тела (ацетоновые тела) — группа органических соединений, являющихся промежуточными продуктами обмена углеводов, жиров, белков. Кетокислоты — это продукт метаболизма ацетил-коэнзима А (ацетил-КоА), который при дефиците пищи образуется либо из собственных белков, либо из жира. К кетоновым телам относятся β-оксимасляная кислота (β-оксибутират), ацетоуксусная кислота (ацетоацетат) и ацетон.
Физиология энергетического обмена
Кетоновые тела синтезируются в основном в митохондриях печеночных клеток из ацетил-КоА, который объединяет несколько ключевых метаболических процессов клетки. Главная функция ацетил-КоА — доставлять атомы углерода с ацетил-группой в цикл трикарбоновых кислот (ЦТК, цикл Кребса), чтобы те были окислены с выделением энергии. Содержание ацетил-КоА определяет направление клеточного метаболизма в данный момент: будет ли происходить синтез и накопление гликогена, жира и синтез белков или, наоборот, будут расходоваться ранее накопленные энергозапасы в организме.
Образование кетоновых тел является физиологическим процессом и необходимой частью энергетического обмена. В процессе этого обмена происходит «сгорание» и взаимотрансформация углеводов, белков, жиров и других энергосубстратов с образованием энергии, которая либо превращается в тепло, либо аккумулируется в виде аденозинтрифосфата (АТФ).
В условиях дефицита энергии в организме воссоздание энергетических запасов возможно за счет активации глюконеогенеза или синтеза кетоновых тел (кетогенез).
Кетоновые тела играют важную роль в поддержании энергетического баланса организма, а активация кетогенеза является более целесообразной и оптимальной для организма в этих условиях. Кетоновые тела не только сохраняют структурные белки организма, угнетая секрецию и действие глюкагона — мощного стимулятора глюконеогенеза, но и по механизму обратной связи регулируют и ограничивают интенсивность кетогенеза [1].
Глюконеогенез — это метаболический путь биосинтеза глюкозы из не углеводных предшественников, активный в печени, почках, тонком кишечнике. Когда запасы гликогена в организме исчерпываются, печень переходит на синтез его путем глюконеогенеза. Субстратами глюконеогенеза являются: пировиноградная кислота (пируват), молочная кислота (лактат), глицерол, глюкогенные аминокислоты, жирные кислоты.
Трансформация пировиноградной кислоты возможна двумя путями — аэробным или анаэробным. Гликолиз, или путь Эмбдема–Мейергофа, — основной путь утилизации глюкозы в клетках. Одна молекула глюкозы превращается при этом в две молекулы пировиноградной кислоты. Превращение пирувата в ацетил-КоА происходит при участии набора ферментов, структурно объединенных в пируватдегидрогиназный комплекс (ПДК).
При аэробных условиях пируват проникает в митохондрии. Образованный ацетил-КоА в цикле Кребса окисляется до СО2 и Н2О. Основная часть глюкозы расходуется на синтез АТФ в процессе окислительного фосфорилирования.
Если содержание кислорода недостаточно, как это может быть в скелетных мышцах при интенсивной физической нагрузке или в тканях, где нет или очень мало митохондрий (эритроциты, белые мышцы, клетки сетчатки глаза, мозгового слоя коры надпочечников), гликолиз является конечным энергетическим процессом, в результате которого пируват преобразуется в лактат, а последний в продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Избыток лактата поступает в печень, где из него вновь синтезируется глюкоза (глюконеогенез). Таким образом, лактат используется в глюконеогенезе постоянно.
При мышечной работе глюкоза в миоците используется не только на энергетические нужды, но и на обеспечение постоянного притока оксалоацетата в ЦТК. При этом с увеличением продолжительности нагрузки «энергетическая» роль глюкозы снижается [2].
Ацетил-КоА является ключевым метаболитом липидного обмена. Он образуется при β-окислении жирных кислот в митохондриях печени. В матриксе митохондрий печеночных клеток происходит окисление жирных кислот в цикле Кноппа–Линена. Ключевым участником этого процесса является L-карнитин, который транспортирует длинноцепочечные жирные кислоты в митохондрии через внутреннюю мембрану последних. Этот процесс является инсулинозависимым. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы.
Аминокислоты (лейцин, тирозин, фенилаланин), образующиеся в результате распада мышечных белков, включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе. В процессе катаболизма они превращаются в ацетоацетат и могут использоваться в синтезе кетоновых тел.
Включение лактата, глицерола и аминокислот в глюконеогенез зависит от физиологического состояния организма. При окислении одной молекулы β-оксибутирата образуется СО2 и Н2О и обеспечивается синтез 27 молекул АТФ.
Биологическая роль кетоновых тел
Кетоновые тела играют важную роль в поддержании энергетического баланса. Образовавшиеся ацетоновые тела поступают из гепатоцитов в кровь и разносятся к клеткам различных органов. Ацетоновые тела в норме достаточно хорошо утилизируются клетками периферических тканей, в особенности это касается скелетных мышц и миокарда, которые значительную часть нужной им энергии получают за счет окисления ацетоновых тел. Основным путем активации ацетоацетата в клетках является путь с участием тиафоразы. В гепатоцитах нет этого фермента. Именно поэтому образовавшийся в гепатоцитах ацетоацетат в них не активируется и не окисляется, тем самым создаются условия для «экспорта» ацетоацетата из гепатоцитов в кровь.
У здоровых при усилении липолиза увеличивается скорость утилизации кетоновых тел, которые являются важными источниками энергии при мышечной работе, голодании. Скелетные мышцы и почки используют кетоновые тела даже при их низкой концентрации в крови. Лишь клетки центральной нервной системы в обычных условиях практически не утилизируют ацетоновые тела [3].
Кетоновые тела это часть метаболического регулярного механизма для предотвращения излишней мобилизации жирных кислот и сдерживания протеолиза, что сберегает структурные белки организма. В норме кетоновые тела стимулируют выход инсулина из поджелудочной железы, что угнетает липолиз и таким образом ограничивает доставку липидов в печень и соответственно кетогенез. Во время голодания кетоновые тела являются одним из основных источников энергии для мозга [4]. В норме процессы синтеза и использования кетоновых тел уравновешены. Концентрация кетоновых тел в крови и в тканях обычно очень низка, поэтому содержание кетоновых кислот в плазме крови в норме присутствует в крайне низких количествах и составляет 0,1–0,3 ммоль (0,03–0,2 ммоль/л по ацетону).
Наличие кетоновых тел в моче всегда указывает на развитие патологического состояния в организме. Кетоновые тела удаляются с мочой в различных количествах: ацетон — 3–4%, ацетоуксусная кислота — 30–40%, β-гидроксимасляная — 60–70%.
Лабораторные тесты, выявляющие кетонурию, основаны на реакциях с ацетоацетатом и ацетоном, так как они не реагируют с β-оксибутиратом. Для качественного определения содержания кетоновых тел в моче используют цветные пробы Ланге, Легаля, Лестраде, Герхарда. Количество ацетоацетата в анализе мочи измеряют в плюсах (от одного + до четырех ++++). Присутствие +++ соответствует повышению уровня кетоновых тел в 400 раз, ++++ — в 600 раз. Физиологический кетоз может выявляться при голодании, тяжелой мышечной работе, у новорожденных [5].
Причины избыточного кетоза
Возникающая в патологических условиях гиперкетонемия связана с диссоциацией кетогенеза в печени и утилизацией кетоновых тел в других органах, то есть либо скорость синтеза кетоновых тел в печени превышает скорость их утилизации периферическими тканями организма, либо нарушена утилизации их как источника энергии в других органах.
Повышение содержания кетоновых тел в организме прежде всего вызывается дефицитом углеводов для обеспечения организма энергией, перегрузкой белками и жирами на фоне недостатка легкоперевариваемых углеводов в рационе, истощением организма, ожирением, нарушением эндокринной регуляции (сахарный диабет, тиреотоксикоз и др.), отравлением, травмами черепа и т. д. [4].
Интенсивное образование кетоновых тел происходит также при наличии дефицита оксалоацетата, так как последний является основным регулятором ЦТК. Обычно в клетке имеется баланс между образованием ацетил-КоА (из глюкозы, жирных кислот или аминокислот) и количеством оксалоацетата. Источником оксалоацетата является глюкоза (синтез из пирувата), поступление из фруктовых кислот самого цикла (яблочной, лимонной), образование из аспарагиновой кислоты. При недостаточном количестве оксалоацетата в плазме крови, наблюдаемом при патологических состояниях, концентрация кетоновых тел может значительно повышаться. Не успевая окисляться и представляя собой достаточно сильные органические кислоты, они вызывают развитие метаболического кетоацидоза.
Стимуляция кетогенеза при дефиците пищи, стрессе, длительной рвоте является компенсаторным процессом, в ходе которого восполняется энергетический дефицит за счет кетокислот.
Гиперкетонемия со сдвигом рН в кислую сторону может наблюдаться при угнетении цикла Кребса, в котором происходит «сгорание» кетоновых тел.
Скорость образования кетоновых тел зависит и от скорости окисления жирных кислот в печени, а процесс окисления ускоряется при усилении липолиза (распада жира) в жировой ткани. Интенсивное образование кетокислот происходит также при приеме с пищей так называемых кетогенных аминокислот (лейцина, тирозина, фенилаланина, изолейцина), некоторых белков и большого количества жиров [5].
При умеренном кетозе в крови циркулируют главным образом ацетоацетат и β-оксибутират. Ацетон образуется только при высоких концентрациях кетоновых тел и преимущественно удаляется через легкие.
Однако в экстремальных условиях из кетоновых тел с помощью глюконеогенеза может синтезироваться глюкоза, служащая источником энергии для работы центральной нервной системы.
Ацетоновые тела, накапливаясь в крови и тканях, оказывают ингибирующее действие на липолиз, в особенности это касается расщепления триглицеридов в адипоцитах. Снижение уровня липолиза в клетках жировой ткани приводит к уменьшению притока высших жирных кислот в гепатоциты и к снижению скорости образования ацетоновых тел и, следовательно, снижению их содержания в крови.
При дефиците энергии в результате изменения гормонального статуса и действия внутриклеточных механизмов регуляции нарастает скорость мобилизации жиров и усиливается глюконеогенез из аминокислот и глицерина. Липолиз активируется глюкагоном, адреналином. Длительная стимуляция кетогенеза или нарушение процессов кетолизиса приводят к изменению буферной емкости крови, а при содержании в чрезмерно высоких концентрациях кетоновых тел крови возникает угрожающий жизни декомпенсированный кетоацидоз.
Такая картина характерна при тяжелом течении сахарного диабета 1-го типа, гипогликемии, длительном голодании, стрессах различной этиологии, заболеваниях печени, тяжелой и длительной мышечной работе [6].
Кетоновые тела являются водорастворимыми кислотами, поэтому, в отличие от жирных кислот, они могут проходить через гематоэнцефалический барьер и служат, наряду с глюкозой, источником энергии для нервной ткани, особенно после 3–5 дней голодания, когда концентрация кетоновых тел в крови существенно увеличивается.
Сахарный диабет
Сахарный диабет 1-го типа является самой частой причиной кетоза и кетоацидоза. Ведущую роль в патогенезе кетоацидоза играет абсолютная инсулиновая недостаточность, приводящая к снижению утилизации глюкозы инсулинзависимыми тканями и, соответственно, гипергликемии и тяжелому энергетическому голоду в них. Инсулин влияет на все виды обмена. Дефицит инсулина при сахарном диабете является причиной резкого повышения в крови уровня всех контринсулярных гормонов (глюкагона, кортизола, катехоламинов, тироксина и др.). Они стимулируют мобилизацию липидов из жировых депо и доставку жирных кислот к органам, что является адаптивным механизмом, поставляющим альтернативный субстрат окисления в условиях снижения утилизации глюкозы клетками. Снижается активность липопротеинлипазы (ЛП-липазы) адипоцитов, поэтому свободные жирные кислоты не поступают в жировую ткань. Начинает преобладать эффект глюкагона, стимулирующий кетогенез в печени и гормончувствительную триацилглицерол-липазу (ТАГ-липазу) в адипоцитах.
При сахарном диабете в избыточном количестве начинает образовываться продукт β-окисления жирных кислот — ацетил-КоА. Однако способность цикла Кребса утилизировать данный продукт существенно снижена, так как β-окисление свободных жирных кислот в митохондриях зависит от их транспорта через мембрану митохондрий. А этот процесс является инсулинозависимым.
Если он затруднен, то жирные кислоты быстро превращаются в ацил-КоА, из которого образуется ацетил-КоА. Цикл Кребса и ресинтез жирных кислот не в состоянии полностью использовать избыточно образующийся ацетил-КоА, тем более что цитратный цикл тормозится этим избытком. В норме цитрат образуется путем конденсации оксалоацетата и ацетил-КоА с участием фермента цитрат-синтетазы. Активность последней при декомпенсации диабета снижена, в частности, из-за ингибирующего влияния АТФ, образующейся в избытке при окислении жирных кислот.
Уменьшено и образование оксалоацетата, так как в результате усиленного окисления свободных жирных кислот и повышенного глюконеогенеза увеличивается соотношение NADH/NAD+. Это ведет к недостаточному образованию цитрата и накоплению ацетил-КоА.
Этому процессу способствует увеличение содержания в печени карнитина (особенно в условиях активации эффектов глюкагона). Карнитин стимулирует транспорт жирных кислот в митохондрии клеток печени, где они подвергаются β-окислению, значительно ускоряя кетогенез.
В результате избыток ацетил-КоА становится источником образования больших количеств кетоновых тел: β-оксимасляной, ацетоуксусной кислот и ацетона.
У больных сахарным диабетом 1-го типа нарушается белковый обмен, который характеризуется преобладанием процессов катаболизма в результате активации процесса глюконеогенеза из глюкогенных аминокислот и снижения проницаемости клеточных мембран для аминокислот, что приводит к недостатку в тканях свободных аминокислот и нарушению процесса синтеза белка [6].
Гипоксия тканей вызывает активацию анаэробного гликолиза и повышение содержания лактата, который не может быть утилизирован в результате дефицита лактатдегидрогеназы на фоне дефицита инсулина. Это усугубляет нарушение кислотно-щелочного баланса организма и приводит к возникновению лактоацидоза.
Активное нарастание содержания кетоновых тел при декомпенсации сахарного диабета связано не только с усиленной продукцией, но со сниженной периферической утилизацией. При избыточном накоплении кетоновых тел буферная способность крови быстро истощается, что приводит к развитию декомпенсированного метаболического кетоацидоза. Кетоновые тела начинают выделяться с мочой в виде натриевых солей, а ацетон — также и в составе выдыхаемого воздуха.
Следствием увеличения концентрации ацетоацетата является ускорение образования ацетона, который обладает токсическим свойством. Он растворяется в липидных компонентах клеточных мембран и дезорганизует их. Страдают все ткани организма, а больше всего — клетки нервной ткани. Нарушается работа многих ферментативных систем. Это может проявляться потерей сознания [7].
При сахарном диабете 2-го типа сохраняется минимальная продукция инсулина, что объясняет редкость развития липолиза и состояния кетоацидоза и кетоацидотической комы при нарастании гипергликемии.
Гипогликемия и гипогликемические состояния
Кетотическая гипогликемия является самой частой причиной низкой концентрации глюкозы в крови. Стимуляция кетогенеза в условиях синдрома гипогликемии связана с активацией процессов липолиза при тяжелом энергетическом голоде. По мере истощения запасов гликогена в печени повышается содержание глюкагона, адреналина, норадреналина, кортизола, гормона роста, которые стимулируют глюконеогенез [8, 9].
Из жировой ткани интенсивно метаболизируются жирные кислоты для обеспечения источника энергии для мышечной деятельности и доступной глюкозы для центральной нервной системы. Жирные кислоты окисляются в печени с образованием кетоновых тел — ацетоацетата и β-оксибутирата.
Гипогликемии при дефиците ферментов
Нарушения обмена гликогена, связанные с его патологическим депонированием, проявляются гликогеновыми болезнями. Это группа наследственных нарушений, в основе которых лежит снижение или отсутствие активности ферментов, катализирующих реакции синтеза (агликогенозы) или распада гликогена (гликогенозы).
Дефект фермента глюкозо-6-фосфатазы (болезнь Гирке). Первичное нарушение при болезни Гирке (гликогеноз 1-го типа) происходит на генетическом уровне. Оно состоит в полной или почти полной неспособности клеток продуцировать глюкозо-6-фосфатазу, обеспечивающую отщепление свободной глюкозы от глюкозо-6-фосфата. В результате этого гликогенолиз прерывается на уровне глюкозо-6-фосфата и дальше не идет. Дефосфорилирование с участием глюкозо-6-фосфатазы является ключевой реакцией не только гликогенолиза, но и глюконеогенеза, который, таким образом, при болезни Гирке также прерывается на уровне глюкозо-6-фосфата.
Возникновение устойчивой гипогликемии, которая в реальных условиях неизбежна из-за непоступления в кровь глюкозы как конечного продукта гликогенолиза и глюконеогенеза, в свою очередь приводит к постоянной повышенной секреции глюкагона как стимулятора гликогенолиза. Глюкагон, однако, в условиях прерывания этого процесса способен лишь без пользы для организма непрерывно стимулировать его начальные стадии.
Психическое и соматическое развитие, а также биохимический статус (повышение уровня триглицеридов, холестерина, гиперурикемия, гипофосфатемия) у этих больных резко нарушены. Содержание глюкозы в плазме натощак постоянно снижено, в связи с чем даже при кратковременном голодании развиваются гипогликемические судороги, кетонурия и метаболический ацидоз. Последний обусловлен не только гиперкетонемией, но и повышенным накоплением и образованием в крови пирувата и лактата, что является результатом нарушенного глюконеогенеза. Характерными чертами заболевания являются: олигофрения, задержка роста, ожирение, остеопороз, большой живот (следствие увеличения печени и почек), ксантоматоз, липемия сетчатки, геморрагический диатез.
Диагноз основывается на данных клинической картины, сниженного содержания глюкозы и повышенной концентрации липидов и лактата в крови. Уровень глюкозы в плазме практически не меняется после введения глюкагона. Однако содержание лактата в крови после его введения возрастает. Биопсия печени, специальные гистохимические методы подтверждают недостаточность соответствующих ферментов [10].
Некоторые гипоталамо-гипофизарные синдромы могут сопровождаться гипогликемией: синдром Лоренса–Муна–Бидля–Борде, синдром Дебре–Мари, синдром Пехкранца–Бабинского (адипозогенитальная дистрофия).
Синдром Лоренса–Муна–Бидля–Борде характеризуется ожирением, гипогонадизмом, умственной отсталостью, дегенерацией сетчатки, полидактилией, глубокими дегенеративными изменениями гипоталамо-гипофизарной системы.
Синдром Дебре–Мари — заболевание обусловлено гиперфункцией задней доли гипофиза и гипофункцией аденогипофиза. Проявляется в раннем детском возрасте. Больные инфантильны, низкорослы, с избыточной массой. В клинической картине типично нарушение водного обмена с олигурией и олигодипсией, плотность мочи высокая. Психическое развитие не нарушено.
Синдром Пехкранца–Бабинского — причиной заболевания считают органические и воспалительные изменения гипоталамуса, которые ведут к ожирению, аномалиям развития скелета и гипоплазии половых органов.
Ожирение
Бурное нарастание ожирения во всех возрастных группах людей в большей степени связано с изменением образа жизни: снижение двигательной активности (компьютеризация, автомобилизация, урбанизация), изменения характера питания (переедание) и т. д. Избыточное поступление энергии или снижение ее затраты приводит к увеличению массы тела и развитию ожирения.
Жировая ткань обладает высокой метаболической активностью. В ней непрерывно совершаются интенсивные процессы обмена веществ, такие как синтез и гидролиз липидов, синтез жирных кислот, в том числе из углеводов, их этерификация в триглицериды или нейтральный жир, депонирование и расщепление их с образованием жирных кислот, использование последних для энергетических целей.
Ожирение приводит к значительным метаболическим и обменным нарушениям. Они характеризуются гиперинсулинизмом и нарушением толерантности к глюкозе; инсулинорезистентностью, вызываемой нарушением инсулинорецепторных взаимоотношений; увеличением содержания свободных жирных кислот в крови, склонностью к кетогенезу при голодании и к гипертриглицеридемии. При ожирении понижается активность липолитических ферментов в жировой ткани: липазы триглицеридов, что приводит к их накоплению, и липопротеинлипазы. Расщепление липопротеидов снижается. Гипертрофированные адипоциты слабее, чем гиперплазированные, реагируют на адреналин, норадреналин и другие липолитические вещества [11].
Важным проявлением нарушения межуточного обмена при ожирении является кетоз, связанный с повышенным липолизом, избыточным поступлением свободных жирных кислот в печень. Скорость реакции в ЦТК снижена, так как оксалоацетат используется для глюконеогенеза. В результате скорость образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА используется для синтеза кетоновых тел. Из-за избытка кетоновых тел нарушается их утилизация.
Этому способствует наблюдающаяся гипогликемия, гиперлипидемия, кетонемия при применении длительной гипокалорийной диеты. А сопутствующий дефицит углеводов тормозит использование ацетил-КоА в цикле Кребса. При дефиците углеводов в организме возникает недостаток энергии в клетках. Усиливается липолиз [12].
Избыток неэстерифицированных жирных кислот, поступающих в печень, вызывает развитие жировой инфильтрации в ней, что нарушает окисление и выведение липопротеидов из печени, обуславливая накопление кетоновых тел. Для эффективного использования продуктов распада жира необходимы продукты углеводного обмена — жиры «сгорают» в пламени углеводов.
Окончание статьи читайте в следующем номере.
ФГБОУ ВО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва