Кислород лучше растворяется в воде чем азот
Кислород в воде
Кислород вместе с другими газами, входящими в состав воздуха, легко растворяется в воде.
Сколько же воздуха может раствориться в воде? Говорить о растворимости воздуха в целом нельзя, нужно говорить о растворимости каждой составной части воздуха в отдельности.
Кислород, азот, аргон, двуокись углерода и другие газы обладают различной растворимостью. При одинаковых температуре и давлении чистого кислорода в воде растворится почти в 2 раза больше, чем азота, а углекислого газа — в 35 раз больше, чем кислорода.
Однако существуют общие закономерности для всех газов. Чем выше температура жидкости, тем меньше растворимость газов. В литре чистой воды при нормальном атмосферном давлении, равном 760 миллиметрам ртутного столба, и при температуре 0° растворяется около 50 кубических сантиметров чистого кислорода. А при температуре 30° — примерно в 2 раза меньше. Чистого азота при температуре 0° и нормальном атмосферном давлении растворится 24 кубических сантиметра, а при температуре 30° — 14 кубических сантиметров.
Чем выше давление газа над жидкостью, тем больше его растворимость.
Если в закрытом сосуде, наполненном на одну треть водой, создать давление в 2 атмосферы, то газа растворится вдвое больше, чем при 1 атмосфере. И, наоборот: при пониженном давлении газа растворится во столько же раз меньше, во сколько ниже давление.
Два равных объема различных газов, смешанных при давлении в 1 атмосферу, растворяясь в воде, будут вести себя как два самостоятельно существующих газа, находящихся под давлением в 1/2 атмосферы. Растворимость каждого из них будет в 2 раза меньше их растворимости при нормальном атмосферном давлении.
Воздух — это смесь газов. Так как в воздухе содержится 21 процент кислорода, то его парциальное давление, то есть та часть давления, которая падает только на кислород, будет в 5 раз меньше давления воздуха. Поэтому кислорода воздуха при нормальном атмосферном давлении растворится в воде в 5 раз меньше, чем чистого кислорода при том же давлении.
В самом деле, если при нормальном давлении и при температуре 0° насытить воду не чистым кислородом, а воздухом, то в литре воды растворится только 10 кубических сантиметров кислорода вместо 50, а азота из воздуха растворится 19 кубических сантиметров вместо 24.
В воде, содержащей различные соли, растворимость газов снижается. В речной воде кислорода растворяется меньше, чем в чистой (дистиллированной), а в морской меньше, чем в речной.
Чтобы растворить газ в воде, его нужно привести в соприкосновение или перемешать с водой; чтобы вытеснить газ из воды, воду нужно подогреть. Доведя температуру воды до 100°, можно почти полностью вытеснить из нее газ.
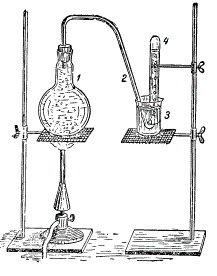
Вытеснение воздуха из воды кипячением: 1 — колба с водой; 2 — загнутая стеклянная трубка; 3 — стакан с водой; 4 — пробирка, в которую собирается вытесненный воздух
Возьмите колбу, наполненную доверху водой, закройте ее пробкой, в которую вставлена загнутая стеклянная трубка. Второй конец этой трубки вставьте в стакан с водой и наденьте на этот конец трубки наполненную водой пробирку. Доведите воду в колбе до кипения. В опрокинутой пробирке появится газ, тот самый газ, который был растворен в воде до ее кипячения.
Хотя до кипячения вода соприкасалась только с воздухом, но в силу различной растворимости кислорода и азота состав вытесненного газа будет существенно отличаться от состава обычного воздуха. В него входит 1 объем кислорода и 2 объема азота. А это означает, что в полученном газе кислорода уже не 21, как в воздухе, а 33 процента.
В обыкновенной, неочищенной воде, кроме растворенного газообразного кислорода, имеется еще кислород, входящий в состав растворенных в ней солей. Этот кислород вытеснить кипячением нельзя, так как он прочно связан с каким-нибудь другим элементом.
Чтобы освободить воду от солей, ее нужно перегнать.
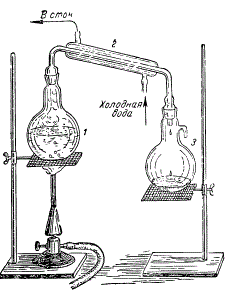
Прибор для перегонки состоит из колбы для кипячения воды, холодильника, где конденсируются пары, и приемника, куда стекает дистиллированная вода.
Полученная таким образом вода содержит только растворенные газы, которые можно вытеснить кипячением.
Что же содержится в воде, в которой нет ни солей, ни растворенных газов?
Вода, как и всякое химическое соединение, состоит из однородных молекул.
В состав молекулы воды (Н2O) входит 2 атома водорода и 1 атом кислорода, тесно связанные между собой.
Лабораторная установка для получения дистиллированной воды: 1 — колба для кипячения воды; 2 — холодильник; 3 — приемник
Разделить, разорвать молекулу воды на ее составные части нелегко, на это нужно затратить энергию.
Молекулярный вес воды равен 18. Он состоит из 2 атомных весов водорода, равных 2 единицам, и атомного веса кислорода — 16. Следовательно, в молекуле воды содержится около 89 процентов кислорода и около 11 процентов водорода. В килограмме воды насчитывается 890 граммов кислорода.
Это означает, что все реки, моря и океаны состоят главным образом из кислорода.
Вода занимает три четверти земной поверхности.
Но в природе вода встречается не только в жидком виде. В полярных странах и на высоких горах круглый год сохраняются огромные толщи льда и снега. Большие количества воды мы встречаем в воздухе в виде пара.
Животные и растения больше чем наполовину состоят из воды. В человеческом организме, при среднем весе тела 65—70 килограммов, содержится до 40 килограммов воды.
Источник: В. Медведовский. Кислород. Государственное Издательство Детской литературы Министерства Просвещения РСФСР. Ленинград. Москва. 1953
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
9.12. Растворимость газов в жидкостях
Вы здесь
Воздух несколько растворим в воде; при комнатной температуре (20°С) и давлении 1 атм в 1 л воды растворяется 19,0 мл воздуха. (Количество растворенного в воде воздуха уменьшается с повышением температуры.) При увеличении давления вдвое растворимость воздуха также увеличивается вдвое. Такую пропорциональность между растворимостью воздуха и его давлением отражает закон Генри*, который можно сформулировать следующим образом: при постоянной температуре парциальное давление одного из компонентов раствора в газовой фазе, находящейся в равновесии с раствором, пропорционально концентрации данного компонента в растворе (в области низкой концентрации).
Это соответствует утверждению, что растворимость газа в жидкости пропорциональна парциальному давлению данного газа.
Пример 9.5.
Распределение растворенного вещества между двумя растворителями
Если водный раствор иода взболтать с хлороформом, то большая часть иода перейдет в хлороформ. Отношение концентрации иода в этих двух фазах, называемое коэффициентом распределения, остается постоянным в области малых концентраций растворенного вещества в каждой фазе. Для иода в хлороформе и в воде при комнатной температуре этот коэффициент равен 250; отсюда следует, что при взбалтывании раствора иода в хлороформе с водой или раствора иода в воде с хлороформом при достижении равновесия концентрация иода в фазе хлороформа будет в 250 раз превышать концентрацию иода в водной фазе.
Из рассмотрения различных равновесий следует, что коэффициент распределения растворенного вещества между двумя растворителями равен отношению растворимостей данного вещества (в виде кристаллической, жидкой или газообразной фазы) в двух растворителях, если растворимости невелики.
* Закон открыт английским химиком Уильямом Генри (1775—1836).
** Атмосферный азот содержит 98,8% N2 и 1,2% Аr.
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Растворимость воздуха в воде. Деаэрация. Закон Генри. Коэффициенты Генри для воздуха.
Деаэрация.
При нагревании пресной воды начинают формироваться воздушные пузырьки. Как известно, вода не может удерживать растворенный воздух при повышении температуры. При 1 баре и температуре 100 0 C (212 0 F) вода закипает и тогда уже водяной пар формирует пузырьки. Если быстро охладить воду, а потом снова ее нагреть, пузырьки не появятся до тех пор пока вода не закипит. Вода деаэрирована.
Растворимость.
Растворимость воздуха может быть выражена через соотношение:
Sa = массовая доля растворимого воздуха в воде
ma = масса воздуха (кг)
Закон Генри.
c = концентрация газа в растворе
k H = коэффициент Генри
pg = парциальное давление газа над раствором
Растворимость кислорода в воде выше растворимости азота. Воздух, растворенный в воде содержит приблизительно 35,6 % кислорода по сравнению с 21% долей в обычном воздухе.
Количество воздуха, растворенного в воде может быть посчитано, исходя из закона Генри.
Коэффициенты Генри при температуре окружающей среды 25 o C (77 o F)
Относительное содержание (по объему) в воздухе:
Объем кислорода, растворенного в воде при атмосферном давлении может быть посчитан как :
co = (1 атм) 0.21 / (756.7 атм/(моль/л)) (31.9988 г/моль)
Объем азота, растворенного в воде при атмосферном давлении может быть посчитан как:
cn = (1 атм) 0.79 / (1600 атм/(моль/л)) (28.0134 г/моль)
Поскольку воздух-это сумма кислорода и азота :
ca = (0.0089 г/л) + (0.0138 г/л)
Таблица. Количество (масса) воздуха, растворенного в воде при различных давлениях и температуре 25 o C (77 o F):
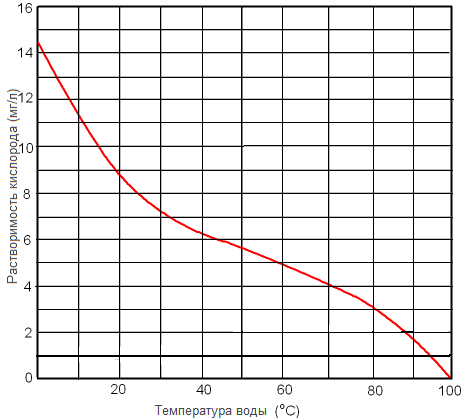
Рисунок. Растворимость кислорода в пресной воде при 1 атм в зависимости от температуры.
Деаэрация
Для максимальной деаэрации вода должна быть нагрета до 212 0 F (100 0 C) при атмосферном давлении. Это обычное инженерное решение для паровых систем, где пресная вода подается в систему через нагретый деаэратор наверху конденсатоприемника.
Также обычным решением является установка деаэрационных устройств с горячей стороны теплообменника в отопительных системах для интенсификации удаления растворенного воздуха из системы.
Поскольку максимум деаэрации приходится на минимум статического давления и максимум температуры в системе, то наилучший результат деаэрации достигается в верхних точках систем относительно уровня земли и/или на входе насоса.
Кислород, растворённый в воде: как и для чего его измеряют
Растворённый кислород (DO) – это международный термин, обычно используемый при аналитической работе с водой и другими жидкостями для измерения количества кислорода, растворённого в единице объёма жидкого образца (пробы). Это важный показатель степени пригодности пробы воды для того или иного конкретного технологического применения в промышленности, лабораторной деятельности и т. д. В каждой из этих сфер существуют определённые требования к допустимому уровню DO. Расскажем, от чего зависит уровень растворённого кислорода в жидкой среде и каковы методы определения этого важного параметра.
Для чего нужно измерять количество растворённого кислорода
Возьмём простой пример – контроль качества пресной воды для рекреационных целей, таких как плавание и рыбалка. В этом случае мы должны поддерживать в воде высокое содержание DO. Если уровень растворённого кислорода упадет слишком низко, то рыба задохнется, кроме того, условия в воде станут благоприятными для роста вредных бактерий.
При очистке сточных вод твёрдые частицы, находящиеся в воде, могут оседать в больших резервуарах. Чтобы ускорить разложение этих частиц, в резервуары добавляют растворы, богатые бактериями. Для нормального протекания процесса разложения требуется определённый оптимальный уровень DO, он поддерживается за счет механической аэрации так называемого «активного ила» – пропитанного бактериями содержимого бассейнов. Если уровень растворённого кислорода в воде падает слишком низко, бактерии погибают и разложение прекращается, в свою очередь, если уровень DO является чрезмерным, то затрачивается гораздо больше энергии, чем необходимо для аэрации, и процесс становится слишком дорогостоящим.
Еще один яркий пример важности роли DO – контроль качества подпиточной воды котла. Поскольку присутствие кислорода в воде усиливает коррозию и вызывает образование накипи в котле, препятствующей передаче тепла, в этом случае очень желательно поддерживать концентрацию DO на минимальном уровне.
Количество кислорода, которое может удерживаться в определённом объёме воды, зависит от давления атмосферного кислорода на границе раздела воздух-вода, температуры жидкости и степени концентрации других веществ, растворённых в воде.
Влияние парциального давления кислорода на содержание растворённого кислорода
Со всей очевидностью, объём воды, «контактирующий» с воздухом, будет поглощать воздушные массы и, следовательно, находящийся в них кислород, до тех пор, пока давление, оказываемое поглощённым кислородом на границе раздела воздух-вода, не сравняется с давлением, оказываемым кислородом воздуха на той же границе раздела. В этот момент вода считается насыщенной кислородом. Фактически поглощённое количество кислорода довольно невелико и составляет порядка пяти или десяти частей кислорода на один миллион частей воды.
Влияние температуры на содержание растворённого кислорода
Как известно каждому, кто когда-либо видел кипение воды в кастрюле, на её стенках и дне в процессе кипения образуются пузыри. Количество и размер пузырьков увеличиваются с ростом температуры. Это пузырьки воздуха, растворенные в воде. Представим стакан с водой, насыщенной кислородом, при комнатной температуре. Показатели парциального давления кислорода над и под поверхностью воды будут равными. Если же систему нагреть, по сути, вливая в неё энергию, то молекулы кислорода, которые имеют низкую растворимость, легко возбуждаются за счет такого вливания. При этом менее расторопные молекулы воды увеличивают свою молекулярную активность в более медленном темпе. В результате молекулы кислорода проникают через границу раздела воздух-вода в пространство над поверхностью воды в гораздо большем количестве, нежели молекулы воды, оставляя меньше молекул кислорода, растворенных в воде. Когда вода закипает, то все молекулы кислорода вытесняются из воды, и теперь молекулы воды выходят из стакана так быстро, что образуют слой водяного пара непосредственно над поверхностью воды. Этот слой эффективно изолирует воду от атмосферного кислорода, а содержание DO в воде становится равным нулю.
Мы можем представить себе объём воды как однородную среду со множеством отверстий, разбросанных по всему объему. Давление воздуха непосредственно над поверхностью воды заставит эти отверстия заполниться воздухом. Если теперь такое вещество, как соль, растворяется в воде, то оно будет занимать некоторые из отверстий, используемых молекулами кислорода, поскольку они постоянно переходят из воздуха в воду и из воды в воздух. Количество кислорода, которое вода может удерживать при данной температуре, теперь уменьшилось, но парциальное давление растворённого кислорода, остающегося в растворе, должно по-прежнему равняться парциальному давлению атмосферного кислорода над поверхностью воды.
Методы измерения растворённого в воде кислорода
В основном есть два общих метода измерения DO. В каждом из них используется электродная система, в которой растворённый кислород «проявляется» на катоде, производя измеримый электрохимический эффект. Этот эффект может быть гальваническим, полярографическим или потенциометрическим.
В одном из методов измерения кислорода, растворённого в воде, используется ячейка типа Кларка, которая представляет собой систему электродов, отделенную от потока пробы полупроницаемой мембраной. Эта мембрана позволяет кислороду, растворённому в образце, проходить через него к системе измерительных электродов. Катод представляет собой водородный электрод и несет отрицательный приложенный потенциал по отношению к аноду. Электролит окружает электродную пару и удерживается мембраной. В отсутствие реагента катод поляризуется водородом, и сопротивление току становится бесконечным. Когда присутствует реагент, такой как кислород, прошедший через мембрану, катод деполяризуется и электроны расходуются.
Анод электродной пары должен реагировать с продуктом реакции деполяризации с соответствующим высвобождением электронов. В результате пара электродов позволяет току течь прямо пропорционально количеству кислорода или реагента, поступающего в систему. Таким образом, величина тока прямо указывает нам на количество кислорода, поступающего в систему.
Что влияет на работу датчика DO
Надо сказать, что мембранные зонды легко поддаются высокой межфазной турбулентности. Такие рабочие условия могут существенно сократить срок службы датчика, содержащего таллий, поскольку высокая турбулентность сметает ионы таллия, вызывая, тем самым, истощение электрода.
Между тем, известно, что растворённые органические материалы не взаимодействуют с выходным сигналом датчиков растворённого кислорода, а неорганические соли, в свою очередь, являются фактором, влияющим на работу электродов. Как мы уже говорили, при использовании датчиков с мембранами в солевых растворах мы должны применить поправочный коэффициент к выходному сигналу. Зонд с таллием требует наличия солей в концентрациях, обеспечивающих минимальную проводимость около 200 микрометров.
Двумя основными газами, препятствующими процессу измерения количества растворённого кислорода с помощью мембранного зонда, являются хлор и сероводород. Соединения серы, такие как сероводород, диоксид серы и меркаптаны, вызывают ошибочные результаты, демонстрируемые таллиевым датчиком. Галогены не мешают нормальной работе таллиевого зонда.
При низких концентрациях растворенного кислорода изменения pH ниже 5 и выше 9 единиц оказывают влияние на работу датчика с таллием. Это вмешательство составляет около ±0,5 мг/л DO на единицу pH. На характеристики мембранных зондов изменения pH не влияют.
Важность поддержания постоянной температуры для измерений DO
Базовый метод определения концентрации растворённого кислорода в воде
Разберём второй метод измерения DO, который считается базовым. В нём используется система электродов, состоящая из электрода сравнения и измерительного электрода с таллием. Полупроницаемая мембрана здесь не используется, электродную систему погружают непосредственно в образец и концентрацию кислорода определяют путём измерения потенциала напряжения, возникающего по отношению к электроду сравнения, когда растворённый кислород вступает в контакт с таллиевым электродом.
На поверхности электрода концентрация талловых ионов пропорциональна растворенному кислороду. Потенциал напряжения, развиваемый ячейкой, зависит от концентрации талловых ионов в этом слое и изменяется по мере изменения концентрации растворённого кислорода. В этой технике используется потенциометрическая система. Измерение концентрации кислорода осуществляется непосредственно в образце. Как и в первом методе, температурная компенсация является обязательной. В обоих методах межфазная динамика на границе раздела зонд-образец является фактором отклика зонда. Необходима значительная межфазная турбулентность, и для обеспечения точности она должна быть постоянной. Впрочем, пока рабочая точка остаётся выше изгиба кривой, можно допустить небольшие изменения турбулентности.
Азот (N)
Применение
Соединения азота используются в различных отраслях промышленности. Большая часть азота используется для производства аммиака по процессу Габера-Боша. Азотная кислота, мочевина, гидразин и амины также являются продуктами азотной промышленности. Соединения азота выделяются в качестве промежуточных продуктов при производстве красок и пластмасс.
Жидкий азот широко используется для замораживания пищевых продуктов. Тот же принцип используется при глубокой заморозке биологических образцов и препаратов. Жидкий азот также представляет интерес для создания сверхпроводников из специальной керамики.
Азот используется в качестве защитного газа, например, при сварке и производстве полупроводников, а также в качестве топлива в аэрозольных баллончиках и огнетушителях. N2O4 является окислителем ракетного топлива. Этот элемент также содержится во взрывчатых веществах и необходим для горнодобывающей промышленности.
Нитраты и нитриты используются в качестве пищевых добавок, например, для сохранения красного цвета мяса и предотвращения образования токсинов.
Воздействие азота на здоровье
Человеческое тело на 2,6% состоит из азота, который входит в состав всех белков и нуклеиновых кислот. Люди в основном поглощают азот в виде белков.
Питьевая вода часто содержит нитраты, воздействие которых на здоровье не ожидается при концентрациях менее 1000 мг / л. Нитраты обычно считаются относительно нетоксичными сами по себе, но могут превращаться в более опасные нитриты. Нитриты — это ядовитые соли азотной кислоты, которые не позволяют крови транспортировать кислород. У взрослых это обычно приводит максимум к тошноте и расстройству желудка.
Нитриты также образуют так называемые нитрозамины с аминами из белковосодержащих продуктов, которые считаются канцерогенными. Восстанавливающие и антиоксидантные свойства витамина С могут предотвратить эту реакцию.
Азот в основном содержится в воздухе, который на 78 процентов состоит из этого элемента. В почве и воде азот присутствует в виде нитратов и нитритов. Все эти вещества являются частью азотного цикла и поэтому взаимозависимы.
Люди значительно увеличили естественную концентрацию нитратов и нитритов, в основном за счет использования удобрений, содержащих нитраты. В промышленных процессах происходит значительная эмиссия азота, что приводит к накоплению нитратов и нитритов в почве и воде. Большие содержания нитратов и нитритов имеют серьезные последствия для здоровья:
Воздействие азота на окружающую среду
Высокие концентрации нитратов и нитритов попадают в окружающую среду в результате деятельности человека, в основном из-за широкого использования удобрений. Во время процессов горения также выделяются оксиды азота, которые затем повышают концентрацию нитратов и нитритов в результате определенных реакций.
Эти соединения азота оказывают разнообразное воздействие на окружающую среду. Во-первых, они влияют на видовой состав, поскольку устойчивость к соединениям азота варьируется от вида к виду. Более того, нитриты вредны для здоровья людей и животных. Богатые азотом пастбищные корма снижают перенос кислорода в кровь, что, в частности, отрицательно сказывается на животноводстве.
Азот и вода
Содержание азота (растворенные неорганические соединения азота) в морской воде составляет до 0,5 частей на миллион (на поверхности всего около 0,1 частей на миллиард). Концентрация в речной воде также сильно варьируется, но обычно составляет около 0,25 промилле. В неорганических проявлениях элемента есть различия в зависимости от природы воды. В аэробных водах азот в основном находится в форме N2 и NO3 и, в зависимости от условий окружающей среды, может также встречаться в виде N2O, NH3, NH4, HNO2.
Элементарный газообразный азот (N2) в основном встречается в прибрежных районах, что неудивительно, если учесть, что 78% воздуха состоит из азота и что контакт с воздухом на побережье довольно высок из-за движения волн и мелководья. Наибольшую роль в биохимических процессах играют аммоний, нитрат и нитрит, а также органические соединения азота в воде.
Растворимость азота и / или его соединений в воде
Растворимость азота в форме N2 в воде при 20 C и давлении 1 бар составляет около 20 мг / л. Растворимость соединений азота может широко варьироваться. Например, оксид азота (I) растворим до 1,12 г / л, тогда как трихлорид азота нерастворим в воде.
Как азот может попасть в воду?
Азот в основном попадает в окружающую среду через сельскохозяйственные процессы. Азотные удобрения, которые содержат элемент в основном в форме нитрата, а также аммиак, аммоний, мочевину и амиды, имеют очень большую долю. После внесения удобрений растениями усваивается лишь относительно небольшая часть (около 25-30% азота). Остальная часть попадает в грунтовые и поверхностные воды через почву, поскольку нитраты особенно хорошо растворяются в воде.
Много азота выделяется в животноводстве, часто в чрезмерно больших количествах. В органических удобрениях это происходит в основном в виде белковых соединений, мочевины или амидов, которые всасываются в разной степени. В конце концов, азот также содержится в различных пестицидах и поэтому активно применяется на сельскохозяйственных землях.
Немалое количество азота содержится в бытовых сточных водах. Количество напрямую зависит от потребления белка населением. Обычно около трети азотной нагрузки составляют органические соединения азота, в основном мочевина, остальное — соли аммония. Доля нитратов и нитритов в сточных водах обычно не превышает 3%. Продукты распада после обычных первых этапов очистки городских сточных вод — это в основном аммоний и нитраты.
Конечно, существует также естественный круговорот азота, который объясняет, почему немалое количество азота содержится в почве, воде и воздухе.
Какие экологические проблемы может вызвать загрязнение воды азотом?
Азот является важным элементом для всех организмов, поскольку он входит в состав всех белков и нуклеиновых кислот. Растения, например, содержат около 7,5% (в пересчете на сухое вещество) этого элемента. Азот очень важен для растений, и его достаточно в воздухе, но он не может быть поглощен в элементарной форме. Сначала он должен быть связан в другой форме, в основном в виде нитрата. При так называемой нитрификации бактерии превращают аммиак в нитрит и нитрат. Это высвобождает энергию, а конечный продукт является одним из наиболее важных источников обычного содержания нитратов в почве, на котором в конечном итоге могут существовать растения.
Некоторые растения, например шпинат, даже накапливают это вещество. Если азотные удобрения использовать вне фазы роста, это совершенно бесполезно и даже отрицательно сказывается на окружающей среде. Вещество не может ни абсорбироваться, ни иммобилизоваться, поэтому легко попадает в грунтовые воды и питьевую воду.
Некоторые растения относительно чувствительны к NO2. В форме HNO3 азот является важным компонентом дождевой воды. Вместе с H2SO4 он вызывает так называемые кислотные дожди, отрицательно влияющие на почву и растения.
Поскольку азот, как уже упоминалось, является важным компонентом белков, он также присутствует в больших количествах в тканях животных. В простейшем виде он не оказывает прямого воздействия на теплокровных животных. Тот факт, что более высокие концентрации азота в выдыхаемом воздухе могут привести к удушью, более вероятен из-за того, что в этом случае содержание кислорода в воздухе ниже.
Сам по себе азот также не считается загрязняющим воду веществом и поэтому обычно не наносит вреда окружающей среде. В океанах нитраты, нитриты и соединения аммония действуют как питательные вещества для планктона, поэтому на поверхности воды значительно меньше соединений азота, чем на глубине. Когда содержание азота в самых верхних слоях воды увеличивается, увеличивается производство планктона и может происходить так называемое цветение водорослей. Таким образом, большое количество азота, которое в нейтральных и аэробных условиях встречается в основном в виде нитрата, может вызвать эвтрофикацию, то есть избыточное поступление питательных веществ, что часто приводит к нехватке кислорода и, как следствие, к гибели рыб.