Кислородосодержащая кислота что это
Кислородсодержащие кислоты



Номенклатура кислородсодержащих кислот: по международной систематической номенклатуре названия кислородсодержащих кислот формируются, как указывалось ранее, с учетом аниона, входящего в состав кислоты. Например:
H2SO4— диводород тетраоксосульфат(VI) (количество атомов водорода в кислотах можно не указывать)
По систематической номенклатуре названия кислот используют редко, чаще всего применяют традиционно сложившиеся названия, которые формируются от русского названия элемента (русская номенклатура) по определенным правилам (см. таблицу). В таблице приведен перечень кислородсодержащих кислот, соли которых наиболее распространены в природе. Следует обратить внимание, что название кислотного остатка определяет название соли и строят его чаще всего по полусистематической (международной) номенклатуре от латинского названия элемента. В связи с этим необходимо вспомнить латинские названия элементов наиболее часто встречающихся в кислотах, например, N – азот, в русской транскрипции латинского названия звучит как [нитрогениум], С – углерод – [карбониум], S – сера – [сульфур], Si- кремний – [силициум], олово – [станнум], свинец – [плюмбум], мышьяк – [арсеникум] и т.д. В таблице приведены общие правила, в соответствии с которыми можно назвать большинство неорганических кислородсодержащих кислот других элементов, их кислотные остатки и соли.
Таблица наиболее распространенных кислородсодержащих кислот
Гидросоли и названия их кислотных остатков будут рассмотрены в разделе«соли». Правила названия кислородсодержащих кислот и кислотных остатков (за исключением тех, которые имеют тривиальные названия или их следует называть по систематической номенклатуре) следующие:
Презентация по химии на тему «Кислородсодержащие кислоты» (11 класс)
Описание презентации по отдельным слайдам:
Цели урока: Обучающие Опираясь на ранее полученные знания, отследить общие свойства неорганических и органических кислот и причину этой общности, проанализировать признаки и условия течения реакций, рассмотрев их с точки зрения ТЭД и ОВР. Развивающие Способствовать развитию у учащихся методов анализа и синтеза, навыков экспериментальной работы на основе личностно-ориентированной, исследовательской технологий. Воспитательные Воспитывать у учащихся стремление и интерес к процессу познания на основе исследовательской деятельности, химическую и экологическую грамотность.
1. Определение и классификация 2. Отдельные представители 3. Обнаружение кислот 4.Техника безопасности 5. Типичные реакции кислот 7. Проверка знаний Кислоты
Определение и классификация Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка. HCl H2SO4 HNO3 H2CO3 H2SiO3 H3PO4 HCl H2SO4 HNO3 H2CO3 H2SiO3 H3PO4 Кислоты Бескислородные H2S H2S Кислородсодержащие В начало
Кислоты Одноосновные Двухосновные Трёхосновные HNO3 HNO2 H2S H2SO3 H2SO4 H2CO3 H2SiO3 H3PO4
Кислоты- электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков HCL H++CL- H2SO4 3H++PO43-
НОМЕНКЛАТУРА КИСЛОТ Бескислородные кислоты: К названию кислотообразующего элемента добавляют гласную «о» и слова «водородная кислота» H2S – сероводородная кислота Кислородсодержащие кислоты: К русскому названию кислотообразующего элемента добавляют суффикс. Если элемент проявляет высшую СО – «-ная»:+5 HNO3 Если СО элемента ниже высшей – «-истая»: +3 HNO2
Химические свойства кислот Диссоциация; Взаимодействие с индикаторами; Взаимодействие с металлами; Взаимодействие с основными оксидами; Взаимодействие с основаниями; Взаимодействие с солями.
Техника безопасности при работе с кислотами
Диссоциация кислот HCl → HNO3→ H2SO4 → H3PO4 → НnКост → Н+ + Костn- H++ Cl- H+ + NO3- 2H+ + SO42- 3H+ + PO43-
Взаимодействие с индикаторами Помни! Нерастворимые кислоты не меняют окраску индикаторов. Индикатор Нейтральная среда Кислая среда Лакмус Фиолетовый Красный Фенолфталеин Бесцветный Бесцветный Метиловый оранжевый Оранжевый Розовый
Взаимодействие с металлами Ме + НnКост → МеnКостm+ Н2 металл + кислота→соль + водород 2 Al + 3 H2SO4 → 3 H2 Реакция возможна, если: Металл находится в ряду активности до водорода; В результате реакции получается растворимая соль; Кислота растворима Al2(SO4)3 +
Металл + кислота Кислота Металлы Продукты Примечания HCl до Н после Н Соль + H2 Не реагируют H2SO4разб до Н после Н Соль + H2 Не реагируют H2SO4конц до Н после Н Соль + H2О + S (H2 S) Соль + H2О + SO2 Fe, Al, Cr: Э2О3 + H2О + S Пассиввация! HNO3конц Все кроме благородных Соль + H2О + NO2 Fe, Al, Cr: Э2О3 + H2О +NO2 Пассивация! HNO3разб до Н после Н Соль + H2О + N2O, N2 Соль + H2О + NO HNO3оч.разб до Н Соль + H2О + NH4NO3
Взаимодействие с основными оксидами МеxOy + HnКост → МеnКостy + H2O Основный оксид + кислота → соль + вода Реакция возможна, если в результате получается растворимая соль MgO + 2 HCl → MgCl2 + H2O MgO + 2H+ + 2Cl- → Mg2+ + 2Cl- + H2O MgO + 2H+ → Mg2+ + H2O
Взаимодействие с основаниями Ме(ОН)m + НnКост → MenКостm + H2O Основание + кислота → соль + вода NaOH + H3PO4→ Na3PO4 + 3 H2O 3 3Na+ + 3OH- + 3H+ + PO43- → 3Na+ + PO43- + 3H2O H+ + OH- → H2O Реакция между щелочью и кислотой с образованием соли и воды называется реакцией нейтрализации.
Взаимодействие с солями МеxКостy + HnКост → HхКост + МеnКостy Соль + кислота → новая кислота + новая соль Li2CO3 + H3PO4 → Li3PO4 + H2O + CO2 3 2 2 3 3 6Li+ + 3CO32- + 6H+ + PO43- → 6Li+ + 2PO43- + 3H2O + 3CO2 2H+ + CO32- → H2O + CO2 Реакция возможна, если в результате образуется осадок, газ или слабый электролит
Кислотные свойства кислот, образованных элементами одной подгруппы: H2SO4 H2SeO3 H6TeO6
Кислотные свойства кислот, образованных элементом в различных СО: +5 +6 HNO3 H2SO4 +3 +4 HNO2 H2SO3
Серная кислота – бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из воздуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов. В начало H2SO4 Серная кислота
Органические кислоты, встречаемые вами в повседневной жизни Щавелевая Лимонная Уксусная Молочная Аскорбиновая В начало
Карбоновые кислоты классифицируют в зависимости от:
Карбоновые кислоты классифицируют в зависимости от:
Формулы Названия tкип (в 0С) HCOOH Муравьиная, или метановая, кислота 100,7 CH3COOH Уксусная, или этановая, кислота 118,1 C2H5COOH Пропионовая, или пропановая, кислота 141,1 C3H7COOH Масляная, или бутановая, кислота 163,3 C4H9COOH Валериановая, или пентановая, кислота 186,4 C5H11COOH Капроновая, или гексановая, кислота 205,4 C6H13COOH Энантовая, или гептановая, кислота 223,5 C15H31COOH Пальмитиновая, или гексадекановая, кислота 351,5 C17H35COOH Стеариновая, или октадекановая, кислота 376,1
Алгоритм составления названий карбоновых кислот Найдите главную (самую длинную) цепь углеродных атомов (включая атом карбоксильной группы). Пронумеруйте углеродные атомы главной цепи, начиная с углерода карбоксильной группы. Назовите соединение по алгоритму углеводородов. В конце названия допишите суффикс «ов», окончание «ая» и слово «кислота»
Назовите вещество 3-метилпентановая кислота СH3 – СH2 – СH – СH2 – С О ОН СН3
cat cat, p cat, t 1. + O2 cat R C + H2O O OH бактерии 2R C + O2 O H cat 2R C O OH 0,1 МПа, cat (перспективный метод) 0,6-0,8 МПа cat, t, HCOONa + H2SO4 HCOOH + NaHSO4 t 3. 2. Уксусную кислоту получают из продуктов пиролиза древесины Методы получения карбоновых кислот окислением Специфические методы получения углеводородов спиртов альдегидов 1. 2CH4 + 3O2 2HCOOH + 2H2O 2C4H10 + 5O2 4CH3COOH + 2H2O (данный метод наиболее перспективен, в процессе используется дешевый бутан) 1. CH3OH + CO CH3COOH 2. 2C36H74 + 5O2 4C17H35COOH + 2H2O (стеариновая кислота) 2. CH3CH2OH + O2 CH3COOH + H2O CO + NaOH HCOONa
Химические свойства 1. Горение: СН3СООН +2О2=2СО2+2Н2О 2. Свойства слабых кислот: a. Mg+2CH3COOH=(CH3COO)2Mg+H2 б. CaO+2CH3COOH=(CH3COO)2Ca+H2O в. NaOH+CH3COOH=CH3COONa+H2O г. K2CO3+CH3COOH=CH3COOK+H2O+CO2
Химические свойства. Взаимодействие с металлами (до водорода) 2HCOOH + Mg (HCOO)2Mg + H2↑ основными и амфотерными оксидами 2HCOOH + MgO (HCOO)2Mg + H2O основаниями и амфотерными гидроксидами 2HCOOH + Mg(OH)2 (HCOO)2Mg + 2H2O солями 2HCOOH + Na2SiO3 2HCOONa + H2SiO3↓ 2CH3COOH + Na2CO3 2CH3COONa + H2O + CO2↑ Органические кислоты вступают в реакцию этерификациии со спиртами, образуя сложные эфиры, согласно уравнению R C + H OR′ = R C + H2O O OH O O R′ кислота спирт сложный эфир CH3COOH + C2H5OH = CH3COOC2H5 + H2O уксусная кислота этиловый спирт этилацетат
Химические свойства 3. Этерификация (реакция со спиртами, приводящая к образованию сложного эфира): НСООН+С2Н5ОН=НСООС2Н5+Н2О Муравьиная этанол этиловый эфир кислота муравьиной кислоты
Химические свойства: 4. Замещение в углеводородном радикале: СН3-СН2-СООН+Cl2=CH3-CHCl-COOH+HCL 5. Качественная реакция на муравьиную кислоту – реакция серебряного зеркала: HCOOH+Ag2O=CO2+H2O+2Ag
Области применения кислот: Азотная кислота широко используется для производства удобрений, красителей, лаков, пластмасс, лекарственных и взрывчатых веществ, а также химических волокон. Серная кислота расходуется в больших количествах для производства минеральных удобрений, красителей, химических волокон, пластмасс, лекарственных веществ. Используется для извлечения металлов из руд; заполнения кислотных аккумуляторов. Находит применение в нефтяной промышленности для очистки нефтепродуктов.
Фосфорная кислота используется в составах для обезжиривания металлических поверхностей перед нанесением защитных покрытий, входит в состав композиций для преобразования ржавчины перед покраской, применяется для защиты от коррозии трубопроводов, прокачивающих морскую воду. Соляная кислота широко применяется в нефтяной промышленности для обработки призабойных зон скважин с целью увеличения нефтеотдачи пластов, используется в составах травильных растворов для удаления ржавчины и отложений в трубопроводах и скважинах, а также как отвердитель фенол-формальдегидных смол.
Применение кислот в жизни человека
1.Формула кислоты это: 1) КOH 2) CаCl2 3) HCL 4) SO2 2. С раствором серной кислоты взаимодействует: 1) оксид калия 3) оксид фосфора 2) оксид углерода 4) медь 3. Соляная кислота не взаимодействует с металлом: 1) алюминием 2) серебром 3) железом 4) цинком
4. Степень окисления серы в серной кислоте 1) +3; 2) +4; 3) +5; 4) +6. 5.Степень окисления углерода в угольной кислоте 1) +3; 2) +4; 3) +5; 4) +6. 6.Фенолфталеин приобретает малиновый цвет в растворе 1) соляной кислоты; 3) хлорида калия; 2) гидроксида бария; 4) нитрата меди 7.Лакмус приобретает красный цвет в водном растворе 1) оксида натрия; 3) серной кислоты; 2) аммиака; 4) хлорида натрия
8. Реакция между магнием и соляной кислотой относится к реакциям 1) соединения; 3) разложения; 2) обмена; 4) замещения 9.Взаимодействие между карбонатом кальция и соляной кислотой относится к реакциям 1) соединения; 3) замещения; 2) нейтрализации; 4) обмена
10.К сильным кислотам относятся вещества ряда 1) HC l; H Br; H2S 2) H2S; H2SO3; H2SO4 3) H2SO4; HNO3; HC l 4) HNO3; HNO2; HF 11. К слабым кислотам относятся вещества ряда: 1) H2SO4; H2CO3; H3PO4 2) H2S; H2CO3; HNO2 3) HC l; HF; HNO3 4) HNO3; H3PO4; HC l
Ответы 1-3 2-1 3-2 4-4 5-2 6-2 7-3 8-4 9-4 10-3 11-2
Обнаружение кислот Для кислот, также как и для щелочей, существуют качественные реакции с помощью которых растворы кислот можно распознать среди растворов других веществ. Это реакции кислот с индикаторами. В начало Название индикатора Окраска индикатора в нейтральной и кислой среде Лакмус Метиловый оранжевый
Техника безопасности При растворении серной кислоты нужно вливать её тонкой струёй в воду при помешивании В начало
ЗНАЧЕНИЕ КИСЛОТ В ЖИЗНИ ЧЕЛОВЕКА Пищевкусовые добавки Консервирование Производство лекарственных средств, красителей, полимеров, взрывчатых веществ, удобрений, пищевых продуктов.
Типичные реакции кислот 1. Кислота + основание → соль + вода Н Сl + Na OH → Н Сl Na OH + 2. Кислота + оксид металла → соль + вода H Cl + Mg O → Mg O H Cl + (H2O) 2 2 2 3. Кислота + металл → соль + водород H Cl + Mg → H Cl Mg 2 + 2 2 4. Кислота + соль → новая кислота + новая соль Ag NO3 + H Cl H Cl Ag NO3 → + В начало
В начало 1. Азотистая а) HCl 2. Азотная б) H2CO3 3. Сероводородная в) H2SO4 4. Сернистая г) HNO3 5. Серная д) H2S 6. Соляная (хлороводородная) е) H3PO4 7. Угольная ж) HNO2 8. Кремниевая з) H2SO3 9. Фосфорная и) H2SiO3
Каким правилом техники безопасности пренебрёг лаборант? В начало
И помните! Кислоты очень опасны! Берегите здоровье!
ДОМАШНЕЕ ЗАДАНИЕ § 31 упр 5-10 на стр.138 Решите задачу 2 стр.138
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
Курс повышения квалификации
Современные педтехнологии в деятельности учителя
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-1098454
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Росприроднадзор призвал ввести в школах курс по экологии
Время чтения: 1 минута
Петербургский Политех перевел студентов на дистанционку
Время чтения: 1 минута
Костромская область разработала программу привлечения педагогических кадров
Время чтения: 2 минуты
Дума проведет расследование отклонения закона о школьных онлайн-ресурсах
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
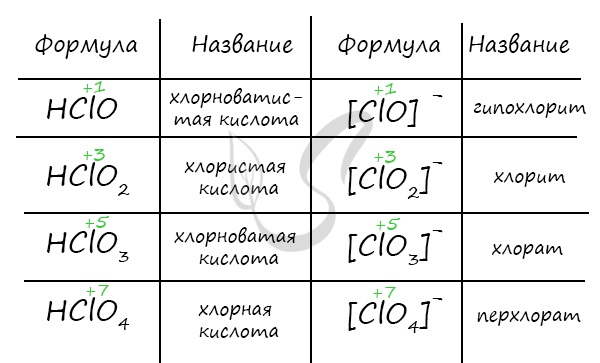
Кислородсодержащие соединения галогенов
Получение кислот
Хлорноватистую кислоту можно получить в реакции хлора с водой, соли хлорноватистой кислоты (гипохлорита) с более слабой кислотой.
В реакции хлорной извести с диоксидом углерода и водой также выделяется хлорноватистая кислота.
Хлорноватую кислоту получают взаимодействием разбавленной серной кислоты и хлората бария.
Химические свойства
HClO + LiOH → LiClO + H2O
И кислоты, и их соли разлагаются схожим образом.
KI + HClO → KIO3 + HCl
Соли этих кислот образуются в результате реакции диспропорционирования, происходящей между щелочью и галогеном.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Кислородсодержащие соединения галогенов
Химические свойства кислот, их классификация и реакции
Общие свойства кислот. Классификация
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 ↔ Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Найти ряд активности можно на последней странице электронного учебника «Химия 9 класс» под редакцией В. В. Еремина.
Бдительные ученики могут сказать: «Золото стоит в ряду активности металлов после водорода, а с „царской водкой“ реагирует. Как же так?»
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF → HCl → HBr → HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
Плавиковая кислота (фтороводородная кислота) — крайне токсичный, но широко востребованный реактив
Фтороводородная кислота — неорганическое вещество, одноосновная кислота, раствор 
Свойства
Соединение — прозрачная жидкость, без цвета, с резким запахом. Не горит, но очень токсично для человека и окружающей среды. С химической точки зрения это кислота средней силы. Она вступает в реакции с большинством металлов, образуя соли — фториды. Соли щелочных металлов водорастворимы, а щелочно-земельных — плохо растворимы или вообще нерастворимы. Реактив любой концентрации не растворяет свинец, платину, палладий, золото, не реагирует с парафином, полиэтиленом, фторопластом и другими пластмассами, каучуковыми материалами. Кислота, содержащая более 60% HF, не взаимодействует с железом.
Важная особенность фтористоводородной кислоты — она единственная реагирует с оксидом кремния, который составляет основу всех силикатных материалов, в том числе, стекла. Поэтому ее нельзя наливать в стеклянные сосуды.
У фтороводородной кислоты есть еще одно интересное свойство — вода с добавлением даже небольшого количества этого реактива замерзает при более низких температурах.
Меры безопасности

Фтористоводородная кислота раздражающе действует на органы дыхания, глаза, оказывает легкое наркотическое действие, обладает способностью повреждать ДНК и усиливать воздействие других неблагоприятных факторов. Она относится ко 2-му классу опасности (газообразный фтороводород — к первому). Работать с плавиковой кислотой необходимо только в респираторе, в очках, плотно прилегающих к коже, в защитной одежде и резиновых перчатках, в вытяжном шкафу. При ликвидации проливов рекомендуется использовать противогазы с автономным источником воздуха. Пострадавших от отравления следует срочно доставить в больницу, предварительно промыв место попадания реактива большим количеством воды и обработав гелем 2,5-процентного глюконата кальция. В больнице в качестве антидота обычно используют внутриартериальные вливания хлорида кальция.
Хранение и перевозка
Хранят и перевозят плавиковую кислоту в пластиковых (полиэтиленовых, 
Применение
Фтористоводородная кислота выпускается различной концентрации, высокой чистоты и техническая с примесями. Основные сферы ее использования:
— В нефтехимии и горнодобывающей отрасли — для увеличения нефтедобычи и разрушения кремнийсодержащих пород.
— Для выделения некоторых металлов, например, тантала, циркония, ниобия.
— В химической индустрии — как катализатор в некоторых процессах; для производства фторопластов, хладагентов, фторосодержащих кислот, боратов и фторидов, органических соединений на основе фтора, синтетических смазочных масел.
— В стекольном деле с помощью этого хим. реактива выполняют прозрачное травление кремниевого стекла.
— Плавиковая кислота высокой чистоты необходима для очистки и травления кремния для полупроводников.
— В аналитической химии — для растворения силикатов.
— При производстве алюминия и работе с ним.
— Является составной частью жидкостей, использующихся для травления и полировки, для электрохимической обработки сплавов и нержавеющей стали. Применяется также для очистки металлических заготовок от песка.
В нашем магазине по выгодным ценам продается 40% и 70% фтористоводородная кислота, можно купить пластиковые емкости для ее хранения и перевозки.