Кислота фосфорная и ортофосфорная в чем разница
Ортофосфорная кислота
ХимЭксперт осуществляет продажи ортофосфорной кислоты с возможностью доставки заказываемого химического сырья в различные регионы России. Область применения ортофосфорной кислоты разнообразна, но самая большая ценность — это удаление ржавчины на металлических поверхностях, данный метод используется как крупными компаниями при восстановлении свойств поверхности металла, также физическими лицами в бытовых и хозяйственных целях.
Ортофосфорная кислота (фосфорная кислота) — неорганическая кислота средней силы с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 %-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима в этаноле, спирте, воде и других растворителях. Ортофосфорная кислота (синоним: кислота фосфорная) представляет собой бесцветную жидкость, плотностью от 1,56г/см3 (для кислоты концентрацией 73%) до 1,71г/см3 (для кислоты концентрацией 87%), не имеющую запаха.
Виды ортофосфорной кислоты и отличия
ГОСТ 10678-76 Кислота ортофосфорная термическая. Марка А, марка Б — 1 и 2 сортов. В зависимости от области применения термическая ортофосфорная кислота выпускается следующих марок:
Б – техническая ( 1-й сорт и 2-й сорт). Применение ортофосфорной кислоты марки Б: применяется для производства реактивных и пищевых фосфорных кислот, технических фосфорных солей, кормовых фосфорных удобрений, синтетических моющих средств, металлообрабатывающей, текстильной, нефтяной, стекольной и керамической промышленности. Широко используется также для фосфатирования металлов, в качестве катализатора в органическом синтезе.
ГОСТ 6552-80 Кислота ортофосфорная. Реактив. Ч (ортофосфорная кислота чистая), ХЧ (химически чистая) и ЧДА (чистая для анализа). Отличия ортофосфорной кислоты по видам и ГОСТам указаны в самих ГОСТах, и это касаемо, прежде всего, норм и содержания, концентрации определенных веществ в растворе.
УСЛОВИЯ ТРАНСПОРТИРОВКИ И ХРАНЕНИЯ
Термическую ортофосфорную кислоту транспортируют железнодорожным и автомобильным транспортом в соответствии с правилами перевозки опасных грузов, действующими на транспорте данного вида. Ортофосфорную термическую кислоту по железным дорогам транспортируют также в вагонах-цистернах. Степень (уровень) заполнения цистерн следует рассчитывать с учетом полного использования вместимости (грузоподъемности) цистерн и объемного расширения продукта при возможном перепаде температур в пути следования.
Термическую ортофосфорную кислоту хранят в стальных футерованных закрытых емкостях, а также в бутылях, канистрах и контейнерах, в которых она транспортировалась.
Применение ортофосфорной кислоты
Ортофосфорная кислота применяется в самых различных сферах и промышленных отраслях:
Требования безопасности. Класс опасности ортофосфорной кислоты
Основной класс опасности — 2, дополнительный — 8. Ортофосфорная кислота по степени воздействия на организм человека относится к веществам 2-го класса опасности по ГОСТ 12.1.007. Предельно допустимая концентрация продукта (по фосфорному ангидриду) в воздухе рабочей зоны производственных помещений составляет 1 мг/м3. При увеличении концентрации пары ортофосфорной кислоты вызывают атрофические процессы слизистых оболочек и крошение зубов, а также воспалительные заболевания кожи. По ГОСТу 19433-88 ортофосфорная кислота относится к 8 классу опасности, стандарт определяет классификацию перевозки опасных грузов (ADR), и распространяется на опасные грузы и устанавливает: классификацию; номенклатуру показателей и критерии для отнесения грузов к опасным и их классификации; методы определения показателей для классификации опасных грузов; маркировку и правила ее нанесения на грузовые единицы с опасными грузами, в том числе поставляемыми на экспорт.
Упаковка, маркировка, транспортирование и хранение ортофосфорной кислоты
Ортофосфорная кислота
Ортофосфорная кислота

Понятие
Ортофосфорная (фосфорная) кислота относится к неорганическим соединениям. На вид – бесцветные твердые гигроскопичные кристаллы с кисловатым вкусом. При температуре выше 42 °C вещество переходит в вязкую жидкость. Обычно данным химическим реактивом называют сиропообразную жидкость без цвета и запаха – 85 % водный раствор. Вещество хорошо растворимо в воде и во многих растворителях (этиловый спитр). Получают такой реактив из фосфора (иногда с добавлением серной кислоты или воды) с использованием специальных приборов и лабораторного оборудования.
Данное вещество относится к слабым кислотам, поэтому ему не присущи восстановительные или окислительные свойства.
Применение
Уникальная химико-физическая формула состава позволила 
— авиационная (компонент в составе гидрожидкостей);
— быту (составная многих моющих средств против ржавчины и образования коррозии, накипи);
— пищевая (пищевая добавка E338 – регулятор кислотности в газированных напитках, молочных и колбасных продуктах, хлебобулочных изделиях);
— деревообрабатывающая (при обработке древесины делает ее негорючим, при производстве негорючих красок);
— медицина (профилактическое средство при мочекаменных болезнях и повышенном pH желудка);
— химическая;
— электрическая (в качестве флюса при пайке);
— молекулярная биология;
— сельское хозяйство (компонент фосфатов для кормов и минеральных удобрений).
Как и большинство химреактивов ортофосфорная кислота широко применяется в стоматологии и фармацевтике.
Стоматология
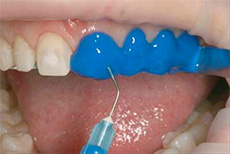
Ортофосфорная кислота входит в состав некоторых отбеливателей для зубов.
Опасность для организма
Несмотря на то, что пищевая добавка, содержащая данный компонент, является безвредной и разрешена к применению во многих странах мира, в результате многих научных исследований было установлено ее негативное влияние на организм. Например: потребление напитков, содержащих орто-фосфорную кислоту, может стать причиной возникновения кариеса, так как данное кислотное соединение «растворяет» зубную эмаль, а сахар, входящий в состав напитков, является благоприятной средой для развития и размножения бактерий.
К тому же, данная добавка нарушает кислотно-щелочной баланс, что приводит к повышению уровня кислотности. Для ее нейтрализации организм вымывает кальций из зубов и костей. Это также является причиной возникновения кариесу и раннего остеопороза.
Высоко концентрированный раствор может вызвать:
— ожоги кожных покровов и слизистых оболочек;
— кровотечения носа;
— крошение и разрушение зубов;
— изменение состава крови;
— рвоту;
— расстройство пищеварительного тракта;
— потерю аппетита и веса.
Не следует забывать о средствах индивидуальной защиты при работе с химвеществом.
Качественные химические реактивы по доступной цене!
Всем известно, что от качества используемых химических реактивов зависят результаты исследований и анализов. Покупая в “Prime Chemicals Group”, Вы приобретает только сертифицированный товар со знаком качества, отвечающий всем стандартам ГОСТ. Салициловая кислота цена, таурин цена, орто-фосфорная кислота или хлористый кальций цена, а также цены на все представленные химреактивы, оборудование и приборы, лабораторное стекло являются приемлемыми на современном рынке лабораторного оснащения.
Разница между фосфором и фосфорной кислотой
Содержание:
Что такое фосфорная кислота?
Фосфорная кислота производится путем гидролиза ангидрида кислоты; п4О6.
Но на производстве в промышленных масштабах хлорид фосфора (PCl3) гидролизуется паром.
Фосфорная кислота используется в качестве восстановителя в химическом анализе. Эта кислота легко превращается в фосфорную кислоту при нагревании примерно до 180 ° C. соли, образованные фосфористой кислотой, известны как фосфиты. Наиболее распространенное применение фосфорной кислоты: он используется в производстве основного фосфита свинца (стабилизатор в ПВХ).
Что такое фосфорная кислота?
Фосфорная кислота представляет собой фосфорсодержащую кислоту, имеющую химическую формулу H3PO4. Название этого соединения по ИЮПАК: тригидроксидооксидофосфор. Это трипротонная кислота, потому что она может выделять три протона (иона водорода) в водной среде.
Производство фосфорной кислоты осуществляется двумя основными способами; мокрый процесс и термический процесс. Мокрый процесс включает производство фосфорной кислоты из фторапатита. Он известен как фосфатная порода и имеет химический состав 3Ca.3(PO4)2.CaF2. Эта фосфатная порода тонко измельчается для увеличения площади поверхности и вступает в реакцию с концентрированной серной кислотой, которая дает фосфорную кислоту и гипс (CaSO4.2H2O) как продукты.
Термический процесс производства фосфорной кислоты включает сжигание элементарного фосфора для получения очень чистой фосфорной кислоты. При сжигании элементарного фосфора образуется пятиокись фосфора (P2О5). Затем это соединение гидратируют с образованием фосфорной кислоты.
В чем сходство между фосфором и фосфорной кислотой?
В чем разница между фосфором и фосфорной кислотой?
Фосфор против фосфорной кислоты
Оксиды фосфора. Фосфорная кислота
Фосфор образует очень большое число различных оксидов и кислот. Среди них наиболее устойчивыми являются оксид фосфора (V) и соответствующая ему ортофосфорная, или фосфорная, кислота Н3РО4.
Оксид фосфора (V), или фосфорный ангидрид Р2О5 – белый порошок, без запаха. По своему характеру является типичным кислотным оксидом. При растворении в воде гидратируется с образованием следующих кислот:
Как кислотный оксид Р2О5 взаимодействует с основаниями и основными оксидами, например:
При взаимодействии Р2О5 со щелочами в зависимости от соотношения реагентов могут образовываться не только средние, но и кислые соли:
Хотя в Р2О5 фосфор имеет высшую степень окисления +5, оксид фосфора (V) не проявляет сколько-нибудь выраженных окислительных свойств, так как эта степень окисления для фосфора очень устойчива.
Оксид фосфора (V) является прекрасным водопоглощающим и водоотнимающим средством. На этом основано его использование в эксикаторах (сосудах для высушивания веществ), при проведении реакций дегидратации и т.д.

Фосфорная (ортофосфорная) кислота Н3РО4 – бесцветное кристаллическое вещество, плавящееся при температуре 42 о С, очень хорошо растворимое в воде. Фосфорная кислота является трёхосновной кислотой средней силы.
В лаборатории её получают окислением фосфора разбавленной азотной кислотой.
В промышленности Н3РО4 получают экстракционным методом, обрабатывая природные фосфаты серной кислотой:
а также термическим методом, восстанавливая природные фосфаты до свободного фосфора, который затем сжигают и образующийся при этом Р2О5 растворяют в воде.
Фосфорная кислота обладает всеми общими свойствами кислот, но она значительно слабее таких кислородсодержащих кислот, как серная и азотная. В отличие от этих кислот фосфорная кислота не обладает даже значительными окислительными свойствами, несмотря на устойчивость степени окисления +5.
Применение фосфорной кислоты
Помимо производства удобрений, фосфорную кислоту используют при изготовлении реактивов, многих органических веществ, для получения катализаторов, для создания защитных покрытий на металлах, в фармацевтической промышленности и т.д.
Соли фосфорной кислоты
Как трёхосновная кислота Н3РО4 образует три ряда солей: средние (нормальные) соли – фосфаты; кислые соли – гидрофосфаты и дигидрофосфаты.
Например, при нейтрализации фосфорной кислоты гидроксидом натрия в зависимости от молярного соотношения кислоты и щёлочи могут идти следующие реакции:
Большинство средних солей – фосфатов – нерастворимо в воде. Исключением являются лишь фосфаты щелочных металлов и аммония. Многие же кислые соли фосфорной кислоты, хорошо растворяются в воде, причем наиболее растворимыми являются дигидрофосфаты.
Фосфорные удобрения
Фосфор, как и азот, является одним из тех элементов, который необходим для питания растений. Поэтому наряду с азотными в сельском хозяйстве широко используются фосфорные удобрения. В качестве удобрения можно использовать только водорастворимые соединения. В связи с этим основная задача при производстве фосфорных удобрений — превращение нерастворимого фосфата кальция (основа фосфоритов и апатитов) в растворимые кислые фосфаты.
Важнейшее фосфорное минеральное удобрение – суперфосфат (или простой суперфосфат), который получают обработкой природных фосфоритов серной кислотой:
Образующаяся смесь содержит дигидрофосфат кальция, который хорошо растворим в воде, и сульфат кальция, который не имеет практического значения.
Для получения двойного суперфосфата из природного фосфорита выделяют сначала фосфорную кислоту по реакции:
Затем полученной кислотой обрабатывают новую порцию фосфорита:
Иногда фосфорную кислоту нейтрализуют гидроксидом кальция, при этом получается так называемый преципитат, который тоже является хорошим удобрением:
СаНРО4 плохо растворяется в воде, но достаточно хорошо растворим при внесении его в кислые почвы.

В последнее время широкое распространение получили сложные удобрения, содержащие несколько необходимых растениям элементов.
Важнейшим из них является аммофос, который содержит азот и фосфор и образуется при взаимодействии аммиака и фосфорной кислоты:
Смесь аммофоса с калийной селитрой KNO3 называется аммофоской. Это удобрение содержит все наиболее необходимые растениям питательные элементы – азот, фосфор и калий.
*на изображении записи минерал апатит
Похожее
Добавить комментарий Отменить ответ
Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.
Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.
При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Химические свойства
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:
Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.




