Кислота и щелочь реакция что получается
Что такое щелочь, в какие реакции вступают самые известные из них
Химия – наука, изучающая различные реакции, протекающие в природе, а также взаимодействия одних соединений с другими. Основными веществами здесь являются кислоты и щелочи, реакции между которыми обычно называются нейтрализацией. Они приводят к образованию растворимой в воде соли.
Что такое щелочь
Гидроксиды щелочных (металлы первой группы главной (А) подгруппы в периодической таблице химических элементов Д. И. Менделеева) и щелочноземельных (металлы второй группы главной (А) подгруппы, включая кальций) металлов, которые бурно взаимодействуют с водой и полностью в ней растворяются, называются щелочами. Так как они способны разрушать органический материал (кожу, древесину, бумагу), их называют едкими. Например, гидроксид калия (KOH) – едкий калий, бария (Ba(OH)2) – едкий барий и так далее.
Физические свойства сильных оснований
Исходя из определения, что такое щелочь, можно добавить, что эти гидроксиды также представляют собой твердые гигроскопичные (способные поглощать из воздуха пары воды) вещества белого цвета. К самым сильным щелочам относятся гидроксиды цезия CsOH и радия Ra(OH)2. Реакции щелочей чаще всего сопровождаются выделением тепла (экзотермические). Также к физическим свойствам таких оснований можно отнести их способность растворяться в некоторых органических соединениях, например, в спиртах: метаноле и этаноле.
Химические свойства
Растворы щелочей способны вступать в различные реакции.
Сильные основания обладают способностью взаимодействовать с кислотными и амфотерными оксидами:
При реагировании с амфотерными металлами (Zn, Al и прочие) также возможно образование как расплава, так и соответствующей комплексной соли. Причем обе реакции сопровождаются выделением газообразного водорода:
Также щелочи способны реагировать с солями, в результате чего образуется другое основание и другая соль. Условием протекания реакции является то, что в результате одно из образовавшихся веществ должно быть не растворимо в воде:
NaOH + CuSO4 = Na2SO4 + Cu(OH)2.
Как уже было упомянуто ранее, щелочи и кислоты вступают в реакцию нейтрализации, образуется соль и вода:
NaOH + HCl = NaCl + H2O.
Щелочи вступают в реакцию с другими основаниями только, если это гидроксиды амфотерных металлов:
NaOH + Al(OH)3 = Na[Al(OH)4].
Некоторые из них могут вступать во взаимодействие со многими органическими веществами: эфирами, амидами, многоатомными спиртами:
2C2H6O2 + 2NaOH = C2H4O2Na2 + 2H2O (продукт реакции – алкоголят натрия).
Как получают сильные основания
Щелочи получают разными способами как в промышленности, так и в лабораториях.
В промышленной индустрии существуют несколько методов получения щелочей: пиролиз, известковый, ферритный, электролиз, который делится на диафрагменный, мембранный и ртутный методы на жидких и твердых катодах.
Это электролиз растворов хлоридов натрия и калия, после чего на аноде и катоде выделяются хлор и водород, и получаются соответствующие гидроксиды:
При пиролизе в 1000 градусов на первом этапе происходит образование оксида натрия:
На втором этапе полученный охлажденный оксид растворяют в воде, в результате чего и получается необходимая щелочь:
В лабораториях также применяется электролиз. Еще щелочи могут получиться путем воздействия на соответствующие металлы водой или взаимодействия солей этих металлов с другими основаниями, в результате чего получается необходимая щелочь и нерастворимый в воде второй продукт реакции – соль.
2Cs + 2H2O = 2CsOH + H2.
В результате действия воды на оксид лития получается щелочь:
Li2O + 2H2O = 2LiOH + H2.
Применение
Опираясь на само определение того, что такое щелочь, можно понять, что они находят широкое применение не только в промышленности, но и в быту:
Меры предосторожности
Становится очевидным, что такие щелочи, как гидроксиды натрия, лития, калия, цезия и прочие, способны сильно повреждать и обжигать кожу и слизистые оболочки глаз даже при попадании туда мельчайших частиц соединения. Чтобы предотвратить это, необходимо носить защитные очки, резиновые перчатки, а также спецодежду, которая обработана специальными веществами, не позволяющими материалу взаимодействовать со щелочами.
Основания. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
2K 0 + 2 H2 + O → 2 K + OH + H2 0
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Химические свойства щелочей
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Химические свойства кислот
8 класс, 9 класс, ЕГЭ/ОГЭ
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
На холоду — пассивация
Реакция не проходит
На холоду — пассивация
На холоду — пассивация
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
Соляная кислота вступает в реакцию с каждым из двух веществ:
Кислоты, щелочи и основания с точки зрения химии
Что же представляют собой кислоты, щелочи и основания с химической точки зрения? Читай внимательно и запоминай. Смотри не запутайся!
Что такое кислота?
Кислоты представляют собой молекулы, которые при растворении в воде высвобождают ион водорода. Ионы — это положительно и отрицательно заряженные частички, которые придают кислотам их свойства.
Давай рассмотрим этот процесс на примере соляной кислоты — HCI. Если соляную кислоту соединить с водой, она распадется на ион водорода (Н+) и ион хлора (CI ). Так как в составе молекулы воды также есть водород, то при распаде соляной кислоты общее количество ионов водорода в растворе увеличится.
А что происходит со щелочами при попадании в воду? В воде щелочи высвобождают гидроксид-ионы. Например, гидроксид натрия (NaOH) — щелочь. При соединении с водой он распадается на ионы натрия (Na+) и гидроксид-ионы (ОН ). Когда гидроксид-ионы встречаются с ионами водорода воды, общее количество ионов водорода в растворе сокращается.
Что такое основание?
Основание — это соединение, химически противоположное кислоте. В состав основания входят ионы металлов и связанные с ними гидроксид-ионы. Эти вещества способны присоединять ионы водорода (Н+) из кислоты. Когда основание смешивается с кислотой, оно полностью нейтрализует его свойства, а в результате реакции образуется соль.
Например, с точки зрения химии хорошо знакомая тебе зубная паста — это основание, которое нейтрализует кислоту, оставшуюся во рту после приема пищи.
ЗАПОМНИ! В связи с тем, что ионы существуют только в растворах, свои свойства кислоты проявляют также лишь в растворах.
Что такое щелочь?
Щелочи — это соединения, в состав которых входят ион металла и гидроксид-ион (ОН-). К щелочам химики относят гидроксиды щелочных и щелочноземельных металлов. Щелочи представляют собой вещества белого цвета, которые хорошо растворяются в воде. Более того, растворение всегда сопровождается очень активным выделением тепла. Щелочи вступают в реакцию с кислотами, образуя соль и воду.
Щелочи очень активны! Они способны поглощать из воздуха не только водяные пары, но и молекулы углекислого газа, сероводорода и т.д. Поэтому хранят щелочи в очень герметичной таре. Концентрированные щелочи разрушают стекло, а иногда даже фарфор. Если сравнивать щелочи с кислотами, то щелочи могут вызвать более сильные ожоги, так как они очень быстро проникают в ткань, и их практически невозможно смыть водой.
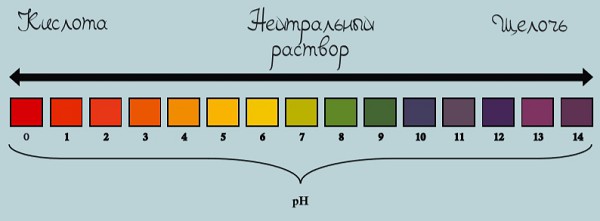
Шкала pH
Почему одни жидкости — кислоты, а другие — щелочи? Оказывается, все дело в типе ионов. Если в жидкости больше концентрация ионов водорода, такая жидкость является кислотой, а если гидроксид-ионов, то щелочью.
Шкала pH используется для измерения кислотности или щелочности раствора от 0 до 14.
Если pH раствора находится в пределах 0—7, то такой раствор считается кислотным, при этом раствор с pH = 0 — самый кислый. Растворы с pH в пределах 7—14 являются щелочами, при этом раствор с pH = 14 считается самым едким и опасным.
Если pH раствора равен 7, то такой раствор является нейтральным, так как концентрация ионов водорода равна концентрации гидроксид-ионов. Пример нейтрального раствора — чистая вода.
Что такое показатель pH?
В переводе с латинского pH (potentia hydrogeny) означает «сила водорода», т.е. активность ионов водорода в водном растворе.
Как химики определяют наличие воды в веществе?
Они берут бесцветный сульфат меди (CuSO4) и добавляют его в вещество. Если воды нет, то порошок остается бесцветным, однако даже при минимальном количестве воды он становится синим.
Концентрированные кислоты и щелочи
Ядовитые жидкости находятся не только в школьных лабораториях, они и вокруг нас. Это различные средства бытовой химии (стиральные порошки и пятновыводители), цветочные удобрения и ядохимикаты, лаки и краски, клеи и растворители, бензин и дизельное топливо, аккумуляторные, тормозные и прочие технические жидкости, а на кухне — уксус и уксусная кислота.
Совершенно очевидно, что все вышеупомянутые вещества должны использоваться строго по назначению и в соответствии с определенными правилами, указанными на этикетке каждого средства. К сожалению, несоблюдение мер безопасности при работе с ядовитыми средствами может привести к серьезным проблемам со здоровьем: отравлению, различным повреждениям кожи и слизистых оболочек.
ВНИМАНИЕ! Обязательно запомни следующую информацию: кислоты с очень низким показателем pH (менее 2) и щелочи, pH которых выше 13, являются чрезвычайно опасными!
Кислоты и щелочи в природе
ОСТОРОЖНО! Как правило, концентрированные кислоты и щелочи есть во всех школьных каби нетаххимии, и пользоваться ими можно только под руководством учителя.
Применение щелочей
Щелочи широко применяются в различных отраслях промышленности, медицине и быту. Например, каустическая сода используется для растворения жиров и входит в состав многих моющих средств, применяется при производстве целлюлозы, масел, дизельного топлива. Также щелочи используют для изготовления мыла, искусственных волокон, различных красителей и т.д.
Кислоты в почве
Оказывается, кислоты есть и в почвах, а способность почвы проявлять свойства кислот называется кислотностью. Этот показатель зависит от наличия в земле ионов водорода. От кислотности почвы зависят рост и развитие растений. Большинство из них предпочитает нейтральные или близкие к ним почвы. Однако есть ряд растений, которые отлично себя чувствуют именно на кислотных почвах, например рододендроны, гортензии, азалии. Некоторые сорта гортензии могут менять цвет бутонов в зависимости от условий выращивания и кислотности почвы. Ученые выяснили, что на цвет бутонов влияет наличие алюминия!
Большинство садовых почв характеризуется достаточным содержанием этого элемента. В кислой среде соединения алюминия превращаются в растворимые и становятся доступными для растений, поэтому и вырастают бутоны голубого цвета. В нейтральной или щелочной среде алюминий находится в виде нерастворимых соединений, поэтому он и не поступает в растения. В результате на таких почвах растут бутоны розового цвета.
Кислоты и щелочи в нашем организме
Для переваривания пищи организм использует желудочный сок, в состав которого входят соляная кислота и различные ферменты. Иногда, особенно после переедания, мы можем почувствовать боль в желудке. Чаще всего для снятия неприятных ощущений достаточно принять антацидный, или противокислотный, препарат, основное действие которого направлено на нейтрализацию соляной кислоты в желудке. Как правило, все антациды — щелочи, и именно они нейтрализуют повышенную активность кислот.