Кислота плюс вода что получится
Кислоты и щёлочи

И получается такое вещество, которое не относится ни к кислотам, ни к щелочам. Оно не способно вызывать ожоги. Но это будет только при правильной пропорции кислоты и щёлочи (иногда для верности пользуются фенолфталеином, он окрашивает щёлочь в слегка фиолетовый цвет).
Кислота и щёлочи — это как две противоположности. Но они очень важны при изготовлении таких вещей как: удобрения, пластик, мыла, моющие средства, красок, бумаги и даже взрывчаток. Это далеко не весь список.
Что такое кислота
Кислота — это и есть что-то кислое, оно характеризуется кислым вкусом. Кислота содержится в уксусе – уксусная кислота, в лимоне – лимонная кислота, в молоке – молочная кислота, в желудке – соляная кислота и т.п. Но это всё так называемые слабые кислоты, помимо них существуют кислоты с большей концентрацией (серная, синильная кислоты и т.д. хотя этот учёный пробовал). Они гораздо опаснее для человека и пробовать их не рекомендуется никому. Они способны разъесть одежду, кожу, вызвать тяжёлый ожог на коже, разъесть бетон и другие вещества. Например, соляная кислота нам нужна для того, чтобы желудок быстрее переваривал пищу, а также для уничтожения большинства вредных бактерий, которые приходят вместе с пищей.
Что такое щелочь?
Щелочь — это те вещества, которые хорошо растворяются в воде. При этом реакция сопровождается с выделением тепла, с увеличением температуры. Если щёлочь сравнивать с кислотой, то на ощупь она намного «мыльнее», то есть скользкая. Вообще, щёлочи не сильно отстают от кислот по разъеданию и по силе. Они также могут с лёгкостью разъесть древесину, пластик, одежду и тому подобное.
Кстати, из щёлочей делают мыло, стекло, бумагу, ткань и это не весь список. Щёлочь можно найти у себя на кухне, ну или в магазине под названием пищевая сода. Кстати, пищевая сода это очень хороший помощник всем домохозяйкам.
Кислоты и щёлочи – отличия
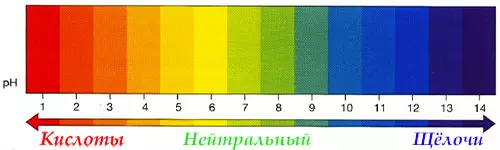
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 — это все кислоты, а больше 7 — это щёлочи.
pH продуктов
Сильные кислоты и слабые кислоты
Есть некоторые кислоты, которые мы можем употреблять, в то время как работа с другими предполагает строгие меры безопасности.
Сильные кислоты — это те, которые полностью диссоциируют или ионизируются в водных растворах.
Один из способов визуализировать, как отличить слабые и сильные кислоты, по аналогии с игроками в регби:
Примеры сильных кислот
Среди известных сильных кислот выделяют:
Примеры слабых кислот
Обычно кислоты органических соединений известны как слабые:
Показатель кислотности растворов рН, механизм действия
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов.
Работа с кислотами и щёлочами
Работа с кислотами и щёлочами требует большой внимательности и осторожности. Ведь при попадании на кожу они вызывают сильные ожоги. Старайтесь работать в проветриваемом помещении. Вдыхать пары щёлочей и кислот также не рекомендуется. Для личной безопасности стоит воспользоваться очками, перчатками и специальной одеждой, чтобы не повредить глаза, руки и любимую одёжку.
При работе с кислотами следует помнить, что сначала вливают кислоту в раствор (воду), а не наоборот. В противном случае произойдёт бурная реакция, которая сопровождается брызгами. А сам процесс добавления кислоты в раствор следует делать очень медленно, при этом контролировать степень нагрева сосуда и обязательно добавлять кислоту по стенкам сосуда.
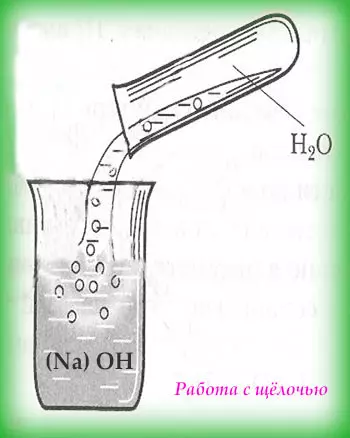
При работе со щёлочами первым следует добавлять понемногу щёлочь. К тому же запрещено пользоваться стеклянной посудой, рекомендуют фарфоровую или специальную посуду.
При химической обработке металлов (оксидирование, анодирование, травление и др.) погружать в раствор и вынимать из раствора изделие следует с помощью специальных приспособлений или инструментов, но никак не руками, даже если они в резиновых перчатках. Кстати, щёлочь входит в состав некоторых батареек.
Запомните, что при химических ожогах кожи поражённое место нужно промыть сильной струёй проточной воды. И окончательно нейтрализовать: от кислот — 3%-ным раствором питьевой соды, а щёлочь — 1%-ным раствором уксусной кислоты.
Кислота плюс вода что получится
Вот мне интересно, когда люди перестанут задавать очевидные вопросы?
Тавитима, вы а Гугле посмотрите отвтеты на эти ворпосы. Думаю, вас это не оставит равнодушной
дай бог памяти. скорее в воду. меньше выброс энергии будет. кажись. а воообще нужно сына спросить он это отлично знает
Нужно наливать серную кислоту в воду тогда все будет ОК.
А если наоборот. то как минимум разорвет сосуд.
У меня за плечами 12 лет работы в хим.лаборатории и все эти годы у нас висел плакат: Не лей воду в кислоту!
А у нас метель! Скоро гулять с собакой, караул!
Собака, это такое дело.
Ну да, ныть можно сколько угодно, а гулять придется.
Другими словами, всякая собака, в любую погоду хозяина на улицу выведет.
Запомните, мы сахар насыпаем в воду (чай), так и серная кислота или любая другая наливается в воду.
кислота. она тяжелее воды. если лить наоборот, вода будет расплёскиваться по поверхности кислоты.
Кислоту льют в воду, никак не наоборот))) Так концентрация кислоты уменьшается с малого объёма.
На уроках химии учили лить воду в кислоту, дабы избежать бурной реакции, насколько я помню.
Давно это было. забылось.
из курса химии знаю что серную кислоту надо лить в воду а не наоборот так что вы правы
Вопрос электромонтеру на засыпку. Если линуть воду в кислоту, можно получить травму.
Кислота в воду,потому,что она тяжелее,а вода легче и будет кипеть и разбрызгиваться
не темните. как спирт надо разбавить что ли..так и скажите! (шутка!)
Да. Чтобы концентрация повышалась постепенно. Иначе возможны брызги, обожгешься
Не думайте об этом, лучше загляните на наши платья они тут http://flfashion.com.ua/
Кислота на них не действует?
Давайте проверим. Выбирите одно тут http://flfashion.com.ua/
кислоту в воду т. к плотность воды меньше и вода может сильно нагреться
Что твердили это да а вот почему?кислота получается спокойно ныряет вглубь воды и растворяется а если на оборот вода на остаетчся на уровне кислоты и по границе может вскипеть. да?
Кислоты. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ).
Получение кислот
1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота.
кислотный оксид + вода = кислота
При этом оксид кремния (IV) с водой не реагирует:
2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты.
Неметалл + водород = бескислородная кислота
H2 0 + Cl2 0 → 2 H + Cl —
3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз.
4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями.
Химические свойства кислот
1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично.
HCl → H + + Cl –
Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония:
HCl + H2O → H3O + + Cl –
Многоосновные кислоты диссоциируют cтупенчато.
HSO3 – ↔ H + + SO3 2–
2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот.
С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты.
нерастворимое основание + растворимая кислота = соль + вода
основный оксид + растворимая кислота = соль + вода
При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой.
С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами.
Растворимая кислота + амфотерный оксид = соль + вода
Растворимая кислота + амфотерный гидроксид = соль + вода
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.).
4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0
6. Кислоты взаимодействуют с солями.
Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 —
7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей.
кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода
KHCO3 + HCl → KCl + CO2 + H2O
Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия:
При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей.
Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли.
Al (OH) Cl2 + HCl → AlCl3 + H2O
8. Кислоты взаимодействуют с металлами.
При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному.
К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI.
Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород:
минеральная кислота + металл = соль + H2↑
Fe + 2 H + Cl → Fe +2 Cl2 + H2 0
Сероводородная кислота H2S, угольная H2CO3, сернистая H2SO3 и кремниевая H2SiO3 с металлами не взаимодействуют.
Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции. Я настоятельно рекомендую выучить их наизусть.
9. Некоторые кислоты разлагаются при нагревании.
Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания:
Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании:
Азотная кислота HNO3 разлагается при нагревании или на свету:
Что льют кислоту в воду или наоборот. Неправильное смешивание концентрированной серной кислоты с водой (как это выглядит на практике)
Как смешать два жидких вещества? Например, какую-нибудь кислоту и воду? Казалось бы эта задача из серии «дважды два – четыре». Что может быть проще: слить две жидкости вместе, в какой-нибудь подходящей емкости, и все дела! Или влить одну жидкость в емкость, где уже находится другая. Увы, это та самая простота, которая, по меткому народному выражению, хуже воровства. Поскольку дело может закончиться крайне печально!
Инструкция
Почему? А потому, что концентрированная серная кислота, во-первых, гораздо плотнее воды, а во-вторых, чрезвычайно гигроскопична. Иными словами, она активно поглощает воду. В-третьих, это поглощение сопровождается выделением большого количества тепла.
Если в емкость с концентрированной серной кислотой начнут приливать воду, первые же порции воды «растекутся» по поверхности кислоты (поскольку вода гораздо менее плотная), и кислота начнет жадно поглощать ее, выделяя тепло. А этого тепла будет так много, что вода буквально «вскипит» и брызги полетят во все стороны. Естественно, не миновав незадачливого экспериментатора. Обжечься и «чистым» кипятком не очень приятно, а если учесть, что в водяных брызгах наверняка будет еще кислота. Перспектива становится совсем невеселой!
Именно поэтому многие поколения учителей-химиков заставляли своих учеников буквально зазубривать правило: «Сначала вода, потом – кислота! Иначе случится большая беда!» Концентрированную серную кислоту следует добавлять в воду, маленькими порциями, при перемешивании. Вот тогда вышеописанная неприятная ситуация не произойдет.
Резонный вопрос: с серной-то кислотой понятно, а как быть с другими кислотами? Как правильно смешивать их с водой? В каком порядке? Необходимо знать плотность кислоты. Если она плотнее воды, например, концентрированная азотная, ее точно так же, как серную, следует приливать в воду, соблюдая вышеуказанные условия (понемногу, при перемешивании). Ну, а если плотность кислоты очень незначительно отличается от плотности воды, как в случае с уксусной кислотой, тут уж без разницы.
Внимание, только СЕГОДНЯ!
Серная кислота по физическим свойствам – тяжелая маслянистая жидкость. Она не имеет запаха и цвета, гигроскопична, хорошо растворяется в воде. Раствор с содержанием H2SO4 менее 70% обычно называют разбавленной серной кислотой, более 70% –…
Серная кислота имеет химическую формулу H2SO4. Это тяжелая маслянистая жидкость, бесцветная или с желтоватым оттенком, который ей придают примеси ионов металлов, например, железа. Серная кислота очень гигроскопична, легко поглощает водяные пары.…
Серная кислота входит в пятерку самых сильных кислот. Необходимость в нейтрализации этой кислоты возникает, в частности, в случае ее утечки и при возникновении угрозы отравления ей. Инструкция 1Молекула серной кислоты состоит из двух атомов…
С давних времен, объясняя, как смешивать концентрированную серную кислоту с водой, учителя заставляли учеников запоминать правило: «Сначала вода, потом – кислота!» Дело в том, что если поступить наоборот, первые же порции более легкой…
Серная кислота, имеющая химическую формулу H2SO4, представляет собою тяжелую, плотную жидкость маслянистой консистенции. Очень гигроскопична, легко смешивается с водой, при этом обязательно следует лить кислоту в воду, ни в коем случае не наоборот.…
В любом автомобиле есть источник тока, этим источником является аккумулятор. Т. к. аккумулятор – это элемент многоразового использования, то его можно подзаряжать и менять в нем электролит. Раньше, в автомобилях применялись как кислотные, так и…
Сульфаты железа – это неорганические химические вещества, они делятся на разновидности. Существует двухвалентный сульфат железа(2) и трехвалентный сульфат железа(3). Есть много способов получения этих сернокислых солей. Вам понадобитсяЖелезо,…
Что происходит, если кислоту соединить с какой-либо солью? Ответ на этот вопрос зависит от того, какая это кислота и какая соль. Химическая реакция (то есть превращение веществ, сопровождающееся изменением их состава) между кислотой и солью может…
Как смешать два жидких вещества? Например, какую-нибудь кислоту и воду? Казалось бы эта задача из серии «дважды два – четыре». Что может быть проще: слить две жидкости вместе, в какой-нибудь подходящей емкости, и все дела! Или влить одну жидкость в емкость, где уже находится другая. Увы, это та самая простота, которая, по меткому народному выражению, хуже воровства. Поскольку дело может закончиться крайне печально!
Инструкция
Почему? А потому, что концентрированная серная кислота, во-первых, гораздо плотнее воды, а во-вторых, чрезвычайно гигроскопична. Иными словами, она активно поглощает воду. В-третьих, это поглощение сопровождается выделением большого количества тепла.
Если в емкость с концентрированной серной кислотой начнут приливать воду, первые же порции воды «растекутся» по поверхности кислоты (поскольку вода гораздо менее плотная), и кислота начнет жадно поглощать ее, выделяя тепло. А этого тепла будет так много, что вода буквально «вскипит» и брызги полетят во все стороны. Естественно, не миновав незадачливого экспериментатора. Обжечься и «чистым» кипятком не очень приятно, а если учесть, что в водяных брызгах наверняка будет еще кислота. Перспектива становится совсем невеселой!
Именно поэтому многие поколения учителей-химиков заставляли своих учеников буквально зазубривать правило: «Сначала вода, потом – кислота! Иначе случится большая беда!» Концентрированную серную кислоту следует добавлять в воду, маленькими порциями, при перемешивании. Вот тогда вышеописанная неприятная ситуация не произойдет.
Резонный вопрос: с серной-то кислотой понятно, а как быть с другими кислотами? Как правильно смешивать их с водой? В каком порядке? Необходимо знать плотность кислоты. Если она плотнее воды, например, концентрированная азотная, ее точно так же, как серную, следует приливать в воду, соблюдая вышеуказанные условия (понемногу, при перемешивании). Ну, а если плотность кислоты очень незначительно отличается от плотности воды, как в случае с уксусной кислотой, тут уж без разницы.
Ответ от Дёминов Анатолий [гуру]
Начинает кипеть и брызгаться.
Ответ от электросварщик [гуру]
реакция))) но при наливании воды в кислоту лучше близко не стоять и не вдыхать и глазки туды не засовывать. перами обозжет
Ответ от Невроз [гуру]
слышали такое выражение кислота ходит в гости.
Ответ от Колосовые [гуру]
слабый раствор кислоты либо воды. =))
Ответ от Їерчилль [гуру]
Второе можно производить только в комбинезоне химзащиты.
Ответ от Анатолий Подплетний [гуру]
В первом случае-кислота тяжелее и сразу уходит на дно остается только помешать и будет элекролит! А во втором случае легкая вода начнет разбрызгивать и повыжигает глаза если нет очков!!
Ответ от Михаил Бармин [гуру]
Диссоциация (растворение происходит с выделением большого количества тепла. На до вливать вещество с большей плотностью в вещество с меньше плотностью, что приведет к лучшему перемешиванию и меньшей скорости, иначе ВЫБРОС раствора и ПОРАЖЕНИЕ ГЛАЗ!!
Ответ от Ира Юшинова [новичек]
Смотря какую кислоту. В случае с азотной и соляной ничего страшного не произойдет, кислоты просто нагреются. Соляная нагреется сильнее. В случае с серной реакция будет идти с большим выделением тепла. В первом случае серная кислота опустится на дно, так у воды меньшая плотность и реакция будет проходить безопасно. Во втором случае реакция будет проходить на поверхности с большим выделением тепла. Похожее происходит, когда на раскаленную сковородку капнуть воды. Но в конце концов кислота поглотит воду.
Послушайте рассказ этой девушки:
Рост мужского гомосексуализма прямо пропорционален росту эмансипации.
Это Германия, XXI век.
Гомосексуализм в Германии стал маргинальным феноменом общественной жизни. В атмосфере вседозволенности он превратился в пандемию.
Институт семьи рухнул под совместным натиском гомосексуалистов, феминисток и атеистов. Мораль и традиция выдавлены в маргинез.
Не только в Германии, но и в других странах мира усилились приметы тотальной болезненности.
Человечество все больше отдаляется от той нормы, которую Эрих Фромм называл «здоровой». Приметами такой жизни являются все возрастающая отчужденность между людьми, усиление эгоцентризма, релятивизация и разрушение традиционных морально-этических ценностей, нарастающая хаотичность жизни, гедонизм и меркантилизм. Источник.
А ведь и те, и другие в равной степени пригреты и обласканы правительством новой Германии!
На мой взгляд, такая «забота» о немецкой нации со стороны канцлера Германии Ангелы Меркель, это на порядок круче замысел, чем чья-то задумка свести в России воедино бойцов ВДВ и питерских геев!
АНЕКДОТ в ТЕМУ от Владимира Вольфовича:
Однажды утром Штирлиц зашёл к Мюллеру. Настроение у того было мрачнее тучи.
— Господин группенфюрер, что случилось? Русские уже в пригородах Берлина?
— Штирлиц, бросьте ваши дурацкие шутки! Мне приснился страшный сон — Германия 2015 года!
— И что же, там всё так плохо?
— Не то слово! Представляете, у нас в Германии канцлер — баба, министр иностранных дел — педераст, на заводах Даймлер-Бенц работают турки, Германия оплачивает долги греков и испанцев, вместо факельных шествий — гей-парады, мы платим деньги евреям и выполняем команды негра из Америки!
Почему? Серная кислота более тяжелая, чем вода.
Вода резко вскипит, в результате полетят брызги серной кислоты и образуется едкий аэрозоль. Эффект может быть примерно такой, как при добавлении воды на горячую сковородку с маслом. Брызги серной кислоты могут попасть в глаза, на кожу и одежду. Аэрозоль серной кислоты не только очень неприятен при вдыхании, но и опасен для легких.
Чтобы это правило было легче запомнить, придумывают специальные стишки вроде:
Разумеется, со всеми мерами предосторожности: начиная от защитных очков, заканчивая использованием небольших количеств веществ.
Для примера, опишу один из экспериментов, проведенный в пробирке. Концентрированной серной кислоты взял 20 мл, воды 5 мл. Обе жидкости комнатной температуры.
Начал добавлять к серной кислоте воду. Вода закипела лишь в момент, когда приливал первые порции воды к кислоте. Новые порции воды погасили кипение. Едкий аэрозоль полетел (к этому я был не готов, пришлось на несколько секунд отойти). Попробовал перемешать алюминиевой проволочкой (то, что было под рукой). Эффекта ноль. Измерил температуру термометром. Оказалось 80 градусов по Цельсию. Эксперимент удался едва ли.
Итак, в коническую колбу налил около 10-15 мл концентрированной серной кислоты. Воды использовал около 10 мл.
Пока готовился к опыту, кислота под палящим солнцем разогрелась до 36-37 градусов (что градусов на 20 выше, чем начальная температура кислоты в прошлом опыте). Вода в пробирке тоже слегка нагрелась, но не так сильно. Думаю, это сыграло большую роль в успехе опыта.
При добавлении основной порции воды в серную кислоту заметно летели брызги и едкий аэрозоль. К счастью, их сносило ветром, который дул с моей стороны, поэтому я даже ничего не ощутил.
В итоге, температура в пробирке поднялась выше 100 градусов!
При работе с бОльшими количествами воды и кислоты вероятность резкого разогрева и разбрызгивания возрастает (напоминаю: мы взяли всего несколько миллилитров).
Если в концентрированную серную кислоту наливать воду, то первые капли воды, попавшие в нее, моментально превращаются в пар и из сосуда вылетают брызги жидкости. Это происходит по той причине, что вода, обладая небольшим удельным весом, не погружается в кислоту, а кислота ввиду малой теплоемкости не поглощает выделившейся теплоты. При вливании горячей воды наблюдается более сильное разбрызгивание серной кислоты.
За неимением стеклянной воронки можно воспользоваться картонной, внутрь которой вводят пипетку с водой.
Если в стакан с водой приливать по каплям или тонкой струей концентрированную серную кислоту, то можно заметить, как более тяжелая серная кислота опускается на дно стакана.