Кислотность и жесткость воды в чем разница
Основные параметры воды (показатели GH, KH и pH)
К основным параметрам воды в аквариуме относят: общую жёсткость (GH), карбонатную или временную жёсткость (KH) и водородный показатель (pH). Данные показатели имеют ключевое значение при содержании рыб и пресноводных креветок и о них следует знать каждому аквариумисту.
Для начала вспомним школьный курс химии о растворении веществ. При растворении в воде какого-либо вещества оно диссоциирует, т. е. распадается на отрицательные (анион) и положительные (катион) ионы. Например, если в воде размешать обычную поваренную соль — хлорид натрия (NaCl), то она диссоциирует катион Na+ и анион Cl-.
Диссоциация хлорида натрия (NaCl)
Аналогичным образом ведут себя растворённые вещества, от которых напрямую зависят показатели GH, KH и косвенно pH.
Общая жёсткость воды GH
Жёсткость воды определяется суммой ионов щёлочноземельных металлов, растворённых в воде. В основном это ионы Кальция (катионов Са+) и Магния (катионов Mg+). Если они присутствуют в большом количестве, значит вода жёсткая, если их мало — мягкая.
Общая жёсткость воды
Исторически сложилось так, что в аквариумистике жёсткость воды обозначается как GH (Grad Härte) и выражается в немецких градусах dGH (или сокращённо dH), либо в американских ppm (part per million — одна часть на миллион). Обе единицы измерения можно легко конвертировать друг в друга.
В Европе и страх на постсоветском пространстве широко используются немецкие градусы и градацию жёсткости, принятые в Германии. Именно в них выражается жёсткость в тестах анализа воды у большинства популярных брендов (JBL, API, Tetra, ADA, Sera и другие).
С 2007 года для адаптации к европейским стандартам в Германии действует следующая градация жёсткости воды:
от 0 до 8.4 dGH — мягкая,
от 8.4 до 14 dGH — средней жесткости,
Больше 14 dGH — жесткая.
Оптимальный диапазон GH для большинства видов рыб находится между 4 и 16 градусами dGH.
Стоит отметить, что некоторые производители тестов для аквариумной воды продолжают использовать старый диапазон жёсткости воды (действовавший до 2007 года), который выглядит следующим образом:
от 0 до 5 dGH — очень мягкая,
от 5 до 10 dGH — мягкая,
от 10 до 20 dGH — средней жесткости,
от 20 до 30 dGH — жёсткая
свыше 30 dGH — очень жесткая
В данной градации оптимальным считается диапазон между 5 и 20 градусами dGH.
Почему важен показатель GH?
В дикой природе параметры воды отличаются от региона к региону. В каждой конкретной местности рыбки приспособились к собственной уникальной среде обитания. Виды, живущие в мягкой воде, оказавшись в среде с высоким GH будут испытывать повышенное осмотическое давление, что приводит к стрессу и нарушению обмена веществ. С другой стороны, в условиях дефицита ионов некоторых щелочноземельных металлов, в особенности кальция и магния, будут наблюдаться проблемы роста, что особенно критично для декоративных креветок.
Таким образом, чтобы обеспечить благоприятные условия содержания, важно поддерживать значения GH на том уровне, которые указаны в описании аквариумных рыбок.
Карбонатная жёсткость KH
Щелочноземельные металлы оказываются в воде в составе других веществ. Напарниками Са и Mg обычно выступают хлориды (Cl2), сульфаты (SO4), карбонаты (CO3) и гидрокарбонаты (НСО3). Именно присутствие в воде анионов CO3- и НСО3- обозначается как карбонатная жёсткость. Её также называют временная, поскольку карбонаты легко удаляются из воды кипячением, осаждаясь в виде всем известной накипи.
В противоположность временной жёсткости существует постоянная, которая обусловлена присутствием в воде оставшихся анионов Cl2- и SO4-. Определение «постоянная» используется потому, что удалить хлориды и сульфаты кипячением не получится.
Временная или карбонатная жёсткость воды
Карбонатная жёсткость является частью общей жёсткости и по аналогии с ней её принято измерять в немецких единицах измерения dKH и обозначать как KH (Karbonathärte hängt). Градация аналогична GH, но чаще применяется старый диапазон жёсткости (действовавший до 2007 года), который, как правило, ограничен диапазоном от 0 до 20 dKH.
Почему важен показатель KH?
KH тесно взаимосвязана с другим важным показателем — pH, имеющим для рыб и растений не меньшее значение чем общая жёсткость.
Оба показателя напрямую зависят друг от друга. Высокие значения pH означают высокие значения KH. И наоборот, кислые значения pH могут быть достигнуты только при низких значениях карбонатной жёсткости (подробнее в Таблице ниже).
В аквариуме для KH отводится особая роль. Карбонатная жёсткость не только взаимосвязана с pH, то также служит для поддержания его стабильного значения. KH выступает своего рода буфером, который препятствует быстрым и значительным изменениям pH.
Водородный показатель pH
Водородный показатель или показатель pH воды указывает на количество свободных ионов водорода (H+), а точнее на соотношение H+ и OH- (вместе образуют знакомую формулу H2O). Вода сама по себе практически не диссоциирует на H+ и OH-, но поскольку в ней присутствует большое растворённых веществ (например, соли щелочноземельных металлов), некоторые из них дают химическую реакцию, смещая водородный показатель в ту или иную сторону. Если ионов водорода в воде много, она кислая, если мало — щелочная.
Ионный состав нейтрального значения pH
Ионный состав кислого значения pH
Ионный состав щелочного значения pH
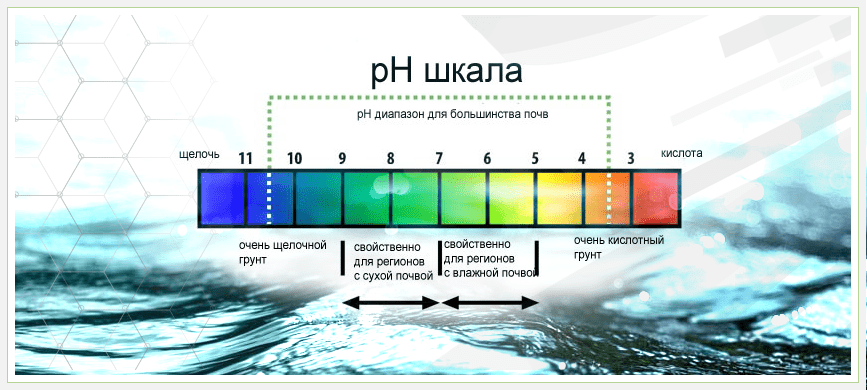
Показатель pH измеряется по шкале от 0 (очень кислая вода) до 14 (очень щелочная вода). В отличие от общей жёсткости воды обозначение водородного показателя одинакового во всех странах, поэтому путаницы не происходит.
Рыбы могут жить в пределах от 5 до 9 pH. Середина шкалы под номером 7 (pH7) считается нейтральным значением.
pH 9 — сильнощелочная
В аквариуме показатель pH очень нестабилен, особенно в мягкой воде. В течение дня возможны небольшие изменения в ту или иную сторону. На суточные колебания наибольшее влияние оказывает углекислый газ, производимый рыбами и растениями (в ночное время), и различные органические отходы (экскременты, не съеденные остатки пищи), которые активно участвуют в окислении воды.
Как было отмечено выше, KH служит буфером для pH, удерживая его в определённом диапазоне значений. Между ними существует прямая зависимость, которую можно описать таблицей. В таблицу третьим показателем включают углекислый газ, поскольку степень растворения CO2 также зависит от соотношения карбонатной жёсткости и водородного показателя.
Таблица соотношения pH, KH и CO2
Почему важен показатель pH?
Наряду с температурой и показателем GH водородный показатель имеет ключевое значение при содержании аквариумных рыб, креветок и выращивании водных растений.
Будучи родом из различных биотопов обитатели аквариума нуждаются в определённом составе воды. Например, африканские цихлиды из рифтовых озёр приспособились к щелочной воде, а рыбки из Амазонии напротив, могут жить только при кислых значениях pH. Для здорового роста растений необходимы питательные вещества, которые наиболее эффективно усваиваются при низких значениях водородного показателя (например, железо, марганец, бор, медь и цинк).
Акваловер
Аквариумистика — аквариум новичкам, аквариум любителям, аквариум профессионалам
Взаимосвязь рН и кН
 Самое читаемое
Самое читаемое
В жесткой воде, т. е. содержащей много солей кальция и магния, всегда мало свободной углекислоты, а в мягкой ее значительно больше.
Показатель рН подвержен колебаниям, которые происходят из-за изменений растворенного в воде СО2 и карбонатной жесткости воды КН. Так, увеличение количества СО2 или снижение КН делает воду более кислой, увеличение КН или снижение СО2, делает ее более щелочной. Поэтому все гидробионты своим дыханием способствуют снижению рН. Особенно заметно это снижение ночью, когда растения не поглощают углекислоту. Днем, во время световой фазы фотосинтеза, активность потребления углекислоты растениями заметно возрастает. Значит, ночью рН в аквариуме становится более кислым, а днем — щелочным.
В жестких водах, содержащих много соединений кальция, растения днем выделяют углекислый газ из карбонатных веществ. Происходит это в виде сложной химической реакции, в ходе которой образуется соль кальция, выпадающая игольчатыми кристалликами кальцита. Этот осадок покрывает серым налетом листья тех растений, которые таким путем получают углекислый газ: элодеи, рдесты, кабомбы (не все водные растения обладают такой способностью).
КH и pH имеют очень простую взаимосвязь между собой. Чем больше содержание гидрокарбоната в воде, то есть значение КH, тем выше, а самое главное, стабильнее, значение pH, т.к. он является прекрасным буфером воды. Особое значение здесь имеет слово «стабильнее»: вода с высокой (более 12 градусов) карбонатной жесткостью, имеет щелочную реакцию. Вода средней жесткости (6-12 градусов) скорее всего, будет близка к нейтральной реакции (pH
7.0), вода с карбонатной жесткостью менее 6 градусов КH, в общем-то может быть какой угодно, но, наиболее вероятно, будет кислой. Более низкие значения кН повышают вероятность обвала кислотности.
Естественным буфером для сдерживания колебаний рН являются соли, образующие жесткость воды. Чем больше жесткость воды, тем выше ее буферный запас, дающий устойчивость рН. Буфером, например, может быть грунт, имеющий в своем составе много известняка — для поддержания высокой жесткости воды. Или буфером может быть кусок дерева, коряга, которая подкисляет воду и понижает pH.
Как правило, жёсткая вода обычно щелочная (pH>7) и является хорошим буфером. В то же время мягкая вода (pH Запись опубликована автором Igor Великолепный в рубрике Аквариумная гидрохимия, Водородный показатель: рН, Карбонатная жесткость: kH, Минерализация и жесткость воды, Описания рН. Добавьте в закладки постоянную ссылку.
Кислотность воды и жесткость: как взаимосвязаны ключевые понятия качества жидкости?
Вода является основой функционирования организма, без нее невозможна работа внутренних органов человека. Поэтому человеку необходимо в день выпивать достаточное количество воды. Но важно не только количество, но и качество. Недостаток необходимых элементов делает ее бесполезной, а наличие вредных примесей и микроорганизмов опасной для здоровья. Тут необходим баланс, ведь в зависимости от концентрации одного компонента, другие могут менять свои свойства и трансформироваться.
Зная особенности жидкости, можно обезопасить себя. Проведение проверки и определение жесткости воды и ее кислотных показаний может выявить отклонение от норм. Так как качество воды является важным для человека, то своевременное выявление и устранение нарушений может предотвратить проблемы со здоровьем. К примеру, общая жесткость воды при отклонении от нормативных показателей может стать причиной многих нарушений. Самой распространенной является аллергическая реакция.
Повышение кислотности может вызывать нарушение кровообращения в организме и особенно это касается головного мозга, также кислота скапливается в организме, к примеру, в легких, и человек становится уязвим перед различными вирусами.
В отличие от жидкости с повышенной кислотностью, щелочные жидкости, наоборот, могут принести пользу для организма. К ним относятся различные минеральные воды. Туда входят ионы натрия, бор, фтор, алюминий и другие элементы, которые необходимы для правильной работы организма.
Вы можете осуществить такую экспертизу самостоятельно или же доверить ее в руки экспертов. В нашей независимой лаборатории «ЭкоТестЭкспресс» сделают все необходимые расчеты за вас и сэкономят ваше время и силы.
Как измерить кислотность воды в домашних условиях?
Узнать показатели кислотности воды не только в лаборатории, но и в домашних условиях. Сейчас не во всех случаях необходимо тщательное исследование с использованием нового и профессионального оборудования. Для простого осуществления контроля качества уже есть специальные способы проведения такого исследования. Конечно же они не могут дать максимально точный результат и точно не подойдут для осуществления постоянного контроля на предприятии.
Такое измерение кислотности воды в домашних условиях проводится при помощи различных химически активных веществ или же измерителей для кислотности воды. Перед началом необходимо изучить всю специфику такого исследования и проводить все в несколько этапов:

Но как было сказано ранее, такое домашнее измерение ph воды или же щелочности воды не всегда дают точные результаты. Иногда погрешности могут быть довольно большими, если не соблюдать все требования. Но даже при следовании инструкциям такие способы не могут выявить некоторые особенности или состав. Существуют сложные приборы, которые могут проверить качество и содержание.
Как производится очищение воды в случае повышенной кислотности?
Для проведения очистки стоит сперва провести точное и качественное исследование таких показателей как уровень жесткости воды и ее кислотность. Их можно исследовать как отдельно исходя из собственных нужд, так и комплексно. Они являются взаимосвязанными показателями и поэтому их удобно проверять вместе. Использование точного лабораторного оборудование и проведение экспертизы экспертами экологами может сберечь ваши силы и дать максимально точные результаты. Но в домашних условиях использование оборудования или лакмусовых бумажек тоже хороший вариант, так как в этом случае погрешность слишком мала для какого-то значительного влияния на результаты.
После получения результатов можно понять, каким способом необходимо понизить уровень кислотности воды. Анализ определяет завышен ли уровень ионов водорода и если он не соответствует нормам, то следует предпринять дальнейшие действия по улучшению качества жидкости. В таком случае следует следить не только за тем, чтобы уменьшить вредные для человека показатели, но и за тем, чтобы не был нарушен естественный баланс.
Существуют следующие способы, которые устраняют повышенную кислотность воды ph:
Таким образом проверка воды не является сложной процедурой и доступна даже в домашних условиях. Благодаря этому контроль за качеством используемой воды может осуществляться постоянно. Это очень важно, ведь здоровье человека напрямую зависит от качества жидкости, которую он употребляет. При длительном употреблении такой воды могут возникнуть сердечно-сосудистые заболевания, различные заболевания скелета или даже образование опухолей. Нарушение кислотно-щелочного баланса также чревато постоянной усталостью и проблемами с кожей.
Устранение отклонения от норм также является доступным и зачастую не требует особых затрат от человека. Нередко их можно осуществить без специального оборудования, но специальные фильтры работают намного эффективнее и обеспечивают лучший результат.
Если же вы не хотите сами проводить измерения, то в исследовательской лаборатории «ЭкоТестЭкспресс» проведут все необходимые вам измерения и расчеты. Получив результаты, вы можете увидеть, соответствуют ли они различным государственным нормам и является ли такая жидкость пригодной для дальнейшего использования в бытовых нуждах или в пищу.
pH воды, жесткость воды, вкус и цвет
Какой должен быть pH воды?
Что такое жесткость воды?
Органолептические свойства воды.
Цвет, вкус и минерализация воды.
Микробиологические показатели питьевой воды.
Читайте в этой статье.
Вступление
Водородная связь очень прочная, и молекула воды практически не распадается на ионы, поэтому вода имеет постоянную структуру и свойства независимо от состояния, коими являются лед, пар и жидкость.
В воде хорошо растворяются различные вещества (то есть вода- окислитель). Известны три агрегатных состояния воды- твердое, жидкое и газообразное (пар). Пресная вода замерзает при температуре 0 градусов Цельсия. При замораживании вода, в отличие от многих других веществ, расширяется, т.е. твердое состояние воды легче жидкого (лед в воде не тонет, а плавает).
Вода обладает большой теплоемкостью (медленно нагревается и так же медленно остывает), регулируя температуру воздуха и делая климат более мягким. Высокая (в 10 раз больше, чем у железа) теплоемкость воды признана эталоном для сравнения с теплоемкостью других веществ. Ее удельный вес (плотность) также признан эталоном. В разработке метрической системы веса в качестве сравнения использована вода. Например, 1 грамма любого вещества соответствует массе 1 милиметра кубического воды, 1 кг- массе 1 литра воды.
Органолептические свойства воды
Органолептические свойства- это свойства, которые определяются органами чувств человека (осязанием, обонянием, вкусом, зрением) и не имеют числовых показателей.
Запах воды определяется количеством присутствующих в ней органических веществ (остатков растительного и животного происхождения) и бывает гнилостным, травянистым, рыбным, болотным; зависит от растворенных газов (сероводорода, метана, хлора, аммиака и других) и бывает сероводородным, хлорным, аммиачным и иным; обусловливается органическими веществами (фенолом, нефтепродуктами) и бывает фенольным, нефтяным. Насыщенность запаха измеряется по пятибалльной шкале. Вода, интенсивность запаха которой составляет 3-5 баллов, непригодна для питья!
Вкус и привкус вызываются растворенными в воде неорганическими и органическими веществами. Например, большое количество растворенных солей делает воду соленой, присутствие железа придает воде металлический привкус, повышенное содержание углекислого газа (углекислоты) и органических кислот (щавелевой, яблочной, муравьиной и других)- кисловатый привкус, сульфат кальция- вяжущий вкус. Свежесть воде придает растворенный кислород. Измеряется вкус в баллах. Качественная вода должна иметь привкус не более 2 баллов.
Цвет (или цветность) воды зависит от содержащихся примесей (большого количества железа, гумусовых веществ), поверхностного цветения в водоемах и прочего. Чистая вода бесцветна, но иногда имеет легкий голубоватый или изумрудный оттенок. При повышенном содержании различных органических веществ вода приобретает желто-коричневую окраску. Примеси минеральных веществ также изменяют цветность воды в зависимости от преобладания того или иного химического элемента.
Мутность воды обусловлена присутствием большого количества взвешенных частиц. Измеряется мутность в миллиграмах на литр (мг/л) при сравнении исследуемой воды с образцом дистилированной воды при одинаковом освещении и при помощи специальных приборов (мутномера, фотокалориметр и других). Подземные воды практически не имеют мутности. В поверхностных водах мутность представлена большим количеством нерастворенных химических соединений и взвешенных веществ и изменяется в зависимости от скорости течения воды, состава почвы, сезоны. Так, наибольшую мутность имеет паводковые воды.
Температура воды в источниках на поверхности Земли постоянно изменяется и зависит от многочисленных факторов- меняющейся температуры и влажности окружающего воздуха, скорости течения воды, наличия родниковых вод и других. У воды подземных источников температура постоянная (2-6 градусов Цельсия). Для питья используется вода, имеющая температуру 10-12 градусов Цельсия.
Минерализация (плотный сухой остаток)- количество растворенных в воде солей (измеряется в мг/л). Наиболее полезной для эдоровья человека степенью минерализации воды считается 200-400 мг/л. Подземные воды имеют более высокую степень минерализации, чем поверхностные воды. При высокой минерализации у воды появляется солоноватый или горьковатый привкус.
Микробиологические показатели воды
В воде содержится большое количество различных микроорганизмов, которые подразделяются на две большие группы: патогенные (болезнетворные) и непатогенные (сапрофитные). Вода, используемая для питья, подвергается строгому санитарно-бактериологическому контролю.
В чистой питьевой воде не должны содержаться болезнетворные микроорганизмы. Через воду могут передаваться различные опасные инфекционные заболевания, поэтому вопрос бактериологической очистки воды имеет огромное значение для сохранения здоровья населения.
За индикатор бактериальной загрязненности воды принято количество кишечных палочек в единице воды.
Колииндекс- количество кишечных палочек в 1 литре воды (предельно допустимая норма- 3 кишечные палочки в 1 литре воды).
Колитест- количество воды, содержащей одну кишечную палочку.
Этот индикатор выбран вовсе не случайно, так как кишечная палочка, в отличии от других микроорганизмов, обладает достаточной устойчивостью во внешней среде (медленно погибает), присутствует в испражнениях человека и животных (может свидетельствовать о загрязнении воды бытовыми и сельскохозяйственными стоками), определяется простыми лабораторными методами.
Химические свойства воды
Химические свойства воды зависят от многих показателей и обусловлены ее свойством растворять различные вещества (она является универсальным растворителем), тем самым изменяя состав воды.
Растворимость веществ в воде объясняется прежде всего тем, что в воде разноименные электрические заряды намного слабее притягиваются друг к другу чем в воздухе. При нагревании воды скорость растворения увеличивается. Вода как расворитель не изменяет растворенных веществ, т.е. является инертным растворителем, что имеет огромное значение для процессов жизнедеятельности, которые происходят с участием воды. Все необходимые питательные вещества доносятся водой в устойчивом виде.
pH или активная реакция среды показывает количественное содержание ионов водорода (pH), определяющее реакцию, которая бывает нейтральной (pH=7), кислой (pH 7).
Это очень важный показатель, который используется для определения различных свойств жидкости. Изменения pH воды меняют ее качества. Например, pH меньше 7 определяет реакцию воды как кислую, такая вода будет иметь кисловатый привкус; pH больше 10- реакция сильно щелочная, при которой вода становится особо мылкой, раздражает кожу и слизистые оболочки.
В жидкостях организма поддерживается постоянный уровень pH, необходимый для нормальной жизнедеятельности (так, pH крови- 7,2-7,4; желудочного сока- 1,2-1,5 и т.п.).
Окисляемость определяется по наличию растворенных органических веществ в воде и служит индикатором загрязненности. Показатель окисляемости чистой воды составляет 2-3 мг/л.
Жесткость воды является одним из показателей ее качества. Она определяется по количеству содержащихся в ней солей кальция, магния (карбонатов, сульфатов и т.п.) и выражается в миллиграмм-эквиваленте на литр. Жесткость воды может быть постоянной и непостоянной. Постоянная жесткость обусловлена присутствием некарбонатных солей, растворимых в воде. Такая жесткость не устраняется при кипячении. Непостоянная (временная) или карбонатная отличается присутствием большого количества растворимых солей (карбонатов), которые становятся нерастворимыми при кипячении и выпадают в осадок (образуя накипь).
Наибольшей мягкостью отличаются воды поверхностных источников воды, дождевая и талая воды. В подземных источниках жесткость воды зависит от глубины и места залегания, но в большинстве случаев она более высокая.
Вязкость у воды незначительная, что обеспечивает ее текучесть и способность транспортировать различные вещества. При нагревании воды вязкость уменьшается. Соленая вода обладает большей вязкостью по сравнению с пресной.
Изменять свойства воды можно различными способами- отстаиванием, замораживанием и размораживанием, кипячением, намагничиванием, добавлением различных химических веществ (минерализацией) и другими.
 Самое читаемое
Самое читаемое