Киста яичника после установки мирены что делать
В помощь практикующему врачу Мирена как эффективный и приемлемый метод контрацепции: анализ побочных реакций при применении
Опубликовано в журнале:
«ГИНЕКОЛОГИЯ», ТОМ 11, №1, с. 32-35
К третьему поколению внутриматочных контрацептивов относятся гормонсодержащие внутриматочные системы (ВМС), из которых наибольший клинический интерес представляет левоноргестрелсодержащая внутриматочная рилизинг-система «Мирена» (ЛНГ-ВМС), сочетающая в себе свойства гормональной и внутриматочной контрацепции.
Левоноргестрел (ЛНГ) – синтетический гестаген из группы 19-норстеро-идов, прочно и избирательно связывается с рецепторами прогестерона, обладает сильным антиэстрогенным и антигонадотропным эффектами и слабыми андрогенными свойствами. Гестагены подавляют митотическую активность эндометрия, вызывая раннюю секреторную трансформацию, а при длительном использовании – гипотрофию и атрофию слизистой оболочки тела матки, что, в свою очередь, препятствует имплантации оплодотворенной яйцеклетки. Помимо этого, гестагены сгущают цервикальную слизь, уменьшают объем крипт и, тем самым, препятствуют проникновению сперматозоидов и некоторых микроорганизмов в полость матки.
Ряд исследований был проведен с целью решения вопроса – отмечается ли торможение процессов овуляции при применении «Мирены»? Большинство исследователей едины во мнении, что в процессе контрацепции овуляторная функция яичников не подавляется. По мнению M.Coleman, на протяжении 1-го года до 78,5% менструальных циклов бывают овуляторными, и лишь в небольшом проценте случаев отмечается торможение процессов овуляции с последующим развитием НЛФ. Для подавления овуляции концентрация ЛНГ в периферической крови должна быть не менее 50 мкг/сут, а на фоне ЛНГ-ВМС суточная доза гормона в периферическом кровотоке составляет 20 мкг/сут. Согласно исследованиям T.Luukkainen, в течение 1-го года контрацепции «Миреной» имеют место несколько вариантов реакции яичников:
1) ановуляция со снижением продукции эстрадиола;
2) ановуляция с повышением продукции эстрадиола;
3) овуляторный цикл с НЛФ;
4) двухфазный овуляторный цикл.
Согласно результатам многочисленных многоцентровых исследований индекс Перля в процессе контрацепции «Миреной» равен 0,1–0,2. Например, итоги крупного эпидемиологического исследования, проведенного в Финляндии, включившего 17 360 женщин, применявших «Мирену» в течении 5 лет, подтвердили высокую контрацептивную эффективность рилизинг-системы с индексом Перля 0,18. Учитывая столь высокую контрацептивную эффективность ЛНГ-ВМС, некоторые исследователи приравнивают ее к хирургической стерилизации.
Основной механизм действия «Мирены» реализуется на уровне эндометрия, в котором создается высокая концентрация ЛНГ. Медленное высвобождение гормона из резервуара приводит к истончению слизистой оболочки матки, атрофии эндометриальных желез и, как следствие – к снижению функциональной активности эндометрия. Всеми авторами подчеркивается характерный морфологический признак – децидуализация клеток стромы эндометрия на фоне атрофии железистого компонента.
Результатом локального действия ЛНГ является полное прекращение циклических изменений в эндометрии, характеризующееся отсутствием менструаций у 20–25% женщин через 12 мес контрацепции, а, по данным некоторых исследователей, – до 50% женщин. Использование термина «аменорея» для оценки отсутствия менструаций на фоне ЛНГ-ВМС является неприемлемым, так как данное состояние не является заболеванием, ввиду отсутствия нарушения функции яичников или гипоталамо-гипофизарной системы, и полностью обратимо.
Возникновение скудных межменструальных кровянистых выделений является типичным при использование чистых гестагенов и отражает переходное состояние эндометрия от активного к атрофическому. По мнению I.Cameron, определенную роль в этом играет повышение проницаемости и ломкости сосудов эндометрия и изменения в спиральных артериях. P.Zhu и соавт. предполагают, что одной из причин нерегулярных кровянистых выделений на фоне применения «Мирены» может быть снижение активности VIII фактора свертывания крови в эндометрии по сравнению с исходным. Доказано, что антиэстрогенный и антимитотический эффекты ЛНГ-ВМС реализуются посредством влияния высоких доз ЛНГ на концентрацию эстрогеновых (ЭР) и прогестероновых рецепторов (ПР) в эндометрии. Матерал и методы исследования Обследованы 73 пациентки в возрасте от 27 до 48 лет, обратившиеся в центр для подбора метода контрацепции. На основании комплексного обследования с учетом данных анамнеза, репродуктивного поведения, ранее использованных методов контрацепции были отобраны 39 женщин, не имевших противопоказаний к назначению внутриматочной контрацепции с применением ЛНГ-ВМС и желающих ее использовать. Критериями исключения служили противопоказания к применению гормонсодержащих ВМС:
Всем пациенткам проведено обследование с применением общеклинических и специальных методов, включая расширенную кольпоскопию, цитологическое исследование мазков-отпечатков с шейки матки (до введения ВМС, через 6 и 12 мес). Эхографию органов малого таза осуществляли серией продольных и поперечных сечений аппаратами сложного сканирования «Aloka SSD 1200, 2000» и «Toshiba SSA-240» с использованием трансабдоминального и эндовагинального конвексных датчиков с частотой 3,5 м 5 МГц. Динамическое ультразвуковое исследование проводили до и через 7 дней после введения ВМС а также по истечении 6, 12 мес контрацепции.
Перед введением ВМС пациентки были проконсультированы в соответствии с существующими стандартами ВОЗ о преимуществах и недостатках указанных методов контрацепции, возможных побочных реакциях и осложнениях, о предполагаемых методах обследования в ходе исследования. Все пациентки заполняли анкету с информированным согласием.
Результаты исследования
По причине большего диаметра проводника затруднения при введении контрацептива отмечались у 8 (20,5%) пациенток, что потребовало дополнительного расширения цервикального канала расширителями Гегара под местной анестезией 9% раствором лидокаина.
В процессе исследования особое внимание уделялось характеру менструального цикла, а также частоте развития побочных реакций и осложнений. У всех 39 (100%) обследуемых очередная после введения ВМС менструация наступила в срок, однако у 12 (30,8%) пациенток отмечались скудные межменструальные кровянистые выделения на протяжении 1-го месяца контрацепции. У всех пациенток характер менструации не претерпел существенных изменений по сравнению с исходным: обильное менструальное кровотечение отмечено у 18 (46,2%) женщин, умеренное – у 21 (53,8%) пациентки (p>0,05). Средняя продолжительность менстуального кровотечения составила 5,6±0,4 дня (рис. 1).
Рис. 1. Характер менструального цикла на фоне применения ЛНГ-ВМС «Мирена».
К 6-му месяцу контрацепции у 30 (76,9%) пациенток на фоне регулярного менструального цикла отмечались скудные межменструальные кровянистые выделения, у 2 (5,1%) развилась аменорея, у 7 (18,0%) наблюдались непрерывные скудные мажущие кровянистые выделения. Большинство пациенток – 29 (74,4%) – отмечали скудные менструации, и лишь у 8 (20,5%) женщин менструальное кровотечение было умеренным. Средняя продолжительность менструального кровотечения к 6-му месяцу контрацепции составила 3,2±0,6 дня.
К концу 1-го года контрацепции у 12 (30,8%) женщин развилась аменорея (pРис. 2. Динамика средней продолжительности менструального кровотечения на фоне применения ЛНГ-ВМС «Мирена».
Ультразвуковое исследование (УЗИ) органов малого таза проводили всем пациенткам через 1, 6 и 12 мес контрацепции. В ходе исследования обращали внимание на правильность расположения контрацептива в полости матки, толщину эндометрия, структуру миометрия и миоматозных узлов, состояние яичников.
При УЗИ «Мирена» определялась в виде двух линейных, перпендикулярно расположенных гиперэхогенных структур. Ножка контрацептива на продольных сканограммах визуализировалась в виде 4 параллельно расположенных тонких гиперэхогенных структур, что было обусловленно отражением ультразвуковых волн от стенок гормонсодержащего резервуара.
Средние размеры матки оставались относительно стабильными на протяжении 12 мес контрацепции и составили: продольный размер – 5,1±0,2 см, поперечный размер – 4,2±0,4 см, переднезадний – 5,1±0,3 см. Средняя толщина эндометрия перед введением ЛНГ-ВМС составила 0,57±0,05 см, а к 12-му мес контрацепции отмечено достоверное уменьшение толщины эндометрия до 0,35±0,05 см (pРис. 3. Динамика толщины эндометрия на фоне применения «Мирены» (данные УЗИ).
На протяжение первых 6 мес контрацепции у 9 (23%) пациенток были диагностированы функциональные кисты яичников (pОбсуждение
Результаты проведенного исследования подтвердили высокую контрацептивную эффективность ЛНГ-ВМС «Мирена»: случаев наступления беременности во время исследования не зарегистрировано. Это согласуется с раннее полученными данными отечественных и зарубежных специалистов установивших, что индекс Перля для ЛНГ-ВМС «Мирена» равен 0,1–0,2, что, по мнению ряда авторов, приравнивает ее по эффективности к хирургической стерилизации.
Результаты исследования согласуются с данными литературы о том, что на фоне ЛНГ-ВМС «Мирена» в течение первых 6-9 мес контрацепции наблюдаются скудные межменструальные кровянистые выделения, с последующим развитием аменореи у каждой третьей пациентки (30,8%). Изменения менструального цикла являются следствием локального действия ЛНГ на эндометрий и временного прекращения в нем циклических процессов, характеризуются снижением его функциональной активности и толщины М-эхо, по данным УЗИ. Ввиду высокой приемлемости, эффективности, отсутствия осложнений, а также в связи с антипролиферативным действием на эндометрий весьма перспективно применение ЛНГ-ВМС у женщин позднего репродуктивного возраста.
Проведенный нами детальный ретроспективный анализ показал, что пациентки, у которых, по данным УЗИ, выявлены функциональные кисты яичников, были раннего репродуктивного возраста, и, по данным анамнеза, у 7,7% из них, раннее были диагностированы функциональные кисты яичников.
В литературе имеются сообщения о случаях формирования функциональных кист яичников при длительном приеме гестагенных препаратов. Так на фоне «Норпланта» они наблюдаются практически у 10% женщин. Некоторые исследователи наблюдали функциональные кисты яичников на фоне ЛНГ-ВМС, которые, как правило, являлись диагностической находкой, так как никаких жалоб пациентки не предъявляли; кисты имели небольшие размеры и подвергались самостоятельному регрессу в течение нескольких месяцев.
По нашему мнению, формирование функциональных кист яичников обусловлено стимулирующим влиянием микродоз ЛНГ и связано с индивидуальной чувствительностью репродуктивной системы женщины, и, в первую очередь, яичников, к гормональным воздействиям. По-видимому, молодой возраст и наличие функциональных кист яичников в анамнезе являются предрасполагающими факторами их развития.
Возникает вопрос о тактике ведения пациенток с функциональными кистами, возникшими на фоне применения «Мирены». По нашему мнению, с целью своевременной диагностики функциональных кист яичников в процессе контрацепции показано динамическое УЗИ органов малого таза каждые 6 мес. В случае их обнаружения показано наблюдение в течение 3 6 мес, и при отсутствии положи тельной динамики–удаление ВМС.
Полученные нами результаты позволяют говорить о ЛНГ-ВМС «Мирена» как об эффективном и приемлемом методе контрацепции. Однако не следует забывать о необходимости полного клинико-лабораторного обследования пациентки для исключения противопоказаний к внутриматочной контрацепции согласно критериям ВОЗ. Должны учитываться возраст пациентки, перенесенные или имеющиеся на данный момент соматические заболевания, возраст менархе, характер становления менструальной функции и характер менструального цикла. При анализе данных репродуктивного анамнеза необходимо учитывать количество беременностей, их течение и исходы, число родов. Немаловажное значение следует уделять раннее использованным методам контрацепции, их эффективности, наличию побочных реакций и осложнений в процессе их применения.
ЛИТЕРАТУРА
1. Coleman M. Levonorgestrel-releasing IUD – more than only a contraceptive method. Aust NZ Obstet Gynaecol 1997; 37 (2).
2. Critchley HO, Wang H, Kelly RW et al. Progestin receptor isoforms and prostaglandin dehydroge-nase in the endometrium of the women using a lev-onorgestre-releasing intrauterine system. Human Reprod 1998; 13 (5): 1210–7.
3. Critchley HOD, Wang H, Jones R et al. Morphological and functional features of endometrial decidu-alisation following long-term intrauterine lev-onorgestrel delivery. Hum Reprod 1998; 13 (5): 1218–24.
4. Gerber B, Reimer T, Krause A et al. Lev-onorgestrel-releasing intrauterine devices. Lancet 2001; 10: 357.
5. Goran Rybo, Kerstin Andersson, Viveca Odlind. Hormonal intrauterine devices. Ann Med 1993; 25: 143–7.
6. Kunz J. Levonorgestrel releasing intrauterine spiral-contraception – therapeutic indications. Schweiz Rundsch Med Prax 2001; 90: 442–52.
7. Lu SM. Effect of levonorgestrel intrauterine device on human endometrial estrogen and progesterone receptors. Chung-Hua-Fu-Chan-Ko-Tsa-Chin 1991; 26 (5): 293–4.
8. Luukkainen T, Pakarinen P, Toivonen J. Prog-estin-releasing intrauterine systems. Semin Reprod Med 2001; 19 (4): 355–64.
9. Mirena. Product monograph. Shering AG. 2002.
10. Oliveira da Silva M, Costa M. Reasons, myths and fantasies: preliminary data and reflections about the Portuguese experience with LNG-IUS-induced hypomenorrhea. The Europ J Contracep Reprod Health Care 1999; 4: 21.
11. Ronnerdag M. Health effects of long-term use of the LNG-IUS. Abstracts book. Mirena – effective contraception with health benefits. 2001; 10–1.
12. Ronnerdag M, Odlind V. Health effect of long-term use of the intrauterine levonorgestrel-releas-ing system. A follow-up study over 12 years of continuous use. Acta Obstet Gynecol Scand 1999; 78 (8): 716–21.
13. Rutanen EM. Endometrial response to intrauter-ine release of levonorgestrel. Gynecol Forum 1998; 3 (3): 11–4.
14. Rutanen EM. Insulin-like growth factors and insulin-like growth factor binding proteins in the endometrium. Effect of the intrauter-inelevonorgestrel-delivery. Hum Reprod 2001; 15 (3): 173–81.
15. Sturridge F, Guillebaud J. A risk-benefit assessment of the levonorgestrel-releasing intrauterine system. Drug Safety 1996; 15 (6): 430–40.
16. Wildemeersch D, Schacht E, Thiery M et al. Intrauterine contraception in the year 2001: can intrauterine devices use be revived with new improved contraceptive technology? The Eur J Con-tacep Reprod Health Care 2000; 5: 295–304.
17. Zhou J, Dsupin BA, Gindice LC et al. Insulin-like growth factor (IGF) IGF binding protein and IGF receptor gene expression in human endometrium. J Con Endocrinol Metab 1994; 79: 1723–34.
Киста яичника после установки мирены что делать
Янишевская И.В., Янишевский А.А.
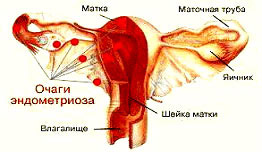
По данным разных авторов, эндометриоз встречается у 6-44% женщин репродуктивного возраста. Более того, эндометриоз обнаруживают в 30-40% случаев бесплодия у женщин.
В настоящее время причину возникновения эндометриоза объясняют генетической предрасположенностью, теорией гормонального развития заболевания, согласно которой происхождение эндометриоза связано с нарушением в организме женщины содержания и соотношения гормонов. Это подтверждают определенные изменения в очагах эндометриоза на протяжении менструального цикла и обратный ход развития заболевания во время беременности и в постменопаузе. Имплантационная теория предполагает, что отторгнутые частицы эндометрия оседают на яичниках, трубах, брюшине и дают начало развитию недуга. Однако наиболее важными представляются негативные сдвиги в нейроэндокринной системе вследствие стрессов, неправильного питания, общих соматических заболеваний, нарушений функций желез внутренней секреции, инфицирования половых органов.
В зависимости от локализации процесса различают генитальный и экстрагенитальный (расположенный вне половых органов) эндометриоз. Генитальный в свою очередь делят на внутренний (поражение тела матки) и наружный (поражение шейки матки, влагалища, яичников, маточных труб, тазовой брюшины и др.). Как правило, эндометриоз имеет вид отдельных или сливающихся с другими тканями мелких очагов (узлов, гнезд) округлой, овальной и неправильной формы, полости которых содержат темную густую жидкость. Эндометриоидные образования могут состоять из множества мелких кистозных полостей (ячеистое строение) или приобретать характер кисты (например, эндометриоидная киста яичника).
Клинические проявления эндометриоза – дисменоррея, боль во время полового сношения, боль в области малого таза или живота в период менструации. Одно из наиболее частых осложнений эндометриоза – бесплодие. В последние десятилетия также значительно возросло число злокачественных новообразований, развитию которых предшествовало появление эндометриоза. Итак:
Определение стадии эндометриоза основано на локализации, количестве, глубине и размере эндометриоидных разрастаний. Специфические критерии включают в себя:
Стадия эндометриоза не всегда коррелирует со степенью болевого синдрома, риском бесплодия или наличием другой симптоматики.
Нередко эндометриозу сопутствуют другие заболевания половых органов: миома, воспаление, анемия
При постановке диагноза учитывают данные клинического анализа, а также применяют специальные методы обследования, такие, как гинекологический осмотр, УЗИ, гистероскопию, гистеросальпингографию, лапароскопию, а также исследование крови на специальные опухолевые маркеры (онкомаркеры).
Следует помнить, что при любых внутриматочных вмешательствах, в первую очередь при хирургических абортах, увеличивается риск возникновения данного заболевания. Поэтому после прерывания беременности хирургическим путем настоятельно рекомендуется проведение комплекса реабилитационных мероприятий, регулярное наблюдение у гинеколога-эндокринолога с целью своевременной профилактики и лечения эндометриоза и связанных с ним осложнений, особенно бесплодия.
Лечение эндометриоза В официальной медицине для лечения эндометриоза применяются медикаментозные и хирургические методы. Для медикаментозного лечения используются гормональные препараты. Курсы лечения, как правило, бывают длительными и малоэффективными, а рецидивы заболевания частыми. В некоторых случаях проводится хирургическое лечение эндометриоза. Хирургическому удалению в обязательном порядке подлежат эндометриоидные кисты яичников. В настоящее время стандартным способом хирургического лечения эндометриоза является лапароскопия.
До недавнего времени женщинам, страдающим эндометриозом пытались помочь средствами, содержащими половые гормоны. Такие препараты действительно хорошо «работают» при многих гинекологических заболеваниях, но, как показала практика, подчас малоэффективны при эндометриозе. Позже был открыт новый класс гормональных препаратов, которые подавляют регуляцию половой системы на уровне головного мозга, в результате чего наступает искусственная менопауза, циклические процессы в яичниках выключаются и эндометрий перестает расти. Его очаги, лишившись гормональной стимуляции, постепенно атрофируются. Прекращение лечения означает и возобновление менструального цикла. Но широкое применение этого метода тормозится высокой стоимостью препаратов.
Разработанное нами направления консервативной терапии эндометриоза включают применение внутриматочной системы «Мирена».
Мы наблюдали 22 женщины, среди которых были 12 больных, страдающих генитальным эндометриозом – аденомиозом, позадишеечными формами эндометриоза, наружным генитальным эндометриозом, 10 больных – с сочетанными формами эндометриоза и миомы матки; у двух пациенток имелись кистозные образования яичников. Ранее пациентки получали различное лечение, включающее гормонотерапию, курсы иммуномодуляторов, антиоксидантную терапию. Однако эффект от полученного лечения не был длительным, сроки ремиссии ограничивались 2-3 месяцами после окончания приема препаратов, причём улучшение касалось в основном клинической симптоматики (некоторое уменьшение болевого синдрома, незначительное улучшение общего состояния). В связи с кратковременным и недостаточно выраженным эффектом от предыдущей медикаментозной терапии мы использовали для лечения внутриматочную систему «Мирена».
До лечения болевой синдром в 9 баллов наблюдался у всех 22 человек, страдающих генитальным эндометриозом и сочетанными формами эндометриоза и миомы матки. Дисменорея оценивалась 3 баллами у всех больных генитальным эндометриозом и сочетанными формами эндометриоза и миомы матки.
При бимануальном исследовании и УЗИ гениталий у всех пациенток в той или иной степени определялась неоднородность консистенции миометрия, перемежающиеся участки уплотнений и тестоватости в толще матки, увеличение размеров матки. В области перешейка отмечалась умеренно выраженная пастозность, резкая болезненность. При УЗИ гениталий у всех наблюдаемых 12 больных генитальным эндометриозом выявлены признаки аденомиоза матки 3 и 4 степени. У пациенток с сочетанными формами эндометриоза и миомы матки определялись на фоне неоднородной мозаичной структуры интерстициальные, субсерозные и субмукозные (у 5 больных) узлы диаметром от 22 до 33 мм, дающие акустическую дорожку. Размеры матки во всех наблюдениях были увеличены до 8-9 недель.
Через 6 месяцев после введения ВМС «Мирена» были повторно обследованы все больные. При бимануальном исследовании у пациенток, страдающих эндометриозом, значительно уменьшились размеры матки, консистенция миометрия чаще была однородной или с небольшими участками уплотнений. При наличии миомы матки с узлами различных размеров наблюдалось уменьшение узлов и тела матки. При генитальном эндометриозе все благоприятные сдвиги были выражены ещё значительнее. У всех наблюдаемых больных эндометриозом УЗИ гениталий выявило уменьшение размеров матки и очагов генитального эндометриоза, у пациенток с сочетанными формами эндометриоза и миомы матки определялось уменьшение размеров интерстициальных, субсерозных и субмукозных узлов диаметром от 16 до 26 мм. Размеры матки во всех наблюдениях уменьшились до 5-6 недель.
У 7-ми пациенток наблюдалась нормализация размеров матки, у этих же пациенток при УЗИ подтверждено полное исчезновение миоматозных узлов. У 2-х пациенток, имевших кистозные образования яичников, мы наблюдали их полное исчезновение.
Болевой синдром у 22 человек, страдающих генитальным эндометриозом и сочетанными формами эндометриоза и миомы матки, снизился до 5-7 баллов.
Ни в одном из случаев мы не наблюдали клинического ухудшения. Больные отмечали уменьшение отеков, исчезновение болевых ощущений в области эстрогензависимых органов, общее улучшение самочувствия, повышение настроения.
Таким образом лечение эндометриоза и его сочетанных форм с миомой матки ВМС «Мирена» приводит к регрессии или полному исчезновению очагов эндометриоза, миоматозных узлов и кистозных образований яичников.
Литература
У трудных задач есть достаточно простые решения. Долговременный высокоэффективный обратимый контрацептив с лечебными свойствами
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Традиционно наиболее распространенным методом контрацепции в России является использование внутриматочных средств. Мирена®, которая объединила преимущества гормональной контроцепции с удобством внутриматочного пути введения, приобрела высокую популярность вр всем мире. За последние 10 лет более 50 тыс. россиянок используют внутриматочную гормональную релизинг–систему Мирена®, в качестве высокоэффективного средства контрацепции [В.Н. Прилепская, 2007].
Мирена® представляет собой полиэтиленовую Т–образную систему, содержащую контейнер, в котором находится левоноргестрел [Hurskainen and Paavonen, 2004]. Этот контейнер покрыт специальной мембраной, обеспечивающей непрерывное контролируемое высвобождение 20 мкг левоноргестрела в сутки. Система вводится в полость матки сроком на 5 лет.
Контрацептивная надежность Мирены® намного выше, чем у других внутриматочных контрацептивов, и сопоставима со стерилизацией (Индекс Перля составляет 0,02). Масштабные клинические исследования показали также, что частота развития внематочной беременности при использовании Мирены® крайне мала и составляет 1 случай на 5000 женщин, что ниже, чем в общей популяции женщин. То есть Мирена® снижает риск развития внематочной беременности [Khawaja, Walsh et al., 2004; Radesic and Sharma, 2004]. При этом использование Мирены® не только не повышает риск развития инфекционных осложнений, но, напротив, снижает частоту возникновения или обострения воспалительных заболеваний органов малого таза [Khawaja, Walsh et al., 2004].
Контрацептивные свойства Мирены® обусловлены рядом механизмов. Левоноргестрел, поступающий непосредственно в полость матки, воздействует на эндометрий, предотвращая пролиферативные изменения в нем и снижая тем самым его имплантационную функцию, а также увеличивает вязкость слизи цервикального канала, что препятствует проникновению сперматозоидов в полость матки. Еще одним механизмом действия Мирены® является способность этой системы вызывать избыточную продукцию гликоделинаА в эндометрии [French, Cowan et al., 2000]. Этот гликопротеин проявляет локальную контрацептивную активность, препятствуя присоединению сперматозоида к яйцеклетке. В норме в периовуляторный период его экспрессия в эндометрии не наблюдается, в то время как в эндометрии женщин, использующих Мирену®, экспрессия гликоделина А повышена на протяжении всего менструального цикла. Левоноргестрел, высвобождаемый Миреной®, приводит также к снижению количества рецепторов эстрогенов и прогестерона, снижает активность инсулиноподобного фактора роста, являющегося одним из основных индукторов пролиферации и дифференцировки клеток эндометрия. Все это приводит к локальным изменениям в аутокринно/паракринных системах регуляции функциональной активности эндометрия, обеспечивающих надежный контрацептивный эффект. Все эти изменения носят обратимый характер.
В течение первых трех месяцев после введения Мирены® эндометрий трансформируется в тонкий, неактивный эпителий, сходный с таковым во время лактационной аменореи, но отличающийся наличием выраженной децидуальной реакции стромы [Rachev, 2001]. Толщина эндометрия за три месяца уменьшается с 11мм до 4,5 мм и остается на этом уровне до конца срока действия Мирены®. Супрессия эндометрия проявляется в уменьшении объема менструаций в среднем на 75%. Как правило, во время первого года использования Мирены® у всех женщин исчезают симптомы дисменореи.
Левоноргестрел может оказывать также незначительное системное воздействие, что иногда проявляется угнетением овуляции в некотором числе циклов.
С целью предотвращения развития осложнений, как и при применении других видов контрацепции, женщины, желающие использовать Мирену®, должны быть тщательно обследованы. Следует исключить беременность, злокачественные заболевания половых органов и молочных желез, иммунодефицитные состояния, аномалии развития половых органов и в обязательном порядке – наличие острых и хронических воспалительных заболеваний гениталий. Важно также установить количество половых партнеров, поскольку женщины или их партнеры, склонные к полигамии, имеют большой риск развития инфекционных осложнений при любой внутриматочной контрацепции.
Вводить Мирену® рекомендуется с 4 по 6–й день менструального цикла. Лактирующим женщинам Мирену® можно вводить через 6–8 недель после родов. Суточная концентрация левоноргестрела в 600 мл грудного молока при этом составляет около 0,1% от суточной дозы, выделяющейся в матке. Как показали исследования, такая концентрация левоноргестрела не оказывает отрицательного влияния на ребенка [French, Cowan et al., 2000].
Введение Мирены® требует определенного навыка, поскольку методика ее введения отличается от таковой при использовании обычных спиралей. Правильное установление Мирены® в дне матки является залогом равномерного воздействия высвобождающегося левоноргестрела на всю площадь эндометрия. В случае необходимости перед введением Мирены® производят парацервикальную блокаду, однако она может быть с успехом заменена предварительным (за 12 часов до процедуры) назначением простагландинов.
Мирена® должна быть заключена в прилагающийся проводник, который вводится в цервикальный канал. Как только наконечник проводника миновал границу внутреннего зева, необходимо высвободить боковые плечики Мирены®. После этого выждать 15–30 секунд – именно столько времени необходимо для того, чтобы боковые плечики Мирены® начали расправляться, а затем медленно и нежно продвинуть Мирену® в дно матки. Раннее высвобождение плечиков Мирены® предотвращает возможность перфорации матки, а также обеспечивает правильное установление Мирены® в дне.
При адекватной установке Мирена® достаточно комфортно переносится женщинами, несмотря на то, что на протяжении 3–6 месяцев после ее введения могут наблюдаться мажущие кровянистые выделения. Это явление очевидным образом сопровождает прогрессивное уменьшение объема менструаций. Так, если в первом цикле после установки Мирены® мажущие кровянистые выделения наблюдаются в среднем в течение 12 дней, то уже к 6–му месяцу споттинг длится не более трех дней. Обычно мажущие кровянистые выделения не требуют никакого лечения.
Другим, в большей степени психологическим, побочным эффектом является развивающаяся у части женщин аменорея или олигоменорея. Социологические исследования установили, что определенная часть женщин не хотели бы, чтобы у них в большую или меньшую сторону изменялось количество менструаций в году. Другая часть женщин, наоборот, чувствовали бы себя комфортно при наличии 2–3 менструаций в год или вообще при их отсутствии. К примеру, если женщина страдает дисменореей и с ужасом ожидает очередной менструации, то их отсутствие или более редкая частота после введения Мирены® будет восприниматься как благо, а не как побочный эффект. Таким образом, изменение ритма менструаций, вплоть до их исчезновения, будет являться побочным эффектом только в зависимости от отношения к этому женщины.
К другим возможным побочным эффектам Мирены® относятся функциональные кисты яичников и явления, связанные с системным действием левоноргестрела [Diaz, Bahamondes et al., 2000; Rachev, 2001; Baldaszti, Wimmer–Puchinger et al., 2003]. Функциональные кисты яичников на фоне Мирены® развиваются в среднем в 12–30% случаев. Клинического значения эти кисты не имеют, поскольку обычно они исчезают самостоятельно в течение нескольких месяцев. Единственным симптомом функциональных кист может быть масталгия или мастодиния, обусловленная повышенной концентрацией эстрогенов в крови.
К возможным левоноргестрел–обусловленным побочным эффектам относят: акне, сальность кожи, изменение веса, тошноту, головные боли, изменения настроения и мастодинию. Частота развития этих побочных эффектов не превышает 3% [Baldaszti, Wimmer–Puchinger et al., 2003].
Мирена® обеспечивает контрацептивный эффект в течение 5 лет, хотя реальный контрацептивный ресурс Мирены® достигает 7 лет [Khawaja, Walsh et al., 2004]. После истечения срока систему удаляют. В том случае, если женщина хочет продолжить использование Мирены®, одновременно с удалением старой системы, можно ввести новую. Фертильность после удаления Мирены® у 50% восстанавливается через 6 месяцев и у 96% – через 12 месяцев [Khawaja, Walsh et al., 2004].
В качестве контрацептивного средства Мирена® наиболее приемлема для рожавших женщин, желающих иметь длительную, но обратимую надежную контрацепцию, но не желающих обременять себя постоянным приемом таблеток. Однако Мирена® нередко является идеальным методом контрацепции даже для нерожавших со сложными клиническими проблемами, когда имеются противопоказания к использованию комбинированных оральных контрацептивов [Мансур Д., 2007].
Использование Мирены® приводит к снижению объема и длительности менструаций и в ряде случаев – к олиго– и аменорее. Именно этот эффект стал основанием применения Мирены® у больных менометрорагией, в том числе ассоциированной с миомой матки и аденомиозом [Bahamondes, Ribeiro–Huguet et al., 2003; Baldaszti, Wimmer– Puchinger et al., 2003]. Известно, что менометрорагия является одним из основных показаний к оперативному вмешательству у больных миомой матки и аденомиозом. В результате серии исследований, включающих большое количество женщин с миомой матки и аденомиозом, сопровождающихся менометрорагией, было достоверно показано, что введение Мирены® приводит к нормализации менструальной функции, существенному снижению объема и длительности менструаций, в 20–25% случаев развивается аменорея, показатели гемоглобина приходят в норму [Rockett, 1998; Bahamondes, Ribeiro–Huguet et al., 2003]. На фоне применения Мирены® не происходит увеличения размеров миоматозных узлов, то есть наблюдается их стабилизация. В связи с тем, что согласно современным данным миома матки имеет потенциал малигнизации эквивалентный нормальному миометрию, нивелирование симптоматики на фоне применения Мирены®, приводящее к социальной адаптации женщин, в конечном итоге снимает вопрос об оперативном вмешательстве. Кроме того, введение Мирены® является эффективным средством для второго этапа комплексной консервативной терапии миомы матки, обеспечивающим профилактику рецидивов роста миоматозных узлов и нормальный объем и длительность менструаций. Это имеет важное значение, так как к концу XX века распространенность гистерэктомий достигла тревожных цифр, которые привлекли внимание служб злравоохранения и общества. Так, в США выполняется около 650тыс. гистерэктомий ежегодно, 85% случаев из которых можно было бы избежать. Мирена® при маточных кровотечениях в качестве постоянной терапии как альтернатива гистерэктомии показала высокую эффективность [Шоки О.А., 2007]. Таким образом, Мирена® является наиболее адекватной и эффективной альтернативой гистерэктомии, еще раз доказывая, что хирургический подход к терапии менометрорагии во многом является анахронизмом.
Мирена®, хорошо зарекомендовала себя и как компонент гормон–заместительной терапии [Xiao, Wu et al,. 2003; Zalel, Gamzu et al., 2003]. Использование Мирены® на фоне терапии эстрогенами приводит к более выраженному супрессивному эффекту на эндометрий, чем при применении прогестинов, вводимых per os. Через 12 месяцев после введения Мирены® в эндометрии наблюдается атрофия эпителия с развитием децидуальной реакции стромы, по своей выраженности превосходящая таковую на фоне перорального приема прогестинов.Использование Мирены® для гормон–заместительной терапии во многом является более удобным методом, поскольку ее можно комбинировать с самыми различными способами введения эстрогенов. Кроме того, Мирена® более эффективно противодействует неблагоприятным воздействиям эстрогенов на эндометрий.
Как отмечалось выше, использование Мирены® приводит к существенному облегчению болевого синдрома у женщин с дисменореей [Vercellini, Aimi et al., 1999], в особенности обусловленной эндометриозом. Помимо этого, как было показано в одном исследовании [Fedele, Bianchi et al., 2001], применение Мирены® у больных с ректовагинальным эндометриозом через 12 месяцев приводило к исчезновению дисменореи и диспареунии, а также, выраженному уменьшению в размерах эндометриоидных образований. Другими словами, Мирена® является эффективным средством терапии болевого синдрома, обусловленного эндометриозом, и способна приводить к регрессии эндометриоидных образований или, по крайней мере, оказывать на них стабилизирующий эффект.
Если ранее комбинация контрацептивного и терапевтического эффектов была присуща лишь оральным контрацептивам, то в настоящий момент создана первая внутриматочная рилизинг–система, обеспечивающая стабильную, эффективную контрацепцию и проявляющая лечебный эффект.
Наличие в Мирене® лишь прогестагенного компонента в значительной степени снижает число противопоказаний, позволяя широко использовать этот вид контрацепции у женщин, в особенности в старших возрастных группах и имеющих сопутствующие заболевания.
Мирена® не приводит к увеличению веса, что для женщины также имеет большое значение. В исследованиях, посвященных изучению чисто прогестагенных методов контрацепции, зарегистрировано снижение риска венозной тромбоэмболии, заболеваний вен и артерий. Для женщин с заболеваниями свертывающей системы крови (болезнь Виллебранда, носительницы гемофилии), часто страдающих меноррагиями, Мирена® является удачным терапевтическим средством, не вызывающим кровотечения во время введения и способным справиться с обильными менструациями при надежнейшем контрацептивном эффекте. Мирена® является безопасным выбором при сахарном диабете и низкой плотности костной ткани в связи с отсутствием метаболического влияния. Важно, что пациентки с муковисцидозом, рассеянным склерозом, эпилепсией и мигренью (в том числе офтальмологической) также могут использовать внутриматочную гормональную релизинг–систему. Недавние исследования отметили, что у женщин, использующих Мирену® более 5 лет, не увеличивается риск развития рака молочной железы [Мансур Д., 2007].
Таким образом, использование Мирены® решает целый ряд актуальных задач (необременительная эффективная контрацепция и терапия наиболее распространенных в гинекологической практике патологических состояний), в очередной раз подтверждая принцип, что и у трудных задач есть достаточно простые решения.
Литература
1. Прилепская В.Н. Мирена в России. Научные и практические аспекты. Сборник тезисов Mirena forum, Москва, 2007, с. 1.
2. Мансур Д. Контрацептивные преимущества внутриматочной системы Мирена. Сборник тезисов Mirena forum, Москва, 2007, с. 3.
3. Шоки О.А. Мирена: больше, чем контрацептив. Сборник тезисов Mirena forum, Москва, 2007, с. 6.
4. Hurskainen, R. and J. Paavonen (2004). «Levonorgestrel–releasing intrauterine system in the treatment of heavy menstrual bleeding.» Curr Opin Obstet Gynecol 16(6): 487–90.
5. Khawaja, N., T. Walsh, et al. (2004). «The Mirena Intrauterine System—reliable contraception for the 21st century.» Ir Med J 97(8): 229.
6. Radesic, B. and A. Sharma (2004). «Levonorgestrel–releasing intrauterine system for treating menstrual disorders: a patient satisfaction questionnaire.» Aust N Z J Obstet Gynaecol 44(3): 247–51.
7. French, R. S., F. M. Cowan, et al. (2000). «Levonorgestrel–releasing (20 microgram/day) intrauterine systems (Mirena) compared with other methods of reversible contraceptives.» Bjog 107(10): 1218–25.
8. Rachev, E. (2001). «[Mirena—the first intrauterine contraceptive therapeutic system].» Akush Ginekol (Sofiia) 40 Suppl 6: 3–6.
9. Diaz, J., L. Bahamondes, et al. (2000). «Acceptability and performance of the levonorgestrel–releasing intrauterine system (Mirena) in Campinas, Brazil.» Contraception 62(2): 59–61.
10. Baldaszti, E., B. Wimmer–Puchinger, et al. (2003). «Acceptability of the long–term contraceptive levonorgestrel–releasing intrauterine system (Mirena): a 3–year follow–up study.» Contraception 67(2): 87–91.
11. Bahamondes, L., P. Ribeiro–Huguet, et al. (2003). «Levonorgestrel–releasing intrauterine system (Mirena) as a therapy for endometrial hyperplasia and carcinoma.» Acta Obstet Gynecol Scand 82(6): 580–2.
12. Xiao, B., S. C. Wu, et al. (2003). «Therapeutic effects of the levonorgestrel–releasing intrauterine system in the treatment of idiopathic menorrhagia.» Fertil Steril 79(4): 963–9.
13. Zalel, Y., R. Gamzu, et al. (2003). «The progestative effect of the levonorgestrel–releasing intrauterine system—when does it manifest?» Contraception 67(6): 473–6.
14. Vercellini, P., G. Aimi, et al. (1999). «A levonorgestrel–releasing intrauterine system for the treatment of dysmenorrhea associated with endometriosis: a pilot study.» Fertil Steril 72(3): 505–8.
15. Fedele, L., P. Vercellini, et al. (1990). «Treatment with GnRH agonists before myomectomy and the risk of short–term myoma recurrence.» Br J Obstet Gynaecol 97(5): 393–6.


