Радикальная операция что это такое
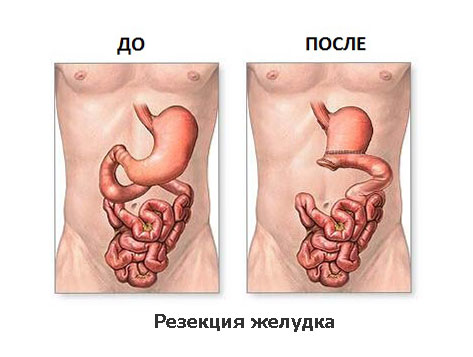
Операция резекции и гастрэктомии
29 января 1881 года Теодор Бильрот провел первую успешную операцию резекции желудка при локализации рака в его выходном отделе. Последующая и также успешная операция резекции была проведена через несколько месяцев ассистентом Бильрота. Успех заключался и в продолжительности жизни пациента, первого среди прооперированных по поводу рака желудка прожившего пять лет после операции.
Уважаемые пациенты! Обратите внимание на следующие материалы сайта:
Несмотря на то, что с момента выполнения первой успешной операции на желудке прошло более 130 лет и за прошедшее время медицина шагнула далеко вперед, основным методом лечения рака желудка остается операция. Никакие другие методы лечения не могут заменить хирургическое вмешательство.
Принципиально выделяют два вида радикальных операций по поводу рака желудка: субтотальная резекция желудка и гастрэктомия. Выбор объема операции зависит в первую очередь от локализации опухоли в желудке, уровня глубины проникновения опухоли в стенку желудка, а также её распространение на соседние органы и структуры.
Дистальная субтотальная резекция желудка
При распространении опухоли на соседние органы выполняется и их резекция. Операция завершается восстановлением непрерывности желудочно-кишечного тракта формированием анастомоза (соустья) между оставшейся частью желудка и тонкой кишкой.
Существует несколько десятков способов восстановления непрерывности желудочно-кишечного тракта, но наиболее часто применяемыми являются следующие: по Бильрот, Бальфуру, Ру, Райхелю—Полиа, Хофмейстеру—Финстереру, Мойнихену. Анастомозы формируются с помощью ручного шва, либо с помощью различных сшивающих аппаратов.
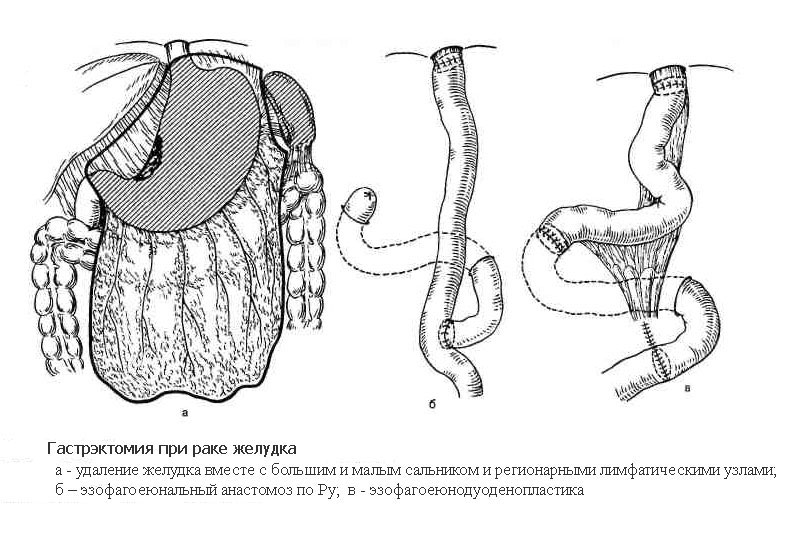
Гастрэктомия
Гастрэктомия – операция, выполняемая при локализации раковой опухоли в средней и верхней трети тела и кардиальном отделе желудка, а также при расположении опухоли в месте перехода желудка в пищевод (кардиоэзофагеальный рак). Объем операции включает удаление всего желудка, также с обязательным выполнением лимфодиссекции. В отдельных случаях дополнительно удаляются селезенка вместе с телом и хвостом поджелудочной железы. При распространении опухоли на соседние органы выполняется и их резекция. Операция завершается формированием анастомоза напрямую между пищеводом и тонкой кишкой, также либо с помощью ручного шва, либо с помощью специальных сшивающих аппаратов.
Изложенные операции могут выполняться традиционным (открытым) методом и с помощью высокотехнологичных малотравматичных методов (лапароскопическим или роботическим).
Традиционный (открытый) метод применяется у пациентов с местнораспространенными опухолями желудка требующие расширенных и комбинированных операций с резекцией соседних органов и структур, а также у пациентов с высоким индексом массы тела (ИМТ>30).
У пациентов с начальной (I-II) стадией заболевания и с ИМТ
Гладышев Дмитрий Владимирович:
Коваленко Сергей Алексеевич:
Городская больница №40, г.Сестрорецк, ул.Борисова, д.9, хирургический корпус (№4), кабинет №19.
Часы приёма: понедельник, среда, пятница с 15.00 до 17.00. По направлению онкологов поликлиник.
Запись по телефону: 8-911-235-21-80.
Информационно-справочная служба: +7 (812) 437-40-75 и +7 (812) 437-31-11
Отдел платных услуг: +7 (812) 437-11-00 и +7 (911) 766-97-70
Информация по отборочной комиссии: +7 (812) 437-09-07
Отдел госпитализации: +7 (812) 437-03-68 и +7 (812) 434-32-13
Запись на МРТ, КТ, ПЭТ КТ : +7 (812) 437-35-13 и +7 (911) 171-06-04
Маммография: +7 (812) 200-16-88.
Вы можете выбрать удобную для Вас дату исследования соответственно с периодом менструального цикла.
Кроме того, Вы можете оставить свой вопрос в рубрике «Вопрос-ответ» и сотрудники отдела платных услуг обязательно свяжутся с Вами или ответят по указанному Вами адресу электронной почты.
Материалы конгрессов и конференций
VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ОРГАНОСОХРАНЯЮЩИЕ МЕТОДЫ ЛЕЧЕНИЯ БОЛЬНЫХ
ПЕРВИЧНЫМ РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ
(СОСТОЯНИЕ И ПЕРСПЕКТИВЫ РАЗВИТИЯ)
В.П. Летягин ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Наиболее высокие уровни заболеваемости и темпы прироста показателей в 2000 г. отмечены в возрастных группах 60-64 и 75 лет и старше: 134,6 и 137,68 на 100 тыс. населения соответственно. Эти показатели увеличились в указанных возрастных группах по сравнению с 1991 г. в 1,5 и 1,95 раза соответственно.
В 2000 г. в России находилась под наблюдением 353201 больная РМЖ, из них 5 лет и более – 190030 женщин. Средний показатель 5-летней выживаемости при данной патологии в России равен 55%. Следует подчеркнуть «значительное постарение» РМЖ и относительно неплохие отдаленные результаты (1).
Различия в течении заболевания у разных пациентов обусловлены биологическими особенностями опухолей.
Определение прогноза любого онкологического заболевания, включая и РМЖ, предполагает по существу идентификацию маркеров, которые в той или иной степени связаны с перечисленными биологическими особенностями опухоли и позволяют прогнозировать развитие «естественной истории», подбирать оптимальную лечебную тактику и предсказывать ее эффективность.
Наиболее значимые прогностические параметры для больных РМЖ:
Практически выбор метода лечения определяется стадией опухолевого процесса, гистологической структурой опухоли (и степенью ее злокачественности), уровнем рецепторов стероидных гормонов (эстрогенов и прогестерона).
Наряду с традиционным особое место отводится иммуноморфологическому стадированию РМЖ.
В основе метода иммунодиагностики метастазов лежит специфика экспрессии ряда генов, присущая только эпителиальным клеткам. Экспрессия эпителиальных генов может быть установлена также на уровне мРНК методом обратной транскрипции и полимеразной цепной реакции (ПЦР).
Чувствительность иммуноморфологических методик с использованием моноклональных антител (МКА) и чувствительность ПЦР примерно одинакова, но значительно превышает чувствительность морфологических методов (4).
Условием успешного оперативного лечения РМЖ является правильное установление стадии заболевания. При начальных стадиях процесса хирургический метод остается основным и наиболее эффективным. При применении же комплексной терапии операция остается важнейшим звеном при лечении РМЖ. В последние годы в связи с внедрением восстановительных операций требования к оперативному вмешательству еще более повысились. Операции должны проводиться с минимальной травматизацией тканей при соблюдении всех принципов радикализма.
Совершенствование методов лечения РМЖ ведет к уточнению показаний к различным видам оперативного вмешательства. Основным критерием является степень распространенности процесса и возможность сочетания хирургического метода с другими. В широкой онкологической практике можно выделить следующие варианты оперативных вмешательств.
В 1891 г. W. Halsted впервые опубликовал результаты предложенного им оперативного вмешательства. Почти одновременно с ним W. Меуег в 1894 г. представил свой опыт использования аналогичной операции. Так возникла и затем сложилась классическая операция по Halsted-Meyer, которая в течение длительного времени была основной в хирургическом лечении РМЖ.
В 1948 г. D. Patey и W. Dyson предложили свой вариант радикальной операции, который предусматривал сохранение большой грудной мышцы. При выполнении этого вмешательства в комбинации с облучением результаты лечения были такими же, как и при операции по Холстеду.
Следующим этапом в развитии щадящих методик операции было предложение J. Madden (1965) удалять лимфоузлы подмышечной межпекторальной области в едином блоке с молочной железой, сохранив обе грудные мышцы.
С 90-х гг. XX века впервые в отечественной практике в клинике опухолей молочных желез в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России выполняется модифицированный вариант радикальной мастэктомии с сохранением большой и малой грудных мышц:
Радикальная резекция молочной железы. Операция заключается в удалении сектора молочной железы в одном блоке с лимфатическими узлами надключично-подмышечно-подлопаточной зоны.
Проблема лучевой терапии при РМЖ чрезвычайно важна. Этот метод лечения, получивший широкое распространение, может применяться как самостоятельно, так и в сочетании с другими методиками. В ходе развития лучевой терапии постоянно менялись варианты и способы лучевого воздействия: от использования ортовольтовой рентгенотерапии до применения тормозного излучения и электронного пучка бетатронов и линейных ускорителей, от дополнительного к операции лечебного фактора до самостоятельного метода лечения и от строго локального метода рационального воздействия до опосредованного угнетения функции гипофиза с помощью протонного медицинского пучка.
Желание изучить непосредственные и отдаленные результаты лечения привело к идее сочетанного использования облучения и операции, т.е. комбинированного лечения.
Существует 3 метода комбинированного лечения:
Облучение в предоперационном периоде с последующим оперативным вмешательством. При операбельных опухолях (T1-2N0M0 И T1N1M0) используется методика предоперационного облучения крупными фракциями первичной опухоли и подключично-подмышечной зоны в течение 5 дней до СОД 20 Гр. Вызывая гибель малодифференцированных и анаплазированных клеточных популяций и подавляя дополнительные участки злокачественного роста, а также микрометастазы в лимфоузлах и лимфатических сосудах, данная методика является оправданной с онкологических позиций и не осложняет хирургического вмешательства, проводимого в ближайшие 1-3 дня после окончания облучения.
Операция с последующей лучевой терапией. Адъювантное облучение после сохраняющих операций является наиболее частым вариантом применения послеоперационной лучевой терапии. В зону лучевого воздействия включаются молочная железа и ложе опухоли. РОД равняется 2 Гр, подводится 5 раз в неделю до СОД 50 Гр при помощи гамма-установки «Рокус» или линейного ускорителя. При наличии метастазов в регионарных лимфоузлах в зону облучения включается подмышечная зона.
Регионарные зоны рекомендуется облучать в следующих случаях:
Регионарные зоны облучаются до СОД 45 Гр. Начинать послеоперационную лучевую терапию рекомендуется не ранее 2-й и не позднее 5-й недели от момента выполнения оперативного вмешательства.
Основной задачей послеоперационного облучения молочной железы после сохранной операции является снижение числа местных рецидивов.
Дистанционная гамма-терапия в качестве самостоятельного метода лечения применяется достаточно редко.
Показания к консервативной лучевой терапии:
В данных случаях облучение производится в 2 этапа до СОД на опухоль молочной железы 60-70 Гр и 50 Гр — на зоны регионарного метастазирования.
Лучевая терапия является одним из важнейших компонентов комбинированного и комплексного лечения местно-распространенного РМЖ.
За исключением преинвазивных форм РМЖ, программа лечения строится из двух компонентов: локального, к которому относятся хирургическая операция или лучевая терапия, и системного, осуществляемого с помощью химио- и гормонотерапии (2, 3).
С этой точки зрения все формы РМЖ можно разделить следующим образом:
Отличительной чертой лечебных методов для больных раком молочной железы является все более широкое использование органосохраняющих операций, особенно у больных ранними стадиями. Стадия 0.
Внутридольковая инфильтрирующая карцинома (LCIS). Возможны несколько вариантов:
Внутрипротоковая неинфильтративная карцинома (DCIS).
Также возможны несколько вариантов:
Местное лечение. На сегодняшний день существуют два варианта хирургического вмешательства:
Радикальная резекция невозможна при:
Лечение рака молочной железы Т1N0М0
При наличии неблагоприятных прогностических факторов у молодых менструирующих больных показано использование 6 курсов системной адъювантной химиотерапии (CAF). В менопаузальной группе при положительных стероидных рецепторах в опухоли возможно использование гормонотерапии 1-й линии (тамоксифен не менее 5 лет, а также фемары и других ингибиторов ароматазы). Гормонотерапия у молодых больных применяется после соответствующего воздействия на яичники (эндоскопическая или лучевая кастрация или использование золадекса)
Лечение больных Т2N0М0 (IIа стадия).
В ряде случаев, при опухолях размером >3 см возможно использование курса предоперационной лучевой терапии в режиме укрупненного фракционирования, либо нескольких (не менее 4) циклов неоадъювантной полихимиотерапии в целях возможного увеличения числа больных, которым может быть предложено органосохраняющее лечение.
Во всех остальных случаях тактика лечения сходна с таковой, применяемой при Т1N0М0 стадии первичного РМЖ.
Лечение больных Т1N1М0 (IIа стадия).
Лечение больных данной категории практически начинается с установления степени распространения опухолевого процесса по лимфатическим узлам на основании цитологических данных пунктата или при исследовании «сторожевого» лимфатического узла. Инициальным моментом комплексной терапии может быть крупно-фракционная лучевая терапия с последующим выполнением операции:
Лечение больных Т2N1М0 и Т3N0М0 (IIb стадия).
Лечебные мероприятия для данной категории больных, как и в предыдущих случаях, состоят из местного и общего воздействий.
В отличие от предыдущих стадий, рассчитывая на возможность выполнения органосохраняющего оперативного вмешательства, целесообразно проведение нескольких курсов неоадъювантной химиотерапии с антрациклинами (4 цикла) с последующей лучевой терапией или их комбинации вне зависимости от локализации первичной опухоли. Трепанобиопсия опухоли с целью получения материала для изучения рецепторов стероидных гормонов и некоторых других прогностических факторов производится до начала специфической терапии. Повторное изучение факторов прогноза в динамике проводится после выполнения оперативного вмешательства.
В ситуациях, когда первичная опухоль не превышает 3 см, лечение может быть начато с курса предоперационной лучевой терапии укрупненными фракциями или же с операционного этапа:
Адъювантная химиогормонотерапия проводится по тем же показаниям и в тех же режимах, что и при лечении предыдущих стадий болезни. Следует отметить, что весьма перспективным является адъювантное применение таксанов, особенно в комбинации с антрациклинами (ТАС).
Лечение больных местно-распространенным раком молочной железы III стадии.
Лечение местно-распространенного рака молочной железы складывается из 3 этапов:
Такая тактика, общепринятая в настоящее время, сложилась не сразу. Исходно местно-распространенный рак был идентифицирован как иноперабельный.
Поэтому начинать лечение местно-распространенного рака как системной болезни следует с проведения индукционной системной и регионарной химиотерапии, что позволяет увеличить число оперированных больных, уменьшить частоту возникновения местных и отдаленных рецидивов и тем самым улучшить результативность лечения в целом.
Наиболее часто применяемые схемы химиотерапии: АС, FACVP, CMFA, CMFAV, AVCF, VAM, VCAF, CAMP, CAP или таксаны в комплексе с антрациклинами (AT, TAC). Считается, что на этапе индукции больная должна получить не менее 4-6 циклов химиотерапии (2, 8).
Вопрос комбинации неоадъювантной химиотерапии и лучевой терапии рассматривается неоднозначно. По общему мнению, предоперационное химиолучевое лечение обеспечивает наибольшую продолжительность жизни при РМЖ III стадии, а оптимальным является многокомпонентный подход к лечению (химиолучевое лечение + операция + химиогормонотерапия).
Основным типом оперативного вмешательства при этой стадии болезни является радикальная мастэктомия с сохранением обеих грудных мышц с возможной первичной, а лучше отсроченной маммопластикой. Однако успехи неоадъювантного этапа делают возможным выполнение органосохранных вмешательств, таких как радикальная резекция.
Паллиативные хирургические вмешательства.
У больных с местно-распространенным иноперабельным или метастатическим процессом по витальным показаниям (кровотечение или абсцедирование распадающейся опухоли) могут выполняться паллиативные оперативные вмешательства. Паллиативная операция, выполняемая у больной, не имеющей отдаленных метастазов, или при перспективах подавления диссеминированной болезни, по возможности должна носить все признаки радикальной операции. Совершенно не исключено, что после проведения адъювантного лечения первая пациентка окажется радикально излеченной, а второй будут подарены годы жизни.
Представленные выше стандарты лечения больных первичным раком молочной железы легли в основу лечения 7048 больных, находившихся под наблюдением ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России и затем прослеженных в отдаленные сроки с 1994 по 2000 гг. Распределение больных по стадиям представлено в табл. 1.
Таблица 1.
Распределение больных по стадиям.
| Абсолютное число | % | |
|---|---|---|
| I стадия | 1968 | 27,8 |
| II стадия | 3552 | 50,4 |
| III стадия | 1326 | 18,9 |
| IV стадия | 202 | 2,9 |
| Итого | 7048 | 100 |
Распределение больных по видам лечения представлено в табл. 2.
Таблица 2.
Распределение больных по видам лечения.
| Абсолютное число | % | |
|---|---|---|
| Хирургическое | 1268 | 17,9 |
| Комбинированное | 3370 | 47,8 |
| Комплексное | 1876 | 26,7 |
| Консервативное | 534 | 7,6 |
| Итого | 7048 | 100 |
Обращает на себя внимание факт наиболее частого использования комбинированного (47,8%) и комплексного (26,7%) методов лечения, что указывает на широкое использование «консервативной хирургии», лучевой и лекарственной терапии. Снижение частоты использования чисто хирургического метода до 17,9% говорит о качественном подходе к лечению больных, позволяющих шире и обоснованно использовать лучевые и лекарственные методы, а также хирургический метод при паллиативном лечении больных, имеющих различного рода осложнения (изъязвления, распад, кровотечение и т.д.). Разработка чисто консервативных методов при распространенном опухолевом процессе и у пожилых пациентов с целым рядом сопутствующих заболеваний позволяет реальным образом помочь этой тяжелой группе онкологических больных.
Детальная характеристика хирургических видов лечения представлена в табл. 3.
Таблица 3.
Распределение больных по видам лечения, включая операцию.
| Маст- эктомия | Радикаль- ная маст- эктомия с сохра- нением большой грудной мышцы | Радикаль- ная маст- эктомия с сохра- нением обеих грудных мышц | Радикаль- ная резекция | Радикаль- ная маст- эктомия по Холстеду | Всего | |
|---|---|---|---|---|---|---|
| Хирургическое | — | 967 77,1% | 301 22,9% | — | — | 1268 17,9% |
| Комби- нированное | — | — | 1345 39,9% | 2025 50,1% | — | 3370 47,8% |
| Комплексное | 18 49,8% | — | 1473 78,6% | 205 10,9% | 14 0,7% | 1876 26,7% |
| Итого | 18 42,8% | 967 14,7% | 3119 47,9% | 2230 34,2% | 14 0,3% | 6514 100% |
Обращает на себя внимание тот факт, что основными типами оперативных вмешательств в настоящее время являются радикальная мастэктомия с сохранением большой или обеих грудных мышц. В равной степени это относится и к комбинированному методу, при котором эти операции выполняются почти у 2/3 больных (78,6%). В комбинированном методе радикальные резекции составляют 50,1%, т.е. являются операцией выбора. Использование радикальной резекции в комплексном методе стало возможным только при использовании эффективных неоадъювантных методов, что удалось применить у 205 больных.
Отдаленные результаты лечения (5-летняя общая и безрецидивная выживаемости) в зависимости от стадии болезни представлены в табл. 4.
Таблица 4.
Общая и безрецидивная 5-летняя выживаемость.
| 5-летняя выживаемость | ||
|---|---|---|
| Общая | Безрецидивная | |
| I стадия | 89,1 | 80,9 |
| II стадия | 90,3 | 78,9 |
| III стадия | 65,9 | 40,5 |
Особый интерес представляют отдаленные результаты использования органосохраняющих оперативных вмешательств у больных III стадией заболевания. Эти данные представлены в табл. 5.
Таблица 5.
Распределение больных по методам лечения и объему оперативного вмешательства.
| Метод лечения | Радикальные резекции | Радикальные мастэктомии | ||
|---|---|---|---|---|
| Абс. число | % | Абс. число | % | |
| Хирургический | 5 | 2,2 | 4 | 1,8 |
| Комбинированный | 24 | 10,6 | 63 | 28,6 |
| Комплексный | 198 | 87,2 | 153 | 69,6 |
| Всего | 227 | 100 | 220 | 100 |
Повышение эффективности лучевой и лекарственной терапии позволяет существенно расширить возможности использования органосохраняющих операций не только при начальных стадиях РМЖ, но и при местно-распространенных T2-3NO-1MO, TO-3N1-2MO стадиях. Однако возможность выполнения органосохраняющих операций при местно-распространенном раке остается спорной. Практически не разработаны клинические и морфологические критерии отбора больных РМЖ T2-3NO-1MO, TO-3N1-2MO стадии для проведения органосохраняющего лечения. Не ясна роль неоадъювантной терапии при выполнении органосохраняющих операций у больных местно-распространенным РМЖ. Таким образом, необходима дальнейшая оценка возможности выполнения, а также роли и места органосохраняющих операций в комплексном лечении больных местно-распространенным РМЖ.
Особенно перспективным с нашей точки зрения является консервативная терапия, когда операция, даже самого небольшого объема, противопоказана по возрасту и сопутствующим заболеваниям или выполнение ее не целесообразно в связи с распространенностью опухолевого процесса. В этих ситуациях показано проведение лучевой терапии на фоне лекарственной.
Второй этап радикальной программы начинался через 3-4 недели. Доза лучевой терапии на молочную железу составляла 30 Гр; к подмышечной области при наличии метастатических лимфатических узлов с поля уменьшенного размера подводили 10-15 Гр; при наличии надключичных метастазов суммарную дозу увеличивали на 10 Гр, парастернальную область облучали до суммарной дозы 30 Гр.
Лечение проводилось в амбулаторных условиях.
В изучаемую группу включены пациентки в возрасте от 60 до 82 лет с различными стадиями первичного рака молочной железы (всего 124 человека), соматическая патология у которых являлась абсолютным противопоказанием к оперативному вмешательству или использованию неоадъювантной химиотерапии. Основную группу составили больные 60-69 лет (46,8%) и 70-79 лет (47,9%). Группа больных старше 80 лет была самой малочисленной (5,3%).
На долю первично неоперабельных форм (Т3-4N1-3М0) РМЖ в изучаемой группе приходилось более половины наблюдений (55,3%). При исследовании все больные с успехом закончили лечение и в последующем продолжали прием тамоксифена или фемары.
Анализ продолжительности жизни при различном распространении опухолевого процесса выявил следующее: 5-летняя общая и безрецидивная выживаемости при локализованном РМЖ (стадия Т1-2N0М0) составляет 83,3±15,2% и достоверно не отличается в разных возрастных группах. Для стадии Т1-2N1М0 эти показатели равняются 80,5±16,7% и 77,6±9,0%.
5-летняя продолжительность жизни при местнораспространенном раке (стадия Т1-2N2-3М0, Т3-4N0-3М0) соответствовала 70,4±13,5% для общей и 67,7±14,8% для безрецидивной.
Радикальная простатэктомия: хирургическая операция по поводу рака простаты
Как сегодня лечится рак предстательной железы в мире?
Рак предстательной железы (РПЖ) по-прежнему является одной из самых часто встречающихся злокачественных опухолей у мужчин. В возрасте 45 — 49 лет им страдает примерно 10 — 11 мужчин из 100 000 мужского населения, в то время как в возрасте 75 — 79 лет заболеваемость составляет 1400 на 100 000 мужчин. За последние несколько десятилетий прирост заболеваемости РПЖ составлял 3% в год, что связано с увеличением продолжительности жизни мужчин и улучшением диагностики заболевания. Сегодня по распространенности и причинам смерти от онкологических заболеваний среди мужчин РПЖ находится в разных странах мира на 2 — 3 месте, уступая только раку легких и злокачественным новообразованиям пищеварительного тракта. Каждый мужчина в течение своей жизни имеет 9 — 11% шансов заболеть РПЖ и до 4,5% шансов умереть от него.
Большим достижением последних десятилетий можно считать внедрение ранней диагностики и более точного стадирования РПЖ. Анализ крови на ПСА (простатоспецифический антиген), трансректальное ультразвуковое исследование (ТРУЗИ) и мультифокальная системная биопсия простаты под ТРУЗИ-контролем позволили устанавливать диагноз РПЖ на самых ранних стадиях, когда РПЖ не выходит за пределы предстательной железы (не метастазирует). На этих ранних стадиях РПЖ может быть полностью излечен методами локального терапевтического воздействия (операция радикальной простатэктомии, наружное облучение простаты, имплантация в простату радиоактивных зерен или брахитерапия, комбинация данных методов лучевой терапии, криохирургия).
В связи с тем, что применение данных методов лечения обеспечивало выживаемость более 15 лет с момента установления диагноза РПЖ подавляющему большинству больных, они стали называться излечивающими. Если обследование показало, что опухоль простаты вышла за ее пределы и/или дала метастазы, полностью вылечится от заболевания уже невозможно. В таких случаях показано применение методов лечения, которые приостанавливают развитие РПЖ. К ним относится гормонотерапия или хирургическое (косметически щадящее удаление ткани яичек) либо медикаментозное (Золадекс, Диферелин, Касодекс, Флутамид, Флуцином, Андрокур и др.) блокирование выработки или усвоения тестостерона, мужского полового гормона, способствующего росту РПЖ. Применяются различные методы лучевой терапии и, реже, химиотерапия. Лечение РПЖ в строгом соответствии со стадией заболевания стало огромным успехом в борьбе с этим недугом. Особенно осязаема рольрадикальной простатэктомии (РПЭ), использование которой стало наиболее широким после того, когда стало возможным выявление ранних стадий РПЖ. Внедрение РПЭ и ее повсеместное применение способствовало снижению смертности от РПЖ в США на 25% за последние 10 лет (P.C. Walsh, 2002).
Как обстоит дело с диагностикой и лечением РПЖ в современной России?
В то время как в странах Западной Европы и США большую часть впервые выявленных РПЖ составляют локализованные и излечимые формы заболевания, в России по-прежнему большинство (около 70%) вновь обнаруженных РПЖ находятся уже на неизлечимой стадии. Это связано в первую очередь с пока еще низкой информированностью врачей и населения о необходимости обязательного ежегодного скрининга РПЖ для мужчин, в возрасте старше 45 — 50 лет. И хотя практически во всех крупных городах России доступен анализ крови на ПСА, далеко не все врачи, даже урологи и онкоурологи, способны правильно интерпретировать его результаты. К чему это приводит? Очень часто больного берут на операцию по поводу «аденомы» простаты, предварительно не сделав ему анализ крови на ПСА и таким образом, пропустив РПЖ. Довольно быстро после такой операции, заранее не выявленный РПЖ дает метастазы, и это приводит к гибели больного. Нередко «урологи по месту жительства» говорят пациентам, что ПСА менее 10 или даже 15 нг/мл (норма менее 4,0 нг/мл), при отсутствии опухоли, определяемой пальцем, это «ничего страшного» и можно успокоиться и не делать биопсию простаты. Такой подход приводит к тому, что заболевание переходит на неизлечимую стадию, а ведь при своевременной диагностике, пациента можно было бы вылечить.
Недавно к нам обратился мужчина 49 лет, у которого ПСА был равен 15 нг/мл. Лечащий врач об этом знал и, тем не менее, продолжал лечить больного от «простатита». Когда же мы сделали ему биопсию простаты, обнаружилось, что у пациента РПЖ высокой степени злокачественности с высокими шансами метастазирования. То, что данного пациента удастся полностью вылечить — под большим вопросом. Мы часто сталкиваемся с тем, что специалисты онкологических диспансеров лечат РПЖ не в соответствии со стадией заболевания, не так как предписывают международные стандарты, а кому как нравится и кто как умеет. Порой нам приходится видеть больных ранними и излечимыми стадиями РПЖ, которым в качестве метода выбора назначается гормонотерапия. Этого нельзя делать категорически! Ведь через 2 года после начала гормонотерапии, РПЖ очень часто становится гормоноустойчивым. Опухоль начинает быстро расти, а потом и метастазировать. Так по вине неквалифицированных врачей больные теряют свой шанс на излечение, а их близкие преждевременно теряют своих родных и любимых.
К большому сожалению, в нашей стране проблему РПЖ знают исчерпывающим образом очень немногие урологи и онкоурологи таких крупных городов России как Москва, Санкт-Петербург, Ростов-на-Дону и некоторых других. В связи с этим, уважаемые пациенты, остерегайтесь неквалифицированных рекомендаций. Постарайтесь обратиться к специалистам, имеющим специальную подготовку и знающим диагностику и лечение РПЖ в соответствии с международными требованиями и современными стандартами. По крайней мере постарайтесь получить «второе мнение» таких специалистов прежде, чем принимать решение о выборе методов диагностики и лечения РПЖ.
Кому показаны методы излечивающей локальной терапии РПЖ, и в частности операция РПЭ?
Методы излечивающей локальной терапии, включающие операцию РПЭ, наружное облучение, имплантацию радиоактивных зерен в предстательную железу и, в редких случаях, криодеструкцию (разрушение замораживанием) простаты показаны на стадиях заболевания Т1-Т3аN0M0 как самостоятельно так и в различных комбинациях. Только квалифицированный онкоуролог, обладающий исчерпывающими знаниями и достаточным практическим опытом в диагностике и лечении РПЖ, может помочь пациенту сделать правильный выбор.
Идеальным кандидатом для РПЭ является, прежде всего, пациент с подтвержденным диагнозом РПЖ на стадиях Т1-Т2а, имеющий уровень ПСА
Всегда ли надо лечить выявленную раннюю стадию РПЖ именно стандартными и общепринятыми в настоящее время методами излечивающей локальной терапии?
Конечно, любой человек боится операции. Есть психологический дискомфорт и перед лучевой терапией. К тому же многие российские урологи привыкли думать, что РПЖ лечится только гормональными препаратами, и порой дают пациентам, возможно и Вам «рекомендации» не «лезть под нож» и «полечиться таблеточками и укольчиками». Найдутся и многообразные «народные целители» и разные «альтернативные» или «нетрадиционные» практики, которые будут предлагать полечиться чем угодно: от трав, пищевых добавок и гомеопатии с иглотерапией, до питья мочи или керосина. Однако следовать таким рекомендациям чрезвычайно опасно, равно как и просто ждать и не делать ничего, думая, что ранняя стадия РПЖ медленно прогрессирует.
Один из наших пациентов с ранней стадией РПЖ, который, боясь предложенной ему операции РПЭ, пытался лечиться травами, рассказал, что когда он попросил пользовавшего его «целителя» познакомить хоть с одним вылеченным им больным, тот не смог этого сделать. Не существует ни одной опубликованной научной работы, которая бы корректно доказывала эффективность каких-либо нетрадиционных средств и методов лечения РПЖ. Зачастую ничего хорошего не сулит и простое выжидание или бездействие, а также лечение ранних стадий рака простаты без применения излечивающих методов.
Исследования естественного развития РПЖ у таких больных показали, что через 5 лет наблюдения метастазы развивались в среднем у 22 — 46% больных. Известно, что даже при наличии адекватного лечения средняя продолжительность жизни больных, у которых обнаружены метастазы РПЖ, составляет в среднем около 2-х лет. В связи с этим, если у пациента с ожидаемой продолжительностью жизни 10 — 15 лет и более выявлены ранние стадии рака предстательной железы подавляющее большинство урологов наиболее развитых стран мира рекомендуют своим пациентам оперативное лечение — РАДИКАЛЬНУЮ ПРОСТАТЭКТОМИЮ (РПЭ).
Какими преимуществами обладает РПЭ перед другими методами излечивающей локальной терапии РПЖ?
Эффективность лечения РПЖ принято оценивать по частоте рецидива заболевания (оценивается по наличию роста ПСА) и выживаемости через определенный срок после лечения (как правило, оценивают сроки выживания после лечения от 5 лет). Большинство исследований последних лет показывают, что надлежащим образом выполненная радикальная простатэктомия у правильно отобранных для этой операции больных РПЖ обеспечивает 95 — 100% выживаемость через 15 лет наблюдения и отсутствие рецидивов на этом же сроке наблюдения у 68 — 90% больных. Специалисты по лучевой терапии часто утверждают, что наружное облучение предстательной железы или имплантация в простату радиоактивных зерен дают сопоставимые результаты с операцией РПЭ. Однако, исследования, проведенные в США D’Amico A.V. и соавт. (2002) более чем на 3000 больных РПЖ показали, что это совсем не так.
По данным различных исследователей частота рецидивов РПЖ уже через 5 лет после имплантации в предстательную железу радиоактивных зерен (брахитерапия) варьирует от 12 до 45%, что значительно хуже аналогичных показателей после РПЭ. Еще чаще бывают рецидивы после криохирургии ранних стадий РПЖ.
В последние годы в ведущих странах мира появился более эффективный и безопасный метод лучевой терапии РПЖ — трехмерная конформная наружная лучевая терапия. Ряд авторов сообщает о сравнительно сопоставимой с РПЭ эффективности этого метода лечения. Однако в нашей стране подобное оборудование на момент написания данной публикации (ноябрь 2003 г.) отсутствует.
Таким образом, РПЭ обладает неоспоримым преимуществом с точки зрения эффективности по сравнению с другими методами излечивающей локальной терапии РПЖ. Это особенно ощутимо у пациентов более низкого риска (маленькая опухоль, низкая степень злокачественности) и у пациентов более молодого возраста (до 65 лет) с большей ожидаемой продолжительностью жизни. Весьма существенным фактом является то, что в России, ввиду отсутствия необходимого оборудования, а в ряде случаев достаточных квалификации и опыта лучевых терапевтов, практически невозможно провести радикальную лучевую терапию РПЖ на столь же высоком уровне, как это возможно в ведущих западных странах.
Я принял решение о выполнении РПЭ. Как подготовиться к операции, в чем заключается операция, что меня ждет в ближайшее время после операции и в дальнейшем?
Прежде всего, следует иметь ввиду, что РПЭ является одной из самых больших и сложных операций в урологии и требует к себе очень серьезного отношения как от пациента, которому она предстоит, так и от его родственников. В первую очередь следует зарезервировать около 4-х недель нерабочего времени, в течение которого происходит послеоперационная реабилитация. Особенно это относится к лицам, занимающимся физическим трудом или работой, связанной с высокой ответственностью и повышенным уровням психоэмоционального стресса.
Перед госпитализацией в стационар, пациент проходит предоперационное обследование, задачей которого является глубокое изучение общего состояния организма, оценка риска операции и наркоза. Пациенты клиники Андрос госпитализируются в стационар за 1 сутки до предстоящей операции. В день госпитализации, возможно, потребуется взять дополнительные анализы, пациент осматривается врачом анестезиологом и обсуждает с ним особенности предстоящего наркоза. Примерно около 16.00 дня накануне операции пациент начинает подготовку кишечника, который перед операцией должен быть полностью освобожден. Для этого следует прекратить употребление пищи и начать прием раствора (около 3-х литров) слабительного препарата (например Фортранс). Таким образом, в течение нескольких часов кишечник полностью очищается. В день накануне операции могут проводиться и другие мероприятия, по индивидуально установленным показаниям.
Операция радикальной простатэктомии заключается в полном удалении всей предстательной железы вместе с семенными пузырьками и прилегающими тканями. Во время операции есть несколько ключевых моментов:
После операции пациент поступает в палату интенсивной терапии, где находится до утра следующего дня. В этот период проводится восполнение кровопотери (если таковая имела место в значимом количестве), восстановление водно-электролитного баланса, проводится антибактериальная терапия с целью профилактики послеоперационных осложнений. На следующий день после операции пациента поднимают с кровати, и он начинает сидеть в кресле, ходить по палате. На второй день после операции пациент уже в сопровождении медперсонала гуляет по больничному коридору.
На 3-й день после операции, как правило, удаляются дренажи и на 4-й, 5-й дни после операции, когда у пациента восстанавливается функция кишечника, и он переводится на обычную диету, подавляющее большинство наших пациентов отправляется домой. Такое быстрое послеоперационное восстановление обеспечивается комплексом лечебно-реабилитационных мероприятий, которые были освоены специалистами клиники Андрос во время их стажировок в США и Западной Европе и успешно внедрены в нашу практику. До удаления катетера Фолея из уретры и мочевого пузыря пациент находится под тщательным амбулаторным наблюдением уролога клиники Андрос.
Как правило, 2 раза в неделю пациенты самостоятельно прибывают в амбулаторный офис клиники для различных процедур (смена повязки, контроль за состоянием катетера и мочеприемника, снятие швов и т.д.). После удаления катетера Фолея из уретры и мочевого пузыря (обычно через 3 недели после операции), пациент, как правило, восстанавливается достаточно хорошо, и некоторые даже возвращаются к работе. Через 4 — 5 недель после операции абсолютное большинство прооперированных полностью возвращаются к своей обычной жизни, за исключением интенсивных физических нагрузок, которые можно возобновить обычно через 3 месяца после операции.
Каковы наиболее частые осложнения РПЭ?
Во время операции самым грозным осложнением может стать кровотечение. Чаще всего оно имеет место у не очень опытных в данной операции хирургов, а также при условии неадекватного технического и инструментального обеспечения операции. Кровотечение более вероятно при операциях у слишком тучных пациентов, когда работать в глубокой из-за толстой жировой прослойки ране часто бывает весьма затруднительно. Высокий уровень подготовки и опыт хирурга, а также адекватное техническое и инструментальное обеспечение операции — сводят риск серьезных кровотечений при радикальных простатэктомиях к абсолютному минимуму. Если же кровотечение все-таки произошло, кровопотеря должна быть адекватно восполнена непосредственно во время и сразу после операции.
Естественно, что радикальной простатэктомии могут сопутствовать осложнения характерные для любой операции (раневая инфекция, плохое заживление раны, боли и т.д.). При качественном выполнении операции и адекватном послеоперационном ведении и, прежде всего ранней выписке из стационара, частота данных осложнений существенно снижается.
Специфическими осложнениями радикальной простатэктомии являются стойкое нарушение эрекции или эректильная дисфункция (ЭД), а также недержание мочи (НМ).
ЭД развивается из-за часто имеющего место повреждения сосудисто-нервных пучков, управляющих процессом эрекции полового члена, которые проходят по бокам в непосредственной близости от предстательной железы. Во время операции РПЭ, даже при соблюдении специальной нейросохраняющей техники, уберечь эти сосудисто-нервные пучки от частичного или полного повреждения зачастую не удается. Частота ЭД после РПЭ составляет по данным различных авторов от 15 до 80% случаев. Чем больший размер имеет опухоль в предстательной железе, тем более обширным будет оперативное вмешательство, и тем меньше шансов сохранить описанные выше сосудисто-нервные пучки. В целом большие шансы сохранить нормальную эрекцию после РПЭ имеют пациенты, имевшие хорошую эрекцию до операции. Повышает шансы сохранения эрекции комплекс ранних реабилитационных мероприятий, включающий в себя пользование препаратами, которые стимулируют эрекцию. Если все же пациент утрачивает способность совершить половой акт из-за отсутствия нормальной эрекции, ее можно восстановить как с помощью медикаментов, так и хирургическим путем.
В первые несколько недель после удаления мочевого катетера НМ в различной степени имеет место практически у всех пациентов, перенесших РПЭ. Через 6 месяцев после операции та или иная степень НМ сохраняется у 20 — 40% прооперированных, а через 1 год после операции не более чем у 10 — 12% пациентов. Чем опытнее хирург, тем меньше шансов развития НМ у прооперированного. Устранить НМ после РПЭ может помочь лечение методом биологической обратной связи (БОС), которое доступно в клинике Андрос. Если через 1 год после операции остается выраженное НМ, его возможно устранить хирургическим путем (введение формообразующего вещества под слизистую оболочку задней уретры, имплантация искусственного сфинктера мочевого пузыря, применение пластических операций — мужской уретральный слинг).
Чрезвычайно важно, чтобы врачи-урологи, которым Вы доверите выполнение операции РПЭ и Ваше послеоперационное наблюдение были способны не только выполнить саму операцию РПЭ, но и хорошо умели предупреждать, во время распознавать и полноценно лечить все осложнения, которые могут возникнуть в результате данной операции.
Как можно оценить качество жизни после РПЭ по сравнению с пациентами, получавшими другие виды излечивающей терапии ранних стадий РПЖ?
Качество жизни — весьма важный показатель для людей. Многие пациенты очень боятся таких серьезных операций как РПЭ, полагая, что, вылечив свое основное заболевание, будут потом жить неполноценной жизнью или, хуже того, станут инвалидами. Некоторые даже считают, что пусть я лучше поживу еще пару тройку лет, зато полноценной жизнью, чем после операции пусть и долго, зато буду сам мучиться и своих родственников обременять. К сожалению, такое расхожее мнение далеко от истины. Если не лечить онкологического больного, он довольно быстро начинает испытывать всю тяжесть своего заболевания, страдать от расстройств функции пораженных органов, мучиться от невыносимых болей, быстро превращаться в недееспособного инвалида, стремительно угасать на глазах родных и близких. В таком состоянии больной и сам страдает и заставляет страдать близких ему людей. Не лучше ли сделать все возможное для излечения?!
РПЭ дает больным ранними стадиями РПЖ великолепный шанс не только выжить, но и жить долгие годы практически полноценной жизнью. По данным немецких авторов J. Hodzic и соавт. (2003) 73% прооперированных удовлетворены или очень удовлетворены качеством жизни после радикальной простатэктомии, а 98% из них согласились бы перенести РПЭ вновь. Современная конформная (фокусированная) лучевая терапия и имплантация радиоактивных зерен в предстательную железу (брахитерапия) также обеспечивает пациентам достаточно хорошее качество жизни после их применения. Эти виды лучевой терапии примерно с такой же частотой, как и РПЭ, вызывают расстройства эрекции, и реже вызывают недержание мочи. Однако значительно чаще они вызывают такие неприятные симптомы, как учащенное и болезненное мочеиспускание (признаки лучевого цистита), а также расстройства стула и кровотечения из прямой кишки (признаки лучевого проктита). Данные осложнения современных видов лучевой терапии ранних стадий РПЖ делают качество жизни после них несколько хуже, чем после РПЭ (Stene JB, Angelsen A., 2003; Penson DF, Litwin MS., 2003). Безусловно, качество жизни больных после того или иного метода лечения зависит от квалификации и опыта врачей, их оснащения современным оборудованием, условиях в которых проводится наблюдение за пациентом после лечения. В условиях нашей страны, к сожалению, практически невозможно провести лучевую терапию ранних стадий РПЖ в соответствии с мировыми стандартами (в основном из-за отсутствия соответствующего оборудования и опыта врачей). Однако у нас есть специалисты, за плечами которых уже многие сотни выполненных операций РПЭ. А высочайшая квалификация и опыт хирурга имеет критически важное значение для того, насколько удачно пройдет послеоперационная реабилитация и насколько полноценной будет жизнь пациента после РПЭ (Downs T.M. и соавт., 2003).
В клинике Андрос накоплен достаточный опыт выполнения радикальных простатэктомий, излечивающих операций на ранних стадиях рака предстательной железы. Послеоперационная реабилитация в клинике осуществляется в соответствии с самыми передовыми стандартами медицины Западной Европы и США. Наши пациенты выписываются из стационара через 3 — 5 дней после операции, а через 3 — 4 недели после нее возвращаются к своей обычной жизни и работе. В случае развития любых осложнений после операции РПЭ специалисты клиники Андрос окажут самую квалифицированную помощь. В клинике доступны все современные методы лечения расстройств эрекции и недержания мочи. Выбирайте надежный путь к излечению от рака предстательной железы!
Список литературы
Если у Вас остались вопросы, Вы можете получить консультацию ведущих специалистов клиники Андрос.