Радикальная позадилонная простатэктомия что это
Промежностная радикальная простатэктомия: собственный опыт. Промежностная и позадилонная радикальная простатэктомия: за и против
Промежностной доступ имеет давнюю историю, так как был основным при удалении камней мочевого пузыря. Первая РПЭ при РПЖ была выполнена в 1867 году T.Billroth. Операция была выполнена промежностным доступом, однако предложенная им техника не получила распространения вследствие плохой интраоперационной визуализации и частых осложнений.
В 1905 году опубликовал свои работы H.Young. Описанная им техника промежностной РПЭ обеспечивала хорошую визуализацию, в том числе за счет предложенного им двухлопастного ретрактора [18].
В последующем, основываясь на работах H.Young были предложены технические приемы и доступы, улучшившие контроль интраоперационного гемостаза и визуализацию при создании везико-уретрального анастомоза. Большой вклад в совершенствование и популяризацию промежностной простатэктомии внес E.Belt, опубликовавший в 1939 году технику более простого подсфинктерного доступа к ПЖ [2].
Таким образом, вплоть до начала 70-х годов XX-го века промежностная РПЭ (ПрРПЭ) оставалась методом выбора при лечении больных с локализованным раком ПЖ.
Несмотря на то, что промежностный доступ был предложен ранее позадилонного, он не стал столь же популярным. Это обусловлено тем, что для урологов все же более традиционным является позадилонный, поскольку он используется при операциях на мочевом пузыре, а также при хирургическом лечении доброкачественной гиперплазии простаты. В последующем анализ накопленного опыта сделал очевидным важность предоперационной оценки состояния тазовых лимфоузлов. Данные обстоятельства способствовали широкому распространению позадилонной простатэктомии, т.к. нижнесрединный доступ позволял одновременно выполнить и лимфодиссеккцию и удалить железу. Кроме того, работы P.Walsh и P.Doncker по анатомии ПЖ и нервосберегающая модификация техники операции позволили значительно снизить частоту осложнений (эректильная дисфункция, недержание мочи) и повысить качество жизни пациентов [14]. Но в свою очередь в 1988 году V. Weldon и F. Tavel сообщили о применении аналогичных технических приемов при выполнении ПрРПЭ. И всё же популяризация и широкое освоение позадилонной РПЭ делает её \золотым стандартом\ хирургического лечения РПЖ.
Промежностная радикальная простатэктомия
Е.А. Безруков
ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» МЗ РФ; Москва, Россия
Введение
В настоящее время методика промежностной радикальной простатэктомии (РПЭ) переживает период возрождения ввиду своей малотравматичности и экономической выгодности, а также малого количества осложнений. Операция отличается малоинвазивным доступом, хорошей визуализацией предстательной железы (особенно верхушки), мочеиспускательного канала, и сосудисто-нервных пучков, даёт хороший косметический эффект. Хирургический доступ проходит вдалеке от крупных сосудов и нервов. К преимуществам также можно отнести возможность надёжного и быстрого формирования пузырно-уретрального анастомоза. Операция удобна у тучных пациентов, пациентов после обширных операций на брюшной полости. Ввиду последних модификаций, промежностная простатэктомия позволяет выполнять нервосберегающее вмешательство, а также вмешательство с одновременной трансперитонеальной лимфаденэктомией.
История
Именно хирургический доступ через промежность был первым, предложенным для осуществления простатэктомии. Впервые технику такой операции разработал и описал ещё в 1867 году C. A. Theodore Billroth. На тот момент операция не получила распространения ввиду высокой сложности и большого количества осложнений. Кроме того, сама проблема рака простаты была мало изучена, ведь это заболевание известно только с 1853 года благодаря работам James Adams, английского хирурга [1]. За неимением маркёра и визуализирующих методов диагностики, выявляемость рака простаты была крайне низкой, и многие пациенты даже по современным воззрениям были неоперабельными.
Следующую попытку совершенствования операции предпринял Hugh H. Young в 1905 году [2], им был применён доступ от переднего края внешнего прямокишечного сфинктера до ректоуретральной мышцы. Чтобы сделать мобилизацию простаты более удобной, Young разработал ретрактор особой формы, впоследствии названный его именем.
Elmer Belt в 1942 году модифицировал доступ Young следующим образом: мышечные волокна внешней и внутренней частей внешнего прямокишечного сфинктера отводятся кверху и латерально, при этом доступ к предстательной железе осуществляется по передней поверхности прямой кишки. Надсфинктерный доступ по Young является более сложным, но обеспечивает более короткий путь к простате [3]. До 70-80-х годов XX века подсфинктерный доступ Belt использовался урологами для лечения пациентов с локализованным, малоразмерным раком предстательной железы, выявленным на ранних стадиях.
В то же время, с 1941 года известна позадилонная РПЭ. Позадилонный доступ традиционно более знаком врачам из общей хирургии, а также из урологических операций на мочевом пузыре и нижней трети мочеточника. Именно с его появлением промежностные операции были порой незаслуженно забыты, хотя даже в 1982 году Patrick C. Walsh советовал применять позадилонную простатэктомию только лишь на тех стадиях онкопроцесса, при которых была необходима лимфодиссекция [4].
Последнюю модификацию промежностной операции предложил Jeff rey P. Weiss, он же провёл первую нервосберегающую промежностную РПЭ [5]. Данная методика является наиболее эффективной по сей день [6].
В настоящее время методика промежностной РПЭ переживает период возрождения ввиду своей малотравматичности и экономической выгодности, а также малого количества осложнений. Операция отличается малоинвазивным доступом, хорошей визуализацией предстательной железы (особенно верхушки), мочеиспускательного канала, и сосудисто-нервных пучков, даёт хороший косметический эффект. Хирургический доступ проходит вдалеке от крупных сосудов и нервов. К преимуществам также можно отнести возможность надёжного и быстрого формирования пузырно-уретрального анастомоза. Операция удобна у тучных пациентов, пациентов после обширных операций на брюшной полости [7]. Ввиду последних модификаций, промежностная простатэктомия позволяет выполнять нервосберегающее вмешательство, а также вмешательство с одновременной трансперитонеальной лимфаденэктомией.
Отбор пациентов и показания к промежностной простатэктомии
Выбор вида операции во многом обусловлен опытом и убеждениями хирурга, оснащённостью лечебного учреждения и желаниями пациента. Любую из видов РПЭ при необходимости можно сочетать с нервосбережением и с лимфаденэктомией (но после промежностной РПЭ для этого потребуется отдельный доступ). Различия между методиками заключаются только в виде доступа к простате и в функциональных результатах, онкологические результаты и процент осложнений принципиально не отличаются. Тем не менее, мы постараемся выделить объективные показатели, при которых промежностная РПЭ целесообразна, или, напротив, нерациональна.
С появлением эндоскопических методик сложилось мнение, что к малоинвазивным можно отнести только лапароскопическую или роботическую простатэктомии. Очевидно, что они отличаются от позадилонной операции маленькими размерами разрезов и хорошим косметическим эффектом, снижением болевого компонента. Также сообщается о меньшей кровопотере и возможностям более тщательного сохранения сосудисто-нервных пучком. Такое мнение имеют многие мировые издания, которые не имеют достаточного фактического материала по промежностной операции ввиду её редкого применения. Особенно это характерно для США, где роботическая РПЭ применяется чаще других методов. Так, в Duke Center, промежностная РПЭ практически не использовалась до 2003 года. Между 2003 и 2005, доля позадилонной, лапароскопической и роботической были 56,7%, 14,9% и 28,4% соответственно. Позже, количество открытых пособий снизилось до 55,4%, лапароскопических – до 3,5%, в то время как роботических операций стало 41,1%. Данная тенденция прослеживалась и в 2007 году: доля роботических РПЭ увеличилась до 63%, позадилонных – снизилась до 36%, а лапароскопических составила менее 1%. Кроме того, подчас коммерческая заинтересованность вносит вклад в выбор метода. В принципе, промежностная операция может быть выполнена практически теми же инструментами, что и позадилонная, в то время как для лапароскопической потребуется большое количество специализированного оборудования, подчас одноразового.
С появлением эндоскопических методик сложилось мнение, что к малоинвазивным можно отнести только лапароскопическую или роботическую простатэктомии. Очевидно, что они отличаются от позадилонной операции маленькими размерами разрезов и хорошим косметическим эффектом, снижением болевого компонента. Также сообщается о меньшей кровопотере и возможностям более тщательного сохранения сосудисто-нервных пучком. Такое мнение имеют многие мировые издания, которые не имеют достаточного фактического материала по промежностной операции ввиду её редкого применения. Особенно это характерно для США, где роботическая РПЭ применяется чаще других методов. Так, в Duke Center, промежностная РПЭ практически не использовалась до 2003 года. Между 2003 и 2005, доля позадилонной, лапароскопической и роботической были 56,7%, 14,9% и 28,4% соответственно. Позже, количество открытых пособий снизилось до 55,4%, лапароскопических – до 3,5%, в то время как роботических операций стало 41,1%. Данная тенденция прослеживалась и в 2007 году: доля роботических РПЭ увеличилась до 63%, позадилонных – снизилась до 36%, а лапароскопических составила менее 1%. Кроме того, подчас коммерческая заинтересованность вносит вклад в выбор метода. В принципе, промежностная операция может быть выполнена практически теми же инструментами, что и позадилонная, в то время как для лапароскопической потребуется большое количество специализированного оборудования, подчас одноразового.
Промежностный доступ особенно удобен у пациентов, страдающих ожирением, у которых жировой фартук препятствует трансабдоминальной хирургии – даже в этом случае допуск к простате легко осуществим. Консолидация тканей в таком случае также быстрее, в то время как в случае нижней срединной лапаротомии нередко бывает несостоятельность раны.
Лимфаденэктомия (ЛАЭ) является также важной темой для обсуждения. Оппоненты методики указывают, что промежностный доступ исключает одновременную лимфаденэктомию, в связи, с чем требуется отдельная процедура, обычно – лапароскопическая лимфаденэктомия. Возможно выполнить эти операции одномоментно, тем не менее, длительность такого вмешательства будет несравнимо больше, чем, например, лапароскопической РПЭ+ЛАЭ.
Исходя из вышеперечисленного, можно сформулировать показания и противопоказания с промежностной РПЭ следующим образом (в данный список мы не включаем показания к простатэктомии в принципе, чтобы акцентировать внимание именно на выборе промежностного доступа). Также стоит отметить, что эти показания и противопоказания являются рекомендуемыми, но не абсолютными.
Показания:
Радикальная простатэктомия
Радикальная простатэктомия (РПЭ) является хирургическим методом лечения РПЖ, который заключается в удалении всей простаты вместе с прилежащими семенными пузырьками. Операция может быть выполнена открытым позадилонным, промежностным, или лапароскопическим доступами. В последние годы всё чаще выполняют робот-ассистированные радикальные операции.
РПЭ показана пациентам с локализованным раком простаты (стадия T1 или T2) и предполагаемой продолжительность жизни не менее 10-15 лет. В ряде случаев в ходе операции удаляются регионарные тазовые лимфатические узлы. У многих пациентов возможно проведение операции по нервосберегающей методике, направленной на сохранение у больного эректильной функции.
Этапы позадилонной РПЭ
— Пациент находится на операционном столе в положении лёжа на спине, мочевой пузырь дренирован по уретре катетером Фолея
— Проводится разрез кожи между пупком и лобковым симфизом
— Острым путем посредством рассечения поперечной фасции осуществляется доступ в предпузырное пространство
— Брюшина отводится кверху и отделяется от наружных подвздошных сосудов до бифуркации общей подвздошной артерии
— При ПСА более 10 нг/мл или сумме Глисона более 7 баллов выполняется двусторонняя тазовая лимфаденэктомия
— Выполняется рассечение внутритазовой фасции и разделение пубопростатических связок
— Осуществляется перевязка дорсального венозного комплекса
— Cохраняются или удаляются сосудисто-нервные пучки
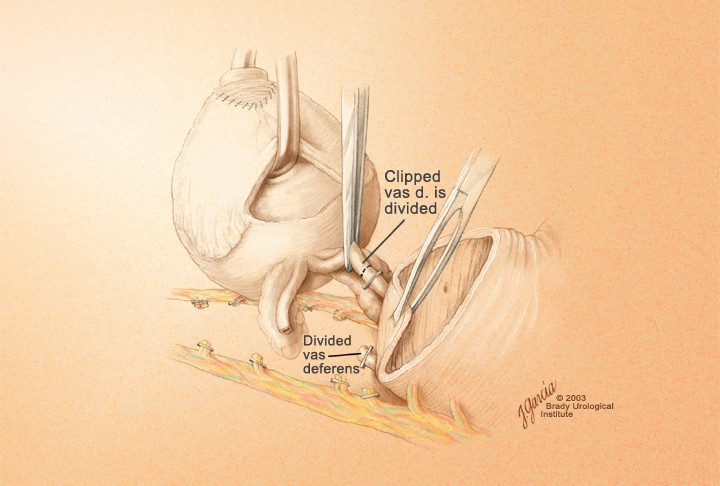
— Семявыносящие протоки отсекаются на уровне верхушек семенных пузырьков
— Простата отделяется от шейки мочевого пузыря, пересекается уретра в области верхушки предстательной железы
— Выполняется простатэктомия
— Создаётся анастомоз (соустье) между уретрой и шейкой мочевого пузыря
— Баллон катетера Фолея наполняется до 10-20 мл, к зоне операции устанавливается страховая дренажная трубка
— Апоневроз прямой мышцы живота ушивается непрерывным швом из медленно рассасывающегося шовного материала
— Целостность кожи восстанавливается с помощью внутрикожных швов из викрила 3/0 или металлических скобок
Спустя 5-7 суток после РПЭ больному амбулаторно удаляется уретральный катетер. Проводится регулярная гимнастика мышц тазового дна для восстановления функции удержания мочи. Полная реабилитация и возвращение к обычному графику работы наступает через 6–8 недель после оперативного лечения.
Возможные осложнения РПЭ
Интраоперационные осложнения
Основное и наиболее грозное интраоперационное осложнение – кровотечение. Хорошее знание анатомии малого таза и тщательная перевязка дорсального венозного комплекса – основные методы борьбы с этим осложнением.
Повреждение стенки прямой кишки – относительно редкое осложнение. Еcли дефект небольшой, проводится его ушивание. Если дефект стенки прямой кишки значительный, или её повреждение не было замечено интраоперационно, а манифестировало только в послеоперационном периоде, то первым этапом лечения таких пациентов выполняется колостомия.
Ранние послеоперационные осложнения
Значительное послеоперационное кровотечение, при котором для поддержания стабильного артериального давления требуется немедленное переливание крови, встречается редко.
Эмболия лёгочных артерий и тромбоз глубоких вен нижних конечностей – серьёзные осложнения радикальной простатэктомии. Они встречаются у 1–3% пациентов. Основной метод борьбы с этими осложнениями – их профилактика. Наиболее распространенные профилактические мероприятия – эластичное бинтование нижних конечностей, профилактическое назначение фракционированных гепаринов в предоперационном периоде, ранняя активизация больных. Немедленно после возникновения подозрения на наличие тромбоэмболических осложнений должна быть начата системная гепаринизация.
Несостоятельность уретровезикального анастомоза – относительно редкое осложнение. Предположение о возможности такой ситуации возникает при постоянном выделении большого количества жидкости по страховым дренажным трубкам. Проведение анализа на содержание креатинина в отделяемом позволяет дифференцировать мочу от лимфы. При высоком уровне креатинина несостоятельность анастомоза может быть подтверждена при цистографии.
В связи с совершенствованием техники анестезии и операции интра- и послеоперационная смертность приближается к нулю (1 из 500 пациентов). Инфаркт миокарда является самым частым ранним послеоперационным осложнением и встречается не чаще, чем у 1% больных.
Поздние послеоперационные осложнения
Стеноз (сужение) шейки мочевого пузыря встречается у 5-8% пациентов и может значительно ухудшить результаты радикальной простатэктомии. К факторам риска развития стеноза шейки мочевого пузыря относятся выраженная интраоперационная кровопотеря, длительное выделение мочи по страховой дренажной трубке и предшествующая трансуретральная резекция простаты. При выявлении стеноза требуется проведение эндоскопического оперативного вмешательства – трансуретральной резекции зоны уретрошеечного анастомоза.
Недержание мочи – серьезное осложнение РПЭ, снижающее качество жизни пациентов. Только 0,2–0,5% пациентов нуждаются в хирургическом вмешательстве по созданию механизма удержания мочи – имплантации искусственного сфинктера мочевого пузыря. Большинство пациентов в послеоперационном периоде отмечают частичное недержание мочи, которое регрессирует в течение 3 мес. Во многих случаях для восстановления контроля над мочеиспусканием оказываются эффективными гимнастика мышц тазового и специальная физиотерапия.
Эректильная дисфункция (ЭД) также является одним из осложнений РПЭ. Благодаря усовершенствованию хирургической техники и тенденции к увеличению выявляемости локализованных форм РПЖ, всё чаще радикальная операция проводится с сохранением сосудисто-нервных пучков, что обеспечивает сохранение эректильной функции в 60-70% случаев. Помимо техники операции, большое прогностическое значение для сохранения потенции имеет возраст больного. Внедрение в клиническую практику ингибиторов фосфодиэстеразы 5-го типа (иФДЭ-5) значительно улучшило результаты лечения ЭД не только у первичных пациентов, но и у больных, перенесших различные оперативные вмешательства на органах малого таза, в том числе и РПЭ. Назначение регулярного приёма иФДЭ-5 после РПЭ является обычной практикой и способствует возникновению ночных эрекций, которые играют защитную роль в нормальном функционировании кавернозных тел (улучшение кровоснабжения). Если в течение 2 лет подобного лечения эректильная функция не восстанавливается, возникает вопрос о целесообразности выполнения эндофаллопротезирования.
ОТКРЫТАЯ ПОЗАДИЛОННАЯ РАДИКАЛЬНАЯ ПРОСТАТЭКТОМИЯ
Полный текст:
Аннотация
Ключевые слова
Для цитирования:
Чибичян М.Б. ОТКРЫТАЯ ПОЗАДИЛОННАЯ РАДИКАЛЬНАЯ ПРОСТАТЭКТОМИЯ. Вестник урологии. 2018;6(1):81-93. https://doi.org/10.21886/2308-6424-2018-6-1-81-93
For citation:
Chibichyan M.B. OPEN RADICAL RETROPUBIC PROSTATECTOMY. Vestnik Urologii. 2018;6(1):81-93. (In Russ.) https://doi.org/10.21886/2308-6424-2018-6-1-81-93
Введение
Рисунок 1. Распространенность и смертность РПЖ в США
Figure 1. Prevalence and mortality of prostate cancer in the USA
По данным исследования МНИОИ им. П.А. Герцена, опубликованным в 2017 г., «грубый» показатель заболеваемости раком предстательной железы в Российской Федерации за последние 15 лет с 2001 по 2015 гг. увеличился 3,0 раза с 19,01 до 57,22 случаев на 100 тыс. населения. И в 2015 г. в России выявлены 38812 новых случаев РПЖ [1].
Общие положения в проблеме лечения локального рака предстательной железы
Радикальная простатэктомия может выполняться открытым (позадилонная, промежностная), лапароскопическим или роботизированным подходами. Более низкие показатели положительных хирургических краев у опытных хирургов позволяют предположить, что опыт и тщательное внимание к хирургическим деталям, влияют на качество лечения рака [2].
РПЭ является одним из методов лечения локального РПЖ. К другим методам относятся активный мониторинг, наружная лучевая терапия, брахитерапия, гормональная терапия.
Решения по поводу лечения должны приниматься после того, как все виды оказания медицинской помощи обсуждались многопрофильным консилиумом (включая урологов, онкологов и радиологов), а также после сопоставления преимуществ и побочных эффектов каждого терапевтического метода вместе с пациентом.
В данной лекции будут рассмотрены аспекты позадилонной радикальной простатэктомии.
История
Тогда же была сформирована современная концепция диагностики и стадирования РПЖ, что способствовало развитию диагностического ажиотажа и переоценке эпидемиологических параметров рака предстательной железы. В 1990-е гг. стал очевидным тот факт, что рак простаты является самым частым опухолевым заболеванием у мужчин в США, а в развитых странах Европы занимает 2-е место после опухолевых поражений кожи. В РФ широкое распространение РПЭ началось со 2-й половины 1990-х гг.
Развитие диагностики и усовершенствование хирургических подходов к предстательной железе дали огромный толчок развитию радикальной хирургии РПЖ. А в ведущих странах мира РПЭ стала самым распространённым урологическим вмешательством [2][3].
В последние годы набирает популярность ро- ботическая радикальная простатэктомия. Alemo- zaffar M et al. сообщают, что если в начале 2000-х гг. позадилонная радикальная простатэктомия в США выполнялась в подавляющем большинстве случаев, то спустя 10 лет роботическая РПЭ имеет долю, превышающую 70 % в хирургии рака простаты [6] (рис. 2.).
Рисунок 1. Распространенность и смертность РПЖ в США
Figure 1. Prevalence and mortality of prostate cancer in the USA
Однако и по сегодняшний день во многих центрах позадилонная радикальная простатэктомия занимает значительную долю в хирургии РПЖ [7].
Отбор пациентов и показания к радикальной позадилонной простатэктомии
РПЖ стадии T1a–T1b. Стадия опухоли Tla определяется как случайно выявленный при гистологическом исследовании рак, который занимает 5% или менее объема резецированной ткани (при ТУР ПЖ или открытой аденомэктомии). Стадия Tlb устанавливается, если рак занимает > 5 % удаленной ткани. РПЖ стадии Tla-Tlb выявляется инцидентально в 4-16 % случаев при хирургическом лечении ДГПЖ. Значимыми прогностическими факторами наличия резидуальной опухоли при РПЭ является уровень простатспецифического антигена (ПСА), определённый до и после операции по поводу гиперплазии ПЖ, а также индекс Глисона. Решение о выполнении РПЭ при инцидентальном РПЖ необходимо принимать с учетом вероятности прогрессии. Прогрессии нелеченого РПЖ T1a–T1b спустя 5 лет реализуется у 5 % мужчин, через 10 лет — у 50%. РПЭ следует предлагать пациентам с большой ожидаемой продолжительностью жизни и при низкодифференцированном РПЖ. Уровень ПСА может быть предиктором в принятии решения об активной тактике [2][3][8].
РПЖ стадии T1c и T2a. Опухоли, которые выявляются только при биопсии ПЖ, выполняемой в связи с повышенным уровнем ПСА (T1c), становятся наиболее часто встречающимся видом РПЖ. Опухоли стадии Tlc всего лишь в 11-16 % клинически не значимые и могут подлежать активному мониторингу. В 30 % случаев при патоморфологическом исследовании после РПЭ диагностируется местно-распространенный РПЖ. Как распознать те опухоли, которые не требуют выполнения РПЭ. Если рак выявлен только в одном или нескольких биоптатах и процент поражения одного столбика незначим при низком индексе Глисона, то скорее всего такой РПЖ можно наблюдать. РПЭ показана пациентам с РПЖ стадии T2a и ожидаемой продолжительностью жизни не менее l0 лет, ввиду того, что в 35-55 % случаев наблюдается прогрессия рака в течение 5 лет при отсутствии лечения [2][3][8].
Пациентам с локальным РПЖ низкого риска выполнять расширенную ТЛАЭ не обязательно, т.к. вероятность поражения опухолью ЛУ не превышает 5 % [3].
Локализованный РПЖ промежуточного риска: стадия T2b-T2c, или индекс Глисона 7, или уровень ПСА 10-20 нг/мл РПЭ — один из рекомендованных стандартных методов лечения РПЖ промежуточного риска при ожидаемой продолжительности жизни пациента более 10 лет. При локализованном РПЖ по данным патоморфологического исследования РПЭ дает прекрасный прогноз. Некоторым пациентам с локализованным раком промежуточного риска предлагается активный мониторинг. Однако если опухоль пальпируется или визуализируется, но клинически остается в пределах ПЖ, у большинства пациентов при длительном наблюдении рак будет прогрессировать. Рак стадии T2b прогрессирует более чем у 70 % пациентов в течение 5 лет [2]. Пациентам с локализованным РПЖ промежуточного риска необходимо выполнять расширенную ТЛАЭ, если установленный риск поражения опухолью ЛУ превышает 5 % [2][3][8].
Локализованный РПЖ высокого риска: стадия T3a, или индекс Глисона 8-10, или уровень ПСА > 20 нг/мл.
В 20-35 % пациентов с впервые диагностированным РПЖ идентифицируется группа высокого риска на основании либо уровня ПСА > 20 нг/мл, индекса Глисона > 8, либо выявляемого клинически местно-распространенной опухоли. У пациентов данной группы имеются повышенные риски опухолевой прогрессии, необходимость проведения адъювантной терапии, риски прогрессирования до фазы метастатической болезни и канцерспецифической смерти от РПЖ. Несмотря на вышесказанное часть пациентов группы высокого риска имеют шансы получить хороший результат от РПЭ. Нет консенсуса по хирургическому лечению пациентов с РПЖ высокого риска.
Предоперационная подготовка
Операцию выполняют через 6-8 недель после полифокальной биопсии простаты, т.е. по существу с момента установления диагноза карциномы. Сроки, выдерживаемые после биопсии необходимы для редукции гематом и воспалительных инфильтратов между простатой и окружающими тканями. Это создает лучшие условия для диссекции тканей при РПЭ, особенно нервно-сосудистых пучков, и предупреждения повреждений прямой кишки. В течение этого срока больным не рекомендуют принимать аспирин и нестероидные противовоспалительные средства, заготавливают 200-400 мл аутологичной крови. Перед принятием решения о выборе РПЭ в качестве основного метода лечения карциномы простаты каждый пациент получает объективную консультацию оперирующего уролога с предоставлением общей информации об операции, возможных осложнениях (кровотечение, недержание мочи, эректильная дисфункция и др.) и особенностях послеоперационного периода, в том числе его длительности. За сутки до операции назначают обезжиренную жидкую пищу. Вечером перед операцией или утром в день операции проводят очистительную клизму. За 30-60 мин до начала анестезии внутривенно вводят один грамм сульперазона.
Используемый специальный инструментарий:
Техника радикальной позадилонной простатэктомии
Позиционирование пациента и операционной бригады. Пациент находится на операционном столе в умеренно разогнутом в области таза положении (супинация) (рис.3.)
Рисунок 3. Позиционирование больного на операционном столе
Figure 3. Patient positioning on the operation table
На этапе диссекции верхушки простаты столу придается умеренная обратная позиция Тренделенбурга, после чего для облегчения визуализации и диссекции шейки мочевого пузыря стол переводили в умеренную позицию Тренделенбурга.
Хирургический доступ. Кожа обрабатывается и укрывается стандартным образом. Катетер Фолея № 20—22 проводится в мочевой пузырь, баллон заполняется 15-20 мл 0,9 % физиологического раствора, катетер соединяется с закрытым резервуаром для сбора мочи. Нижнесрединный внебрюшинный разрез живота производится от лона до пупка, длиной 10-15 см. Прямые мышцы разделяются по средней линии, а поперечная фасция рассекается, обнажая пространство Retzius. Передняя фасция рассекается остро вплоть до лона. Латерально от мочевого пузыря мобилизовывается брюшина до уровня бифуркации общих подвздошных артерий. Семявыносящие протоки не выделяются и не перевязываются. В рану устанавливается ретрактор Balfour, который фиксируется к операционному столу.
Тазовую лимфаденэктомию производят до радикальной простатэктомии. Немедленное интраоперационное морфологическое исследование лимфатических узлов рекомендовано при дооперационном индексе Глисона > 7 и их пальпаторном увеличении.
Техника. Тазовую лимфаденэктомию начинают со стороны, где определяется наибольшая опухоль в простате, путем рассечения фасциального футляра над наружной подвздошной веной. Иссечение жиролимфатического образца начинают внутрь от наружной подвздошной вены, позади нее, доходя до внутренней стенки таза и продвигаясь дистально к феморальному каналу до уровня устья поверхностной огибающей подвздошной вены. Здесь лимфатические сосуды лигируются. Затем диссекция продолжается в краниальном направлении до бифуркации общей подвздошной артерии. Удаляются лимфатические узлы в углу между наружной и внутренней подвздошными артериями и вперед от последней. Разделяемые ткани перевязываются лигатурой. Отделение тканевого комплекса от внутренней стенки таза вглубь приводит к визуализации запирательного нерва. Такая же лимфаденэктомия производится с контралатеральной стороны (рис. 4).
Рисунок 4. Границы ТЛАЭ
Figure 4. Borders of pelvic lymphadenectomy
Жировые ткани, покрывающие переднюю полуокружность простаты удаляются путем их коагуляции с тем, чтобы обнажить перипростатическую фасцию и поверхностные ветви дорсальной вены.
Расширенная тазовая лимфаденэктомия включает удаление лимфоузлов по ходу наружной подвздошной артерии и вены, лифоузлов в запирательной ямке, расположенных краниально и каудально относительно запирательного нерва, и лимфоузлов, расположенных медиальнее и латеральнее внутренней подвздошной артерии. Удалению подлежат так же и общие подвздошные лимфоузлы до перекреста с мочеточниками. Это способствует удалению 75 % всех потенциальных лимфогенных метастазов. Для повышения качества морфологического исследования среднее количество удаленных лимфоузлов должно быть не менее 20 (рис. 5).
Рисунок 5. Операционное поле после расширенной ТЛАЭ: НПА — наружная подвздошная артерия, НПВ — наружная подвздошная вена, ВПА — внутренняя подвздошная артерия
Figure 5. The surgical field after extended pelvic lymphadenectomy: AIE— arteria iliaca externa, VIE — vein iliaca externa, AII — arteria iliaca interna
Простатэктомия. Рассечение эндопельви- кальной фасции. Эндопельвикальную фасцию освобождают мягким тупфером от жировых тканей, которые сдвигали к боковым стенкам таза. На границе перехода с внутренней стенки таза на простату вскрывали фасцию остроконечными ножницами. Ее разрез продлевали на 2-3 см в краниальном направлении и аккуратно в каудальном. Длина разреза фасции составляла около 4-5 см. Аналогичный разрез производили с контралатеральной стороны (рис.6, 7).
Рисунок 6. Доступ к фасции Endopelvica (отмечена зона вскрытия фасции)
Figure 6. Access to the endopelvic fascia (the area is marked)
Рисунок 7. Рассечение фасции Endopelvica
Figure 7. Endopelvic fasciotomy
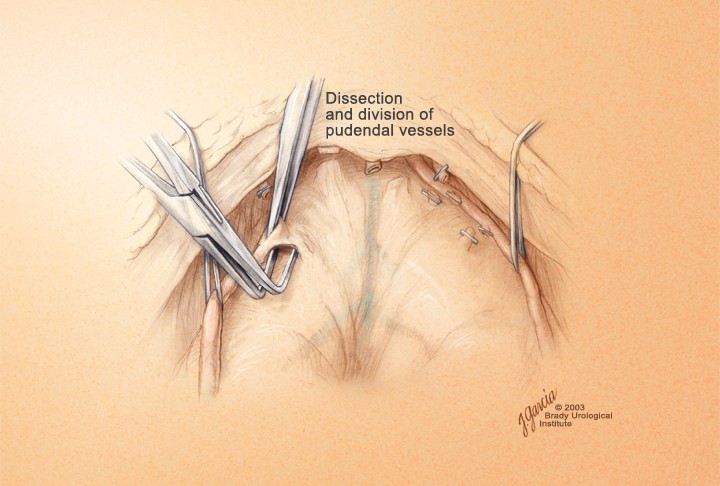
В своей работе чаще всего мы применяем способ R.P. Myers c использованием зажима Babcock, которым захватывается вся порция дорсального венозного комплекса, тем самым уменьшая его в объёме; останавливается кровотечение, которое иногда может возникнуть при выполнении вышеописанных манипуляций (Myers R.P., 1987) [9] (рис. 8).
Рисунок 8. Выделение дорсального венозного комплекса по R.P. Myers
Figure 8. Division of dorsal venous complex by R.P. Myers
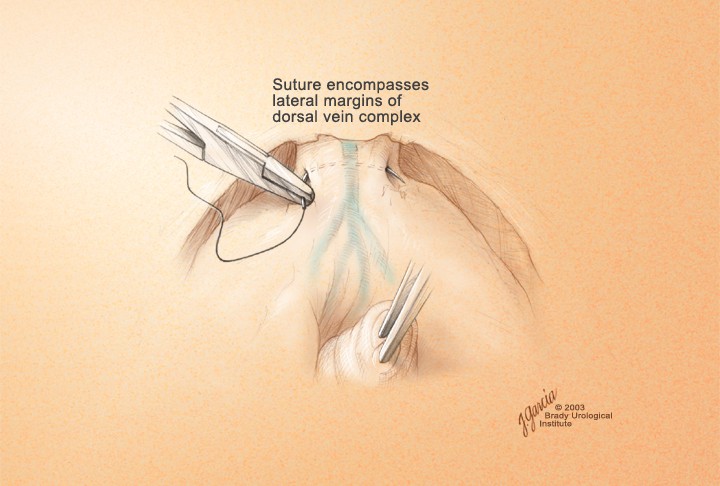
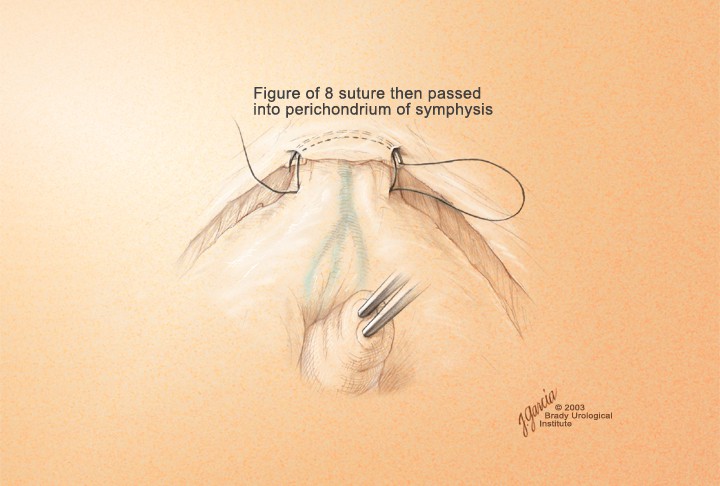
Прошивание комплекса производится лигатурой из полисорба 2.0 на атравматической игле в плоскости между перепончатой уретрой и венозным комплексом, но без прошивания верхушки предстательной железы и уретры и, не захватывая мышцы мочеполовой диафрагмы (рис. 9). Узел завязывается, и таким же образом накладывается вторая лигатура. Во избежание ретроградного кровотечения из проксимальных концов вен прошиваются и перевязываются латеральные венозные сплетения справа и слева у основания предстательной железы, после чего пересекается дорсальный венозный комплекс. Для этого предстательная железа тупфером максимально смещается краниально и вглубь таза, что позволяет хорошо идентифицировать ткани и пересечь венозное сплетение без повреждения капсулы предстательной железы и лигатур, наложенных на дорсальный венозный комплекс (рис. 9, 10). Средний объем кровопотери на данном этапе составлял до 100 мл.
Рисунок 9. Прошивание ДВК
Figure 9. Underrunning dorsal venous complex
Рисунок 10. Песечение ДВК
Figure 10. Transection dorsal venous complex
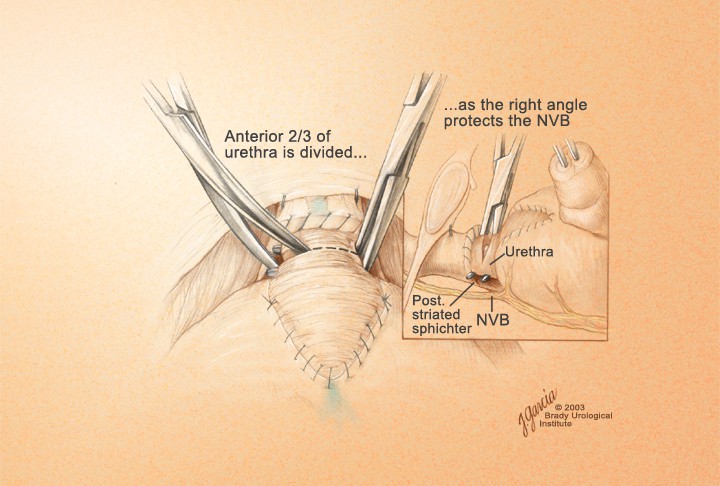
Отсечение уретры. После разделения дорсального венозного комплекса визуализация простатоуретрального соединения позволяла определить место отсечения уретры от простаты. Отсечение уретры скальпелем начинают с поперечного рассечения передней стенки уретры от 3 до 9 ч, сразу дистальнее верхушки простаты (рис. 11). Обнаженный катетер Фолея извлекают частично через рану уретры, накладывая на него зажим и дистальнее зажима катетер пересекают полностью (рис. 12). Дистальный свободный фрагмент катетера удаляют из уретры.
Рисунок 11. Пересечение уретры
Figure 11. Transection uretra
Рисунок 12. Катетер в уретре
Figure 12. Catheter into the urethra
Остроконечными ножницами заднюю стенку уретры поперечно пересекают. Обнажают заднюю часть поперечнополосатого уретрального сфинктера. Диссектор проводят справа налево под сфинктером посередине расстояния между верхушкой простаты (рис. 13).
Рисунок 13. Пересечение задней полуокружности уретры
Figure 13. Transection of semicircle external opening of urethra
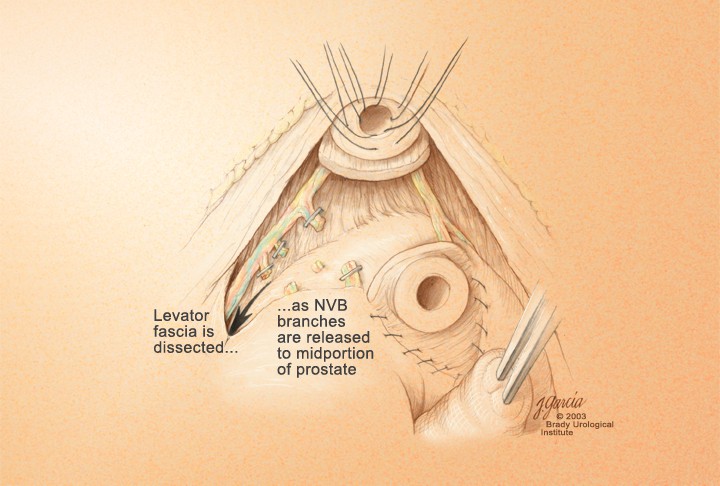
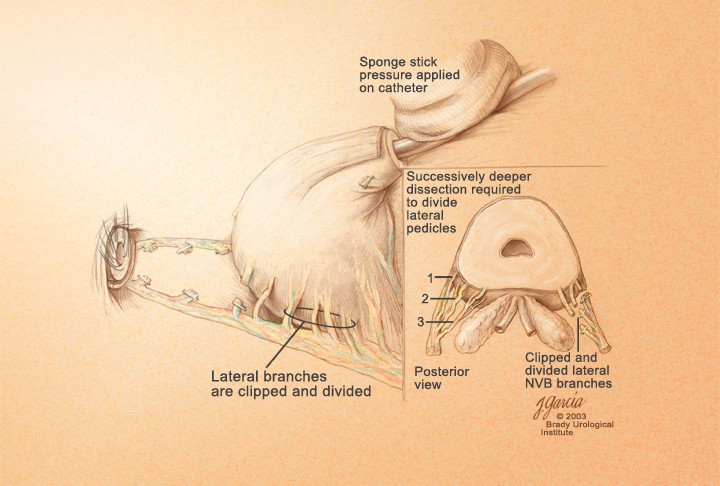
Идентификация и сохранение нервно-сосудистых пучков. После рассечения задней составляющей уретрального сфинктера и визуализации передней стенки прямой кишки, пальцем, скользя по передней стенке прямой кишки в краниальном направлении, производят ход между простатой и прямой кишкой вплоть до уровня семенных пузырьков. После этого пальцевого маневра отделение нервно-сосудистых пучков может начаться от верхушки простаты. Подтягивая простату с помощью катетера вверх и краниально остроконечными ножницами, скользя по поверхности простаты, от верхушки рассекают тонкий и мягкий слой фиброзно-жировых тканей, что и приводит к отделению нервно-сосудистого пучка. Латеральные сосудисто-нервные пучки предстательной железы дробно и поочерёдно берут на зажимы и лигируют резорбируемым шовным материалом. Мобилизацию производят до основания предстательной железы (рис 14).
Рисунок 14. Завершена мобилизация до основания простаты
Figure 14. Surgical release until prostate’s base is finished
Пересечение шейки мочевого пузыря и диссекция семенных пузырьков. Скальпелем поперечно рассекают шейку мочевого пузыря по передней поверхности на границе с простатой со вскрытием слизистой. Сдутым катетером Фолея, оба конца которого находятся в одном зажиме, выполняют любые тракции простаты при манипуляциях с ней. Разрез шейки расширяют в обе стороны, концентрически. Сразу сзади от шейки на 5 и 7 часах определяются нижние мочепузырные сосудистые ножки, идущие к простате. После их разделения и перевязки обнажается пространство между задней стенкой мочевого пузыря и передней стенкой семенных пузырьков, после чего простата переворачивается задней поверхностью вперед. Скальпелем рассекают фасцию Denonvillier по длине 1,5-2 см на границе простаты и семенных пузырьков. Оба семявыносящих протока перевязываются и пересекаются. Острым путем выделяют задние и боковые поверхности семенных пузырьков. Затем выделяют переднюю их поверхность, опасаясь повреждения треугольника Льето вблизи устьев мочеточников. Органокомплекс — простата и семенные пузырьки — удаляется (рис. 15.). Малый таз подвергается тщательной ревизии на предмет гемостаза.
Рисунок 15. Пересечение шейки мочевого пузыря
Figure 15. Transection of the bladder neck
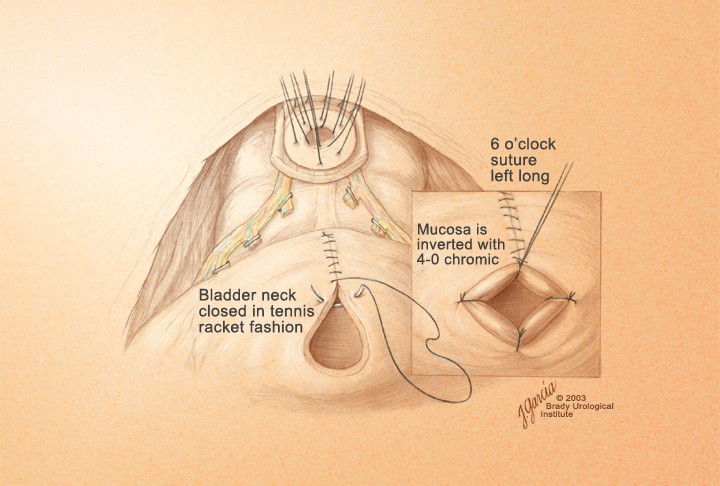
Формирование уретроцистоанастомоза. Диаметр шейки мочевого пузыря должен равняться 7-8 мм, т.е. соответствовать уретральному катетеру 22 Ск Наложением швов на шейку мочевого пузыря через все слои с помощью по- лисорба 3-0 формируют необходимый диаметр шейки, который должен соответствовать диаметру мембранозной уретры. Целесообразно осуществлять марсупиализацию слизистой, выполняемую полисорбом 4-0 в 6-8 точках по диаметру шейки так, чтобы стыковочный край шейки с уретрой был укрыт слизистой, после чего шейка пузыря адаптируется к анастомозу (рис. 16, 17).
Рисунок 16. Шейка мочевого пузыря после удаления простаты
Figure 16. The bladder neck after prostatectomy
Рисунок 17. Шейка мочевого пузыря перед созданием анастомоза
Figure 17. The bladder neck before anastomosis
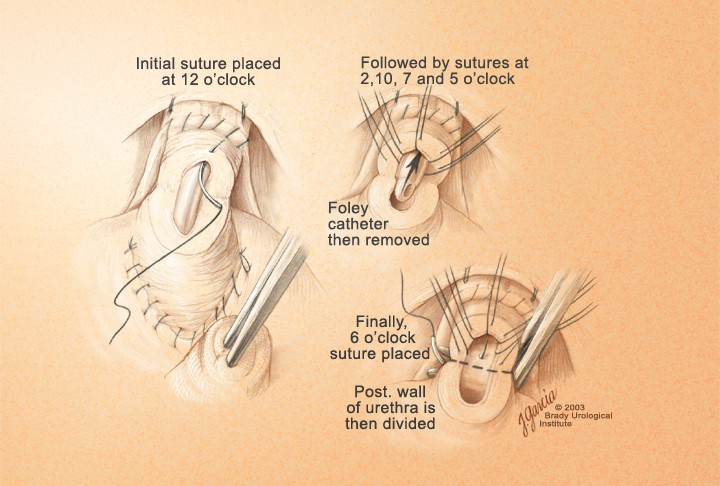
Наложение швов вначале производится на мембранозную уретру, в которую вводится металлический буж Гюйона или уретральный катетер. Они визуализируют просвет уретры перед её прошиванием (рис. 18.). Швы накладываются снаружи внутрь, причем локализация первого шва выбиралась наиболее удобным местом для первого вкола иглы.
Рисунок 18. Вид уретры перед завязыванием лигатур
Figure 18. Type of urethra before ligature binding
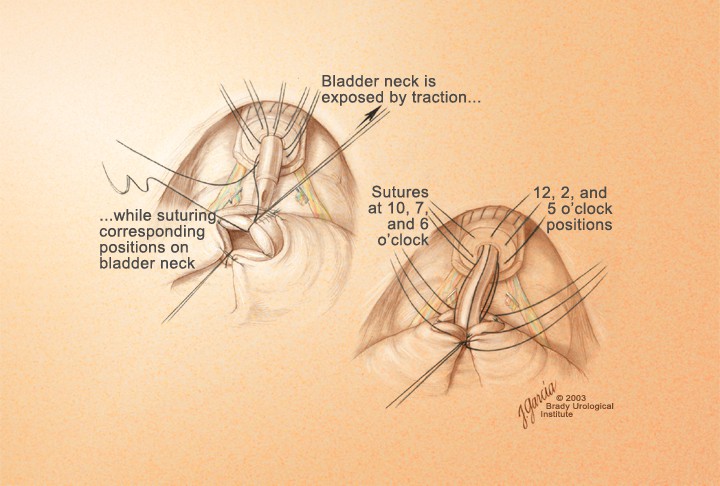
В качестве шовного материала используют биосин или монокрил 3-0. Достаточно наложения 5-6 нитей равномерно по всей окружности. В швы берется в зоне 5-7 часов задняя порция поперечнополосатого уретрального сфинктера, и нить проходит через все слои уретры в 2-2,5 мм от ее края. В зоне 12 часов в шов берется вместе со всей уретрой и дорсальный венозный комплекс. Таким образом, швы накладывали на 12, 3, 5, 7 и 9 часах (5 нитей) или на 12, 2, 4, 6, 8, 10 часах (6 нитей) условного циферблата (рис. 19). перед созданием цистоуретроанастомоза
Рисунок 19. Окончательный вид уретры
Figure 19. The final appearance of urethra
Далее, нити, проведенные через уретру, накладывают на соответствующие зоны шейки мочевого пузыря изнутри наружу последовательно, начиная с задних нитей (рис. 20). После проведения 3 задних нитей через шейку по уретре в мочевой пузырь устанавливают катетер Фолея 20-22 Ch, наполнив баллон до 10 мл. Затем проводят остальные нити. После декомпрессии раны живота (удаление ретрактора), подтягивают все нити и последовательно завязывают их, начиная с задних, заканчивая формирование уретроци- стоанастомоза (рис. 21, 22).
Рисунок 20. Натяжение лигатур
Figure 20. Ligatures intension
Рисунок 21. Сопоставление слизистой уретры и шейки пузыря
Figure 21. Apposition of urethral mucosa and bladder neck
Рисунок 22. Анастомоз
Figure 22. Anstomosis
Мочевой пузырь отмывают от мелких сгустков крови. Полость таза орошают антисептиком.
Полость таза дренируют силиконовыми трубками. Однорядно непрерывно ушивают апоневроз не рассасывающимся шовным материалом. На кожу — клипсы или отдельные швы.
Осложнения радикальной позадилонной простатэктомии
Частота тяжёлых осложнений после РПЭ в последнее время значительно снизилась и это связано с соблюдением анатомичности и накоплением хирургического опыта в выполнении операции.
Одним из частых и серьёзных интраоперационных осложнений является кровотечение из венозных коллекторов простаты. Повреждение вен Санториниева сплетения обычно происходит при рассечении внутритазовой фасции и при перевязке дорсального венозного комплекса. Остановить кровотечение позволяет ушивание дорсального венозного комплекса, но только после его полного пересечения, иначе тракции за простату при неполном пересечении дорсального венозного комплекса только усилят кровотечение за счет расширения отрытого просвета сосудов. Удовлетворительная визуализация операционного поля для выполнения последующих шагов, в частности пересечения уретры, возможно только после достижения полного гемостаза в венозном комплексе. При правильности выполнения и соблюдения анатомичности простатэктомии объём кровопотери, как правило, не превышает 500 мл.
Реже при РПЭ повреждается прямая кишка (до 3 %) и мочеточники (0,2 %). При обнаружении дефекта прямой кишки интраоперационно края прямокишечной раны освежаются и ушиваются двухрядным швом. Производят девульсию анального сфинктера. Между прямой кишкой и уретро-везикальным анастомозом целесообразно сделать прослойку путем использования пряди большого сальника. Эта тактика позволяет избежать развития раневой инфекции, абсцесса таза и ректоуретрального свища. В случае плохой коморбидности пациента полезно выполненные процедуры сопровождать наложением колосто- мы. Повреждение мочеточников происходит как правило в предпузырном отделе и требует их реимплантации в мочевой пузырь [2][3][8].
Ранние послеоперационные осложнения. Смертность в течение 30 дней после операции колеблется от 0 до 1,2 % и связана в основном тромбоэмболическими осложнениями магистральных сосудов сердечно-легочной системы, которые встречаются у 0,6-1,7 % больных. Профилактика этих осложнений должна быть направлена на соблюдение стандартных мероприятий, предусматривающих использование компрессии нижних конечностей и низкомолекулярных гепаринов.
Поздние осложнения радикальной позадилонной простатэктомии. Способность пациента к удержанию мочи после перенесенной РПЭ является одним из важнейших аспектов качества выполненного оперативного лечения. Недержание мочи — важнейшая социальная проблема, способная значительно ухудшить качество жизни пациента и снизить удовлетворённость проведённым лечением.
При выполнении РПЭ удержание мочи может быть сохранено, если часть рабдосфинктера, лежащая между верхушкой ПЖ и бульбозной уретрой, остаётся без повреждений. Континентность обеспечивается оставшейся частью сфинктера [2][6].
Эректильная функция
Онкологические результаты позадилонной радикальной простатэктомии
Заключение
Позадилонная РПЭ демонстрирует удовлетворительные параметры отдаленного онкологического контроля на большой когорте пациентов c РПЖ. Тщательная оценка соматического статуса необходима при отборе пациентов c РПЖ, особенно группы низкого риска, для РПЭ. В связи с этим необходимы дальнейшие исследования c целью верификации групп пациентов, которые могли бы претендовать на благоприятные показатели своей онкологической безопасности, ожидаемые от оперативного вмешательства.
Список литературы
2. Коган М.И., Лоран О.Б., Петров С.Б. Радикальная хи- рургия рака предстательной железы. М.: ГЭОТАР- Медиа; 2006.
3. Клиническая онкоурология. Под ред. Матвеева Б.П. М.; 2011.
4. Walsh PC, Lepor H, Eggleston JC. Radical prostatectomy with preservation of sexual function: Anatomical and pathological considerations. Prostate. 1983;4(5):473-85.
5. Mullins JK, Feng Z, Trock BJ, Epstein JI, Walsh PC, Loeb S. The impact of anatomical radical retropubic prostatectomy on cancer control: the 30-year anniversary. J Urol. 2012;188(6):2219-24. doi: 10.1016/j.juro.2012.08.028
6. Alemozaff ar M, Sanda M, Yecies D, Mucci LA, Stampfer MJ, Kenfi eld SA. Benchmarks for operative outcomes of robotic and open radical prostatectomy: results from the Health Professionals Follow-up Study. Eur Urol. 2015;67(3):432-8. doi: 10.1016/j.eururo.2014.01.039
7. Hu JC, Gandaglia G, Karakiewicz PI, Nguyen PL, Trinh QD, Shih YC, Abdollah F, Chamie K, Wright JL, Ganz PA, Sun M. Comparative effectiveness of robot-assisted versus open radical prostatectomy cancer control. Eur Urol. 2014;66(4):666-72. doi: 10.1016/j.eururo.2014.02.015
8. Клинические рекомендации Европейской ассоциации урологов, 2016. М.; 2016.
9. Myers RP, Goellner JR, Cahill DR. Prostate shape, external striated urethral sphincter and radical prostatectomy: the apical dissection. J Urol. 1987;138(3):543-50.
11. Han M, Partin AW, Pound CR, Epstein JI, Walsh PC. Longterm biochemical disease-free and cancer-specific survival following anatomic radical retropubic prostatec tomy. The 15-year Johns Hopkins experience. Urol Clin North Am. 2001;28(3):555-65.
12. Roehl KA, Han M, Ramos CG, Antenor JA, Catalona WJ. Cancer progression and survival rates following anatomical radical retropubic prostatectomy in 3,478 consecutive patients:long-term results. J Urol. 2004;172(3):910- 4. doi: 10.1097/01.ju.0000134888.22332.bb
Об авторе
д.м.н., доцент кафедры урологии и репродуктивного здоровья человека с курсом детской урологии-андрологии,