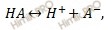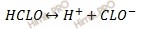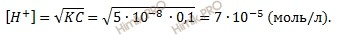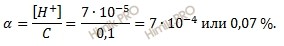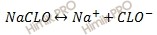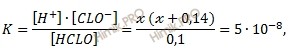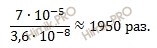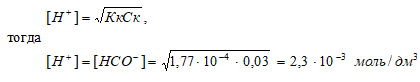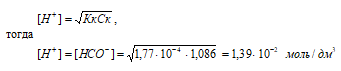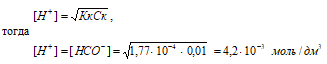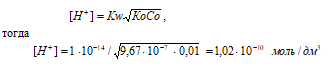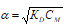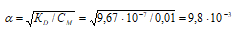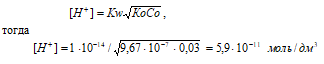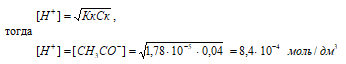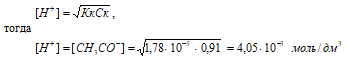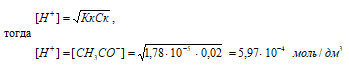Рассчитать концентрацию раствора mg no3 2 зная что степень диссоциации
Электролитическая диссоциация
Материалы портала onx.distant.ru
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Ассоциированные электролиты подразделяются на три типа:
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура t, о С | Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H + + Cl —
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na + + OH —
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na + + HSO3 —
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3 — → H + + SO3 2-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH + + Cl —
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH + → Mg 2+ + OH —
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6] 3- → Fe 3+ + 6CN —
Константа диссоциации
При растворении слабого электролита К А в растворе установится равновесие:
КА ↔ К + + А —
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации :
Kд = [К + ] · [А — ] /[КА] (2)
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α 2· с)/(1-α) (3)
Для практических расчетов при условии, что α
Кд = α 2· с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT 0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
Следовательно, концентрации ионов К + и РО4 3- равны соответственно 0,075М и 0,025М.
Решение. Уравнение диссоциации электролита:
Kд = αС · αС /(1 — αС)
Кд ≈ α 2 С
α = √( Кд / С) = √(1,76× 10 — 5 / 0,03 ) = 0,024 или 2,4 %
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
α = [Н + ] / Сисх(CH3CОOH)
Kд = [Н + ] 2 / Сисх(CH3CОOH)
Решение.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н + и СООН — в водном растворе приведены ниже:
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT 0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT 0 /RT= — 21500/(8,31 298) = — 8,68
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
13.2. К слабым электролитам в водных растворах относятся:
3. Определите концентрацию ионов NH4 + в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
Химик.ПРО – решение задач по химии бесплатно
Решение задачи
Запишем уравнение диссоциации хлорноватистой кислоты (HClO):
Найдем равновесную концентрацию ионов водорода ([H + ]) по формуле:
Вычислим степень диссоциации хлорноватистой кислоты (HClO), используя формулу вычисления степени диссоциации:
Запишем уравнение диссоциации гипохлорита натрия (NaClO):
Обозначим концентрацию ионов водорода (H + ) через х, тогда концентрация ионов ClO — будет равна:
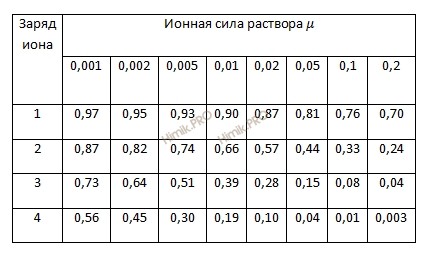
Из таблицы 1 находим, что для 0,2 раствора гипохлорита натрия (NaClO) (µ = 0,2) коэффициент активности ионов ƒ = 0,7, а αClO— составит 0,14 моля (0,2 ∙ 0,7).
Таблица 1. Приближенные значения средних коэффициентов активности (ƒ) в зависимости от ионной силы (µ) раствора и заряда иона
Подставим эти величины в выражение для константы диссоциации:
Так как х 2 величина очень маленькая, для упрощения вычислений пренебрегаем ею, тогда:
Найдем во сколько раз уменьшилась равновесную концентрацию ионов водорода ([H + ]), а следовательно и степень диссоциации:
Ответ:
равновесная концентрация ионов водорода уменьшится в 1950 раз.
Образец выполнения ТР №3 (Растворы электролитов) (2014)
Описание файла
Онлайн просмотр документа «Образец выполнения ТР №3 (Растворы электролитов) (2014)»
Текст из документа «Образец выполнения ТР №3 (Растворы электролитов) (2014)»
Примеры решения задач.
для ИТАЭ (гр. Тф – 9¸ 14)
ЗАДАЧА 1. Растворы кислот и оснований.
1. Напишите уравнение диссоциации заданного электролита в водном растворе. Определите, является этот электролит сильным или слабым.
Молярная масса вещества: МRbОН = 102,5 г/моль.
По определению массовой доли, в 100 г раствора электролита содержится 0,2 г RbОН. Соответственно, в 1 л раствора:
Рассчитаем молярную концентрацию вещества RbОН в растворе:
3. Рассчитайте водородный показатель рН раствора данного электролита. Плотность раствора r = 1 г/мл. По величине рН оцените, кислотную или щелочную реакцию среды имеет заданный раствор электролита.
Согласно уравнениям диссоциации, концентрация ионов в растворе электролита: сRb+ = сOH— =0,02 моль/л.
Ионная сила раствора:
Водородный показатель раствора электролита:
ЗАДАЧА 2. Растворы кислот и оснований.
Водородный показатель водного раствора H2CO3 рН=4,52.
1. По величине рН оцените, кислотную или щелочную реакцию среды имеет заданный раствор электролита.
Водородный показатель раствора
рН = 4,52 + + НCO3 – (1-я ступень),
Значения КД1 и КД2 берем из табл. 3.2. приложения.
Таким образом, равновесная концентрация ионов Н + в заданном растворе электролита:
Для оценочных расчетов степень диссоциации a можно считать по приближенной формуле закона разведения Оствальда:
Равновесная концентрация ионов H + и НCO3 – в растворе (по 1-ой ступени диссоциации):
Решаем систему из этих двух уравнений и получаем выражение для расчета молярной концентрации раствора электролита:
Эквивалент молекулы H2CO3 равен 1/2 молекулы: Э(H2CO3 ) =1/2 H2CO3. Соответственно, в одном моле H2CO3 содержится 2 моль-эквивалента. Следовательно, для H2CO3 молярная концентрация эквивалента
ЗАДАЧА 3. Растворы солей.
1. Напишите уравнение диссоциации заданного электролита в водном растворе. Определите, является этот электролит сильным или слабым.
2. Напишите уравнение гидролиза заданной соли по всем возможным ступеням. Оцените, кислую, нейтральную или щелочную реакцию среды имеет водный раствор данной соли.
Al 3+ + Н2О ↔ AlОН 2+ + Н +
Равновесная концентрация ионов H + в растворе (по 1-ой ступени гидролиза):
Водородный показатель раствора:
Выражение для произведения растворимости ПР малорастворимого электролита As2S3:
2. По табличным значениям ПР рассчитайте предельную растворимость ( Ср , моль/л ) для полученного малорастворимого электролита.
Предельная растворимость полученного малорастворимого электролита:
3. Рассчитайте, в каком объеме воды можно растворить заданную массу ( m, г ) полученного малорастворимого вещества.
Объем воды, в котором можно растворить заданную массу полученного малорастворимого вещества ( m = 0,3 г ) :
Табл. 3.1. Приближенные коэффициенты активности отдельных ионов
Как правильно рассчитать константу диссоциации слабого электролита
1. Вычисление степень диссоциации уксусной кислоты
Для расчета будем использовать формулу: [H + ] = СМ · α
α = [H + ]/CM(CH3COOH) = (1,3 · 10 –3 )/0,1 = 1,3 · 10 –2 или 1,3%.
2. Вычисление константы диссоциации уксусной кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
Ответ: KD(СН3СООН) = 1,71 · 10 –5 ; альфа = 1,3%.
1. Вычисление концентрацию муравьиной кислоты
Концентрацию кислоты находим из вычисления:
СМ(НСООН) = [(w% · 1000г)/100%]/M(НСООН); СМ(НСООН) = [(0,46% · 1000г)/100%]/46 г/моль = 0,1 моль/дм3.
2. Вычисление константы диссоциации НСООН
В случае слабых электролитов константа диссоциации определяется по формуле:
Задача 96.
Вычислите константу диссоциации диметиламина, если в 0,2 М растворе он диссоциирован на 7,42%.
Решение:
M[(CH3)2NH] = 45,08 г/моль;
CM[(CH3) 2 NH] = 0,2 М;
α = 7,42% или 0,0742.
1. Вычисление константы диссоциации (CH3)2NH
В случае слабых электролитов константа диссоциации определяется по формуле:
1. Вычисление степень диссоциации этановой кислоты
Для расчета будем использовать формулу: [H + ] = СМ · α
α = [H + ]/CM(C2H5COOH) = (1,2 · 10 –2 )/0,2 = 6,0 · 10 –2 или 6%.
2. Вычисление константы диссоциации кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
Как вычислить концентрацию ионов в растворе электролита и рН раствора
а) 0,03 М НСООН
Диссоциация муравьиной кислоты: HCOOH = Н + + НСОО – ;
НСООН – слабая кислота. Для слабых кислот [H + ] вычисляется по формуле:
рН = –lg[H + ] = –lg2,3 · 10 –3 = 3 – lg2,3 = 2,64.
Ответ: [H + ] = [HCOO – ] = 2,3 · 10 –3 моль/ дм 3 ; рН = 2,64.
б) растворе (w% = 5,0%)
Концентрацию кислоты находим из вычисления: CM(HCOOH) = [(w% · 1000г)/100%]/M(НСООН); CM(HCOOH) = [(5% · 1000г)/100%]/46,03 г/моль = 1,086 моль.
Рассчитаем [H + ] и [HCOO – ]
рН = –lg[H + ] = –lg1,39 · 10 –2 = 2 – lg1,39 = 1,86.
Ответ: [H + ] = [HCOO – ] = 1,39 · 10 –2 моль/дм 3 ; рН = 1,86.
в) растворе, содержащем 4,6 г/дм 3 НСООН
Концентрацию кислоты находим из вычисления: CM(HCOOH) = m(HCOOH)/М(HCOOH) = 4,6/46,03 = 0,01 M.
Рассчитаем [H + ] и [HCOO – ]
рН = –lg[H + ] = –lg4,2 · 10 –3 = 3 – lg4,2 = 2,38.
Ответ: [H + ] = [HCOO – ] = 4,2 · 10 –3 моль/дм 3 ; рН = 2,38.
а) 0,01 М NH2OH
Диссоциация гидроксиламина: NH2OH + H2O = NH3OH+ + OH–
NH2OH – слабое основание. Для слабых оснований [H + ] вычисляется по формуле:
рН = –lg[H + ] = –lg1,02 · 10 –10 = 10 – lg1,02 = 9,99.
Так как гидроксиламин (NH2OH) является слабым электролитом, то для расчета применяют упрощенную формулу закона разбавления Оствальда:
где: α – степень диссоциации; KD – константа диссоциации; CM – молярная концентрация электролита.
Подставим данные задачи в уравнение Оствальда, получим:
Теперь рассчитаем концентрацию гидроксид ионов, получим:
Ответ: а) [H + ] = 1,02 · 10– 10 моль/дм 3 ; [ОН – ] = 9,80 · 10 –5 моль/дм 3 ; рН = 9,99.
б) растворе NH2OH (w% = 0,1%)
Концентрацию гидроксиламина находим из вычисления:
Рассчитаем [H + ], получим:
а) 0,04 М СН3СООН
Диссоциация уксусной кислоты: СH3COOH ⇔ Н + + СН3СОО – ;
СН3СООН – слабая кислота. Для слабых кислот [H + ] вычисляется по формуле:
рН = –lg[H + ] = –lg8,4 · 10 –4 = 4 – lg8,4 = 3,08.
Ответ: [H + ] = [HCOO – ] = 8,4 · 10 –4 моль/ дм 3 ; рН = 3,08.
б) растворе (w% = 5,5%)
Концентрацию кислоты находим из вычисления:
СМ(СH3COOH) = [(w% . 1000г)/100%]/M(СН3СООН); СМ(СH3COOH) = [(5,5% . 1000г)/100%]/60 г/моль = 0,92 моль.
Рассчитаем [H + ] и [СH3COO – ]
рН = –lg[H + ] = –lg4,05 · 10 –3 = 3 – lg4,05 = 2,39.
Ответ: [H + ] = [СH3COO – ] = 4,05 · 10 –3 моль/дм 3 ; рН = 2,39.
в) растворе, содержащем 1,2 г/дм 3 CН3СООН
Концентрацию кислоты находим из вычисления: (CM(СH3COOH) = m(СH3COOH)/М(СH3COOH) = 1,2/60 = 0,02 M.
Рассчитаем [H + ] и [СH3COO – ]
рН = –lg[H + ] = –lg5,97 · 10 –4 = 4 – lg5,97 = 3,22.
Ответ: [H + ] = [СH3COO – ] = 5,97 · 10 –4 моль/дм3; рН = 3,22.