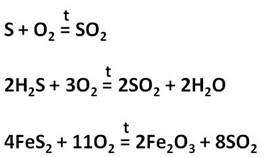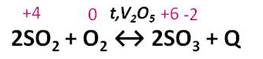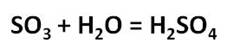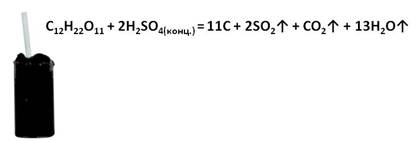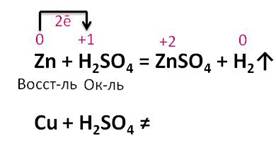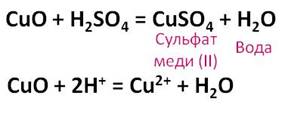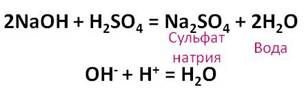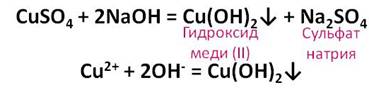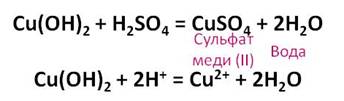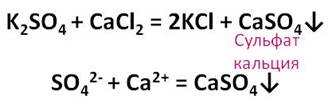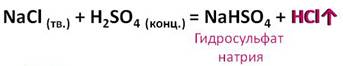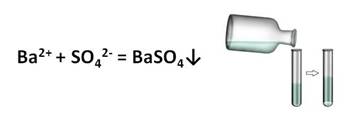Разбавленная и концентрированная кислота в чем разница
Серная кислота и её соли
Урок 21. Химия 9 класс ФГОС
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Серная кислота и её соли»
Серная кислота и её соли
Как получают серную кислоту? Получают серную кислоту в три стадии.
В качестве сырья для получения серной кислоты применяют серу, сероводород или пирит. При обжиге этих соединений образуется сернистый газ.
Затем проводят реакцию окисления оксида серы (IV) до оксида серы (VI). Эта реакция протекает при высокой температуре и в присутствии катализатора – оксида ванадия (V).
Оксид серы (VI) представляет собой летучую бесцветную жидкость с удушливым запахом. Этот оксид при растворении в воде образует серную кислоту.
Однако, при получении серной кислоты оксид серы (VI) растворяют не в воде, а в концентрированной серной кислоте, при этом получается олеум – раствор оксида серы (VI) в безводной серной кислоте.
Поэтому производство серной кислоты идёт в три стадии: на первой стадии из исходного сырья получают оксид серы (IV), на второй стадии из оксида серы (IV) получают оксид серы (VI), а на третьей стадии из оксида серы (VI) получают серную кислоту.
Производство серной кислоты создаёт ряд проблем: выбросы от производств оказывают негативное воздействие на животный и растительный мир, повышается коррозионная стойкость материалов, разрушаются сооружения из мрамора и известняка, а также происходит закисление почв.
Серная кислота – H2SO4 – бесцветная маслянистая и тяжёлая жидкость. Она обладает сильными гигроскопическими, то есть водоотнимающими свойствами, это позволяет использовать её для осушения газов или других веществ.
Концентрированная серная кислота способна отнимать воду у молекул органических веществ, обугливая их. Например, при добавлении к сахару концентрированной серной кислоты сахар чернеет и в виде объёмной массы поднимается вверх.
Помните, при разбавлении концентрированной серной кислоты нельзя приливать воду к кислоте, а следует тоненькой струйкой приливать кислоту в воду, чтобы избежать сильного разогревания раствора.
Химические свойства разбавленной и концентрированной серной кислоты отличаются.
Так разбавленная серная кислота проявляет все характерные свойства кислот. Она изменяет окраску индикаторов: лакмус в растворе кислоты красный, метиловый оранжевый тоже.
Серная кислота вступает во взаимодействие с металлами, стоящими в ряду напряжений металлов до водорода.
Нальём в две пробирки раствора серной кислоты, в первую пробирку поместим гранулу цинка, а во вторую – кусочек меди. Выделение водорода идёт только в первой пробирке, во второй пробирке изменений нет
Цинк, в отличие от меди, стоит в ряду напряжений металлов до водорода, поэтому он вытеснил водород из раствора кислоты. При чем, это окислительно-восстановительная реакция, цинк повышает свою степень окисления с 0 до +2, а водород понижает с +1 до 0. Каждый атом цинка отдаёт по 2 электрона ионам водорода. Поэтому цинк – восстановитель, а водород – окислитель.
Разбавленная серная кислота реагирует с основными и амфотэрными оксидами с образованием соли и воды. Если поместить в пробирку немного чёрного порошка оксида меди (II) и прилить немного раствора серной кислоты, а затем содержимое нагреть на пламени спиртовки, то постепенно чёрный порошок оксида меди (II) начинает растворяться, а раствор меняет свою окраску на голубую.
В результате данной реакции образуется соль – сульфат меди (II) и вода.
Разбавленная серная кислота вступает во взаимодействие с основаниями. Например, к раствору щёлочи добавим несколько капель фенолфталеина, раствор приобретает малиновую окраску. К этому раствору прильём разбавленную серную кислоту до исчезновения окраски. Таким образом, между щёлочью и кислотой прошла реакция нейтрализации, при этом образовалась соль – сульфат натрия и вода.
Разбавленная серная кислота реагирует не только с растворимыми основаниями – щелочами, но и с нерастворимыми. Получим нерастворимое основание – гидроксид меди (II). Для этого, в раствор медного купороса прильём щёлочи – гидроксид натрия, в результате чего образуется гидроксид меди (II) и соль – сульфат натрия.
Теперь, к этому осадку добавим раствор серной кислоты до его исчезновения. В результате данной реакции образуется соль – сульфат меди (II) и вода.
Кроме этого, разбавленная серная кислота реагирует с солями. Прильём к раствору сульфата калия раствор хлорида кальция. В результате образуется малорастворимое вещество белого цвета. Это сульфат кальция.
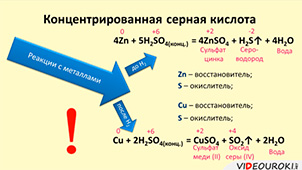
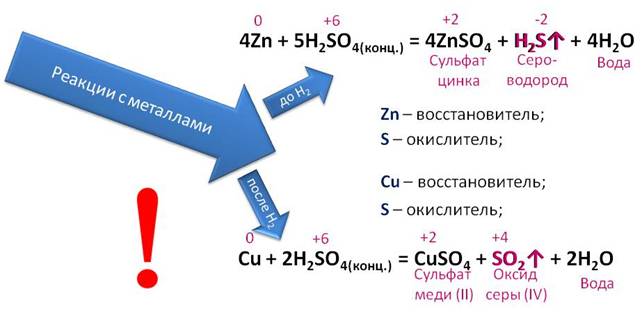
Концентрированная серная кислота также реагирует с металлами. Если металл стоит в ряду напряжений до водорода, то в результате реакции образуется газ сероводород и вода.
В реакции с металлами, стоящими после водорода образуется оксид серы (IV). Например, при взаимодействии меди с концентрированной серной кислотой, образуется соль – сульфат меди (II), оксид серы (IV) и вода. В этой реакции медь повышает свою степень окисления с 0 до +2, а сера понижает с +6 до +4. Поэтому медь восстановитель, а сера – окислитель.
Обратите внимание, что в данных реакциях водород не выделяется, потому что здесь окислителем выступает не водород, а сера.
Железо и алюминий пассивируются концентрированной серной кислотой, потому что покрываются защитной плёнкой, что позволяет перевозить её в стальных и алюминиевых цистернах.
Концентрированная серная кислота вытесняет кислоты из их солей. Например, если к твёрдому хлориду натрия добавить концентрированной серной кислоты, то образуется соль – гидросульфат натрия и хлороводород.
Серная кислота – это двухосновная кислота, поэтому она образует средние и кислые соли. Соли серной кислоты – сульфаты. Например, Na2SO4 – сульфат натрия, NaHSO4 – гидросульфат натрия.
Качественной реакцией на серную кислоту и её соли является ион бария. В результате взаимодействия сульфат-иона и иона бария образуется сульфат бария – осадок белого цвета.
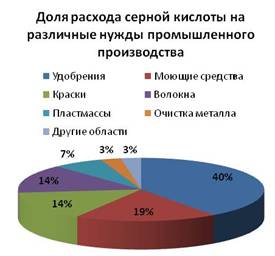
Серная кислота находит широкое применение. Она используется при производстве взрывчатых веществ, минеральных удобрений, электролитической меди, моющих средств, эмалей и красок, искусственного шёлка, лекарств, пластмасс, при очистке нефтепрдуктов, в качестве электролита в аккумуляторах.
Среди солей серной кислоты наиболее распространена глауберова соль – Na2SO4 ∙ 10H2O, гипс – CaSO4 ∙ 2H2O, BaSO4 – сульфат бария и CuSO4 ∙ 5H2O – медный купорос, который используют для борьбы с вредителями и болезнями растений.
Таким образом, серную кислоту получают в три стадии, она представляет собой тяжёлую маслянистую жидкость. При разбавлени концентрированной кислоты следует кислоту приливать к воде, а не наоборот. Свойства разбавленной и концентрированной кислот различаются. Разбавленная серняа кислота реагирует с металлами до водорода, основными и амфотэрными оксидами, с основаниями и солями, а концентрированная серная кислота взаимодействует с металлами и до водорода и после водорода (кроме золота и платины), она пассивирует железо и алюминий, а также реагирует с солями. Серная кислота и её соединения находят широкое применение в промышленности.
Серная кислота
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.
Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:
Химические свойства
В водном растворе диссоциирует ступенчато.
С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)
Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические свойства серной кислоты – концентрированной и разбавленной (9 класс, химия)
Серная кислота – одна из сильнейших кислот, представляющая собой маслянистую жидкость. Химические свойства серной кислоты позволяют широко применять её в промышленности.
Общее описание
Серная кислота (H2SO4) обладает характерными свойствами кислот и является сильным окислителем. Это наиболее активная неорганическая кислота с температурой плавления 10°C. Кислота закипает при 296°C с выделением воды и оксида серы SO3. Способна поглощать пары воды, поэтому её используют для осушения газов.
Рис. 1. Серная кислота.
Серную кислоту получают промышленным путём из диоксида серы (SO2), который образуется при горении серы или серного колчедана. Два основных способа образования кислоты:
Раствор SO3 в серной кислоте называется олеумом. Его также используют для получения серной кислоты.
Рис. 2. Процесс получения серной кислоты.
Реакция с водой способствует выделению большого количества тепла. Поэтому к воде примешивают кислоту, а не наоборот. Вода легче кислоты, она остаётся на поверхности. Если добавить воду в кислоту, вода мгновенно закипит, что приведёт к разбрызгиванию кислоты.
Свойства
Серная кислота образует два вида солей:
Химические свойства концентрированной серной кислоты представлены в таблице.
Реакция
Что образуется
Пример
– С активными: 2H2SO4 + Mg → MgSO4 + SO2 + 2H2O
– с металлами средней активности: 4H2SO4 + 2Cr → Cr2(SO4)3 + 4H2O + S;
– с малоактивными: 2H2SO4 + Cu → CuSO4 + SO2 + 2Н2О
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
– Металлов: H2SO4 + CuO → CuSO4 + H2O;
– неметаллов: H2SO4 + CO → CO2 + SO2 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O
Качественная реакция: H2SO4 + BaCl2 → BaSO4 (белый осадок) + 2HCl
Окисление сложных веществ
H2SO4 + 2HBr → Br2 + SO2 + 2H2O;
H2SO4 + 2HI → I2 + 2H2O + SO2
Обугливание сахаров (целлюлозы, крахмала, глюкозы)
C6H12O6 + 12H2SO4 → 18H2O + 12SO2↑ + 6CO2↑
Рис. 3. Реакция с сахаром.
Разбавленная кислота не окисляет малоактивные металлы, стоящие в электрохимическом ряду после водорода. При взаимодействии с активными металлами (литием, калием, натрием, магнием) выделяется водород и образуется соль. Концентрированная кислота проявляет окислительные свойства с тяжёлыми, щелочными и щелочноземельными металлами при нагревании. Отсутствует реакция с золотом и платиной.
Серная кислота (разведённая и концентрированная) на холоде не взаимодействует с железом, хромом, алюминием, титаном, никелем. Благодаря пассивации металлов (образования защитной оксидной плёнки) серную кислоту можно перевозить в металлических цистернах. Оксид железа разрушается при нагревании.
Что мы узнали?
Из урока 9 класса узнали о свойствах серной кислоты. Это мощный окислитель, вступающий в реакции с металлами, неметаллами, органическими соединениями, солями, основаниями, оксидами. При взаимодействии с водой выделяется тепло. Получают серную кислоту из оксида серы. Концентрированная кислота без нагревания не взаимодействует с некоторыми металлами, что позволяет перевозить кислоту в металлической таре.
Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.
Валентность серы в серной кислоте равна VI.
Способы получения
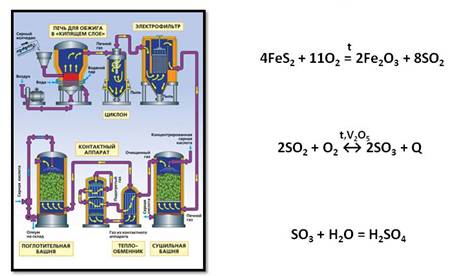
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
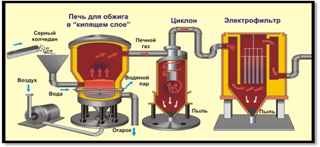
Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800 о С |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3): Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне. Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
Химические свойства
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
4. Т акже серная кислота вступает в обменные реакции с солями.
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород: