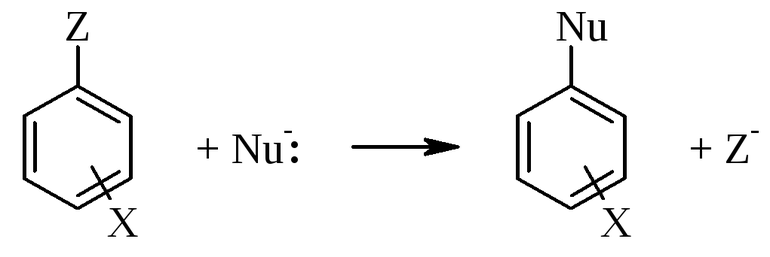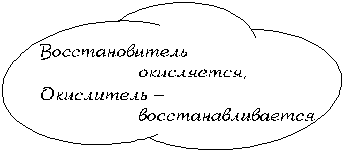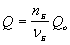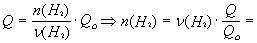Реакция замещения как понять что
Общие сведения
Все вещества принято разделять на два вида. Химические тела, образованные атомами одного химического реагента, называют простыми. Например, железо, в состав которого входят молекулы, образованные атомами Fe. Тела, состоящие из атомов разных элементов, относят к сложному виду — например, серная кислота. Состоит H2SO4 из молекул, образующихся атомами водорода, серы и кислорода.
В процессе химических взаимодействий новые вещества получаются только из тех атомов, которые имелись в исходном состоянии. Для того чтобы понять, по каким признакам происходит классификация химических реакций, следует рассмотреть несколько уравнений.
Медь, взаимодействуя с кислородом, образует оксид меди два: 2Cu + O2 — 2CuO. При смешении сульфата меди и гидроксида натрия образуется синий гидроксид меди и сульфат натрия: CuSO4 + 2NaOH — Cu (OH)2 + Na2SO4. Оксид гидраргиума распадается на двухвалентный кислород и ртуть: 2HgO — 2Hg + O2. Кальций, соединяясь с углекислым газом, образует карбонат: CaO +CO2 — CaCO3. Цинк при смешении с серной кислотой вытесняется ею: Zn + H2SO4 — ZnSO4 + H2, гидроксид железа распадается на трёхвалентное железо и воду: 2Fe (OH) — Fe2O3 + 3H2O.
Таким образом, различные реакции можно объединить в группы по количеству, составу и качеству исходных веществ и продуктов. Всего их существует четыре вида:
Впервые высказал предположение о классификации реакций Д. И. Менделеев. Судить об их прохождении можно по изменению цвета, выпадению осадка, выделению газа, образованию свечения.
Механизмы взаимодействия
Протекание реакций замещения в органической химии описывают механизмами. Под ними понимают процесс детального изучения всех стадий и промежуточных веществ, а также природы взаимодействия реагентов между собой. Ими описывают характер разрыва связей и изменение энергии при переходе из начального состояния в конечное.
Механизмы замещения характеризуют по наиболее часто используемой классификации Ингольда, основоположником многих понятий органической химии. По его таблице, реакцию замещения (S) разделяют по составу частиц входящих во взаимодействия. Она бывает:
Это удобная классификация, хотя они и не учитывает молекулярность соединений. Её альтернативной является разделение по Июпаку. Оно реже используется и основано на описании базовых актов создания и уничтожения связей. Предложена классификация была в 1988 году. Июпак утверждал, что использование классификации Ингольда вызывает двусмысленные ситуации, когда одно объяснение может использоваться для разного замещения, например, одностадийного ароматического замещения и двустадийной реакции алифатического атома углерода.
В его описании используются символы A и D, пишущиеся слитно при отщеплении и разделенные плюсом, если стадии происходят отдельно. Нижние индексы обозначают тип реакции. Такое описание обычно громоздкое, поэтому в учебной литературе редко когда приводится.
Электрофильные и нуклеофильные
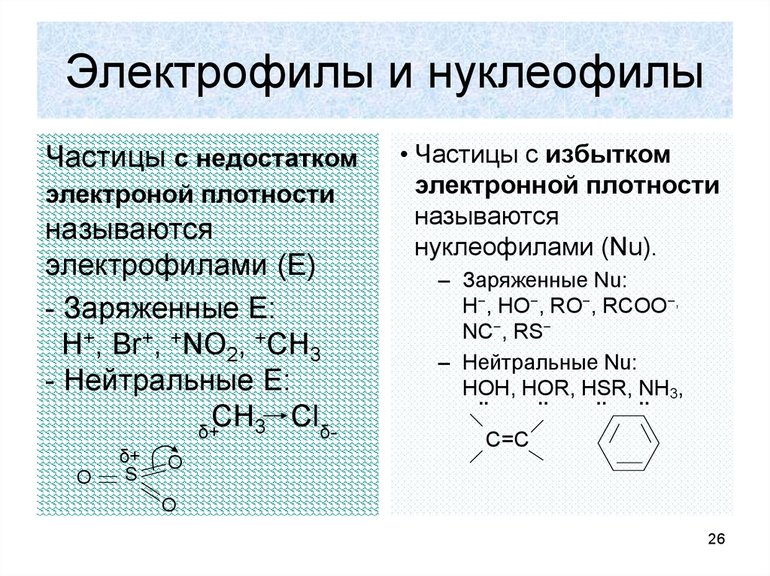
Самое важное, что нужно знать об электрофильных реакциях, это то, что существует два варианта разрыва связи: монополярная и гетерополярная. В первом случае электронная пара разрушающегося соединения не разрывает связь с атомом углерода. Например, вещество, для которого характерна реакция замещения, метан: H3CH — H3C +H, то есть из предельного углеводорода образуется отрицательно заряженный карбанион, а электронная пара остаётся у атома углерода.
Карбанионы могут быть разной гибридизации sp2 и sp3. Чем больше их устойчивость, тем у них ниже способность к реакциям. Определяется она степенью делокализации заряда у атома углерода. Устойчивость уменьшается в ряду: фенил — винил — циклопропил — метил. Самая слабая у вторичного и третичного карбаниона (разделение происходит по количеству связей углерода).
Нуклеофильная реакция будет протекать при разрушении углеродной связи. В этом случае электронная пара отсоединяется. Образуется углеродный ион с положительным зарядом. Формула записи будет соответствовать виду: H3C: Cl — H3C+: Cl-. Образуемый элемент носит название карбкатион. Электронная пара теряет атом углерода. Положительный заряд находится в sp2-гибридизации, то есть, меняет своё валентное состояние на более энергетически выгодное. Устойчивость карбкатионов определяется степенью делокализации. Она увеличивается в ряду метил — катион — первичный — вторичный — третичный.
Радикальные реакции
Затормозить свободнорадикальные реакции можно ингибиторами или инициаторами, так как они очень реакционноспособные частицы. В качестве ингибиторов выступает кислород, йод, полифенол, амин и другие соединения. Есть два способа появления радикалов:
Устойчивое состояние определяется делокализацией свободной частицы, пространственным и конформационным фактором. К первичным радикалам относят: метилы, этилы, пропилы и изобутилы. К вторичным — изопропилы, втор-бутилы, а к третичным — трет-бутилы. Стабилизация возрастает от первичных к третичным.
Наиболее типичным механизмом является реакция замещения хлорирования метана:
CH 4 + Cl 2 — CH3Cl + HCl.
При радикальном замещении происходит следующее:
К более серьёзным реакциям относится взаимодействие брома с пропаном в результате термолиза: CH3CH2CH3 + Br2 — CY3CHCH3: Br + HBr. При обрыве цепи, после взаимодействия двух радикалов, образуется молекула брома. Реакция радикала с изопропилом приводит к появлению двух бром пропан, а также образованию соединение «два, три диметилбутан».
Взаимодействие с галогенами зависит от их расположения и соответствует следующему: F2 > Cl2 > Br2 > I2. С йодом реакция уже не идёт.
Типичное замещение
Различные задания на определение типа реакций начинают решать в восьмом классе. Для того чтобы решать задачи, необходимо не только правильно знать, как записать процесс, но и определить невозможный тип, а также различать вид термического процесса. Ведь протекание любой химической реакции невозможно без поглощения или выделения тепла. Такие процессы соответственно называются экзотермическими и эндотермическими.
К особенностям элементов, способных участвовать в реакции, относят:
Все эти элементы могут вступать в реакцию с образованием простого или сложного нового вещества. Во время процесса образуются новые соединения. Это происходит до тех пор, пока не иссякнут все свободные радикалы.
Примеры и онлайн-решения
Реакции замещения в своём большинстве являются окислительно-восстановительными. Примеры процессов, в которых не наблюдается изменение степени окисления, немногочисленны.
Из распространённых реакций, можно привести следующие:
Для проверки своих знаний существуют интернет-сервисы, позволяющие быстро решить любое химическое уравнение онлайн, например, chemequations.com. Пользоваться им сможет любой, даже тот, кто не умеет правильно указать обозначения химических элементов. Для работы с сайтом необходимо написать части соединения (система будет сама предлагать правильное их обозначение) и нажать «Поиск». Правильное решение будет рассчитано автоматически.
Классификация химических реакций
Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
В ходе химической реакции разрушаются химические связи, и образуются новые.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
2. Реакции, протекающие с изменением состава
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
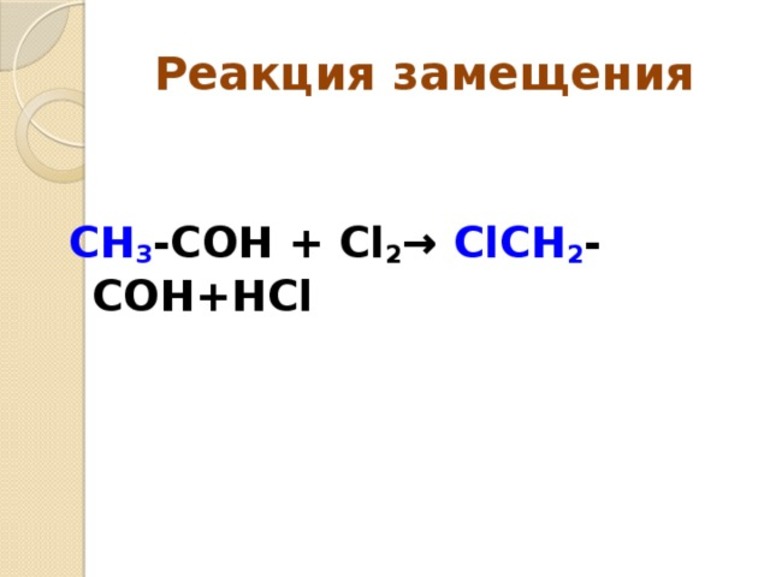
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
Реакция газообразного водорода с твердым йодом также эндотермическая:
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Также экзотермическими являются:
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Также эндотермическими являются:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практичсеки не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так: A + K = AK; AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом. К обратимым реакциям относятся большинство гомогенных реакций, этерификация; реакции гидролиза; гидрирование-дегидрирование, гидратация-дегидратация; получение аммиака из простых веществ, окисление сернистого газа, получение галогеноводородов (кроме фтороводорода) и сероводорода; синтез метанола; получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях. Примеры необратимых реакций: горение; реакции, идущие со взрывом; реакции, идущие с образованием газа, осадка или воды в растворах; растворение щелочных металлов в воде; и др.
Реакция замещения как понять что
9.1. Какие бывают химические реакции
Вспомним, что химическими реакциями мы называем любые химические явления природы. При химической реакции происходит разрыв одних и образование других химических связей. В результате реакции из одних химических веществ получаются другие вещества (см. гл. 1).
Выполняя домашнее задание к § 2.5, вы познакомились с традиционным выделением из всего множества химических превращений реакций четырех основных типов, тогда же вы предложили и их названия: реакции соединения, разложения, замещения и обмена.
| Реакции соединения – химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество. |
Примеры реакций соединения:
| Реакции разложения – химические реакции, в которых из одного сложного по элементному составу вещества получаются два или несколько менее сложных веществ. |
Примеры реакций разложения:
| Реакции замещения – химические реакции, в которых атомы или группы атомов одного из исходных веществ замещают атомы или группы атомов в другом исходном веществе. |
Примеры реакций замещения:
| Реакции обмена – химические реакции, в которых исходные вещества как бы обмениваются своими составными частями. |
Примеры реакций обмена:
Ba(OH)2 + H2SO4 = BaSO4 + 2H2O; (10)
HCl + KNO2 = KCl + HNO2; (11)
AgNO3 + NaCl = AgCl + NaNO3. (12)
Традиционная классификация химических реакций не охватывает все их разнообразие – кроме реакций четырех основных типов существует еще и множество более сложных реакций.
Выделение двух других типов химических реакций основано на участии в них двух важнейших нехимических частиц: электрона и протона.
При протекании некоторых реакций происходит полная или частичная передача электронов от одних атомов к другим. При этом степени окисления атомов элементов, входящих в состав исходных веществ, изменяются; из приведенных примеров это реакции 1, 4, 6, 7 и 8. Эти реакции называются окислительно-восстановительными.
| Окислительно-восстановительные реакции (ОВР) – химические реакции, в которых происходит изменение степеней окисления атомов, входящих в состав реагирующих веществ. |
В другой группе реакций от одной реагирующей частицы к другой переходит ион водорода (Н + ), то есть протон. Такие реакции называют кислотно-основными реакциями или реакциями с передачей протона.
| Кислотно-основные реакции (КОР) – химические реакции, сопровождающиеся передачей протона. |
Среди приведенных примеров такими реакциями являются реакции 3, 10 и 11. По аналогии с этими реакциями окислительно-восстановительные реакции иногда называют реакциями с передачей электрона. С ОВР вы познакомитесь в § 2, а с КОР – в следующих главах.


а) HgO Hg + O2
(t); б) Li2O + SO2
Li2SO3; в) Cu(OH)2
CuO + H2O
(t);
г) Al + I2 AlI3; д) CuCl2 + Fe
FeCl2 + Cu
; е) Mg + H3PO4
Мg3(PO4)2 + H2
;
ж) Al + O2 Al2O3 (t); и) KClO3 + P P2O5 + KCl (t); к) CuSO4 + Al
Al2(SO4)3 + Cu
;
л) Fe + Cl2 FeCl3 (t); м) NH3 + O2
N2 + H2O (t); н) H2SO4 + CuO
CuSO4 + H2O.
Укажите традиционный тип реакции. Отметьте окислительно-восстановительные и кислотно-основные реакции. В окислительно-восстановительных реакциях укажите, атомы каких элементов меняют свои степени окисления.
Рассмотрим окислительно-восстановительную реакцию, протекающую в доменных печах при промышленном получении железа (точнее, чугуна) из железной руды:
Определим степени окисления атомов, входящих в состав как исходных веществ, так и продуктов реакции
Как видите, степень окисления атомов углерода в результате реакции увеличилась, степень окисления атомов железа уменьшилась, а степень окисления атомов кислорода осталась неизменной. Следовательно, атомы углерода в этой реакции подверглись окислению, то есть потеряли электроны (окислились), а атомы железа – восстановлению, то есть присоединили электроны (восстановились) (см. § 7.16). Для характеристики ОВР используют понятия окислитель и восстановитель.
Таким образом, в нашей реакции атомами-окислителями являются атомы железа, а атомами-восстановителями – атомы углерода.
| Вещество-окислитель – исходное вещество данной ОВР, содержащее атомы-окислители |
| Вещество-восстановитель – исходное вещество данной ОВР, содержащее атомы-восстановители. |
В нашей реакции веществом-окислителем является оксид железа(III), а веществом-восстановителем – оксид углерода(II).
В тех случаях, когда атомы-окислители и атомы-восстановители входят в состав одного и того же вещества (пример: реакция 6 из предыдущего параграфа), понятия » вещество-окислитель» и » вещество-восстановитель» не используются.
Таким образом, типичными окислителями являются вещества, в состав которых входят атомы, склонные присоединять электроны (полностью или частично), понижая свою степень окисления. Из простых веществ это прежде всего галогены и кислород, в меньшей степени сера и азот. Из сложных веществ – вещества, в состав которых входят атомы в высших степенях окисления, не склонные в этих степенях окисления образовывать простые ионы: HNO3 (N +V ), KMnO4 (Mn +VII ), CrO3 (Cr +VI ), KClO3 (Cl +V ), KClO4 (Cl +VII ) и др.
Типичными восстановителями являются вещества, в состав которых входят атомы, склонные полностью или частично отдавать электроны, повышая свою степень окисления. Из простых веществ это водород, щелочные и щелочноземельные металлы, а также алюминий. Из сложных веществ – H2S и сульфиды (S –II ), SO2 и сульфиты (S +IV ), йодиды (I –I ), CO (C +II ), NH3 (N –III ) и др.
В общем случае почти все сложные и многие простые вещества могут проявлять как окислительные, так и восстановительные свойства. Например:
SO2 + Cl2 = S + Cl2O2 (SO2 – сильный восстановитель);
SO2 + C = S + CO2 (t) (SO2 – слабый окислитель);
C + O2 = CO2(t) (C – восстановитель);
C + 2Ca = Ca2C (t) (С – окислитель).
Вернемся к реакции, разобранной нами в начале этого параграфа.
Обратите внимание, что в результате реакции атомы-окислители (Fe +III ) превратились в атомы-восстановители (Fe 0 ), а атомы-восстановители (C +II ) превратились в атомы-окислители (C +IV ). Но CO2 в любых условиях очень слабый окислитель, а железо, хоть и является восстановителем, но в данных условиях значительно более слабым, чем CO. Поэтому продукты реакции не реагируют друг с другом, и обратная реакция не протекает. Приведенный пример является иллюстрацией общего принципа, определяющего направление протекания ОВР:
Окислительно-восстановительные реакции протекают в направлении образования более слабого окислителя и более слабого восстановителя.
Окислительно-восстановительные свойства веществ можно сравнивать только в одинаковых условиях. В некоторых случаях это сравнение может быть проведено количественно.
Выполняя домашнее задание к первому параграфу этой главы, вы убедились, что подобрать коэффициенты в некоторых уравнениях реакций (особенно ОВР) довольно сложно. Для упрощения этой задачи в случае окислительно-восстановительных реакций используют следующие два метода:
а) метод электронного баланса и
б) метод электронно-ионного баланса.
Метод электронного баланса вы изучите сейчас, а метод электронно-ионного баланса обычно изучается в высших учебных заведениях.
Оба эти метода основаны на том, что электроны в химических реакциях никуда не исчезают и ниоткуда не появляются, то есть число принятых атомами электронов равно числу электронов, отданных другими атомами.
Число отданных и принятых электронов в методе электронного баланса определяется по изменению степени окисления атомов. При использовании этого метода необходимо знать состав как исходных веществ, так и продуктов реакции.
Рассмотрим применение метода электронного баланса на примерах.
Пример 1. Составим уравнение реакции железа с хлором. Известно, что продуктом такой реакции является хлорид железа(III). Запишем схему реакции:
Fe + Cl2 FeCl3.
Определим степени окисления атомов всех элементов, входящих в состав веществ, участвующих в реакции:
Чтобы число отданных электронов было равно числу принятых, надо первое электронное уравнение умножить на два, а второе – на три:
Введя коэффициенты 2 и 3 в схему реакции, получаем уравнение реакции:
2Fe + 3Cl2 = 2FeCl3.
Пример 2. Составим уравнение реакции горения белого фосфора в избытке хлора. Известно, что в этих условиях образуется хлорид фосфора(V):
0
Молекулы белого фосфора отдают электроны (окисляются), а молекулы хлора их принимают (восстанавливаются):
10
20
Cl2 + 2e – = 2Cl –I
10Cl2 + 20e – = 20Cl –I
Полученные первоначально множители (2 и 20) имели общий делитель, на который (как будущие коэффициенты в уравнении реакции) и были разделены. Уравнение реакции:
Пример 3. Составим уравнение реакции, протекающей при обжиге сульфида железа(II) в кислороде.
FeS
В этом случае окисляются и атомы железа(II), и атомы серы(– II). В состав сульфида железа(II) атомы этих элементов входят в отношении 1:1 (см. индексы в простейшей формуле).
Электронный баланс:
| 4 | Fe +II – e – = Fe +III S –II – 6e – = S +IV | Всего отдают 7е – |
| 7 | O2 + 4e – = 2O –II |
Пример 4. Составим уравнение реакции, протекающей при обжиге дисульфида железа(II) (пирита) в кислороде.
FeS2
Как и в предыдущем примере, здесь тоже окисляются и атомы железа(II), и атомы серы, но со степенью окисления – I. В состав пирита атомы этих элементов входят в отношении 1:2 (см. индексы в простейшей формуле). Именно в этом отношении атомы железа и серы вступают в реакцию, что и учитывается при составлении электронного баланса:
4
2S –I – 10e – = 2S +IV
Встречаются и более сложные случаи ОВР, с некоторыми из них вы познакомитесь, выполняя домашнее задание.


2.Составьте уравнения ОВР, обнаруженных вами при выполнении задания к § 1 этой главы. На этот раз для расстановки коэффициентов используйте метод электронного баланса. 3.Используя метод электронного баланса, составьте уравнения реакций, соответствующие следующим схемам: а) Na + I2 NaI;
б) Na + O2 Na2O2;
в) Na2O2 + Na Na2O;
г) Al + Br2 AlBr3;
д) Fe + O2 Fe3O4 (t);
е) Fe3O4 + H2 FeO + H2O (t);
ж) FeO + O2 Fe2O3 (t);
и) Fe2O3 + CO Fe + CO2 (t);
к) Cr + O2 Cr2O3 (t);
л) CrO3 + NH3 Cr2O3 + H2O + N2 (t);
м) Mn2O7 + NH3 MnO2 + N2 + H2O;
н) MnO2 + H2 Mn + H2O (t);
п) MnS + O2 MnO2 + SO2 (t)
р) PbO2 + CO Pb + CO2 (t);
с) Cu2O + Cu2S Cu + SO2 (t);
т) CuS + O2 Cu2O +SO2 (t);
у) Pb3O4 + H2 Pb + H2O (t).
Почему происходят химические реакции?
Для ответа на этот вопрос вспомним, почему отдельные атомы объединяются в молекулы, почему из изолированных ионов образуется ионный кристалл, почему при образовании электронной оболочки атома действует принцип наименьшей энергии. Ответ на все эти вопросы один и тот же: потому, что это энергетически выгодно. Это значит, что при протекании таких процессов выделяется энергия. Казалось бы, что и химические реакции должны протекать по этой же причине. Действительно, можно провести множество реакций, при протекании которых выделяется энергия. Энергия выделяется, как правило, в виде теплоты.
| Экзотермическая реакция – химическая реакция, при которой происходит выделение теплоты. |
Если при экзотермической реакции теплота не успевает отводиться, то реакционная система нагревается.
Например, в реакции горения метана
Такая запись означает, что 484 килоджоуля теплоты выделится, если два моля водорода прореагируют с одним молем кислорода и при этом образуется два моля газообразной воды (водяного пара).
Таким образом, в термохимических уравнениях коэффициенты численно равны количествам вещества реагентов и продуктов реакции.
| Термохимическое уравнение реакции – уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения. |
От чего зависит тепловой эффект каждой конкретной реакции?
Тепловой эффект реакции зависит
а) от агрегатных состояний исходных веществ и продуктов реакции,
б) от температуры и
в) от того, происходит ли химическое превращение при постоянном объеме или при постоянном давлении.
Зависимость теплового эффекта реакции от агрегатного состояния веществ связана с тем, что процессы перехода из одного агрегатного состояния в другое (как и некоторые другие физические процессы) сопровождаются выделением или поглощением теплоты. Это также может быть выражено термохимическим уравнением. Пример – термохимическое уравнение конденсации водяного пара:
В термохимических уравнениях, а при необходимости и в обычных химических уравнениях, агрегатные состояния веществ указываются с помощью буквенных индексов:
(г) – газ,
(ж) – жидкость,
(т) или (кр) – твердое или кристаллическое вещество.
Зависимость теплового эффекта от температуры связана с различиями в теплоемкостях исходных веществ и продуктов реакции.
Так как в результате экзотермической реакции при постоянном давлении всегда увеличивается объем системы, то часть энергии уходит на совершение работы по увеличению объема, и выделяющаяся теплота будет меньше, чем в случае протекания той же реакции при постоянном объеме.
Тепловые эффекты реакций обычно рассчитывают для реакций, протекающих при постоянном объеме при 25 ° С и обозначают символом Qo.
Если энергия выделяется только в виде теплоты, а химическая реакция протекает при постоянном объеме, то тепловой эффект реакции (QV) равен изменению внутренней энергии (D U) веществ-участников реакции, но с противоположным знаком:
Под внутренней энергией тела понимают суммарную энергию межмолекулярных взаимодействий, химических связей, энергию ионизации всех электронов, энергию связей нуклонов в ядрах и все прочие известные и неизвестные виды энергии, » запасенные» этим телом. Знак » – » обусловлен тем, что при выделении теплоты внутренняя энергия уменьшается. То есть
Если же реакция протекает при постоянном давлении, то объем системы может изменяться. На совершение работы по увеличению объема также уходит часть внутренней энергии. В этом случае
где Qp – тепловой эффект реакции, протекающей при постоянном давлении. Отсюда
Зависимость количества теплоты, выделяющейся в реакции (Q) от теплового эффекта реакции (Qo) и количества вещества (nБ) одного из участников реакции (вещества Б – исходного вещества или продукта реакции) выражается уравнением:
Задача
Определите количество вещества водорода, сгоревшего в кислороде, если при этом выделилось 1694 кДж теплоты.
Решение
2Н2(г) + О2(г) = 2Н2О(г) + 484 кДж.
(Н2) = 2 моль,
= 2 мольЧ (1694 кДж/484 кДж) = 7 моль.


2.Как вы думаете, может ли реакционная система при протекании экзотермической реакции охлаждаться?
3.Какое количество теплоты выделится при сгорании 320 г серы в кислороде по реакции:
4.Какое количество теплоты выделится при сгорании 405 г алюминия в кислороде по реакции:
5.Определите объем водорода, прореагировавшего с кислородом (объему газов измерены при н. у.), если при этом выделилось 114,4 кДж теплоты.
6.Тепловой эффект реакции взаимодействия кристаллического алюминия с газообразным хлором равен 1408 кДж. Запишите термохимическое уравнение этой реакции и определите массу алюминия, необходимого для получения 2816 кДж теплоты с использованием этой реакции.
7.Определите количество теплоты, выделяющейся при сгорании на воздухе 1 кг угля, содержащего 90 % графита, если тепловой эффект реакции горения графита в кислороде равна 394 кДж.
Кроме экзотермических реакций возможны реакции, при протекании которых теплота поглощается, и, если ее не подводить, то реакционная система охлаждается. Такие реакции называют эндотермическими.
| Эндотермическая реакция – химическая реакция, при которой происходит поглощение теплоты. |
Таким образом, энергия, выделяющаяся при образовании связей в продуктах этих и им подобных реакций, меньше, чем энергия, необходимая для разрыва связей в исходных веществах.
Что же является причиной протекания таких реакций, ведь энергетически они невыгодны?
Раз такие реакции возможны, значит существует какой-то неизвестный нам фактор, являющийся причиной их протекания. Попробуем его обнаружить.
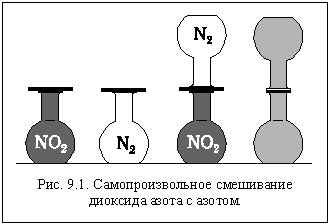
Возьмем две колбы и заполним одну из них азотом (бесцветный газ), а другую – диоксидом азота (бурый газ) так, чтобы и давление, и температура в колбах были одинаковыми. Известно, что эти вещества между собой не вступают в химическую реакцию. Герметично соединим колбы горлышками и установим их вертикально, так, чтобы колба с более тяжелым диоксидом азота была внизу (рис. 9.1). Через некоторое время мы увидим, что бурый диоксид азота постепенно распространяется в верхнюю колбу, а бесцветный азот проникает в нижнюю. В результате газы смешиваются, и окраска содержимого колб становится одинаковой.
Что же заставляет газы смешиваться?
Хаотическое тепловое движение молекул.
Приведенный опыт показывает, что самопроизвольно, без какого бы то ни было нашего (внешнего) воздействия может протекать процесс, тепловой эффект которого равен нулю. А он действительно равен нулю, потому что химического взаимодействия в данном случае нет (химические связи не рвутся и не образуются), а межмолекулярное взаимодействие в газах ничтожно и практически одинаково.
Наблюдаемое явление представляет собой частный случай проявления всеобщего закона Природы, в соответствии с которым системы, состоящие из большого числа частиц, всегда стремятся к наибольшей неупорядоченности.
Мерой такой неупорядоченности служит физическая величина, называемая энтропией.
| Энтропия – физическая величина, характеризующая степень неупорядоченности систем, состоящих из большого числа частиц, находящихся в тепловом движении. |
чем БОЛЬШЕ ПОРЯДКА – тем МЕНЬШЕ ЭНТРОПИЯ,
чем МЕНЬШЕ ПОРЯДКА – тем БОЛЬШЕ ЭНТРОПИЯ.
Уравнения связи между энтропией (S) и другими величинами изучаются в курсах физики и физической химии. Единица измерений энтропии [S] = 1 Дж/К.
Энтропия возрастает при нагревании вещества и уменьшается при его охлаждении. Особенно сильно она возрастает при переходе вещества из твердого в жидкое и из жидкого в газообразное состояние.
Что же произошло в нашем опыте?
При смешении двух разных газов степень неупорядоченности возросла. Следовательно, возросла энтропия системы. При нулевом тепловом эффекте это и послужило причиной самопроизвольного протекания процесса.
Если теперь мы захотим разделить смешавшиеся газы, то нам придется совершить работу, то есть затратить для этого энергию. Самопроизвольно (за счет теплового движения) смешавшиеся газы никогда не разделятся!
Итак, мы с вами обнаружили два фактора, определяющих возможность протекания многих процессов, в том числе и химических реакций:
1) стремление системы к минимуму энергии (энергетический фактор) и
2) стремление системы к максимуму энтропии (энтропийный фактор).
Посмотрим теперь, как влияют на возможность протекания химических реакций различные комбинации этих двух факторов.
1. Если в результате предполагаемой реакции энергия продуктов реакции оказывается меньше, чем энергия исходных веществ, а энтропия больше (» под гору к большему беспорядку» ), то такая реакция может протекать и будет экзотермической.
2. Если в результате предполагаемой реакции энергия продуктов реакции оказывается больше, чем энергия исходных веществ, а энтропия меньше (» в гору к большему порядку» ), то такая реакция не идет.
3. Если в предполагаемой реакции энергетический и энтропийный факторы действуют в разные стороны (» под гору, но к большему порядку» или » в гору, но к большему беспорядку» ), то без специальных расчетов сказать что-либо о возможности протекания такой реакции нельзя (» кто перетянет» ). Подумайте, к какому из этих случаев относятся эндотермические реакции.
Возможность протекания химической реакции можно оценить, рассчитав изменение в ходе реакции физической величины, зависящей как от изменения энтальпии, так и от изменения энтропии в этой реакции. Такая физическая величина называется энергией Гиббса (в честь американского физикохимика XIX в. Джозайя Уилларда Гиббса).
Условие самопроизвольного протекания реакции:


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору