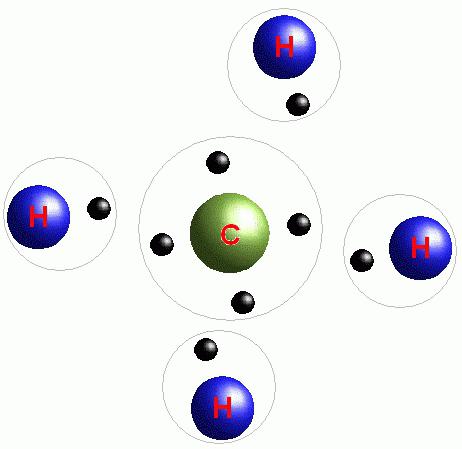
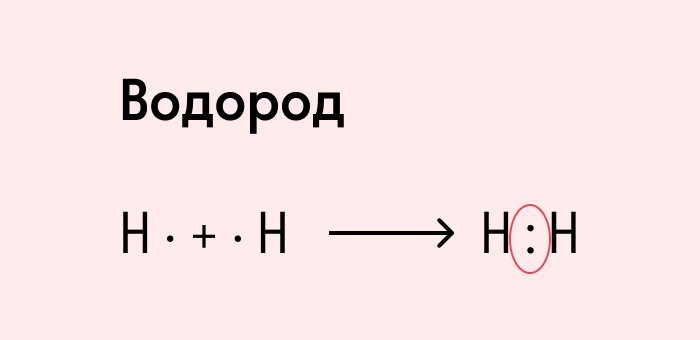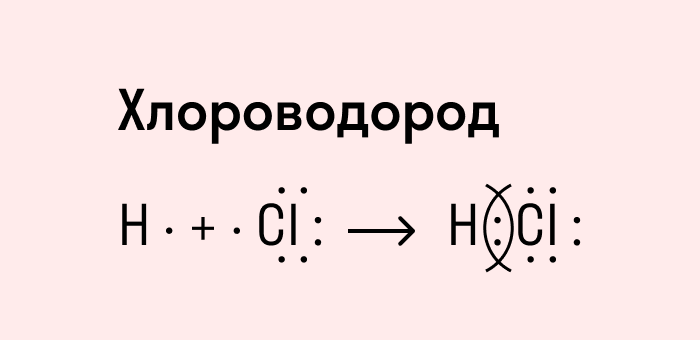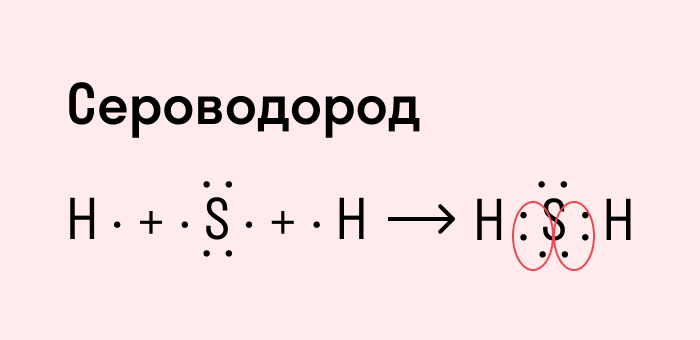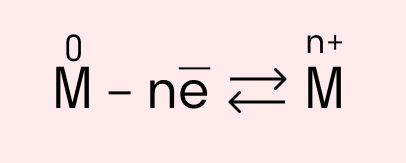зачем атомы вступают в химическую связь
Химическая связь
Химическая связь и строение вещества
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8-электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
| Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому. |
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической связи
Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону от каждого атома и соединение их в общую пару;
донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
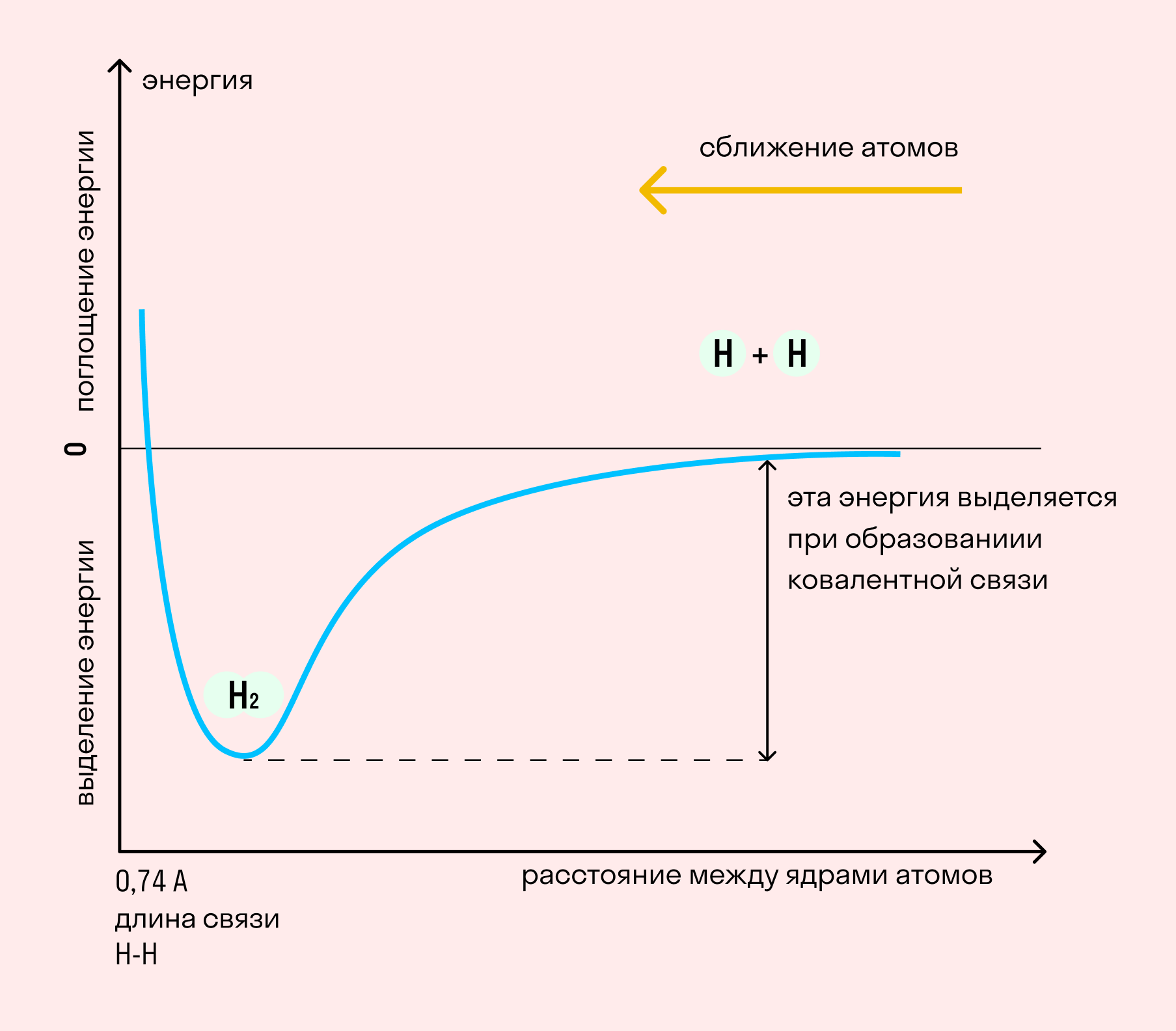
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
| Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва. |
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
Основные типы химических связей
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Если это ковалентная связь — образуется атомная решетка, если водородная — молекулярная решетка, а если ионная или металлическая — соответственно, будет ионная или металлическая решетка. Таком образом, влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и смещение общей пары электронов к одному из них;
направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
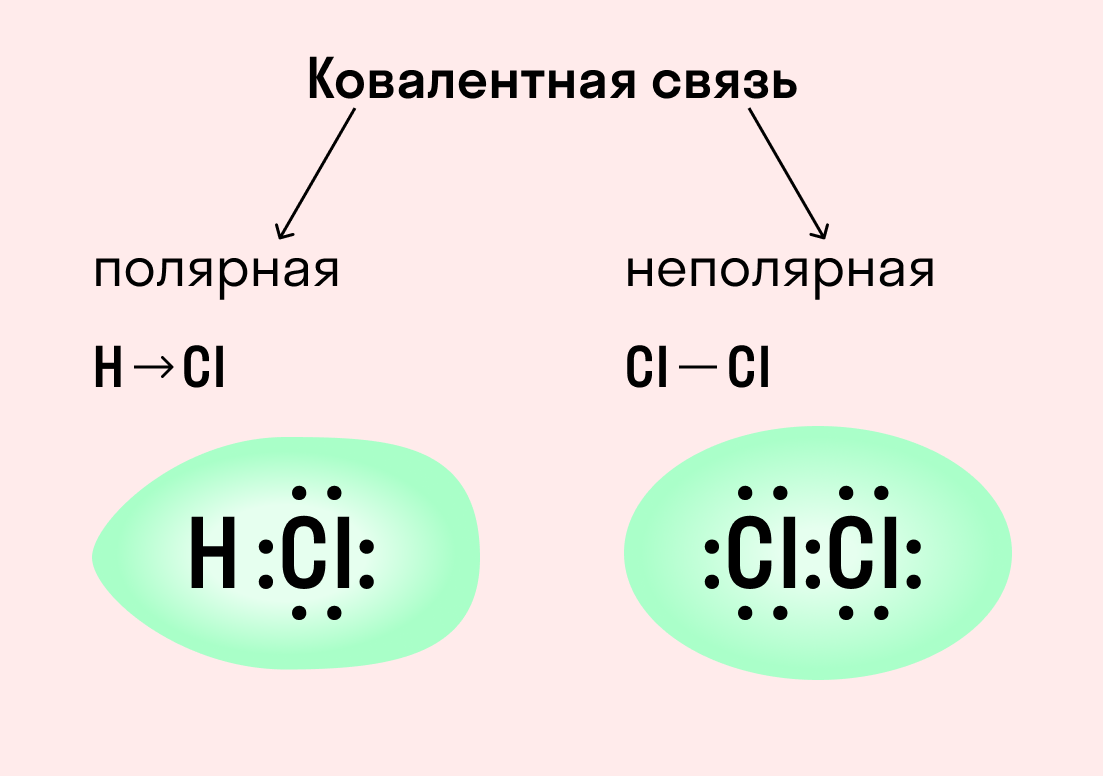
Ковалентная связь
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорно-акцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
| Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь. |
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи:
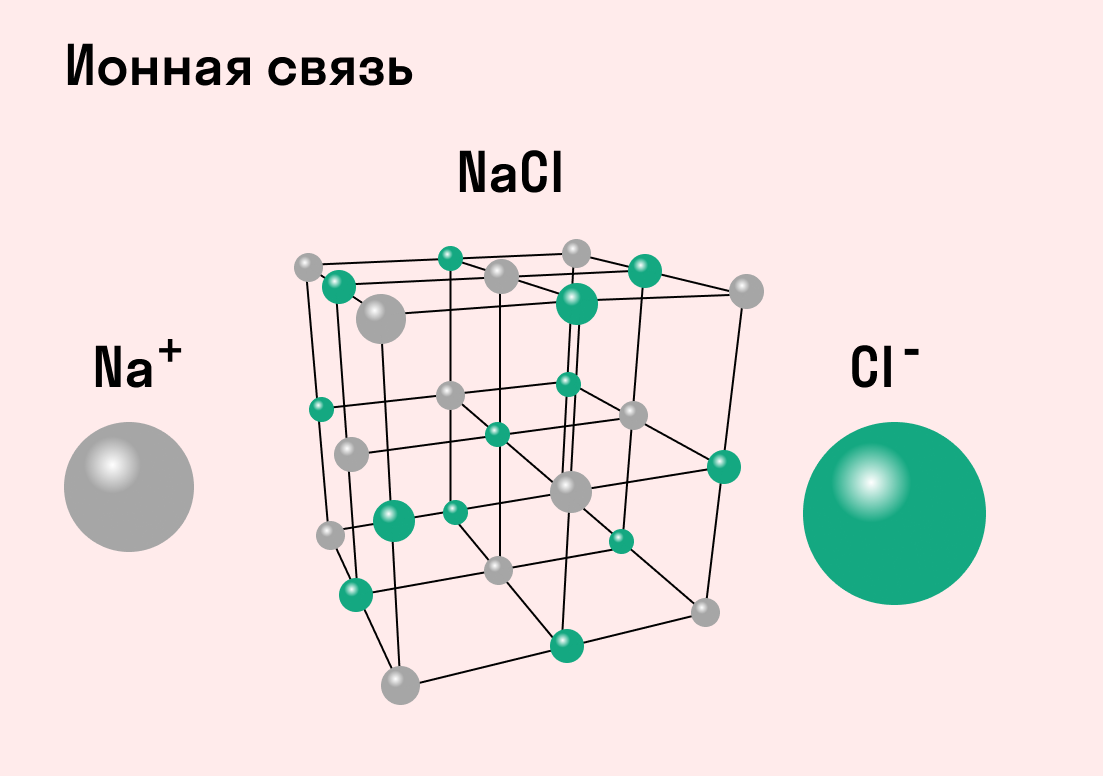
Ионная связь
Как понятно из названия, данный тип связи основан на взаимном притяжении ионов с противоположными зарядами. Он возможен между веществами с большой разницей ЭО — металлом и неметаллом. Механизм таков: один из атомов отдает свои электроны другому атому и заряжается положительно. Второй атом принимает электроны на свободную орбиталь и получает отрицательный заряд. В результате этого процесса образуются ионы.
| Ионная связь — это такое взаимодействие между атомами в молекуле вещества, итогом которого становится образование и взаимное притяжение ионов. |
Разноименно заряженные ионы стремятся друг к другу за счет кулоновского притяжения, которое одинаково направлено во все стороны. Благодаря этому притяжению образуются ионные кристаллы, в решетке которых заряды ионов чередуются. У каждого иона есть определенное количество ближайших соседей — оно называется координационным числом.
Обычно ионная связь появляется между атомами металла и неметалла в таких соединениях, как NaF, CaCl2, BaO, NaCl, MgF2, RbI и других. Ниже схема ионной связи в молекуле хлорида натрия.
Характеристики ионной связи:
не имеет направленности.
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница. Сравним эти виды химических связей в таблице.
Характеризуется появлением электронных пар, принадлежащих обоим атомам.
Характеризуется появлением и взаимным притяжением ионов.
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов.
Ионы с противоположными зарядами подвержены кулоновскому притяжению.
Имеет направленность и насыщенность.
Ненасыщенна и не имеет направленности.
Количество связей, образуемых атомом, называется валентностью.
Количество ближайших соседей атома называется координационным числом.
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО.
Образуется между металлами и неметаллами — веществами со значимо разной ЭО.
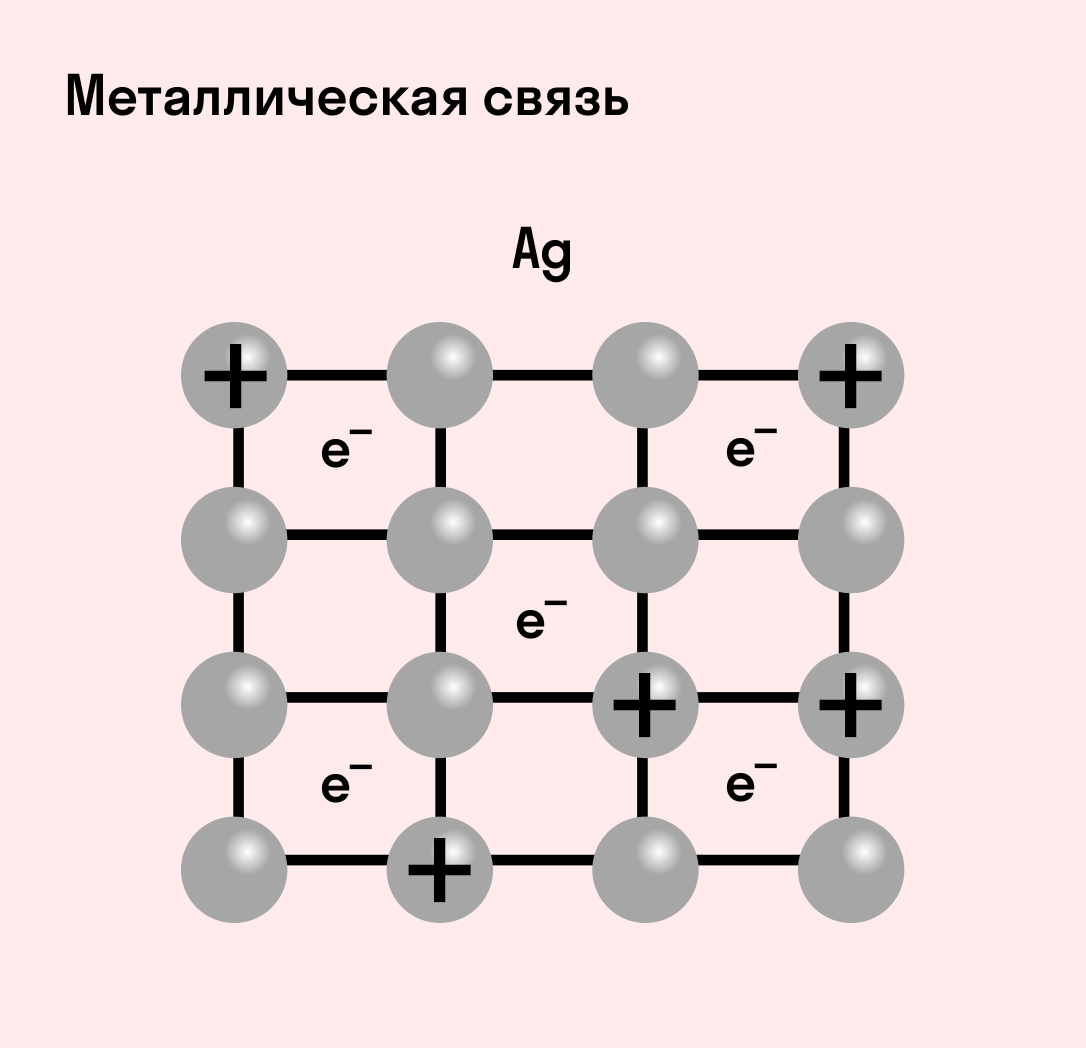
Металлическая связь
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
| Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества. |
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
Характеристики металлической связи:
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
M — металл,
n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
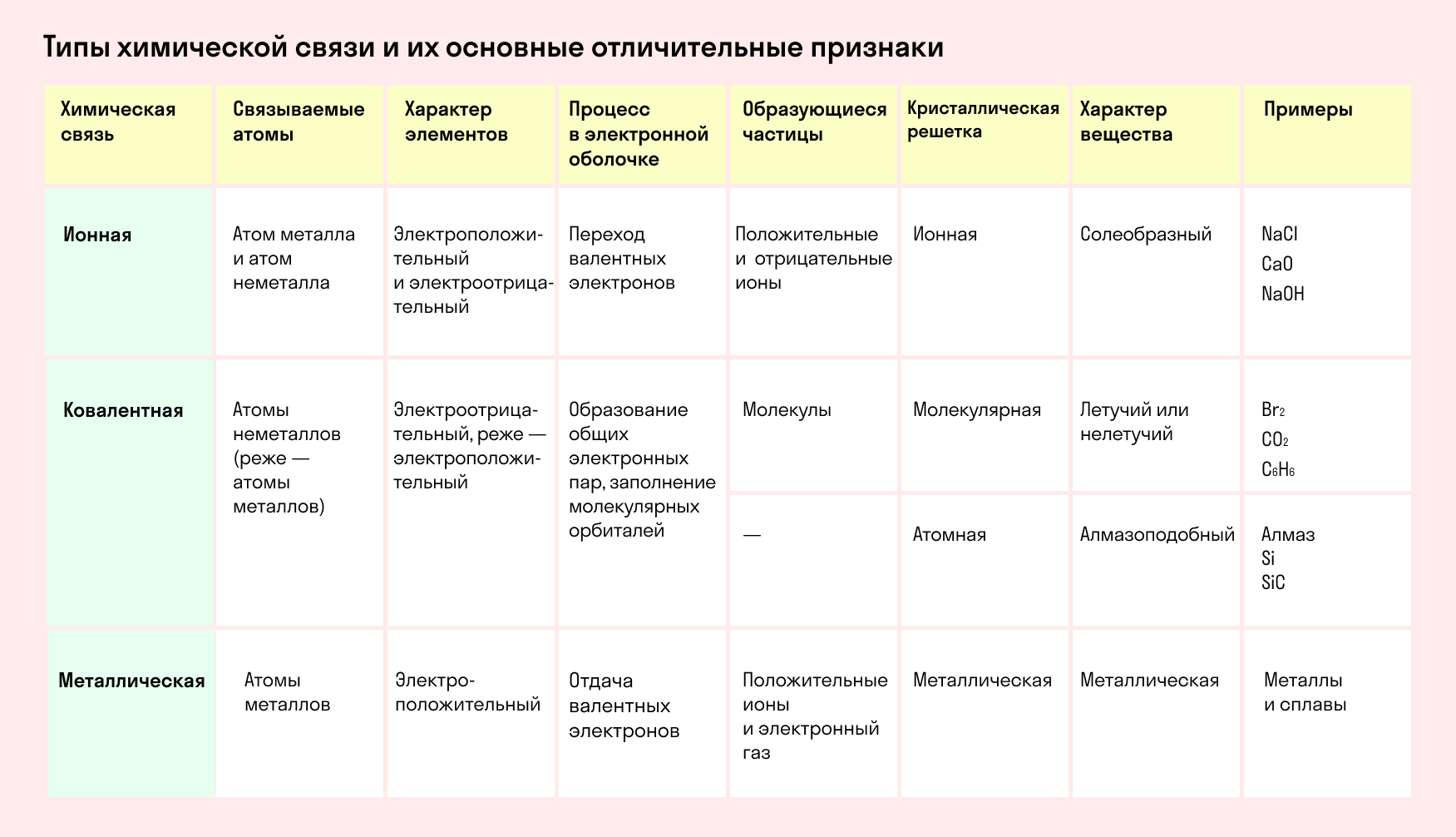
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
Типы химической связи и их основные отличительные признаки
Водородная связь
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
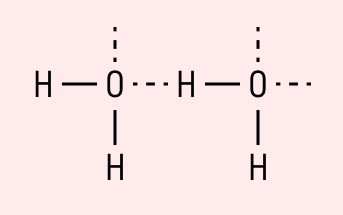
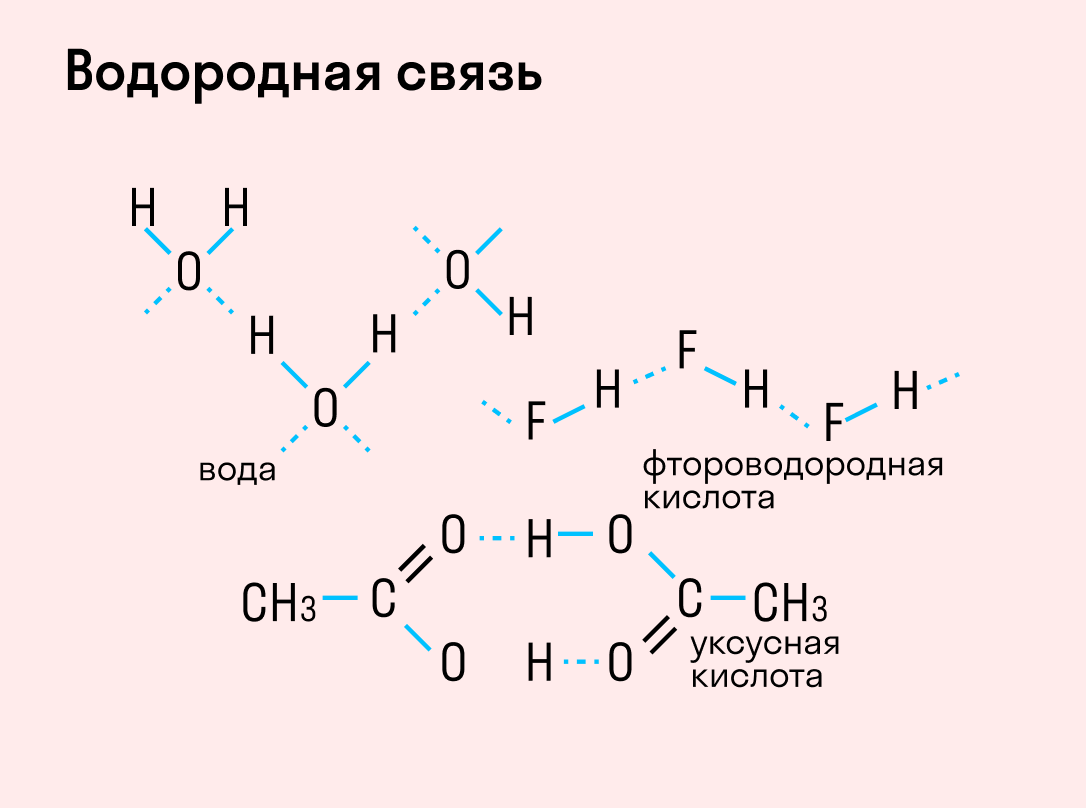
| Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества. |
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Такое взаимодействие носит донорно-акцепторный характер. Донором электронов в данном случае выступают электроотрицательные элементы, а акцептором — водород.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
Характеристики водородной связи:
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
Определить тип химической связи в 8 классе поможет таблица.
Правило октета. Почему образуется связь?
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами.
Причина образования химических связей – выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами.
При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа.
Движущей силой, заставляющей атомы соединяться между собой, является стремление принять, отдать или объединить электроны с тем, чтобы получить полностью заполненную внешнюю электронную оболочку. У водорода Н и гелия Не внешняя электронная оболочка представляет собой 1s-орбиталь, для заполнения которой требуется два электрона (вспомним, что первый электронный слой не имеет р-орбиталей).

Электронная конфигурация атома особенно стабильна (иными словами, имеет минимальный запас энергии, что всегда предпочтительно), когда внешняя электронная оболочка заполнена. Поэтому атомы склонны к таким превращениям, в результате которых во внешнем слое оказывается „магическое” число электронов — восемь. Исключение составляют атомы первых двух элементов периодической системы, для которых предпочтительно образование двухэлектронной внешней оболочки.
Правило октета объясняет, почему инертные газы (группа VIIIA) гелий, неон и аргон обычно не вступают в химические реакции. Их внешняя электронная оболочка уже заполнена, следовательно нет необходимости во взаимодействии с другими атомами с целью принять, отдать или объединить электроны.
Элементы 3—7-го периодов также обычно подчиняются правилу октета (т. е. склонны к заполнению s- и р-орбиталей, хотя могут иметься d- и f-орбитали).
Согласно правилу октета большинство атомов склонно принимать, отдавать или объединять электроны с тем, чтобы создать восьмиэлектронную внешнюю оболочку.
Виды химических связей. Как соединить атомы?
Химия – удивительная и, признаться, запутанная наука. Почему-то ассоциируется она с яркими экспериментами, разноцветными пробирками, густыми облаками пара. Но мало кто задумывается о том, откуда же берётся это «волшебство». На самом деле ни одна реакция не проходит без образования соединений между атомами реагентов. Более того, эти «перемычки» иногда встречаются и в простых элементах. Они влияют на способность веществ вступать в реакции и объясняют некоторые их физические свойства.
Какие же бывают виды химических связей и как они влияют на соединения?
Теория
Начинать надо с самого простого. Химическая связь – это взаимодействие, при котором атомы веществ соединяются и образуют более сложные вещества. Ошибочно полагать, что это свойственно только соединениям вроде солей, кислот и оснований – даже простые вещества, молекулы которых состоят из двух атомов, имеют эти «перемычки», если так можно условно назвать связь. Кстати, важно запомнить, что объединиться могут только атомы, имеющие разные заряды (это основы физики: одинаково заряженные частицы отталкиваются, а противоположные – притягиваются), так что в сложных веществах всегда найдётся катион (ион с положительным зарядом) и анион (отрицательная частица), а само соединение всегда будет нейтральным.
Теперь попробуем разобраться в том, как происходит образование химической связи.
Механизм образования
У любого вещества есть определённое количество электронов, распределённых по энергетическим слоям. Самым уязвимым считается внешний слой, на котором обычно находится самое малое количество этих частиц. Узнать их число можно, посмотрев на номер группы (строка с цифрами от одного до восьми в верхней части таблицы Менделеева), в которой находится химический элемент, а количество энергетических слоёв равно номеру периода (от одного до семи, вертикальная строка слева от элементов).
В идеале на внешнем энергетическом слое находятся восемь электронов. Если же их не хватает, атом старается перетянуть их у другой частицы. Именно в процессе отбора необходимых для завершения внешнего энергетического слоя электронов образуются химические связи веществ. Их число может варьироваться и зависит от количества валентных, или неспаренных, частиц (чтобы узнать, сколько их в атоме, нужно составить его электронную формулу). Число электронов, не имеющих пару, будет равно количеству образовавшихся связей.
Чуть подробнее о типах
Виды химических связей, образующихся при реакциях или же просто в молекуле какого-то вещества, целиком и полностью зависят от самого элемента. Различают три типа «перемычек» между атомами: ионный, металлический и ковалентный. Последний, в свою очередь, делится на полярный и неполярный.
Для того чтобы понять, какой связью связаны атомы, используют своеобразное правило: если элементы находятся в правой и левой частях таблицы (то есть являются металлом и неметаллом, например NaCl), то их соединение – отличный пример ионной связи. Два неметалла образуют ковалентную полярную связь (HCl), а два атома одного вещества, соединяясь в одну молекулу, – ковалентную неполярную (Cl2, O2). Вышеназванные типы химических связей не подходят для веществ, состоящих из металлов, – там встречается исключительно металлическая связь.
Ковалентное взаимодействие
Как уже упоминалось ранее, виды химических связей имеют определённое влияние на вещества. Так, например, ковалентная «перемычка» очень нестойкая, из-за чего соединения с ней легко разрушаются при малейшем внешнем воздействии, нагревании например. Правда, касается это только молекулярных веществ. Те же, что имеют немолекулярное строение, практически неразрушимы (идеальный пример – кристалл алмаза – соединение атомов углерода).
Вернёмся к полярной и неполярной ковалентной связи. С неполярной всё просто – электроны, между которыми образуется «перемычка», находятся на равном расстоянии от атомов. Но во втором случае они смещаются к одному из элементов. Победителем в «перетягивании» окажется то вещество, электроотрицательность (способность привлекать электроны) которого выше. Определяется она по специальным таблицам, и чем больше разница этой величины у двух элементов, тем более полярной будет связь между ними. Правда единственное, для чего может пригодиться знание электроотрицательности элементов, – определение катиона (положительный заряд – вещество, у которого эта величина будет меньше) и аниона (отрицательная частица с лучшей способностью к привлечению электронов).
Ионная связь
Для соединения металла и неметалла подходят далеко не все типы химических связей. Как уже говорилось выше, если разница в электроотрицательности элементов огромна (а именно так бывает, когда они расположены в противоположных частях таблицы), между ними образуется ионная связь. В этом случае валентные электроны переходят от атома с меньшей электроотрицательностью к атому с большей, образуя анион и катион. Самым ярким примером подобной связи является соединение галогена и металла, например AlCl2 или HF.
Металлическая связь
С металлами всё ещё проще. Им чужды вышеперечисленные виды химических связей, потому что у них есть собственная. Соединять она может как атомы одного вещества (Li2), так и разных (AlCr2), в последнем случае образуются сплавы. Если говорить о физических свойствах, то металлы совмещают в себе пластичность и прочность, то есть они не разрушаются при малейшем воздействии, а просто изменяют форму.
Межмолекулярная связь
Химические связи
Атомы могут присоединяться друг к другу, либо отдавая и принимая электроны, либо делясь парами электронов с соседними атомами, либо делясь электронами со многими другими атомами, либо благодаря эффекту поляризации.
Электроны в атоме занимают ряд вложенных слоев (см. Атом Бора), при этом воздействию другого атома могут подвергаться, как правило, только электроны, находящиеся во внешнем слое (он называется валентным слоем). Когда электроны в двух атомах выстраиваются так, что возникает сила, удерживающая вместе эти два атома, мы говорим, что образуется химическая связь. Различают несколько видов химической связи.
Ионная связь
Когда внешние электронные слои полностью заполнены, общая энергия атомов понижается. Например, атом натрия, имеющий на внешнем слое один электрон, охотно отдает этот электрон. И наоборот, атом хлора, которому не хватает одного электрона для заполнения внешнего слоя, стремится присоединить электрон для завершения уровня. Когда атомы натрия и хлора оказываются рядом, натрий отдает электрон, а хлор его принимает. При этом атом натрия, потеряв отрицательный заряд, становится положительно заряженным ионом натрия, а атом хлора, получив дополнительный электрон, становится отрицательно заряженным ионом хлора. По закону Кулона между двумя ионами возникает электростатическое притяжение, приводящее к образованию химической связи, которая и удерживает атомы вместе (см. также Правило октета).
С этой реакцией связано одно из чудес химии: бурно реагирующее вещество натрий и сильно ядовитый газ хлор, соединяясь, образуют обычную поваренную соль, широко применяемую в питании.
Ковалентная связь
Некоторые атомы, в основном это касается углерода, образуют связи по-другому. Когда два таких атома достаточно приближаются друг к другу, между ними возникает взаимодействие, которое можно рассматривать как длительный взаимный обмен электронами. Как будто атом бросает один из своих внешних электронов другому атому, затем ловит электрон другого атома и снова бросает его обратно в бесконечной игре в мяч. В соответствии с законами квантовой механики, такой обмен электронами вызывает силу притяжения, которая и удерживает атомы вместе.
Дело в том, что такой атом как углерод, имеющий четыре электрона во внешнем слое, может дополнить этот валентный слой до восьми электронов, образуя ковалентные связи с четырьмя другими атомами. Поэтому атомы углерода способны образовывать молекулы с длинными цепями, какие мы наблюдаем в биологических системах). Некоторые ученые (и я в том числе) даже утверждают, что вследствие этого свойства атома углерода вся жизнь во Вселенной, как и жизнь на Земле, должна быть углеродной.
Металлическая связь
В металлах образуется химическая связь еще одного вида. Каждый атом в металле отдает один или два подвижных электрона, как бы делясь этими электронами со всеми соседними атомами металла. Эти квазисвободные электроны образуют что-то вроде желе, в котором располагаются тяжелые положительные ионы металла. Все это напоминает трехмерную пространственную решетку из стеклянных шариков в вязкой патоке — если толкнуть один из таких шариков, он слегка сдвинется, но сохранит свое положение относительно других. Точно так же атомы металла, потревоженные внешним механическим воздействием, останутся связанными друг с другом благодаря «электронному желе» (или «электронному газу»). Вот почему, если ударить по металлу молотком, останется вмятина, но сам кусок металла, скорее всего, не разломится. Именно «электронное желе» делает металлы хорошими проводниками электричества (см. Электронная теория проводимости).
Водородная связь
Строго говоря, это не химическая связь в том смысле, в каком мы рассматривали предыдущие три типа связи. Это, скорее, притяжение между отдельными молекулами. Многие молекулы, хотя и являются в целом нейтральными (то есть имеют одинаковое количество отрицательных электронов и положительных протонов в своем ядре), оказываются поляризованными. Это значит, что некоторые части таких молекул имеют суммарный отрицательный заряд, в то время как другие части — положительный. Конечно, суммарный заряд молекулы нейтрален, но положительный и отрицательный заряды распределены неравномерно.
Представим, что полярная молекула, как ее называют, приближается своей отрицательной областью к молекуле-мишени. Электростатическая сила со стороны этой отрицательной области больше, чем со стороны положительной, т. к. положительная область расположена дальше. Эта электростатическая сила вызывает в молекуле-мишени передвижение электронов прочь от точки контакта, тем самым создавая в этом месте молекулы-мишени незначительный положительный заряд. В результате между двумя молекулами возникает сила притяжения и, следовательно, образуется связь.
Самая известная полярная молекула — это молекула воды. Отрицательный заряд собирается вокруг атома кислорода, приводя к образованию слабого положительного заряда около атомов водорода. Благодаря такой поляризации вода является хорошим растворителем. Ее молекулы способны создавать связи более прочные, чем те, которые удерживают молекулы-мишени вместе. Связи, создаваемые посредством положительно заряженных атомов водорода, называются водородными связями. Поскольку молекул водорода очень много в биологических молекулах, водородные связи в них образуются достаточно часто. В частности, именно водородные связи удерживают вместе две спирали молекулы ДНК.
(с)Дубровский П.И., 2007 г.
PS при перепечатке прошу указывать источник.
Если кому понравилась эта идея, и он готов поучаствовать в ее доказательстве и продвижении, с удовольствием приму любую помощь.