жесткость сосудов что это
Жесткость сосудов что это
AGEs — конечные продукты гликирования
MMPs — матриксные металлопротеиназы
TGF-β — трансформирующий β-фактор роста
TIMPs — тканевые ингибиторы металлопротеиназ
TNF-α — α-фактор некроза опухоли
В течение более 30 лет формируется возрастающий интерес к роли жесткости артерий в развитии сердечно-сосудистых заболеваний [1]. Обусловленная повышенной жесткостью сосудов отраженная волна является признанной детерминантой высокого артериального (АД) и пульсового давления [2]. Жесткость сосудистой стенки имеет тесную связь с сердечно-сосудистой заболеваемостью и смертностью и включает такие клинические исходы, как инфаркт миокарда, хроническая сердечная недостаточность (ХСН), инсульт, деменция и хроническая почечная недостаточность (ХПН) [3—6]. В связи с тем что традиционные шкалы риска могут недооценивать возможность возникновения сердечно-сосудистых осложнений, определение жесткости артерий имеет большую прогностическую ценность наряду с классическими факторами риска [2]. В некоторых исследованиях речь идет о том, что показатели сосудистого возраста более надежны, чем паспортный возраст, в прогнозировании неблагоприятных исходов со стороны сердечно-сосудистой системы (ССС) [7].
Связь ХСН с сохраненной фракцией выброса (ХСН-СФВ) и жесткости сосудов. В исследованиях и литературных обзорах, опубликованных в последние годы, наметилась отчетливая тенденция к изучению роли жесткости сосудов в развитии ХСН-СФВ [8—10]. Изначально этот тип ХСН чаще назывался диастолической хронической сердечной недостаточностью (ДХСН). Тем самым подчеркивалось ее отличие от систолической ХСН (фракция выброса левого желудочка — ФВ ЛЖ 

Механизмы жесткости сосудов.Роль волоконного состава и фенотипа гладких мышечных клеток (ГМК). Судя по обзору исследований относительно обсуждаемой темы связь ригидных артерий и ДД представляется уместной. Однако патогенез этого процесса столь же многогранен, как и связанная с ним патология диастолы. Ремоделирование артерий провоцируется широким спектром взаимосвязанных патофизиологических процессов, которые влияют на клеточные и неклеточные компоненты артериальной стенки. Они включают фиброз, гиперплазию интимы и медии, изменение соотношения коллаген/эластин, дисфункцию эндотелия (ДЭ) и кальцификацию [42].
На своем протяжении артерии имеют разный волоконный состав средней оболочки: в грудной аорте преобладает эластин, в более дистальных артериях — коллаген. Это объясняется различиями в их функциях [53]. Эластин образует фенестрированную сеть параллельно расположенных волокон, каждый слой которой связан с коллагеновыми фибриллами и слоем циркулярно ориентированных ГМК [54]. Механические свойства артериальной стенки зависят от соотношения этих белков внеклеточного матрикса. В норме существует высоко контролируемая регуляция между синтезом и распадом этих молекул c помощью матриксных металлопротеиназ (MMPs) [55]. С увеличением возраста эластический слой повреждается под действием циклического напряжения при каждом сердцебиении, и в нем образуются надрывы [42]. Этот процесс деградации является одним из наиболее характерных в старении сосудов и приобретении ими большей ригидности [56]. При этом эластин не замещается, так как его экспрессия секреторными ГМК происходит преимущественно в неонатальном периоде [57].В то же время продукция коллагена продолжается, что сдвигает соотношение этих молекул в сторону последнего и более жесткого. Дополнительно увеличивается количество депозитов кальция в эластическом слое мышечной оболочки, что достоверно связано с жесткостью артерий [56, 58].
В ситуации, когда сосуды подвергаются иммунологическому стрессу, клетки воспаления продуцируют целый ряд MMPs, ответственных за разрушение волоконного каркаса в их стенке. Наблюдается связь между высоким содержанием MMPs в плазме и низкой эластичностью артерий по данным СРПВ [59]. В опытах на экспериментальных животных показано, что у мышей со значительным ремоделированием артерий происходит активная экспрессия MMP-2 и MMP-9 [60]. Кроме того, возможно снижение экспрессии тканевых ингибиторов металлопротеиназ (TIMPs) [54].
Существенный вклад в регуляцию сосудистой функции вносят ГМК. Для выполнения этой роли они должны иметь сократительный фенотип. Однако исследования показывают, что определенная доля ГМК средней оболочки под влиянием стрессовых факторов способна изменять свой фенотип и приобретать способность к синтезу и миграции. После повреждения интимы эндотелиальные клетки, тромбоциты и клетки воспаления выделяют цитокины и факторы роста, которые вызывают множество эффектов, в том числе изменение фенотипа ГМК с контрактильного на синтетический, а также их пролиферацию [61]. За счет того что ГМК, обладающие синтетическим фенотипом, продуцируют эластолитические MMPs, становятся возможными их миграция в субэндотелий и накопление в интиме коллагена и протеогликанов [42]. Одновременно с этим вследствие апоптоза снижается число ГМК в медии [56]. Как приобретение нового фенотипа ГМК, так и деградация внеклеточного матрикса приводят к более интенсивному процессу кальцификации в артериальной стенке. В настоящее время она рассматривается как следствие дисбаланса между ферментами, активирующими и препятствующими этому процессу [42]. Все это способствует увеличению толщины и ригидности артерий [43].
Роль ДЭ. ДЭ и жесткость артериальной стенки представляют собой два взаимосвязанных аспекта в сосудистой патологии.
В пользу этого свидетельствует то, что препараты, активно влияющие на ДЭ (статины, ингибиторы ангиотензинпревращающего фермента — АПФ), успешно снижают ригидность сосудов [62].
Влияние эндотелиальных клеток на эластичность артерий опосредовано образованием в них вазоактивных медиаторов, изменяющих напряжение ГМК [63]. Существует мнение, что нарушение функции эндотелия и жесткость артерий имеют не только причинно-следственную связь, но и формируют порочный круг, усугубляя друг друга [64]. Снижение доступности NO имеет несколько этиологий, включая дефицит субстрата (аргинина) или кофактора (тетрагидробиоптерина), окисление глутатиона. В дополнение к вазоактивному эффекту NO регулирует активность матриксных трансглутаминаз [65]. Потеря контроля над этим ферментом неблагоприятна, так как усугубляет жесткость сосудов [66].
Последние исследования посвящены роли аргиназы в развитии ремоделирования сосудов. Представляется, что эта находка может стать многообещающей точкой приложения современной терапии. Субстратом этого фермента является L-аргинин, который метаболизируется в эндотелиальных клетках с помощью NO-синтазы с образованием оксида азота. Две изоформы аргиназы обнаружены в ГМК сосудов и в эндотелии. Изучение свойств этого фермента в лаборатории позволило выявить, что факторы роста и циклический гемодинамический стресс, испытываемые сосудистой стенкой, являются его потенциальными индукторами. Этот же эффект доказан у интерлейкинов (IL) 4 и 13. Активность аргиназы также положительно коррелировала с увеличением толщины интимы. Широкий круг факторов, провоцирующих патологию эндотелия, способны стимулировать активность или экспрессию эндотелиальной аргиназы, в том числе медиаторы воспаления. Наблюдения за функционированием аргиназы и NO-синтазы выявило их конкуренцию за L-аргинин. По этой причине основу роли аргиназы в развитии ДЭ составляет как свойственное этому ферменту профибротическое действие, так и уменьшение генерации NO, который считается ингибитором синтеза коллагена и изменения фенотипа ГМК на синтетический [67].
Роль трансформирующего β-фактора роста (TGF-β). В современной концепции жесткости артерий значительное место занимает представление о роли TGF-β. Эта молекула отказывает плейотропное влияние на ССС, регулируя рост клеток, фиброз и воспаление. В течение долгого времени считалось, что это один из основных регуляторов внеклеточного матрикса. В сосудистых ГМК, эндотелиоцитах и фибробластах TGF-β увеличивает синтез коллагена и фибронектина. Кроме того, он снижает уровень коллагеназы и стимулирует экспрессию TIMPs, что находит отражение в торможении деградации внеклеточного матрикса и избыточном накоплении его компонентов. В то же время TGF-β сам является медиатором сосудистого фиброза, вызванного механическим стрессом, ангиотензином II (АТII), высоким уровнем гликемии, конечными продуктами гликирования белков [68]. Обнаружено ассоциированное с возрастом повышение активности TGF-β и компонентов его сигнального пути в аорте [69].
Обсуждается роль кальпаина в регуляции активности MMP-2 в ГМК сосудов и влияние таким образом на ассоциированные с возрастом накопление кальция и фиброз аорты. Это происходит при активации кальпаином-1 MMP-2 с последующим увеличением продукции коллагена I и III типов и кальцификацией сосудов. В дополнение к этому кальпаин-1 индуцирует сигнальный путь TGF-β/Smad, деградацию эластина и подавляет экспрессию ингибиторов кальцификации [70].
Значение воспаления. Современные исследования осветили роль воспаления в патогенезе жесткости артерий. Последняя связана с высокой активностью АТII, что приводит к увеличению активности NADPH-оксидазы, снижению доступности NO, продукции активных форм кислорода. Кроме того, АТII активирует MMPs, участвующие в деградации предшественника TGF-β и образовании его активной формы. АТII также повышает активность моноцитарного хемотаксического протеина, α-фактора некроза опухоли (TNF-α), IL-1, IL-17, IL-6.
Провоспалительные цитокины стимулируют локальную продукцию С-реактивного белка ГМК. Эта молекула играет важную роль в инициации процессов воспаления в стенке сосуда и ДЭ. Окислительный стресс также является важным механизмом жесткости артерий, влияя на местное воспаление и увеличивая пролиферацию клеток [41].
Существует множество клинических примеров, демонстрирующих связь воспаления и жестких сосудов, а также то, что снижение уровня воспаления улучшает состояние сосудистой стенки. Следует отметить, что у пациентов с ревматоидным артритом высокая СРПВ успешно снижалась после применения антагонистов TNF-α [71]. Более того, в последних обзорах наблюдается тенденция к обсуждению новой парадигмы ХСН-СФВ как реакции на системное воспаление, вызванное вкладом характерных для этой патологии сопутствующих заболеваний [72].
Роль альдостерона. Известно участие альдостерона в процессах гипертрофии и фиброза миокарда и сосудистой стенки. Это связано с его способностью увеличивать экспрессию генов фиброгенных факторов роста (например, TGF-β), стимулировать синтез коллагена III и IV типов и накопление других компонентов внеклеточного матрикса. Наряду с этим альдостерон посредством блокады эндотелиальной NO-синтазы и снижения сродства эндотелиальных клеток к образованному NO способствует ДЭ. Он также потенцирует нежелательные последствия гиперактивации симпатической части вегетативной нервной системы (С-ВНС), увеличивая захват катехоламинов клетками-мишенями [73]. Посредством активации минералокортикоидных рецепторов альдостерон может стимулировать процессы воспаления и фиброза в стенке сосудов. По этой причине ожидаемым оказывается то, что применение спиронолактона снижает жесткость сосудов и замедляет механизмы, ответственные за их возрастные изменения [74].
Значение конечных продуктов гликирования. Аккумуляция конечных продуктов гликирования (AGEs) в тканях и органах является частью нормальных процессов старения и ускоряется в условиях гипергликемии [75]. Предполагается, что AGEs способствуют повышению жесткости миокарда путем формирования поперечных сшивок между коллагеновыми и эластическими волокнами, воспаления и окислительного стресса [76]. Формирование поперечных сшивок между волокнами коллагена способствует увеличению общего количества коллагена в артериальной стенке путем замедления его деградации [54].
Существует мнение, что фиброз миокарда и гипертрофия кардиомиоцитов у пожилых больных с ХСН скорее являются следствием образования внесердечных AGEs. В подтверждение этому обнаруживается корреляция между концентрацией AGEs в плазме и ДД и отсутствие связи между последней и миокардиальными AGEs. Это предполагает роль экстракардиальных AGEs в развитии ДД у пожилых. В данном случае местом аккумуляции AGEs могут быть сосуды, что вызовет снижение их податливости [77].
Вместе с тем расширяются наши представления о том, что стимуляция воспаления AGEs способствует образованию свободных радикалов кислорода, цитокинов и факторов роста, которые увеличивают жесткость артерий посредством активации MMPs, развития ДЭ, увеличения тонуса ГМК и инициируют атеросклероз (рис. 3) [55]. 
Перспективы лечения жесткости артерий. Представляется привлекательной идея применения терапии, направленной на модификацию жесткости артерий с целью воздействия на прогноз и качество жизни пациентов с ДХСН.
Поскольку ренин-ангиотензин-альдостероновая система играет профибротическую роль в ремоделировании сосудов, предполагается, что блокада этого пути вносит вклад в снижение ригидности артерий независимо от антигипертензивного эффекта [42].
Известно, что ангиотензин активирует трансформирующий фактор роста, который оказывает мощное профибротическое действие. Поэтому применение ингибиторов АПФ остается особенно важным в профилактике фиброза миокарда и сосудов.
В экспериментах получены убедительные данные об антифибротическом действии практически всех известных ингибиторов АПФ. При лечении больного АГ с ДХСН необходимо помнить о том, что это пациенты относятся к группе высокого риска, следовательно нуждаются в комбинированной антигипертензивной терапии. Одной из рациональных и эффективных выступает комбинация амлодипина и лизиноприла (экватор). По данным завершившегося исследования ДИРИЖЕР, применение фиксированной комбинации у пациентов с ДХСН и метаболическим синдромом улучшало параметры, косвенно свидетельствующие о развитии фиброза ЛЖ и левого предсердия. Так, на фоне применения экватора уменьшалась гипертрофия ЛЖ, уменьшался объем левого предсердия и снижалось отношение пика Е к пику Еm, что расценивается как важный показатель нарушения диастолы.
Кроме того, перспективным для улучшения эластичных свойств сосудов является использование препарата алагебриум — разрушителя поперечных сшивок в конечных продуктах гликирования белков [78]. В одном из исследований применение алагебриума привело к значительному увеличению податливости артерий и снижению СРПВ. Лечение им пациентов с ХСН-СФВ выражалось в уменьшении массы миокарда ЛЖ, улучшении диастолического наполнения и качества жизни [79].
Другая стратегия — предупреждение деградации эластина путем воздействия на контролирующие этот процесс ферменты. Показано, что применение TIMPs на биологических моделях способствует сохранению эластина. Кроме того, ингибирование кальпаина блокирует зависимую от ATII активацию ММР-2 в культуре ГМК и может предотвращать жесткость артерий [54].
Фармакологическая блокада пути TGF-β/Smad также рассматривается в качестве перспективной антифибротической терапии [6]. По причине того, что изменение фенотипа ГМК играет важную роль в ремоделировании сосудов, можно ожидать смещение направления лечения в сторону и этого механизма [42].
Остается актуальной тема раннего определения факторов риска ремоделирования сосудов и последующей модификации образа жизни [80]. Например, продемонстрировано, что аэробная нагрузка у пожилых с СД 2-го типа, АГ и гиперхолестеринемией приводит к улучшению эластичности сосудов [81].
Заключение. Клинический опыт и проведенные исследования позволяют сделать предположение, что жесткие артерии могут рассматриваться в качестве аналога ДД ЛЖ, а также что эти состояния имеют общие факторы риска. Однако остается открытым вопрос, действительно ли жесткость артерий — предиктор ДД, или же эти два состояния — следствие нормальных процессов старения. Подводя итоги, следует подчеркнуть, что простые неинвазивные методы оценки жесткости сосудов позволяют предполагать увеличение давления наполнения ЛЖ и нарушения диастолы до их клинической манифестации, особенно у здоровых людей. Поскольку сниженная податливость артерий представляется потенциально модифицируемой, следует рассматривать это состояние как возможную мишень эффективной терапии у пациентов с ХСН-СФВ.
Жесткость артериальной системы, как фактор риска сердечно-сосудистых осложнений: методы оценки
Статья посвящена оценке интегральной жесткости артериальной системы с использованием математической модели сердечно-сосудистой системы, разработанной на основе эластического резервуара Франка. Проведен сравнительный анализ данных здоровых лиц и больных гипертонической болезнью — коэффициент объемной упругости, среднегемодинамическое артериальной давление, общее периферическое сопротивление с аналогичными показателями, рассчитанными или измеренными по общепринятым методикам. Найдено соответствие изучаемых показателей, полученных разными методами, как у здоровых лиц, так и у больных гипертонической болезнью.
The rigidity of the arterial system as a risk factor for cardiovascular events: methods of assessment
Article is devoted an estimation of integrated rigidity of arterial system with use of mathematical model of cardio — vascular system on a basis of elastic Frank’s reservoir. The comparative analysis of the data healthy people and patients with hypertensive disease were received — factor of volume elasticity, mean hemodynamic arterial pressure, the general peripheral resistance with those of calculated or measured by conventional methods. Conformity of studied indicators received by different methods both at healthy people and at patients with hypertensive disease is found.
Рост смертности по причине сердечно-сосудистых заболеваний диктует необходимость поиска доступных практической медицине, надежных критериев стратификации риска развития сердечно-сосудистых осложнений, таких как мозговой инсульт, инфаркт миокарда, хроническая сердечная недостаточность. [1]. В последнее время усилился интерес к исследованиям жесткости сосудистой системы. Сосуды — один из главных органов — мишеней, которые поражаются при разнообразных заболеваниях и состояниях: артериальные гипертензии (АГ), сахарный диабет, аутоиммунные заболевания, гипотиреоз, атеросклероз, старении и др. При этом меняется состояние стенки артериальных сосудов и, прежде всего, эластично-вязкие свойства. По мнению Я.А. Орловой и Ф.Т. Агеева, жесткость артерий является интегральным фактором, определяющим сердечно-сосудистые риски [1]. Таким образом, поиск показателей оценки состояния жесткости артериальной системы является поиском критериев развития сердечно-сосудистых осложнений, определяющих смертность от сердечно-сосудистых заболеваний.
Артериальная система обладает двумя основными функциями: проводящей и демпфирующей [2, 3]. Нарушение проводящей функции проявляется при сужении или спазме сосуда. Демпфирующая функция обеспечивает сглаживание осцилляций давления, обусловленных циклическим выбросом крови из левого желудочка и превращения пульсирующего артериального кровотока в непрерывный. Эта способность зависит от эластических свойств артериальной стенки [4, 5]. Снижение демпфирующей функции артериальной системы возникает при снижении растяжимости (эластичности) артериальной стенки, то есть увеличении ее жесткости. При этом возникает ряд нежелательных явлений. Во-первых, происходит пиковое повышение систолического АД за счет того, что кинетическая энергия потока крови из левого желудочка в аорту не переходит в потенциальную энергию растягивающейся стенки аорты, а реализуется в артериальном давлении. При этом происходит увеличение постнагрузки на ЛЖ, что способствует развитию гипертрофии миокарда, увеличению потребления кислорода, нарушению диастолической функции ЛЖ, снижению сердечного выброса и развитию сердечной недостаточности [6, 7]. Во-вторых, уменьшение диастолической отдачи стенки аорты и смещение возвращения возвратной волны из дистолы в позднюю систолу, приводит к снижению диастолического артериального давления (ДАД). Учитывая, что уровень ДАД определяет распределение коронарного кровотока и коронарную перфузию, при его снижении может возникнуть недостаточность коронарного кровообращения [4, 5, 6]. В-третьих, повышение САД и пульсового АД (АДп), в свою очередь, ускоряют повреждение артерий, формируя «порочный круг», и ответственны за развитие разрывов стенок сосудов с формированием острых окклюзий или геморрагий [7, 8, 9]. Увеличение АДп при АГ ассоциируется с поражением органов мишеней. В исследовании PIUMA у пациентов с АГ показано, что высокое АДп как маркер повышения жесткости артериальной системы является независимым предиктором сердечно-сосудистой смертности [9, 10]. Таким образом, нарушение эффективности функционирования сердечно-сосудистой системы за счет увеличения жесткости артерий приводит к развитию сердечно-сосудистых осложнений, поражению органов мишеней при АГ, развитию коронарной недостаточности, гипертрофии миокарда, нарушению систолической и диастолической функций ЛЖ, развитию сердечной недостаточности и в результате к увеличению сердечно-сосудистой смертности [1].
Для оценки эффективности работы сердечно-сосудистой системы необходимо основываться на интегральных показателях системы. Под интегральными показателями сердечно-сосудистой системы мы понимаем параметры, которые отражают состояние системы в целом. К ним можно отнести системное артериальное давление (АД), минутный объем кровообращения (МО), общее периферическое сосудистое сопротивление (ОПСС), показатели жесткости артериальной системы.
Б.И. Ткаченко (1999) за системное АД принимает среднее гемодинамическое артериальной давление (АДср), которое обеспечивает циркуляцию крови по системе в целом [11]. В то же время этот показатель является наиболее стабильным и даже при выраженных изменениях жесткости артериальной системы с формированием изолированной артериальной гипертензии остается в переделах нормы, хотя эффективность работы сердечно-сосудистой системы будет ниже [12, 13]. Для характеристики системного артериального давления мы принимаем как АДср, так и АДс и АДд, что более точно отражает пульсирующий характер кровотока в артериальной системе. Общепринято, что артериальное давление измеряется на правом или левом плече в положении пациента сидя, чтобы манжета находилась на уровне сердца. Используя аускультативный или осциллометрический метод, мы получаем цифры АДд и АДс, считая, что эти показатели и отражают системное АД пациента. Если давление на верхних конечностях разное, то за системное АД берут большие значения и в дальнейшем при наблюдении за пациентом измерения проводят именно на этой руке [14, 15, 16].
МО определяется как произведение числа сердечных сокращений (ЧСС) на ударный объем (УО) и характеризует производительность работы сердца [12]. Общее периферическое сосудистое сопротивление (ОПСС) характеризует гидравлическое сопротивление потоку крови общим микроциркуляторным руслом. Этот показатель нельзя измерить, его можно только рассчитать, вводя допущение, что микроцируляторное кровообращение подчиняется закону Пуазеля. В этом случае ОПСС (дин*сек/мл) =1332*АД ср/МО [12].
Жесткость артериальной системы относятся к наиболее сложно определяемым свойствам, хотя в клинической практике методов изучения состоянии артериальной стенки и ее упруго эластических свойств достаточно много. Все методы изучения жесткости артерий можно разделить на две большие группы: оценивающие регионарную или локальную жесткость и интегральную (системную) артериальную жесткость [17]. Для оценки регионарной, локальной жесткости используют либо измерение скорости распространения пульсовой волны по какому-либо из участков артериальной системы, или изучают структуру стенки артерий, изменения просвета в систолу и диастолу, используя различные методы визуализации сосудов — ультразвуковые, МРТ, ангиографические [1, 17]. Этот подход, несомненно, дает ценную информацию о состоянии артерий у пациента и позволяет прогнозировать развитие сосудистых осложнений. Но, так как локальные изменения в артериях возникают неравномерно, методы оценки локальной или регионарной жесткости не позволяют определить влияние этих показателей на развитие артериальной гипертензии, количественно оценить динамику процесса при лечении этих состояний. Для этих целей необходимо определять интегральную (системную) жесткость артериальной системы. В клинической практике использовался показатель системной жесткости как отношение пульсового артериального давления (АДп) к ударному объему (УО) [18]. Этот метод прост для вычислений, имеет физиологический смысл, так как является обратной величиной растяжимости артериальной системы — характеризует величину изменения объема сосуда при изменении давления в этом сосуде при одном сердечном сокращении. Существенным недостатком этого метода является отсутствие в расчетах ЧСС и соответственно длительности сердечного цикла. Для непрерывного движения потока крови в системе кровообращения с формированием определенного уровня АД необходимо больше чем одно сердечное сокращение, так как минимальное и максимальное АД определяется не только основной пульсовой волной, но и отраженными волнами от разветвлений сосудов. Таким образом, без учета ЧСС анализ жесткости артериальной системы будет неполным. Н.Н.Савицкий (1974) вывел формулу вычисления «суммарного модуля объемной упругости» Он предположил, что ее длину можно представить равной половине пути пробега волны давления. После преобразований формула имеет вид: Eо=ОПСС*АДп/АДср*D, где D — продолжительность диастолы в сек. [12]. Этот подход учитывает продолжительность диастолы сердечного цикла и, таким образом, более полно отражает зависимость жесткости артериальной системы от других параметров сердечно-сосудистой системы. Но в то же время не учитывается фаза изометрического сокращения миокарда, которая зависит от силы сокращения левого желудочка.
Таким образом, анализ интегральной жесткости артериальной системы является сложной задачей, так как зависит от многих факторов: УО, ЧСС, АД, продолжительности фаз сердечного цикла. Поэтому наиболее адекватно задача по расчету интегрального показателя жесткости артериальной системы может быть решена с использованием математической модели сердечно-сосудистой системы. А.Э. Терегуловым была предложена математическая модель сердечно-сосудистой системы на основе упругого резервуара Франка [19]. По данной модели может быть проведен расчет коэффициента объемной упругости (КОУ), который отражает упругие свойства полого образования. Этот коэффициент равен отношению прироста давления ΔР к приросту объема (ΔV). Если упругий материал легко растяжим, то его КОУ мал, и наоборот [20]. Если в модели вся артериальная система представлена как единая упругая камера, то, вычисленная по модели КОУ, является интегральным показателем, характеризующим упругие свойства или жесткость всей артериальной системы.
Основные положения модели
• Вся артериальная система — упругий резервуар, в который поступает кровь из ЛЖ с объемной скоростью Qлж и вытекает в микрососудистое русло с объемной скоростью Q мс (рис. 1).
Рисунок 1. Эластическая камера Франка
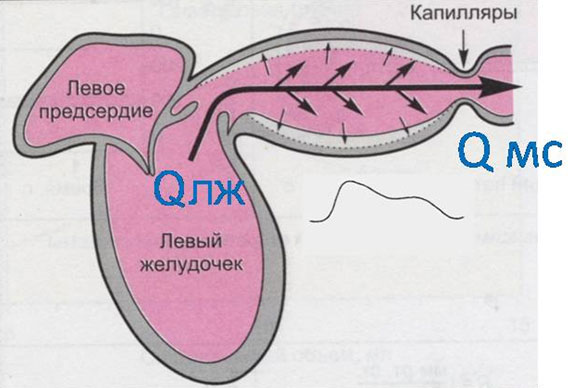
Vа — объем крови в артериальной системе
Vао — ненапряженный объем крови
Ра — артериальное давление
К — объемная упругость
• Поток крови в микрососудистом русле удовлетворяет закону Пуазеля: Qмс=(Ра(t)-Рв(t))/R
Qмс — объемная скорость крови
Ра — артериальное давление
Рв — венозное давление (правое предсердие)
R — общее периферическое сосудистое сопротивление
На основе этих положений строится дифференциальное уравнение, которое позволяет рассчитать КОУ.
Входные параметры модели : ЧСС, длительность изометрического сокращения (IC) в сек, длительность систолы (Тc) в сек, УО ЛЖ в мл, АДс, АДд в мм рт. ст., венозное давление в правом предсердии в мм рт. ст. (как правило, принимаем за 0).
Вычисляемые параметры по модели: КОУ (дин/мл), ОПСС (дин*сек/мл), АДср (мм рт. ст.).
Перед клиническим использованием математической модели необходимо было убедиться, что данная модель сердечно-сосудистой системы на основе эластического резервуара Франка соответствует общепринятым физиологическим представлениям функционирования сердечно-сосудистой системы. Для этого мы провели моделирование изменения потоков крови и артериального давления при поступлении крови из левого желудочка в артериальную систему при следующих параметрах гемодинамики: ЧСС=80 в мин, IC=0,0345 сек., Тс=0,27 сек., УО=56 мл, Pmin=80 мм рт. ст., Pmax=120 мм рт. ст. (рис. 2, 3).
Рисунок 2. График потока крови из ЛЖ в артериальную систему

Рисунок 3. Рассчитанный по модели график изменения давления крови в артериальной системе в систолу и диастолу

Используя математическую модель, нами было проведено изучение изменения параметров артериального давления от КОУ (мм рт. ст. /мл). На Рис. 4 представлен график изменения АДс (Рmax), АДср (Рср), и АДд (Рmin) от КОУ при зафиксированных следующих параметрах сердечно-сосудистой системы: ЧСС=80 в мин., IC=0,0345 сек., УО=56, ОПСС=1838 дин*сек./мл.
Рисунок 4. График изменения систолического, диастолического и среднегемодинамического артериальных давлений от К (коэффициент объемной упругости)

Для оценки возможности клинического использования метода путем сравнения со стандартно признанными методиками нами было проведено клиническое исследование. Обследованы 2 группы пациентов. В 1-ю вошли 35 здоровых лиц: 21 женщина и 14 мужчин в возрасте от 21 до 45 лет (M±σ — 25,2±6.17). Критериями отбора пациентов в 1-ю группу были: отсутствие сердечно-сосудистых заболеваний, в том числе артериальной гипертензии, заболеваний эндокринной системы, болезни почек, анемии, нормальные показатели липидного обмена (холестерин, триглицериды, липиды высокой и низкой плотности), АД у пациентов при исследовании не превышало 130/90 мм рт. ст.
2-ю группу составили 64 пациента с гипертонической болезнью (ГБ) без признаков ИБС, ХСН и ХПН в возрасте от 18 до 77 лет (M±σ — 48,9±12,4), из них 22 — женщины и 42 — мужчины. АДс во время исследования этих пациентов было ≥140 мм рт. ст.
• Артериальное давление АДс и АДд определяли аускультативным методом
• АДср измеряли осциллометрическим методом на приборе АПКО 8 РИЦ, рассчитывали по формуле Хикема (АДср=АДд + (АДс-АДд)/3) и по формуле Вецлера — Богера (АД ср=0,42АДс+0,58АДд) [23]
• УО, ЧСС — определяли при эхокардиографии методом Тейхольца
• Системную упругость (СУ) определяли по формуле АДп/УО [18]
• Ео рассчитывали по формуле Н.Н. Савицкого [12]
• ОПССр вычисляли по формуле 1332*АДср/МО [23]
• Венозное давление в правом предсердии принимали за 0
• По модели рассчитывали следующие параметры: КОУ, АД ср, ОПСС, КОУ/ОПСС
Статистическую обработку полученных данных проводили с помощью компьютерных программ Statistica 8.0 и Biostat.
Изучались сопоставимость данных Адср, полученных с помощи математической модели (АДср модель), с данными Адср, измеренных осциллометрическим методом на аппарате АПКО 8 РИЦ и рассчитанных по формулам Вецлера — Богера (АД ср (Вецлер) и по формуле Хикема (Адср (Хикем). Провели сравнение КОУ, вычисленного по модели с Eo и СУ; ОПСС по модели с ОПССр, рассчитанного по общепринятой формуле. Данные здоровых лиц и у больных ГБ представлены в таблицах 1 и 2.
Для сравнения полученных значений использовали критерий Стьюдента и метод Блэнда — Альтмана, рассчитывали коэффициент корреляции Пирсона [25].
Показатели АДср у здоровых лиц и больных ГБ, полученные разными методами