жидкостное содержимое вдоль фасции герота слева что это такое
Университет
Николай Сивец, заведующий хирургическим отделением 6-й ГКБ Минска, доктор мед. наук, профессор кафедры военно-полевой хирургии БГМУ:
— Спаечной болезнью называют патологические состояния, связанные с образованием спаек в брюшной полости при ряде заболеваний, при травматических повреждениях внутренних органов, в т. ч. при операционной травме. Относится к числу еще не решенных проблем абдоминальной хирургии. В большинстве случаев — неизбежный брак именно хирургии, а не хирурга. Врач, спасая больного от одного смертельного заболевания, вынужденно способствует возникновению нового.
Большой вклад в изучение спаечной болезни внес Н. И. Пирогов, первым в России выполнивший операцию под эфирным наркозом по поводу странгуляционной тонкокишечной непроходимости. В 1914 году немецкий хирург Эрвин Пайр опубликовал 157 случаев спаек брюшной полости после различных вмешательств и впервые поставил вопрос о необходимости профилактики развития спаек. Исследования продолжили В. А. Оппель, Ю. М. Дедерер, В. А. Блинов.
С развитием хирургии шире становился диапазон операций. Чаще возникали и болезненные состояния, обозначаемые как спайки, спаечная непроходимость, спаечная болезнь. Изучение процесса спайкообразования показало, что болезненные состояния, сопровождающие образование спаек, дают значительные варианты клинических проявлений, обозначаемых симптомокомплексом спаечной болезни. Установлено: в основе спаечного процесса лежат нарушения функции брюшины, связанные с гипоксией, развивающейся вследствие длительного воспалительного процесса, что приводит к нарушению ее фибринолитической функции (А. Н. Дубяга, 1987; Р. А. Женчевский, 1989; D. M. Scott-Combes, 1995; J. N. Thompson, 1995; S. A. Whawell, 1995).
Наличие спаек приводит к снижению качества жизни, хроническим болям в животе, бесплодию у женщин, угрожает кишечной непроходимостью. По данным ряда авторов, 1% перенесших операции на органах брюшной полости ежегодно лечатся от спаечной болезни. Внутрибрюшные сращения после манипуляций хирурга на органах брюшной полости возникают в 80–90% случаев. Частота развития рецидива острой спаечной непроходимости кишечника — 30–69%, повторные операции усугубляют состояние и приводят к летальным исходам в 13–55% случаев.
Существует множество классификаций спаечной болезни, однако в практической работе чаще всего применяется классификация по Д. П. Чухриенко.
Масштабы спаечного процесса — от тотального до образования отдельных тяжей, фиксированных в двух точках. Как правило, спаечный процесс сильнее выражен в зоне операции. Часто петли кишок припаиваются к послеоперационному рубцу или фиксируются к стенкам послеоперационного грыжевого мешка.
Клинические проявления — от незначительных болей в животе до тяжелых форм острой кишечной непроходимости. Одна из основных жалоб — постоянная боль по всему животу без четкой локализации. Также отмечаются тошнота, нередко рвота, вздутие живота, урчание в кишечнике, затруднение отхождения газов и стула, желудочно-кишечный дискомфорт. Имеют место функциональные расстройства со стороны других органов, вовлеченных в спаечный процесс. При спаечной болезни с преобладанием болевого синдрома характерных изменений показателей периферической крови, функций печени, органов ЖКТ обычно не наблюдается.
Для установления диагноза «спаечная болезнь» необходимо провести рентгенологическое обследование ЖКТ, т. к. наличие лапаротомий в анамнезе еще не говорит о присутствии спаек в брюшной полости. Рентгенодиагностика основывается на обнаружении деформаций, необычной фиксации, сращений с брюшной стенкой в полипозиционном исследовании.
Лапароскопия до недавнего времени была противопоказана из-за высокого риска повреждения внутренних органов. Сейчас ее применяют при спаечной болезни как с диагностической, так и с лечебной целью.
Нередко эффективной в плане диагностики оказывается фиброколоноскопия.
Лабораторные данные не дают ничего патогномоничного.
Лечение трудное: никогда нельзя быть уверенным, что лапаротомия, произведенная при спаечной болезни, ликвидирует причины, вызвавшие спаечный процесс.
Вмешательства чаще выполняются по экстренным показаниям. В плановом порядке оперируются пациенты с хронической обтурационной и рецидивирующей спаечной непроходимостью.
В сложной ситуации оказывается хирург при наличии плотного конгломерата кишечных петель. Рациональным будет наложение выключающего обходного анастомоза; радикальным, оптимальным для больного — резекция всего конгломерата.
Самая серьезная проблема — рецидивирующая спаечная непроходимость кишечника, собственно спаечная болезнь.
Операции различны — в зависимости от характера сращений и вида кишечной непроходимости. Наиболее частая — разделение спаек. Плоскостные спайки, вызывающие перегибы, перетяжки, образование двустволок, рассекают. Соединительнотканные тяжи иссекают у места их прикрепления. Десерозированные поверхности на кишке перитонизируют путем наложения узловых швов на стенку кишки. При рубцовых спайках, деформирующих петли кишок без нарушения питания стенки, обычно накладывают обходные анастомозы между петлями тонких кишок, между тонкой и толстой кишкой, реже — между отделами толстой.
Важен выбор доступа. Многих оперируют не по разу — передняя брюшная стенка у них с рубцами. Поэтому лучшим доступом большинство хирургов считает нижнесрединную лапаротомию, которая при необходимости может быть расширена кверху. Доступ через старый операционный рубец чреват вскрытием просвета кишки.
Разрезы передней брюшной стенки должны быть достаточными. Брюшину не следует грубо захватывать и вытягивать на края раны; салфетки, введенные в брюшную полость, не фиксировать к брюшине. Необходимо избегать обширной эвентрации кишечных петель и высыхания висцеральной брюшины, их покрывающей. Кишечные петли укрывать влажными салфетками, смоченными изотоническим раствором хлорида натрия. Во время операции нужен тщательный гемостаз, а излившаяся кровь должна быть своевременно эвакуирована. Важно предупреждать попадание на париетальную и висцеральную брюшину растворов йода, спирта, масел, мелких инородных тел, сухих антибиотиков.
Случай из практики
Больной К., 55 лет. Врач по специальности. Обратился в хирургическое отделение 6-й ГКБ Минска в плановом порядке для консультации с направительным диагнозом «спаечная болезнь брюшной полости с эпизодами кишечной непроходимости». Жалуется на периодическое вздутие живота, приступы болей последние 3 месяца, тошноту, задержку отхождения газов и стула.
В 1971 году в возрасте 10 лет оперирован по поводу острого деструктивного аппендицита с разлитым перитонитом. Проведена аппендэктомия, брюшная полость дренирована. Через 2 недели повторно оперирован в связи с развившейся ранней послеоперационной спаечной кишечной непроходимостью. Выполнена лапаротомия, спайки разделены.
Спустя 10 лет оперирован в одной из клиник Минска по поводу острой спаечной кишечной непроходимости: лапаротомия, спайки рассечены, кишечная непроходимость ликвидирована. Через год в другой клинике снова оперирован по поводу острой спаечной кишечной непроходимости. Имел место массивный спаечный процесс в брюшной полости. Войти в полость удалось только путем иссечения внутренних листков влагалищ прямых мышц живота в мезогастрии.
При ревизии органов брюшной полости выявлено массивное распространение спаек по петлям тонкого и толстого кишечника с вовлечением в процесс большого сальника, париетальной и висцеральной брюшины. В правой половине брюшной полости обнаружен конгломерат из петель тонкого кишечника, слепой, восходящей и правой половины поперечно-ободочной кишки. Попытка выделить петли кишечника из конгломерата безуспешна. Операция завершена наложением обходного илеотрансверзоанастомоза «бок в бок».
Пациент выписан по выздоровлению. Около 20 лет выраженных симптомов нарушения пассажа по кишечнику не было.
Медленное ухудшение началось приблизительно 3 года назад, в течение последних 6 месяцев — интенсивное. Задержка стула и газов на 2–3 дня стала постоянным явлением. Пациент отказался от твердой и грубой пищи, стал есть мало. За 2 месяца до обращения в 6-ю ГКБ Минска принимал только жидкую пищу — часто, небольшими порциями. Для обеспечения пассажа по кишечнику менял положение тела и массировал переднюю брюшную стенку. Началось похудание, снижение работоспособности. В последние 3 недели рацион включал жидкие супы, детские гомогенизированные смеси и жидкий шоколад.
При первичном осмотре — пациент c пониженным питанием, однако без признаков истощения. Кожа обычной окраски, суховатая. Легкие, сердце — без особенностей. Живот не вздут. Имеются рубцы после аппендэктомии и верхнесреднесрединной лапаротомии. При пальпации живот мягкий, слабо болезненный в мезогастрии. По правому боковому каналу определяется инфильтрат без четких границ. Симптомы раздражения брюшины отрицательные.
Клинический диагноз при поступлении: «спаечная болезнь брюшной полости с хроническим нарушением пассажа по кишечнику».
Общеклинические анализы пациента без существенных отклонений.
На рентгенограмме легочные поля без видимых инфильтративных изменений. Усилен, обогащен легочной рисунок в прикорневых отделах, корни малоструктурные, несколько расширены. Сердце не расширено. Аорта уплотнена, развернута.
Выполнена фиброколоноскопия, к которой пациент во избежание острой спаечной кишечной непроходимости готовился сам в течение 2 дней (отказ от питания и питья; ни фортранс, ни очистительные клизмы не применялись). Проблем для осмотра кишечника при колоноскопии не возникло. Эндоскоп введен в купол слепой кишки. Просвет кишки обычный. В нем до печеночного угла незначительное количество промывных вод. Стенки кишки эластичны. Перистальтика, складки не изменены. Слизистая оболочка блестящая, розовая. Сосудистый рисунок в норме. Баугиниева заслонка хорошо выражена. Интубирован терминальный отдел подвздошной кишки. Просвет обычный, на слизистой уплощенные эрозии под фибрином. В просвете восходящей кишки большое количество сформированных каловых масс. В поперечно-ободочной кишке широкое устье илеотрансверзоанастомоза. Эндоскоп проведен в отводящую кишку на глубину 40–50 см. Просвет обычный. На слизистой множественные плоские эрозии на грани изъязвлений, под фибрином. Биопсия (3 фрагмента). Интубирована приводящая кишка на глубину до 35 см (без особенностей).
Заключение: состояние после наложения илеотрансверзоанастомоза (функционирует). Диффузный эрозивный илеит отводящей кишки (болезнь Крона?).
Рентгенологическое исследование кишечника с пассажем сернокислого бария решено не выполнять, дабы не спровоцировать острую спаечную кишечную непроходимость. Клиническая картина и данные колоноскопии достаточные для принятия обоснованного решения о выполнении хирургического вмешательства в плановом порядке.
Пациент оперирован под эндотрахеальным наркозом. Иссечен старый операционный рубец. Верхнесрединная лапаротомия с обходом пупка слева. Свободная брюшная полость как таковая отсутствует. Массивный спаечный процесс после предыдущих операций. К передней брюшной стенке на всем протяжении операционного рубца «вмурованы» петли тонкого кишечника, поскольку брюшина передней брюшной стенки была удалена на предыдущей операции. С техническими трудностями выполнена мобилизация проксимального отдела тонкой кишки. Кишка имеет ригидную стенку, диаметр около 6 см. Выявлено, что в 150 см от трейцевой связки имеется илеотрансверзоанастомоз. Дальнейшая мобилизация позволила установить в области илеотрансверзоанастомоза конгломерат петель тонкого кишечника. Конгломерат разделен, однако сами петли тонкого кишечника со стороны слепой кишки рубцово изменены и признаны функционально несостоятельными. Пальпаторно определяется стриктура отводящего сегмента илеотрансверзоанастомоза. Прослежен ход тонкой кишки от трейцевой связки до илеотрансверзоанастомоза. Последний наложен антиперистальтически.
По правому боковому каналу имеется конгломерат петель тонкого кишечника, не разделенный на предыдущей операции. Попытка его разделения оказалась безуспешной. В результате тщательной ревизии установлено, что причиной нарушения пассажа по тонкой кишке являются множественные ее спайки и перегибы, конгломерат кишечных петель по правому боковому каналу, а также стриктура илеотрансверзоанастомоза. Спайки, насколько это возможно, разъединены. Петли кишечника расправлены по левой половине брюшной полости. Справа разделить петли тонкого кишечника без их повреждения нереально. Показана правосторонняя гемиколэктомия. Единым блоком мобилизован конгломерат кишечных петель, включающий около 80 см рубцово-измененной, со спайками подвздошной кишки, слепую, восходящую и правую половину поперечно-ободочной кишки с илеотрансверзоанастомозом. Правосторонняя гемиколэктомия выполнена. Сформирован изоперистальтический илеотрансверзоанастомоз «конец в конец» двухрядным швом. Анастомоз проходим, наложен без натяжения. Ушито «окно» в брыжейке кишечника. Частично восстановлена целостность брюшины правого бокового канала. Дренажная трубка по правому боковому каналу и в малый таз, а также по левому боковому каналу. Брюшная полость осушена. Рана передней брюшной стенки послойно ушита с наложением механического кожного шва. Повязка. Длительность операции — 9 часов 15 минут.
Макропрепарат: рубцово-измененные петли тонкого кишечника (около 80 см подвздошной кишки), слепая, восходящая и половина поперечно-ободочной с илеотрансверзоанастомозом общей длиной около 140 см.
Гистологическое заключение: фрагменты тонкой и толстой кишок с десквамацией эпителия в просвете, геморрагиями, очаговыми некробиотическими изменениями слизистого слоя толстой кишки, скудной лимфолейкоцитарной инфильтрацией в слизистом и подслизистом слоях. Со стороны серозы — разрастание фиброзной ткани с неоангиогенезом, лейкоцитарной инфильтрацией. В краях резекции — аналогичные изменения. Брыжейка с полнокровными сосудами, лимфатическими узелками с синусовым гистиоцитозом, участками фиброзной ткани.
Заключительный клинический диагноз: хроническая спаечная болезнь брюшной полости с тотальным спаечным процессом и нарушением пассажа по кишечнику. Рубцовая стриктура илеотрансверзоанастомоза.
Операция: лапаротомия, ликвидация спаечного процесса, правосторонняя гемиколэктомия с резекцией илеотрансверзоанастомоза и формированием нового илеотрансверзоанастомоза «конец в конец».
Послеоперационный период протекал гладко, дренажи удалены на 3-и–4-е сутки, рана зажила первичным натяжением. Пациент выписан с выздоровлением. Стул на день выписки и позже — 3 раза в сутки. Признаков нарушения пассажа по кишечнику в ближайшем послеоперационном периоде не отмечается.
1. Операции при длительно протекающей спаечной болезни органов брюшной полости с хроническим нарушением пассажа по кишечнику предпочтительнее проводить в плановом порядке, в дневное время, подготовленной хирургической бригадой.
2. Во избежание повреждения петель тонкого кишечника лучшим доступом следует считать нижнесрединную лапаротомию, которая при необходимости может быть расширена кверху.
3. Рационально накладывать выключающий обходной анастомоз; радикальный, оптимальный для больного вариант — резекция всего конгломерата.
4. Оперируя пациента со спаечной болезнью, необходимо соблюдать ряд известных мер, предупреждающих рецидив спайкообразования.
Медицинский вестник, 18 июля 2016
Почечно-клеточный рак — клиника и диагностика
Статистика и эпидемиология. Почечно-клеточный рак (ПКР) — общепринятый в настоящее время термин для обозначения рака, развившегося из эпителия почечных канальцев. Составляет 3% всех злокачественных опухолей у взрослых и около 97% всех опухолей почек. Среди урологических опухолей рак почки занимает третье место после новообразований предстательной железы и мочевого пузыря, а по смертности находится на первом месте. В последние годы отмечается умеренный рост заболеваемости (около 2% в год). Наибольшая заболеваемость регистрируется в Скандинавских странах, в 5 раз превышая таковую в Италии и Японии. Ежегодно в США отмечается около 180000 случаев заболевания раком почки, из которых более 9000 заканчивается смертельным исходом.
Рак почки чаще встречается у городских, чем у сельских, жителей. Среди заболевших мужчин в 2-3 раза больше, чем женщин.
Число случаев поздней диагностики рака почки в 3 раза выше, чем других урологических новообразований. Уже при первичном обращении 25-30% больных имеют отдаленные метастазы, у 25% диагностируется местно-распространенный рак почки. После радикального лечения еще у 40-50% больных появляются метастазы. Впервые почечно-клеточный рак был описан Konig в 1826 г. Первая нефрэктомия была выполнена Walcott в 1863 г.
Этиология почечно-клеточного рака до настоящего времени окончательно не установлена. На возникновение его определенное влияние оказывают специфика работы пациентов (нитрозосоединения, циклические углеводороды, нитраты, ионизирующая радиация), злоупотребление фенацетинсодержащими аналгетиками, курение, генетическая предрасположенность (болезнь Гиппеля-Линдау, туберкулезный склероз, приобретенный поликистоз).
Патогенез почечно-клеточного рака тесно связан с общими закономерностями канцерогенеза, в частности химического, который к настоящему времени хорошо изучен. Основные положения двухстадийной модели канцерогенеза можно определить следующим образом. В течение первой стадии (инициации) происходят необратимые нарушения генотипа нормальной клетки, вследствие чего она переходит в предрасположенное к трансформации состояние. Вторая стадия — стадия промоции канцерогенеза. Инициированная клетка приобретает фенотипические свойства трансформированной клетки в результате измененной генной экспрессии.
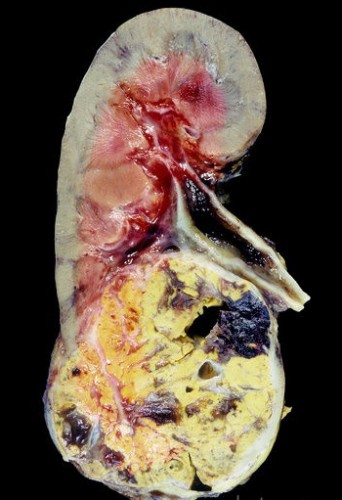
Патологическая анатомия. Макроскопически почечно-клеточный рак представляет собой опухоль сферической формы, располагающуюся в корковом веществе почки и распространяющуюся на периферические ткани. Истинная капсула отсутствует, но по периферии опухоли может быть уплотнение из фиброзной ткани и воспалительных клеток. Фасция Героты часто является барьером для инвазии в паранефральную клетчатку.
На разрезе опухоль, как правило, неоднородна из-за многочисленных кровоизлияний, некрозов, участков фиброза, кист и кальцификатов. Преобладают опухоли желтого цвета, обусловленного накоплением внутриклеточных липидов. Коричневую окраску имеют опухоли с большим количеством гранулированных клеток (содержат цитохромные ферменты). Опухоли, состоящие из веретенообразных клеток, менее пигментированы — серые или белесоватые.
Гистологическое строение и клеточный состав ПКР крайне разнообразны, что не только создает диагностические и гистогенетические проблемы, но и чрезвычайно затрудняет создание единой общепринятой гистологической классификации.
Наиболее типично трабекулярное, альвеолярное, папиллярное и солидное строение. Тубулярные структуры встречаются довольно редко. Выделяют три основных клеточных типа: светлые, гранулярные и веретенообразные (саркомоподобные, полиморфные) клетки. Ядра клеток рака почки варьируют по форме и размерам. В большинстве клеток ядрышко не определяется. На ядерных признаках основывается идентификация степени гистологической злокачественности почечно-клеточного рака. Митозы редки. Опухоль хорошо васкуляризирована. Из-за неполноценности опухолевых сосудов для рака почки типичны многочисленные кровоизлияния. Другие микроскопические признаки — некрозы, фиброзы, депо гемосидерина, псаммомные тельца, скудные мононуклеарные инфильтраты. Выраженная воспалительная реакция наблюдается редко.
Классификация. Из существующих классификаций ПКР наибольшей известностью, особенно в США, продолжает пользоваться классификация Robson Flocks и Kadesky. Существенным недостатком этой классификации является то, что она не предусматривает выделение ранних форм рака и в ней отсутствует детализация вовлечения в процесс различных групп лимфатических узлов, вен.
В настоящее время стадии ПКР рекомендуют оценивать по системе TNM, основанной на клинико-рентгенологических и патогистологических данных.
Международная классификация по системе TNM
Классификация применима только для почечно-клеточной карциномы. Диагноз должен быть подтвержден гистологически.
TNM — клиническая классификация
Т — первичная опухоль:
Тх — недостаточно данных для оценки первичной опухоли,
Т0 — первичная опухоль не определяется,
Т1 — опухоль до 7 см в наибольшем измерении, ограниченная почкой,
Т2 — опухоль более 7 см в наибольшем измерении, ограниченная почкой,
Т3 — опухоль распространяется в крупные вены или надпочечник либо околопочечные ткани, но в пределах фасции Героты:
Т3а — опухоль распространяется на надпочечник или околопочечные ткани, но в пределах фасции Героты,
Т3b — массивное распространение опухоли в почечную(ые) или полую вены, ниже диафрагмы,
Т3с — массивное распространение опухоли в полую вену, выше диафрагмы,
Т4 — опухоль распространяется за пределы фасции Героты.
N — регионарные лимфатические узлы. Регионарными лимфатическими узлами для почки являются лимфатические узлы ворот почки, абдоминальные парааортальные и паракавальные. При определении категории N сторона поражения не учитывается.
Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов,
N0 — нет признаков метастатического поражения регионарных лимфатических узлов,
N1— метастаз в одном лимфатическом узле,
N2 — метастазы в нескольких лимфатических узлах.
М — отдаленные метастазы:
Мх — недостаточно данных для определения отдаленных метастазов,
М0 — нет признаков отдаленных метастазов,
M1 — имеются отдаленные метастазы.
pTNM — патогистологическая классификация. Требования к определению категорий рТ, pN и рМ соответствуют требованиям к определению категорий Т, N и М.
Группировка по стадиям
Стадия I Т1 N0 М0
Стадия II Т2 N0 М0
Стадия III ТЗ N0 М0
Т1-3 N1 М0
Стадия IV Т4 N0-2 М0
Т1-4 N2 М0
Т1-4 N0-2 M1
Клиника. Симптомы почечно-клеточного рака складываются из:
1.общих симптомов:
2.местных симптомов;
3.признаков метастазирования опухоли.
Системные, или общие, симптомы ПКР, как правило, не имеют «урологического» характера и не являются специфичными для рака почки. Они могут быть как ранними, так и поздними.
Среди общих симптомов определенное значение имеют: ухудшение общего состояния, потеря аппетита (у 8-22% больных), похудание (у 25-30%), недомогание (у 20-40%), повышение температуры тела (у 11-50% больных). Как правило, повышенная температура тела при ПКР является прогностически неблагоприятным симптомом. Очень часто ей сопутствует повышенная СОЭ.
У значительного числа больных (29-88%) развивается гипохромная анемия как результат частых гематурий или гемолиза. Вторичный эритроцитоз при ПКР диагностируется у 1,8-2,5% больных. Механизм данного явления связан не с пролиферативными процессами в костном мозге, а с избыточным продуцированием опухолью или паренхимой почки эритропоэтина, являющегося а2-гликопротеином, в ответ на развитие злокачественного новообразования.
В 1961 г. Staufter впервые описал синдром, ассоциированный с ПКР. Он включает в себя гиперглобулинемию, гипоальбуминемию, гиперкальциемию, гипопротромбинемию, повышение уровня щелочной фосфатазы, задержку трансферрина и появляется обычно вместе с лихорадкой, анемией, утомляемостью, потерей массы тела. Наблюдается у 40% больных раком почки, является обратимым и исчезает после радикального лечения.
В последние годы стало известно, что ПКР может проявляться артериальной гипертензией (3-20% больных), однако механизм ее окончательно не установлен.
Местные симптомы. Триада симптомов опухоли, ранее считавшаяся классической, — гематурия, боли и обнаружение опухоли при пальпации — обычно появляется в поздних стадиях ПКР и встречается в настоящее время реже благодаря более раннему выявлению заболевания. Вместе эти три симптома отмечаются нечасто (у 14,3% больных).
На первом месте по частоте среди них стоит макрогематурия (60-79,3%), затем боли в области почки (40-73,6%) и, наконец, пальпируемая опухоль (38-96%).
При ПКР гематурия чаще всего бывает тотальной, безболезненной. Она возникает, как правило, внезапно на фоне вполне удовлетворительного состояния больного. Гематурия может выявляться при одном акте мочеиспускания либо продолжаться несколько часов или дней, а затем неожиданно исчезнуть. Промежутки между первой и последующей макрогематурией бывают различными — от нескольких дней до нескольких месяцев и даже лет.
Нередко гематурия при ПКР бывает со сгустками, характер которых зависит от ее интенсивности и места свертывания крови. Сгустки могут быть червеобразными, когда кровь, поступившая из почки, свертывается в мочеточнике (эта форма особенно характерна для ПКР), или бесформенными, когда они образуются в мочевом пузыре. Нередко вслед за гематурией в области почки возникают острые боли, т.е. развивается типичный приступ почечной колики, обусловленный обтурацией мочеточника сгустком крови и исчезающий после отхождения с мочой кровяных сгустков. Такое проявление болезни в виде гематурии с почечной коликой позволяет установить, с какой стороны поражена почка. Важнейшее значение приобретает срочная цистоскопия в момент кровотечения, так как она дает возможность выявить источник кровотечения (мочевой пузырь, почки) и сторону поражения.
Характер боли обусловлен вызвавшими ее причинами. Тупая ноющая боль может быть следствием растяжения, прорастания фиброзной капсулы почки, врастания в нервные окончания паранефрия и нервные корешки, а также прорастания опухоли в соседние органы. Боль иногда может иррадиировать в бедро, половые органы, имитировать ишиас. Острые боли возникают в результате закупорки мочеточников сгустками крови, кровоизлияний в почечную паренхиму или ткань опухоли.
Наиболее редкий и самый поздний симптом из клинической триады — пальпируемая опухоль. Подвижность опухоли зависит как от степени распространения ее в окружающих тканях, так и от степени вовлечения в воспалительный процесс окружающей паранефральной клетчатки. Наиболее часто пальпируется опухоль, расположенная в нижнем сегменте почки. Поверхность опухоли может быть бугристой или гладкой, консистенция — плотной или эластичной.
Важным местным симптомом ПКР у мужчин является варикоцеле. Причинами его развития могут быть: сдавление нижней полой вены или одной из яичковых вен опухолью или метастатическими узлами; сдавление или прорастание опухолью почечной вены; наличие опухолевого тромба в почечной вене; тромбоз нижней полой вены; перегиб почечной вены в результате увеличения массы почки, смещения ее книзу. Если варикоцеле диагностируется с правой стороны, это, как правило, указывает на наличие опухоли в правой почке.
Диагностика. Рак почки у части пациентов может длительное время протекать без всякой симптоматики, у других же нередко бывают необычные и вводящие в заблуждение симптомы, по этой причине ПКР называют «великим имитатором».
Определенную роль в постановке диагноза играет правильно и тщательно собранный анамнез. Одна из жалоб, с которыми больные обращаются к врачу, — гематурия в различных ее проявлениях. Особое внимание должно быть уделено лихорадке и повышенной СОЭ.
Во время осмотра необходимо обратить внимание на общее состояние больного, окраску кожных покровов, состояние лимфатической системы, наличие измененной конфигурации живота. Отеки нижних конечностей свидетельствуют о сдавлении нижней полой вены. Расширение подкожных вен живота может быть следствием нарушенного оттока из почки. Во время осмотра больного необходимо помнить о возможном наличии варикоцеле. Если при осмотре выявляется деформация костей, это может свидетельствовать о наличии костных метастазов.
К сожалению, данные осмотра позволяют выявить в основном далеко зашедшие формы ПКР.
Клиническая диагностика ранних форм ПКР крайне затруднительна, следовательно, необходимо использовать инструментальные методы диагностики.
Рентгенологический метод исследования занимает одно из ведущих мест в распознавании опухолей почки. Обследование больного всегда следует начинать с обзорной рентгенографии. Она дает представление о контурах, форме, размерах, структуре, положении почек, позволяет оценить состояние окружающих тканей, лимфатических узлов. Для более четкого выявления контуров почки можно прибегнуть к таким ранее широко применявшимся методам, как томография и пневморетроперитонеум.
Следующим этапом рентгенологического обследования больных ПКР является экскреторная урография. Она неспецифична, нечувствительна и обычно может использоваться для первоначальной оценки новообразований почки. В последние годы применяется так называемая внутривенная инфузионная урография и нефротомография.
Экскреторная урография и ее разновидности помогают диагностировать ПКР, если имеются некоторые характерные признаки опухоли:
1.увеличение размеров почки, увеличение расстояния между полюсами почки и ее общих контуров, смещение почки, ротация ее вокруг продольной оси;
2.деформация лоханки, дефект ее наполнения, узурация контуров лоханки; при тотальном прорастании лоханки контрастное вещество может совершенно не заполнить лоханку;
3.изменения со стороны чашечек: частичное или полное исчезновение, ампутация одной или нескольких чашечек, сдавление чашечек с сужением и вытягиванием или расширением, смещение чашечек, сближение или раздвигание их с увеличением угла между ними, деформация чашечек в виде «ножки паука»;
4.изменение положения мочеточника и сдавление его в верхнем отделе за счет больших размеров опухоли нижнего полюса почки и метастазов в регионарных лимфатических узлах.
Ретроградная пиелография для диагностики ПКР в последние годы применяется крайне редко.
В настоящее время важное значение в диагностике ПКР имеют методы исследования сосудов: аортография, селективная почечная ангиография, венокавография и селективная почечная венография.
При интерпретации почечных ангиограмм учитываются изменения сосудистого рисунка, а также характер изображения контуров и размеров почки в зависимости от фазы циркуляции контрастного вещества в ее сосудах. При ПКР архитектоника сосудистого дерева почки полностью разрушена: сосудистая сеть в опухолевой ткани развита обильно, распределена бессистемно, сосуды анастомозируют между собой с образованием артериовенозных анастомозов, которые называются «озерами» или «лужицами».
Преимущество метода почечной ангиографии состоит не только в том, что она позволяет уточнить характер, локализацию, распространенность ПКР, установить нарушение кровообращения в зоне патологического очага, но и дает возможность определить целесообразность, характер и масштаб оперативного вмешательства. Неоценимое значение она приобретает для выявления ранних форм ПКР, а также для дифференциальной диагностики с другими заболеваниями почек.
Что касается венокавографии, то она позволяет получить дополнительные данные о характере опухолевого процесса, прорастании или тромбозе нижней полой вены, почечных вен, а также уточнить наличие и локализацию увеличенных, пораженных опухолевыми метастазами регионарных лимфатических узлов и до операции выяснить операбельность и объем хирургического вмешательства.
В настоящее время рентгеновская компьютерная томография признана наиболее точным и объективным методом выявления опухолей почек. Она позволяет установить:
1.локализацию и размеры опухолевого образования;
2.отношение опухоли к чашечно-лоханочной системе;
3.глубину прорастания паренхимы;
4.структуру опухоли;
5.инфильтрацию паранефрального жира;
6.тромбирование почечных вен (исключить или выявить);
7.опухолевый тромбоз нижней полой вены;
8.увеличение регионарных лимфатических узлов, их консистенцию, локализацию и размеры;
9.инвазию опухоли в соседние органы;
10.абдоминальную пенетрацию;
11.метастазы в печени;
12.метастазы в костях.
Рак почки на компьютерных томограммах определяется в виде объемного образования с гомогенной или неоднородной внутренней структурой по плотности несколько выше или ниже нормальной паренхимы, может сопровождаться: резкой деформацией почки и синуса или отсутствием их изображения на срезе; наличием симптомов «клюва» или «хобота»; полной или частичной облитерацией паранефрона, уплотнением почечной фасции; утолщением сосудистой ножки, увеличением забрюшинных лимфатических узлов и нижней полой вены, вовлечением в процесс фасции Героты; деформацией мышц и мягких тканей спины.
Применение магнитно-резонансной томографии в исследовании ПКР все еще остается противоречивым и дискутабельным вопросом.
Ультразвуковое исследование в настоящее время является одним из ведущих методов неинвазивной диагностики опухолей почки. Эхографическая картина при ПКР находится в прямой зависимости от размера опухолевых узлов, их локализации и степени акустической однородности новообразования. ПКР определяется как образование неправильной округлой или овальной формы с неровными контурами, наружный контур может быть четким до тех пор, пока не разрушена жировая капсула почки, в то время как на границе со здоровой паренхимой он является размытым. Чаще всего рак почки имеет пониженную эхогенность и неоднородную структуру, нередко определяются сдавление, раздвоение, деформация, смещение или уменьшение чашечно-лоханочной системы. Часто выявляются деформация почки и увеличение ее размеров.
Цистоскопия играет важную роль в топической диагностике ПКР, особенно при наличии у больного примеси крови в моче. Необходима для определения источника кровотечения (почка или мочевой пузырь) и стороны поражения.
Пункционная биопсия используется для уточнения природы неясных объемных новообразований почки. Этот метод имеет диагностическое значение только при положительных результатах исследования, отрицательные данные не исключают наличия опухоли.
Лабораторные методы исследования: изменения в анализах крови и мочи не являются патогномоничными для ПКР.
Иммунологические методы исследования основаны на различиях антигенов опухолевой и нормальной ткани. Эти различия имеют как качественный, так и количественный характер. Оценка противоопухолевого иммунитета для диагностических целей основывается на изучении реакций клеточного и гуморального иммунитета.
Дифференциальная диагностика. В распознавании ПКР дифференциальная диагностика имеет важное значение, поскольку многие заболевания почки имеют сходную клиническую картину и симптоматику, а также рентгенологические и другие признаки. К таким заболеваниям относятся: солитарная киста почки, парапельвикальная киста, поликистоз почек, мультикистозная почка, гидронефроз и пионефроз, туберкулез почки, абсцесс или карбункул почки, эхинококк почки, камень почки, паранефрит, переходно-клеточный рак лоханки, ангиомиолипома, онкоцитома, метастатические опухоли почек, опухоли забрюшинного пространства и другие заболевания.
Правильная интерпретация и оценка симптомов заболевания и данных всех методов диагностики в комплексе позволяют установить точный диагноз.