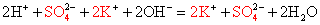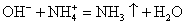Как сделать реакцию ионного обмена
Реакции ионного обмена
Содержание:
Что есть реакция ионного обмена? Определение
Химическое взаимодействие ионов в электролитах называется реакцией ионного обмена (РИО).
Сущность РИО заключается в связывании ионов.
Напоминание. Электролиты – это водные растворы кислот, солей или оснований, в которых эти вещества распадаются (диссоциируют) на свободные заряженные ионы.
Необходимое условие РИО. Правило Бертолле
Главное условие необратимого протекания ионнообменной реакции между электролитами – образование осадка, газообразного вещества или малодиссоциирующего соединения (слабого электролита, в т.ч. воды).
Данное утверждение носит название правила Бертолле. Этот французский химик сформулировал его в 1803 г.
Следует помнить, что это правило справедливо при взаимодействии ненасыщенных растворов.
Особенности РИО. Суть необратимого процесса
Более реально состояние реагентов в растворе демонстрирует запись в виде заряженных ионов:
Эти уравнения получили названия:
(2) – полное ионное уравнение,
(1) – молекулярное уравнение реакции.
Вывод: уравнение в ионной форме отражает сущность процесса, показывает за счёт чего возможно его протекание.
Знать: в обратимых РИО не бывает сокращенной ионной формы уравнения.
Правила (алгоритм) составления уравнений ионно-обменных реакций
В обычных химических уравнениях разложение молекул на ионы не учитывается. Чтобы отразить сущность взаимодействия электролитических растворов, пользуются ионными уравнениями, которые составляются по определённым правилам.
Примеры РИО с выделением газа и выпадением осадка
Применение РИО
Во многих отраслях индустрии, сельском хозяйстве, в решении проблем экологии используются реакции ионного обмена. Несколько примеров применения РИО.
В заключении интересный факт: домашние хозяйки, сами того не зная, используют правило Бертолле, когда применяют реакцию ионного обмена между столовым уксусом и пищевой содой. Выделяющийся при этом газ способствует «поднятию» теста.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакции ионного обмена протекали, необходимо, чтобы выполнялись не только условия: образование осадка, газа или воды, но и вещества –реагенты должны быть растворимыми.
Вывод:
Как сделать реакцию ионного обмена
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. На уроке будет дано определение новому понятию реакции ионного обмена.
Также будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
Урок поможет закрепить умение составлять уравнения реакций ионного обмена в молекулярной и ионной формах, научит составлять по сокращенному ионному уравнению молекулярные.
I. Сущность реакций ионного обмена
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами.
Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
AgNO3 + HCl = AgCl
Реакция протекает до конца, так как выпадает осадок хлорида серебра
Сu(OH)2 + 2HCl = CuCl2 + 2H2O
Реакция идет до конца, так как образуется слабый электролит вода
Na2CO3 + 2H2SO4 = Na2SO4 + CO2
Реакция протекает до конца, так как образуется углекислый газ
Правила написания уравнений реакций в ионном виде
1. Записывают формулы веществ, вступивших в реакцию, ставят знак «равно» и записывают формулы образовавшихся веществ. Расставляют коэффициенты.
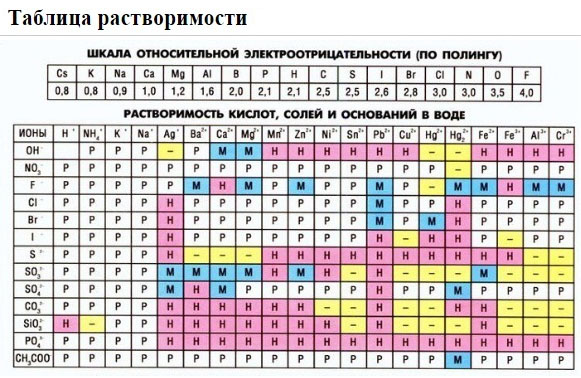
2. Пользуясь таблицей растворимости, записывают в ионном виде формулы веществ (солей, кислот, оснований), обозначенных в таблице растворимости буквой «Р» (хорошо растворимые в воде), исключение – гидроксид кальция, который, хотя и обозначен буквой «М», все же в водном растворе хорошо диссоциирует на ионы.
3. Нужно помнить, что на ионы не разлагаются металлы, оксиды металлов и неметаллов, вода, газообразные вещества, нерастворимые в воде соединения, обозначенные в таблице растворимости буквой «Н». Формулы этих веществ записывают в молекулярном виде. Получают полное ионное уравнение.
4. Сокращают одинаковые ионы до знака «равно» и после него в уравнении. Получают сокращенное ионное уравнение.
На ионы диссоциируют
Реагенты (исходные вещества)
Растворимые (P) в воде (см. ТР):
(включая Ca(OH)2 – M)
Растворимые (P) в воде (см. ТР):
Исключения – неустойчивые вещества не диссоциируют, а разлагаются на газ и воду:
Алгоритм составления реакций ионного обмена (РИО)
в молекулярном, полном и кратком ионном виде
1) Записываем уравнение РИО в молекулярном виде:
Взаимодействие сульфата меди (II) и гидроксида натрия:
2) Используя ТР указываем растворимость веществ воде:
— Если продукт является М или Н – оно выпадает в осадок, справа от химической формулы ставим знак ↓
— Если продукт является газом, справа от химической формулы ставим знак ↑
4) Записываем уравнение реакции в кратком ионном виде. Сокращаем одинаковые ионы, вычёркивая их из уравнения реакции.
Помните! РИО необратима и практически осуществима, если в продуктах образуются:
Краткий ионный вид
Вывод – данная реакция необратима, т.е. идёт до конца, т.к. образовался осадок Cu(OH)2↓
Заишем еще несколько примеров РИО, идущих с образованием осадка:
Пример №1
а) Молекулярное уравнение реакции двух растворимых солей:
б) Полное ионное уравнение реакции:
в) Cокращенное ионное уравнение реакции:
Пример №2
а) Молекулярное уравнение реакции нерастворимого основания с кислотой:
б) Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным. Эта реакция протекает до конца, о чем свидетельствуют сразу два факта: образование вещества, нерастворимого в воде, и выделение воды.
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
О протекании данной реакции до конца свидетельствуют два признака: выделение воды и газа – оксида углерода (IV).
Заишем еще несколько примеров РИО, идущих с образованием газа:
Пример №1
Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой:
Полное ионное уравнение реакции:
2K + + S 2– + 2H + + 2Cl – = 2K + + 2Cl – + H2S↑
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции нерастворимой соли (карбоната) с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение реакции совпадает с сокращенным уравнением. Эта реакция протекает до конца, о чем свидетельствуют сразу три признака: выделение газа, образование осадка и выделение воды.
Посмотрите видео-опыт: “Реакция нейтрализации”
Пример №1
Молекулярное уравнение реакции щелочи с кислотой:
KOH (р) + HCl (р) = KCl(р) + H2O (мд)
Полное ионное уравнение реакции:
K + + OH – + H + + Cl – = K + + Cl – + H2O
Cокращенное ионное уравнение реакции:
Пример №2
Молекулярное уравнение реакции основного оксида с кислотой:
Полное ионное уравнение реакции:
Cокращенное ионное уравнение реакции:
CaO + 2H+ = Ca 2+ + H2O.
Пример №3
Молекулярное уравнение реакции нерастворимого основания с кислотой:
Полное ионное уравнение реакции:
В данном случае полное ионное уравнение совпадает с сокращенным ионным уравнением.
V. Выполнение заданий
Задание №1. Определите, может ли осуществляться взаимодействие между растворами гидроксида калия и хлорида аммония, записать реакциив молекулярном, полном, кратком ионном виде.
— Составляем химические формулы веществ по их названиям, используя валентности и записываем РИО в молекулярном виде (проверяем растворимость веществ по ТР):
так как NH4OH неустойчивое вещество и разлагается на воду и газ NH3уравнение РИО примет окончательный вид
— Cоставляем полное ионное уравнение РИО, используя ТР (не забывайте в правом верхнем углу записывать заряд иона):
— Cоставляем краткое ионное уравнение РИО, вычёркивая одинаковые ионы до и после реакции:
Взаимодействие между растворами следующих веществ может осуществляться, так как продуктами данной РИО являются газ (NH3 ↑) и малодиссоциирующее вещество вода (H2O).
Подберите вещества, взаимодействие между которыми в водных растворах выражается следующими сокращёнными уравнениями. Составьте соответствующие молекулярное и полное ионное уравнения.
— Составляем молекулярное уравнение РИО:
так как угольная кислота – неустойчивое вещества, она разлагается на углекислый газ CO2 ↑ и воду H2O, уравнение примет окончательный вид:
— Составляем полное ионное уравнение РИО:
— Составляем краткое ионное уравнение РИО:
Сокращаем коэффициенты на три и получаем:
В конечном итоге мы получили искомое сокращённое ионное уравнение, следовательно, задание выполнено верно.
Задание №3. Запишите реакцию обмена между оксидом натрия и фосфорной кислотой в молекулярном, полном и кратком ионном виде.
1. Составляем молекулярное уравнение, при составлении формул учитываем валентности (см. ТР)
2. Составляем полное ионное уравнение:
3. Сокращаем одинаковые ионы и получаем краткое ионное уравнение:
Данная реакция необратима, т.е. идёт до конца, так как в продуктах образуется малодиссоциирующее вещество вода.
VI. Задания для самостоятельной работы
Задание №1. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена карбоната натрия с серной кислотой в молекулярном, полном и кратком ионном виде.
Задание №2. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Задание №3. Посмотрите следующий эксперимент:
Составьте уравнение реакции ионного обмена хлорида бария с сульфатом магния в молекулярном, полном и кратком ионном виде.
Задание №4. Закончите уравнения реакций в молекулярном, полном и кратком ионном виде:
При выполнении задания используйте таблицу растворимости веществ в воде. Помните об исключениях!
Ионные уравнения
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации. Разберем историю вопроса, алгоритм составления ионных уравнений и примеры задач.
ИСТОРИЯ ВОПРОСА
Еще древние алхимики, проводя нехитрые химические реакции в поисках философского камня и записывая в толстые фолианты результаты своих исследований, использовали определенные знаки для химических веществ. У каждого ученого была своя система, что неудивительно: каждый хотел защитить свои тайные знания от происков завистников и конкурентов. И лишь в VIII веке появляются единые обозначения для некоторых элементов.
В 1615 году Жан Бегун в своей книге «Начала химии», что по праву считается одним из первых учебников в этом разделе естествознания, предложил использовать условные обозначения для записи химических уравнений. И лишь в 1814 году шведский химик Йонс Якоб Берцелиус создал систему химических символов на основе одной или двух первых букв латинского названия элемента, подобную той, с которой ученики знакомятся на уроках.
В восьмом классе (параграф 12, учебник «Химия. 8 класс» под редакцией В.В. Еремина) ребята научились составлять молекулярные уравнения реакций, где и реагенты, и продукты реакций представлены в виде молекул.
Однако это упрощенный взгляд на химические превращения. И об этом задумывались ученые уже в XVIII веке.
Аррениус в результате своих экспериментов выяснил, что растворы некоторых веществ проводят электрический ток. И доказал, что вещества, обладающие электропроводностью, в растворах находятся в виде ионов: положительно заряженных катионов и отрицательно заряженных анионов. И именно эти заряженные частицы вступают в реакции.
ЧТО ТАКОЕ ИОННЫЕ УРАВНЕНИЯ
Ионные уравнения реакций — это химические равенства, в которых вещества, вступающие в реакцию, и продукты реакций обозначены в виде диссоциированных ионов. Уравнения данного типа подходят для записи химических реакций замещения и обмена в растворах.
Ионные уравнения — неотъемлемая часть сложной и интересной химической науки. Такие уравнения позволяют наглядно увидеть, какие ионы вступают в химические превращения. В виде ионов записывают вещества, которые подвергаются электролитической диссоциации (тема подробно разбирается в параграфе 10, учебник «Химия. 9 класс» под редакцией В.В. Еремина). В виде молекул записывают газы, вещества, выпадающие в осадок, и слабые электролиты, которые практически не диссоциируют. Газы обозначаются стрелкой вверх (↑), субстанции, выпадающие в осадок, стрелкой вниз (↓).
ОСОБЕННОСТИ ИОННЫХ УРАВНЕНИЙ
1. Реакции ионного обмена, в отличие от окислительно-восстановительных реакций, протекают без нарушения валентности веществ, вступающих в химические превращения.

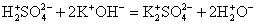
2. Реакции между ионами протекают при условии образования в ходе реакции плохорастворимого осадка, выделения летучего газа или образования слабых электролитов.
Удивительно, что реакции обмена могут проходить даже с нерастворимыми солями слабых кислот. В этом случае сильная кислота вытесняет слабую из ее солей. В качестве примера можно привести сокращенное ионное уравнение разведения карбоната кальция в сильных кислотах.
АЛГОРИТМ СОСТАВЛЕНИЯ ИОННОГО УРАВНЕНИЯ
Записываем молекулярное уравнение химического процесса.
Балансируем молекулярное уравнение с помощью коэффициентов.
Чтобы правильно сбалансировать равенство, нужно вспомнить закон сохранения массы веществ (параграф 12, «Химия. 8 класс» под редакцией В.В. Еремина), согласно которому в ходе химических превращений новые атомы не появляются, а старые не разрушаются. Т.е. число атомов в продуктах реакции равно числу атомов в исходных веществах. Помним, что водород и кислород уравниваем в последнюю очередь.
Определяем, какие вещества в химической реакции диссоциируют, т.е. распадаются на ионы.
Записываем в виде ионов:
Записываем в виде молекул:
Если есть сомнения в растворимости реагента или продукта реакции, можно проверить по специальной таблице, которая является справочным материалом, ей можно пользоваться на различных экзаменах.
В таблице, помимо растворимости соединений, представлены также заряды катионов и анионов, участвующих в реакциях.
Определяем многоатомные ионы.
Это необходимо сделать, т.к. данные соединения не разлагаются на отдельные атомы и имеют свой заряд. Чаще всего в химических превращениях участвуют следующие многоатомные ионы:
Записываем равенство таким образом, чтобы все диссоциирующие субстанции были представлены в виде катионов и анионов.
Проверяем, чтобы уравнение было сбалансировано, т.е. количество различных атомов в частях с реагентами и продуктами реакции совпадало.
На данном этапе мы получили полное ионное уравнение.
Вычеркиваем идентичные ионы в обеих частях равенства, т.е. катионы и анионы с одинаковыми нижними индексами и зарядами, и переписываем равенство без данных ионов.
Проверяем, чтобы количество атомов элементов совпадало в правой и левой частях уравнения. Таким образом получаем краткое ионное уравнение.
ПРИМЕРЫ
Задача 1
Выясните, произойдет ли химическое взаимодействие между растворами гидроксида калия и хлорида аммония. (Записать для реакции молекулярное, полное ионное и сокращенное ионное уравнение.)
Записываем молекулярное уравнение, проверяем коэффициенты.
Помним, что гидроксид аммония — нестабильное соединение и разлагается на аммиак и воду.
Записываем окончательное уравнение:
NB! Благодаря летучести и резкому раздражающему запаху 3%-й раствор NH3 называется «нашатырный спирт» и используется в медицине.
Подсматривая в таблицу растворимости, помечаем полное ионное уравнение, не забывая о зарядах ионов.
Вычеркивая идентичные катионы и анионы в обеих частях реакции, составляем краткое ионное уравнение.
Делаем вывод: химическая реакция между гидроксидом калия и хлоридом аммония протекает с образованием воды и выделением аммиака — летучего газа с резким запахом.
Задача 2
А сейчас выполним задание из учебника «Химия. 9 класс» под редакцией В.В. Еремина.
Налейте в пробирку 1 мл раствора карбоната натрия и аккуратно прилейте к нему пару капелек соляной кислоты.
Составьте уравнение реакции, напишите полное и сокращенное ионные уравнения.
Записываем реакцию в молекулярном виде, расставляем коэффициенты, если это необходимо.
Подсматривая в таблицу растворимости, записываем полное ионное уравнение, не забывая отмечать заряды ионов.
Вычеркивая одинаковые катионы и анионы в правой и левой частях равенства, составляем краткое ионное уравнение.
Вопрос «Что происходит?» остался без ответа. К сожалению, в домашних условиях этот опыт осуществить трудновато, так как стиральной содой уже давно никто не пользуется, да и соляную кислоту в аптеке уже не продают. Но примерно такой же визуальный эффект можно наблюдать, если смешать раствор пищевой соды с раствором уксусной кислоты.
1.4.6. Реакции ионного обмена.
Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
Полное и сокращенное уравнение будут иметь вид: