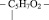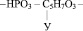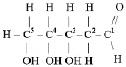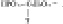Какая реакция доказывает что белки являются полипептидами
Белки (протеины, полипептиды)
Дано определение, состав, структура и функции белков организма человека. Приведена их классификация. Описаны синтез и катаболизм белков.
Белки (протеины, полипептиды)
Определение
Белки – высокомолекулярные азотсодержащие соединения, состоящие из аминокислот.
Молекулярная масса белков
Состав белков
Несмотря на то, что в составе белковой молекулы могут входить десятки, сотни и тысячи аминокислот, все белки синтезируются из 20 видов аминокислот. Эти аминокислоты имеют следующие названия: глицин, аланин, серин, цистеин, треонин, метионин, валин, лейцин, изолейцин, аспарагиновая кислота, аспарагин, глутаминовая кислота, глутамин, лизин, аргинин, фенилаланин, тирозин, триптофан, гистидин, пролин.
Структура белков
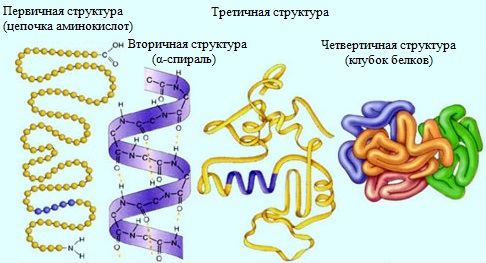
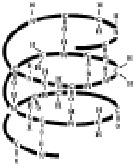
Различают четыре уровня структурной организации молекулы белка (рис.1).
Рис.1. Структуры белков
Первичная структура. Аминокислоты соединяясь друг с другом пептидной связью образуют длинные неразветвленные цепи – полипептиды.
Вторичная структура. Эта структура белков характеризует их определенную пространственную организацию. Например, многие белки имеют форму спирали. Фиксируется вторичная структура дисульфидными и водородными связями.
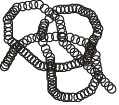
Третичная структура. Третичная структура отражает пространственную организацию вторичной структуры. Например, вторичная структура в виде спирали может укладываться в пространстве в виде глобулы, то есть иметь шаровидную или эллипсовидную форму. Примером белка, обладающего третичной структурой является миоглобин.
Четвертичная структура. Этой структурой обладают некоторые белки. Четвертичная структура – сложное образование, состоящее из нескольких белков, имеющих свою первичную, вторичную и третичную структуры. Примером белка, обладающего четвертичной структурой является гемоглобин.
Классификация белков
Существуют разные классификации белков. Приведу две классификации.
Согласно первой классификации белки делятся на простые (протеины) и сложные (протеиды). Простые белки состоят только из аминокислот. Пример: альбумины и глобулины крови. В молекуле сложного белка, кроме аминокислот, имеется еще неаминокислотная часть. В зависимости от неаминокислотной части выделяют такие сложные белки как нуклеопротеиды (содержат нуклеиновую кислоту), липопротеиды (содержат липоид) и. т.д.
Согласно второй классификации белки делятся на группы на основе своей пространственной формы. Различают глобулярные и фибриллярные белки. Молекулы глобулярных белков имеют шаровидную или эллипсовидную форму. Примерами таких белков являются альбумины и глобулины крови. Молекулы фибриллярных белков вытянутые. Их длина значительно превышает их диаметр. Примером фибриллярного белка является белок коллаген.
Функции белков
Функции, которые выполняют белки в организме настолько важны, что белки еще называют протеинами (от греч. слова proteus – первый, главный). Различают следующие функции белков в организме человека.
Перевариваривание белков в организме человека
В организм человека с пищей попадает в сутки около 100 г белков.
Расщепление белков начинается в полости желудка под воздействием желудочного сока, содержащего протеолитический фермент пепсин. Под воздействием пепсина в белках разрываются пептидные связи, образующие первичную структуру. В результате белковые молекулы превращаются в смесь полипептидов различной длины.
Дальнейшее переваривание белков протекает в тонкой кишке под воздействием ферментов: трипсина, химотрипсина и эсталазы, которые синтезируются в поджелудочной железе. В результате полипептиды расщепляются до олигопептидов, состоящих из нескольких аминокислот.
Завершается переваривание белков в тонкой кишке под воздействием ферментов кишечного сока. Образовавшиеся в результате этого процесса аминокислоты всасываются в кровь и по воротной вене поступают в печень и далее попадают в большой круг кровообращения.
Синтез белков
Синтез белков протекает в четыре этапа.
Первый этап синтеза белков протекает в ядрах клеток и называется транскрипцией.
Второй этап синтеза белков протекает в цитоплазме клетки и называется рекогницией.
Третий этап синтеза белков протекает на рибосомах и называется трансляцией.
Четвертый этап синтеза белков протекает в эндоплазматической сети и комплексе Гольджи и называется процессингом.
Более подробно синтез белков в мышечных волокнах описан в отдельной статье.
Катаболизм белков
В организме человека происходят одновременно два процесса: синтез белков и их распад (катаболизм). В тканях организма катаболизм белков происходит под воздействием внутриклеточных протеиназ, которые называются катепсинами. Эти ферменты локализованы в лизосомах.
Также катаболизм белков осуществляется особыми мультиферментными комплексами, которые называются протеосомы.
По данным С.С. Михайлова (2009) в сутки внутриклеточному протеолизу подвергается 200-300 г собственных белков организма. При этом при распаде как пищевых, так и собственных белков организма образуются одни и те же 20 видов аминокислот.
Научная электронная библиотека
§ 2.1.11. Аминокислоты. Белки. Нуклеиновые кислоты
Аминокислотами называются органические соединения, содержащие аминогруппу и карбоксильную группу. Например:
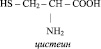
Аминокислоты относятся к веществам со смешанными функциями. Кроме того, они являются азотсодержащими и кислородсодержащими одновременно. Некоторые природные аминокислоты содержат также серу, как, например, цистеин:
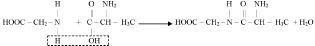
Наиболее характерным химическим свойством аминокислот является способность аминогруппы одной молекулы вступать в реакцию замещения с карбоксильной группой другой молекулы:
В результате образуется новая аминокислота, но уже с пептидной связью, способная взаимодействовать со следующей молекулой аминокислоты и образовать ещё одну пептидную связь. Последовательное увеличение количества пептидных связей в одной молекуле приводит к образованию полимеров, которые называются полипептидами, важнейшими представителями которых являются белки.
Белки – важнейшая составная часть клеток живых организмов – представляют собой полипептиды, составленные взаимодействием различных α-аминокислот. Таким образом, белки можно рассматривать как полимеры, мономером которых являются α-аминокислоты. Молекулярные массы природных белков колеблются от нескольких десятков тысяч до нескольких сот тысяч а.е.м. Аминокислотные остатки, являющиеся звеньями полипептида называют аминокислотными звеньями. Последовательность аминокислотных звеньев в линейной полипептидной цепи называется первичной структурой белковой молекулы (рис. 2.6).
Рис. 2.6. Первичная структура белков.
R1, R2, R3, R4 – радикалы остатков аминокислот
Благодаря многочисленным водородным связям между группами –СО– и –NH– первичная структура белков свёртывается в спираль, которая называется вторичной структурой белковой молекулы (рис. 2.7).
Рис. 2.7. Вторичная структура белков
В свою очередь, вторичная структура также способна свернуться, образовав третичную структуру (рис. 2.8).
Рис. 2.8. Третичная структура белков
Третичная структура поддерживается уже не только водородными связями, но также и ковалентными. В частности между атомами серы различных участков полипептида часто образуется дисульфидный мостик
Некоторые белковые макромолекулы могут соединяться друг с другом, образуя относительно крупные агрегаты. Подобные полимерные образования белков называются четвертичными структурами. Примером такого белка является гемоглобин, который представляет комплекс из четырёх макромолекул (рис. 2.9). Оказывается, что только при такой структуре гемоглобин способен присоединять и транспортировать кислород в организме.
Рис. 2.9. Четвертичная структура белков
Нуклеиновыми кислотами (полинуклеотидами) называют высокомолекулярные органические соединения, повторяющимся звеном которых являются нуклеотиды состоящие из
1. Остатка фосфорной кислоты – НРО3 –
2. Остатка рибозы 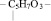
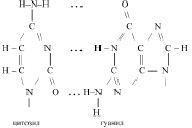
3. Радикалов азотистых оснований, а именно таких как: аденин, тимин, гуанин, цитозин, урацил.
Например, если радикал урацила обозначить У, то молекулярную формулу одного из нуклеотидов можно представить следующим образом:
К нуклеиновым кислотам относятся рибонуклеиновые кислоты (РНК) и дезоксирибонуклеиновые кислоты (ДНК). Рибонуклеиновые кислоты – это полинуклеотиды, включающие в себя остаток рибозы, радикалы аденина, гуанина, цитозина и урацила. Поскольку различные нуклеотиды РНК отличаются только радикалами азотистых оснований, то нередко каждый нуклеотид обозначают прописной первой буквой названия этого нуклеотида. Поэтому фрагмент какой либо РНК можно представить так
Первичная структура молекулы белка, синтезируемого на информационной (матричной) рибонуклеиновой кислоте (м-РНК) с помощью ферментов[31], определяется именно последовательностью нуклеотидов на этой РНК. Набору из трёх азотистых оснований, который называется триплет нуклеотидов или кодон, соответствует одна и только одна α-аминокислота. В настоящее время насчитывается 20 таких аминокислот (табл. х). Но одной аминокислоте может соответствовать несколько триплетов нуклеотида. Соответствие аминокислоты кодонам называется генетическим кодом. Реакции синтеза белка, у которого последовательность аминокислотных звеньев определяется последовательностью нуклеотидов м-РНК, называются реакциями матричного синтеза.
Последовательность нуклеотидов и-РНК в свою очередь определяется последовательностью азотистых оснований в дезоксирибонуклеиновой кислоте (ДНК), на которой и происходит синтез м-РНК
Дезоксирибонуклеиновые кислоты – это кислоты, состоящие из двух полинуклеотидных цепей, включающих в себя остаток дезоксирибозы, радикалы аденина, гуанина, цитозина, тимина и соединённых между собой по принципу комплементарности (совместимости) водородными связями. То есть, вместо радикала урацила, нуклеотиды ДНК содержат тимил, вместо остатка рибозы, остаток дезоксирибозы,
образующей замкнутый цикл соединением альдегидной группы с гидроксогруппой четвёртого атома углерода.
При этом А комплементарен Т, Г комплементарен Ц. То есть, фрагмент первичной структуры ДНК можно представить следующим образом:
Действительно, аденил в ДНК образует водородную связь только с тимилом, а тимил, только с аденилом. Гуанил только с цитозилом, а цитозил только с гуанилом:
Молекулярную формулу одного из нуклеотидов ДНК можно представить так
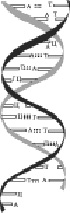
Вторичная структура ДНК представляет собой двойную спираль – две нити ДНК закручены одна вокруг другой (рис. 2.10).
Рис. 2.10. Вторичная структура ДНК
Ферментативный синтез м-РНК осуществляется на одной из цепей ДНК в соответствии с принципом комплементарности. При этом аденин ДНК комплементарен урацилу РНК, тимил ДНК коиплементарен аденину РНК, гуанил ДНК комплементарен цитозилу РНК, цитозил ДНК комплементарен гуанилу РНК. Затем с м-РНК осуществляется матричный синтез белка. К каждому кодону информационной РНК доставляется соответствующая аминокислота с помощью транспортной РНК (т-РНК).
Таким образом, основным хранителем информации о структуре всех белков, вырабатываемых организмом является ДНК.
Отрезок ДНК, содержащий информацию о первичной структуре одного определённого белка, называется геном.
Процесс переписывания информации, содержащейся в гене ДНК на м-РНК называется транскрипцией.
1. Приведите структурные формулы аминокислот, которые Вы знаете. Дайте им названия.
2. Дайте определения понятиям: полипептиды и белки.
3. Что представляют собой первичная, вторичная, третичная и четвертичная структуры белка?
4. В чём сходство и различия химического состава, строения ДНК и РНК? Что такое ген?
5. Каким образом в клетках живых организмов синтезируется м-РНК? Что такое транскрипция?
6. Что такое матричный синтез? Почему в качестве отдельной структурной единицы РНК рассматривают три соседних нуклеотида, а не два или, например, четыре?
Полипептиды, белки
Понятие, первичная и вторичная, третичная и четвертичная структура, а также функции и биологическая роль белков и полипептидов в организме человека. Физико-химические свойства и особенности, пространственное строение данных биологических соединений.
| Рубрика | Биология и естествознание |
| Вид | лекция |
| Язык | русский |
| Дата добавления | 26.09.2017 |
| Размер файла | 661,0 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Размещено на http://www.allbest.ru/
1. Биологическая роль белков и полипептидов
2. Первичная структура полипептидов и белков
Полипептиды и белки образуются в результате поликонденсации б-аминокислот:
3. Физико-химические свойства полипептидов и белков
Молекулы полипептидов и белков имеют в своем составе ионогенные карбоксильные и аминогруппы и, подобно аминокислотам, всегда несут на себе электрический заряд, знак и величина которого зависит от рН раствора.
Если рН раствора ниже изоэлектрической точки (pH pI), то молекула в целом имеет отрицательный заряд.
Если количества карбоксильных и аминогрупп в молекуле одинаковы, то изолектрическая точка вещества находится в области нейтрального рН (pI = 7). Это нейтральные полипептиды.
Если в молекуле преобладают карбоксильные группы, то изолектрическая точка находится в кислотной области рН (pI 7). Это основные полипептиды.
Растворимость полипептидов в воде зависит от их молекулярной массы.
Олигопептиды и низкомолекулярные полипептиды подобно аминокислотам хорошо растворимы в воде.
Высокомолекулярные белки образуют коллоидные растворы. Их растворимость зависит от рН (т.е. от заряда молекулы). В изоэлектрической точке растворимость белка минимальна и он выпадает в осадок. При подкислении или подщелачивании молекулы снова приобретают заряд и осадок растворяется.
биологический белок полипептид химический
4. Пространственное строение белков и полипептидов
Строение пептидной группировки определяет пространственное строение полипептидной цепи.
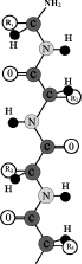
Л. Полинг (1950 г.) расчетным путем показал, что для б-полипептиной цепи одной из наиболее вероятных является структура правозакрученной б-пирали. Вскоре это было экспериментально подтверждено рентгено-структурным анализом:
Между С=О 1-го и N-H 5-го аминокислотных остатков образуются водородные связи, направленные почти параллельно оси спирали, они скрепляют спираль. Боковые радикалы R расположены по периферии спирали.
2) в-складчатая структура
В этом виде вторичной структуры вытянутые одна вдоль другой полипептидные цепи образуют водородные связи между собой:
Многие белки имеют вторичную структуру с чередующимися фрагментами б-спирали и в-складчатой структуры.
6. Третичная структура
б-Спираль, будучи достаточно протяженной, изгибаясь, складывается в клубок. Это происходит в результате взаимодействия боковых радикалов достаточно удаленных друг от друга. Образуется глобула:
Виды взаимодействия, формирующие третичную структуру
1) Водородные связи
2) Ионное взаимодействие
3) Гидрофобное взаимодействие
4) Дисульфидные связи
7. Четвертичная структура
Четвертичная структура Четвертичная структура гемоглобина
Размещено на Allbest.ru
Подобные документы
Понятие белков как высокомолекулярных природных соединений (биополимеров), состоящих из остатков аминокислот, которые соединены пептидной связью. Функции и значение белков в организме человека, их превращение и структура: первичная, вторичная, третичная.
презентация [564,0 K], добавлен 07.04.2014
Первичная структура полинуклеотидов. Вторичная и третичная структуры ДНК. Типы РНК и их биологические функции. Физико-химические свойства ДНК. Структура и физико-химические свойства РНК. Определение нуклеозидфосфатов методом тонкослойной хроматографии.
курсовая работа [1,4 M], добавлен 20.03.2011
Первичная, вторичная и третичная структуры ДНК. Свойства генетического кода. История открытия нуклеиновых кислот, их биохимические и физико-химические свойства. Матричная, рибосомальная, транспортная РНК. Процесс репликации, транскрипции и трансляции.
реферат [4,1 M], добавлен 19.05.2015
Белки как источники питания, их основные функции. Аминокислоты, участвующие в создании белков. Строение полипептидной цепи. Превращения белков в организме. Полноценные и неполноценные белки. Структура белка, химические свойства, качественные реакции.
презентация [896,5 K], добавлен 04.07.2015
Белки (протеины) – высоко молекулярные, азотосодержащие природные органические вещества, молекулы которых построены из аминокислот. Строение белков. Классификация белков. Физико-химические свойства белков. Биологические функции белков. Фермент.
реферат [4,0 M], добавлен 15.05.2007