Каким образом готовятся плотные питательные среды и для чего они используются
Питательная среда
Содержание:
Питательные среды
Виды питательных сред
По составу питательные среды делят на:
По целевому назначению питательные среды делят на:
По физическому состоянию питательные среды делят на:
Культура бактерии Xanthomonas axonopodis
Селективная питательная среда [5]
Требование к питательным средам
Для культивирования микроорганизмов используют различные по составу питательные среды. Но все они должны соответствовать ряду общих требований:
Потребность в сере удовлетворяются сульфатами. В фосфоре – солями фосфорной кислоты. Все необходимые металлы и прочие элементы – в форме катионов или анионов неорганических солей. В частности, источник магния – сульфат магния (MgSO4), натрия – хлорид натрия или поваренная соль (NaCl), кальция – хлорид кальция (CaCl2) или карбонат кальция (CaCO3).
Использование питательных сред
Питательные среды используются для:
Питательные среды
Питательные среды — биологические препараты, используемые для выращивания микроорганизмов и изучения культуральных, биохимических, антигенных свойств, фаголизабельности и чувствительности к антибиотикам.
Питательные среды широко используют в лабораторной практике при диагностике инфекционных заболеваний, а также для контроля за стерильностью лекарственных средств. Для того чтобы микроорганизмы росли и развивались, питательные среды должны отвечать следующим требованиям.
1. Оптимальный состав. В их состав должны входить все необходимые компоненты, которые нужны для развития микробов: белки, витамины, углеводы, минеральные вещества.
2. Оптимальное значение pH. Большинство микроорганизмов развивается при pH 7,2…7,4.
3. Стерильность. Она необходима для того, чтобы избегать конкурентной борьбы между микробами.
4. Прозрачность. Для лучшего изучения характера микробных колоний.
5. Влажность. Питание и дыхание осуществляются путем осмоса и диффузии, поэтому питательные среды должны быть слегка влажными.
Классификация сред. Питательные среды подразделяют по следующим признакам.
1. По консистенции: а) плотные (твердые) — агара 1,2…2 % (мясопептонный агар); б) полужидкие — агара 0,2…0,3 % (полужидкий агар); в) жидкие — мясопептонный бульон.
Для придания средам плотной или полужидкой консистенции чаще всего используют агар-агар — полисахарид, выделяемый из морских водорослей. Агар способен образовывать в воде гель, плавящийся при 80…100 °С и затвердевающий при 37…40 °С. Устойчивость агара к разжижающему действию большинства микроорганизмов, а также способность образовывать прочные студни обусловили его широкое применение в бактериологии.
2. По происхождению: а) искусственные: животного (МПА, МПБ) и растительного происхождения (пивное сусло); б) естественные: животного (кровь, молоко) и растительного происхождения (кусочки картофеля).
3. По составу: а) белковые; б) безбелковые; в) минеральные.
4. По назначению: а) среды для культивирования (простые, специальные); б) среды для обогащения (для накопления микроорганизмов при их низкой концентрации в исходном материале); в) среды консервирующие для первичного посева и транспортировки патогенов; г) среды для идентификации (дифференциально-диагностические) — микробы одного вида образуют колонии, отличающиеся по внешнему виду от колоний других микроорганизмов.
Если материал слабо загрязнен посторонней микрофлорой, то для выделения культур применяют простые среды общего назначения (МПА), при обильной контаминации сапрофитами используют специальные среды: элективные (для отдельных видов) и дифференциально-диагностические (для облегчения идентификации).
Характеристики сред. Консервирующие транспортные среды (глицериновая смесь, фосфатный буфер, тиогликолевая среда для анаэробов и др.). Предупреждают отмирание патогенных микробов и подавляют рост сапрофитов.
Среды обогащения (селективный бульон, желчный бульон, среда Мюллера, Раппопорт, среда Кауфмана, щелочная пептонная вода). Применяют для накопления определенной группы бактерий за счет создания условий, оптимальных для одних видов и неблагоприятных для других. Наиболее часто используют различные красители и химические вещества — соли, желчные кислоты, теллурит калия, антибиотики, фуксин и т. д.
Элективные (селективные среды). Обеспечивают более благоприятные условия для изолируемого микроба с одновременным подавлением сопутствующей микрофлоры. Например, среды Плоскирева и солевой агар применяют для первичного посева материала или для пересева с консервирующих сред или сред обогащения с целью получения чистой культуры.
Дифференциально-диагностические среды. Предназначены для определения видовой принадлежности исследуемого микроба, основываясь на особенностях его обмена веществ.
Среды для выявления протеолитической, гемолитической способности микробов. Содержат в своем составе белковые вещества (кровь, молоко, желатин и др.).
Среды с индифферентными химическими веществами. Служат источником питания для одних видов микробов и не усваиваются другими видами (цитратный агар Симмонса).
Среды с углеводами (моносахариды, дисахариды, полисахариды), многоатомными спиртами (сорбит, маннит), гликозидами (салицин, инозит) для обнаружения соответствующих ферментов.
Среды для определения редуцирующей способности микробов. В своем составе содержат краски, обесцвечивающиеся при восстановлении (агар Омелянского с индигокармином), а также нитраты для определения денитрифицирующей способности микроорганизмов.
Сухие питательные среды. В бактериологических лабораториях используют в основном коммерческие сухие среды. Они представляют собой высушенные и измельченные до порошкообразного состояния готовые питательные среды. У сухих сред имеется ряд преимуществ перед средами обычного изготовления: их можно хранить длительно в сухом затемненном помещении в герметически закрытой таре, они транспортабельны, удобны в применении и стандартны, что облегчает получение сравнимых результатов при бактериологическом исследовании.
Плотные среды состоят из питательной основы, агар-агара, индикаторов и других органических и минеральных веществ, улучшающих рост одних и задерживающих рост других микроорганизмов.
В качестве питательной основы сухих сред используют различные источники белка. За рубежом сухие среды чаще всего изготавливают на мясопептонном бульоне, требующем большого расхода говяжьего мяса. В нашей стране в качестве источника белка используют гидролизаты кильки, казеина, кормовых дрожжей.
Для упаковки сухих питательных сред используют стеклянные банки из оранжевого стекла (250 г), полиэтиленовые банки (250, 500, 1000 г), а также пакеты из трехслойной ламинированной бумаги (50…200 г). Сроки хранения в стеклянных и полиэтиленовых банках составляют 2…4 года, а в пакетах из трехслойного ламината — от 1 года до 4 лет.
Отечественная промышленность выпускает более 120 наименований различных сухих питательных сред. Крупнейшими производителями являются ФГУП НПО «Питательные среды» (г. Махачкала) и ГНЦПМ (г. Оболенск) (Меджидов М. М. Справочник по микробиологическим питательным средам. — М.: Медицина, 2003). Наиболее часто применяют в практических лабораториях следующие среды.
Сухие дифференциально-диагностические среды. Если раньше в практике ветеринарных бактериологических лабораторий для идентификации микроорганизмов широко использовались среды Гисса, содержащие какой-либо одни углевод, то в последнее время все шире стали применяться среды, позволяющие дифференцировать микроорганизмы по двум-трем признакам.
Среда Росселя (ФГУП НПО «Питательные среды»). Предназначена для первичной идентификации энтеробактерий. Готовая среда имеет зеленый цвет. После посева культуры через 18…20 ч инкубации при 37 °С о ферментации лактозы судят по появлению желтой окраски в скошенной части агара, а о ферментации глюкозы — по желтой окраске столбика агара. О газообразовании заключают по появлению пузырьков, разрывам агара. Если микроорганизм не ферментирует глюкозу и лактозу, то среда остается зеленой или приобретает синий цвет.
Среда Клиглера (ФГУП НПО «Питательные среды», г. Махачкала и АООТ «Биомед» им. И. И. Мечникова, г. Москва). Предназначена для первичной идентификации энтеробактерий. Готовая среда имеет красный цвет. Скашивать необходимо так, чтобы остался столбик высотой 2.5…3 см. Посев производят сначала в толщу среды, а затем по скошенной поверхности. Через 18…20 ч инкубации при 37 °С учитывают результаты. Если микроорганизм ферментирует лактозу, то скошенная часть агара приобретает желтый цвет. При сбраживании глюкозы среда желтеет в столбике. При газообразовании — появление пузырьков и разрывы агара. В случае образования сероводорода среда приобретает черный цвет. Продуцирование индола определяют при помощи специальных индикаторных бумажек.
Двухслойный железоглюкозолактозный агар с мочевиной. Среда Олькеницкого (ФГУП НПО «Питательные среды»). Эти среды позволяют идентифицировать бактерии по их способности ферментировать глюкозу и лактозу, образовывать сероводород и расщеплять мочевину. С подробной инструкцией о приготовлении, способе посева микроорганизмов и учете результатов можно ознакомиться в «Справочнике по микробиологическим питательным средам» М. М. Меджидова.
Сухие элективные питательные среды. Элективный солевой агар (СА) (ФГУП НПО «Питательные среды» и ФГУП «Аллерген», г. Ставрополь). Предназначен для выделения стафилококков из исследуемого материала. Может служить основой для приготовления желточно-солевого или молочно-солевого агара. При посеве материала на СА через 48 ч инкубации при 37 °С рост стафилококков в виде круглых колоний диаметром 2…4 мм.
Элективно-питательная среда для выделения пневмококка (пневмококк-агар) (ФГУП НПО «Питательные среды»). Предназначена для элективного выделения пневмококка из патологического материала (крови, мокроты, гноя). Готовая среда имеет коричневый цвет. Через 24…48 ч после посева материала и инкубации его при 36…38 °С в условиях «свечного сосуда» пневмококк образует на среде выпуклые колонии размером до 1 мм, хорошо отличимые от бледно-розовых колоний стафилококка.
Среда подавляет рост сопутствующей бактериальной флоры (кишечной палочки, протея, стафилококка).
Готовая среда красно-коричневого цвета, прозрачная, с легкой опалесценцией. Через 16…20 ч инкубации посева при 37 °С лактозоотрицательные сальмонеллы образуют прозрачные бесцветные колонии, лактозоположительные эшерихии — колонии ярко-малинового цвета. Среда подавляет «роение» протеев, которые растут в виде бесцветных изолированных колоний в О-форме. Рост стафилококков полностью подавляется.
Питательные среды других групп. Гликолевая среда (ФГУП НПО «Питательные среды», г. Махачкала; ОАО «Биомед» им. И. И. Мечникова, г. Москва). Предназначена для контроля стерильности медицинских и биологических препаратов. Учет результатов проводят согласно инструкции «Испытание лекарственных средств на микробиологическую чистоту».
Питательные среды № 1 и 2 выпускают ФГУП НПО «Питательные среды» (г. Махачкала) и ФГУП «Аллерген» (г. Ставрополь).
Питательная среда для контроля микробной загрязненности сухая № 1. Используют для определения общей обсемененности нестерильных лекарственных препаратов и пищевых продуктов.
Питательная среда для контроля микробной загрязненности (Сабуро-агар) № 2. Рекомендуется для культивирования грибов, а также определения содержания грибов в нестерильных лекарственных средах и других объектах внешней среды.
Эритрит-агар и эритрит-бульон. Предназначен для выделения и культивирования бруцелл.
Питательная среда для выделения и культивирования сибиреязвенного микроба.
Кетоглутаровый агар. Эффективен для изоляции и культивирования возбудителя туляремии.
Питательная среда для листерий. Рекомендуется для изоляции листерий из инфицированного материала (кровь, ликвор, околоплодные воды и др.) и культивирования штаммов.
Среда АГВ. Предложена для определения чувствительности микроорганизмов к антибиотикам дискодиффузным методом.
Питательная среда для экспресс-определения антибиотикочувствительности условно-патогенных бактерий. Предложена для ускоренного определения антибиотикочувствительности грамотрицательных условно-патогенных микроорганизмов. Учет результатов можно проводить через 4…5 ч.
Ассортимент выпускаемых отечественной промышленностью сухих питательных сред постоянно расширяется. Приведено лишь небольшое количество тех, которые могут быть использованы в повседневной работе ветеринарных лабораторий. Кроме того, в настоящее время имеется возможность приобретать и импортные питательные среды. Коммерческие названия можно узнать, заказав соответствующие каталоги. Однако их внедрение и широкое использование в ветеринарных лабораториях РФ возможно лишь в отдаленной перспективе из-за довольно высокой стоимости. Кроме того, в этой главе не упомянуты готовые коммерческие питательные среды довольно хорошего качества производства НИЦФ (г. Санкт-Петербург). Они расфасованы во флаконы по 400 мл; срок хранения 1 год. Среды, безусловно, могут быть полезны при проведении бактериологических работ в полевых условиях.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Питательная среда
При культивировании микроорганизмов важно создать оптимальные условия для их роста. Одним из основных факторов успешного культивирования является состав и свойства питательной среды. Универсальной питательной среды, пригодной для роста и развития всех без исключения микроорганизмов не существует, поскольку конструктивные и энергетические процессы микробов различны.
Виды питательных сред
По составу питательные среды делят на:
По целевому назначению питательные среды делят на:
По физическому состоянию питательные среды делят на:
Требование к питательным средам
Для культивирования микроорганизмов используют различные по составу питательные среды. Но все они должны соответствовать ряду общих требований:
Основные компоненты любой питательной среды – источники азота и углерода. Их количественное отношение является определяющей характеристикой большинства сред.
Автотрофные микробы требовательны к наличию углекислого газа, поскольку его концентрация в воздухе составляет только 0,03 %. Для обеспечения питательных сред углекислым газом вносят обычно карбонат кальция (СаСО3), иногда – гидрокарбонат натрия (NaHCO3), либо другие карбонаты. В некоторых случаях через среду продувают воздух, искусственно обогащенный углекислым газом до 1–5%.
Гетеротрофные организмы успешно развиваются на средах, содержащих источники углерода в виде органических соединений. В зависимости от индивидуальных особенностей гетеротрофные микроорганизмы используют разнообразные органические соединения – спирты, органические кислоты, углеводы, углеводороды, ароматические соединения. Обычно в лабораторной практике в качестве источника углерода применяют глюкозу, поскольку именно это соединение углерода легче всего утилизируется микробами.
Потребности в источниках азота удовлетворяются азотосодержащими соединениями, с разной степенью восстановленности азота. В основном это соли аммония вносимые в питательную среду в форме сульфатов и хлоридов. При использовании этих веществ необходимо учитывать их высокую физиологическую кислотность, влияющую на кислотность среды и развитие микроорганизмов. Кроме того, потребность в азоте удовлетворяется нитратами. Нитриты используются очень редко, поскольку токсичны для многих микроорганизмов.
Не маловажными для построения веществ микробной клетки являются соединения фосфора, серы, калия, магния, кальция и других микроэлементов, которые так же должны содержаться в питательной среде в доступной форме. Их потребность удовлетворяется за счет минеральных солей.
Потребность в сере удовлетворяются сульфатами. В фосфоре – солями фосфорной кислоты. Все необходимые металлы и прочие элементы – в форме катионов или анионов неорганических солей. В частности, источник магния – сульфат магния (MgSO4), натрия – хлорид натрия или поваренная соль (NaCl), кальция – хлорид кальция (CaCl2) или карбонат кальция (CaCO3).
Для нормального развития микробов, в том числе бактерий, необходимы так называемые факторы роста (аминокислоты, азотистые основания, витамины, жирные кислоты, железоприны и многие другие соединения). Их добавляют в питательные среды в значительно меньшем количестве, чем макроэлементы.
Потребность в нескольких аминокислотах удовлетворяют, добавляя гидролизат белка. Для его получения используют белки животного или растительного происхождения. В первом случае это мясо, рыба, желатин, казеин. Во втором – семена сои, подсолнечника, кукурузы. Источником аминокислот могут служить клетки микроорганизмов – дрожжи, водоросли, бактерии.
Гидролиз проводится с использованием протеолитических ферментов, кипячением крепких щелочей или минеральных кислот. Некоторые натуральные вещества (дрожжевой или кукурузный экстракт) содержат несколько факторов роста (минеральные соли, витамины, аминокислоты).
Использование питательных сред
Питательные среды используются для:
7.6. Приготовление питательных сред в лабораторных условиях
Приготовленные в лабораторных условиях гидролизаты разводят до нужного значения аминного азота (от 120 до 200 мг%) и добавляют входящие в рецептуру среды ингредиенты, предварительно отвешенные на лабораторных весах.
Растворение. Подготовленные навески ингредиентов помещают в стеклянную колбу или кастрюлю, доливают требуемое количество бульона или дистиллированной воды, кипятят на электрической плитке до растворения всех компонентов, устанавливают необходимое значение рН: сначала с помощью индикаторной бумажки, а затем потенциометра.
Фильтрование. Жидкие питательные среды фильтруют через двойной складчатый фильтр из фильтровальной бумаги, предварительно смоченной водой, или через фильтровальное полотно, которое накладывают на стеклянную воронку. Полотняные фильтры значительно практичнее бумажных, так как годны к употреблению в течение длительного времени, в то время как бумажные фильтры употребляются лишь однократно. Рекомендуется иметь отдельные полотняные фильтры для каждого вида среды.
Агаровые среды в расплавленном состоянии лучше всего фильтруются через ватно-марлевый фильтр: стеклянную воронку покрывают марлевой салфеткой такого размера, чтобы концы салфетки были перекинуты через края воронки наружу; затем на марлю кладут слой гигроскопической ваты, фильтр смачивают горячей дистиллированной водой. Агар наливают на фильтр горячим.
Желатиновую среду фильтруют через бумажный фильтр, предварительно смоченный дистиллированной водой. Желательно фильтрацию производить быстро в теплом помещении.
Розлив сред. После осветления и фильтрации питательные среды разливают в колбы, флаконы, пробирки, бутыли или матрацы.
Для разливки жидких питательных сред пользуются одной из описанных ниже установок.
При розливе сред края посуды нельзя смачивать питательной средой, так как ватно-марлевые пробки, Приклеиваясь к стеклу во время стерилизации, вынимаются с трудом и оставляют в просвете отверстия сосуда остатки ваты. Попадая в среду, они могут вызывать загрязнение ее посторонней микрофлорой.
Поверх ватно-марлевой пробки на колбы и флаконы с питательными средами надевают бумажные колпачки.
Разливка плотных стерильных питательных сред в чашки Петри. Плотную питательную среду (агар, желатин) во флаконах или пробирках растапливают в водяной бане (сняв предварительно бумажные колпачки). Среду охлаждают до температуры 45–50 °С, сосуд берут в правую руку, левой рукой над огнем вынимают пробку и держат ее между мизинцем и ладонью, а края флакона или пробирки обжигают. Открытую посуду со средой держат в наклонном положении, чтобы избежать попадания в среду микробов из воздуха. В асептических условиях вносят стерильную кровь, сыворотку или другие необходимые добавки, тщательно перемешивают содержимое сосуда. Левой рукой приподнимают с одной стороны крышку чашки Петри и выливают в нее питательную среду в количестве 15–20 мл, слегка покачивая чашку, чтобы среда распределялась равномерным слоем по ее поверхности (рис. 7.3).
В настоящее время ряд фирм изготовляют приборы-автоматы для разливки агаризованных сред в чашки Петри, обеспечивающие высокую стерильность и точное дозирование разливаемых сред. Один из таких приборов изображен на рис. 7.4.
При застудневании агара образуется большое количество конденсационной воды, которая оседает на внутренней стороне крышки и увлажняет поверхность среды. В связи с этим перед посевом среды подсушивают: чашку в открытом виде помещают в термостат таким образом, чтобы крышка служила опорой для края ее дна, перевернутого средой вниз. Чтобы избежать образования конденсированной влаги, чашки с расплавленным агаром тотчас после заливки накрывают листом фильтровальной бумаги, которую стерилизуют вместе с чашкой. Бумага не должна касаться поверхности среды. Когда среда окончательно остынет, фильтровальную бумагу снимают, а чашки закрывают крышками.
Стерилизация питательных сред. Стерилизацию питательных сред осуществляют различными способами в зависимости от тех ингредиентов, которые входят в их состав.
Для стерилизации питательных сред, содержащих в своем составе нативные белки, пользуются фильтрацией через мембранные фильтры, изготовляемые различными фирмами.
Приготовленные к употреблению стерильные питательные среды проверяют на стерильность. Для этого их ставят в термостат при температуре 37 °С. Среды, простерилизованные в автоклаве, выдерживают в термостате 1 сут, простерилизованные текучим паром – 3 сут.
Классификация питательных сред и способы их приготовления



Питательные среды классифицируют в зависимости от исходных компонентов, консистенции, целевого назначения, химического состава.
В зависимости от химического состава и исходных компонентов различают следующие типы питательных сред.
Среды неопределенного химического состава. Их подразделяют на: 1) среды животного происхождения (исходные продукты — мясо, рыба, яйца, молоко и т.д.); 2) среды растительного происхождения (исходные продукты — соя, горох, картофель, морковь и т.д.).
Некоторые продукты используют в натуральном виде (картофель, морковь, молоко и т. д.), но чаще животные и растительные ткани подвергают различной обработке (экстрагированию, ферментативному или кислотному гидролизу).
Среды известного химического состава (синтетические). В них входят известные химические соединения (соли, углеводы, аминокислоты, витамины и т. д.) в оптимальном количественном соотношении. Синтетические питательные среды используют, когда выращиваемую клеточную массу необходимо максимально освободить от балластных органических соединений, входящих в состав обычных сред, например при получении диагностических аллергенов или при изучении метаболических потребностей микроорганизма в том или ином конкретном химическом соединении.
По консистенции питательные среды дифференцируют на плотные, полужидкие и жидкие.
Жидкие питательные среды. Готовят, используя экстракты, гидролизаты, растворы исходных продуктов.
Полужидкие и плотные питательные среды. Необходимую консистенцию среде придают добавлением различных уплотнителей.
Агар-агар (малайское желе) — полисахарид, продукт переработки некоторых морских водорослей. Плавится при 80. 86 ºС, затвердевает при 40 ºС. Для получения плотных сред его добавляют в количестве 1,5. 2%, реже 3 %; полужидких — 0,3. 0,7%.
Желатина — экстракт из тканей, содержащих много коллагена (кости, хрящи, сухожилия и т.д.). Желатиновый гель плавится при 25 °С, что делает его неудобным для выращивания микроорганизмов с температурным оптимумом 37. 38 °С. Кроме того, ряд бактерий выделяют протеолитические ферменты, разлагающие желатину. Обычно в питательные среды вносят 10. 20 % желатины.
По целевому назначению различают общеупотребительные (основные), обогащенные, специальные, элективные (избирательные) и дифференциально-диагностические питательные среды.
Общеупотребительные (основные) среды. Их применяют для культивирования относительно неприхотливых микроорганизмов.
В качестве исходных компонентов для приготовления основных сред используют наиболее часто мясную воду, перевар Хоттингера, растительные гидролизаты.
Мясная вода: говядину освобождают от костей, жира, сухожилий, пропускают через мясорубку. Мясной фарш заливают водопроводной водой в соотношении 1: 2, кипятят 1 ч. После кипячения мясную воду охлаждают, фильтруют через ватно-мар-левый фильтр, затем доливают водопроводной водой до первоначального объема, разливают по емкостям, закрывают ватно-мар-левыми пробками и стерилизуют при 120 °С 20 мин.
Перевар Хоттингера готовят из мясных отходов путем их триптического гидролиза. Жир, фасции, сухожилия мелко нарезают, заливают кипящей водой в соотношении 1:2, кипятят, охлаждают до 45 °С и добавляют панкреатин, подщелачивают раствором карбоната натрия до рН 7,8. 8,0, встряхивают и добавляют хлороформ (10 мл/л), плотно закрывают, выдерживают в теплом месте 10 дней, получают продукт гидролиза (перевар).
Мясо-пептонный бульон (МПБ). К 1 л мясной воды добавляют 1 % пептона[1] и 0,5 % хлорида натрия, устанавливают необходимый рН дробным добавлением 10%-го раствора гидроксида натрия или гидроксида калия. Фильтруют через бумажный фильтр, разливают по колбам, пробиркам и стерилизуют при 120 «С 15. 20 мин.
Рис. 32. Приготовление скошенного агара
Мясо-пептонный агар (МПА): к МПБ добавляют 2. 3 % промытого мелко нарезанного агар-агара, нагревают до расплавления агара, доводят до кипения, в горячем виде проверяют рН, затем, если необходимо, доводят его до нужного значения (7,2. 7,6), фильтруют через ватно-марлевый фильтр. Профильтрованный горячий агар разливают по пробиркам и колбам, стерилизуют автоклавированием при 1 атм 20. 30 мин. Чтобы получить скошенную поверхность агара, удобную для посева, после стерилизации пробирки с расплавленным МПА оставляют при комнатной температуре до уплотнения в наклонном положении (конец с пробкой приподнят) (рис. 32).
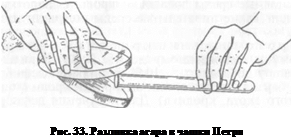
Широко используют культивирование микроорганизмов на плотных питательных средах в чашках Петри. Диаметр стандартной чашки Петри (рис. 33) около 10 см, выпускают чашки меньшего и большего диаметров, а также одноразовые пластиковые. В стандартные стерильные чашки Петри над пламенем горелки наливают около 20 мл расплавленного и охлажденного до 45. 50 «С питательного агара, чашки помещают на горизонтальную поверхность до застывания агара.
 |
Полужидкий мясо-пептонный агар (ПЖА) готовят, как МПА, но добавляют 0,25 % агара. Кипятят при помешивании до полного расплавления агара, устанавливают рН 7,2. 7,6, фильтруют в горячем виде, стерилизуют в автоклаве.
Мясо-пептонная желатина (МПЖ): к МПБ добавляют 10. 20% измельченной желатины, нагревают до расплавления уплотнителя, устанавливают рН 7,2. 7,4, кипятят, фильтруют через ватно-марлевый фильтр, разливают по пробиркам и стерилизуют дробно в аппарате Коха три дня по 20 мин или однократно в автоклаве при 112°С 15 мин.
Бульон Хоттингера: основной перевар Хоттингера разводят водопроводной водой в соотношении 1 :5 (1:8) до содержания аминного азота 120 мг%, добавляют 0,5% хлорида натрия, 0,1 г гидрофосфата калия, устанавливают рН 7,4. 7,6, кипятят 15. 20 мин, фильтруют через ватно-марлевый или бумажный фильтр, разливают по емкостям и стерилизуют при 120 °С 20. 30 мин.
Агар Хоттингера готовят, добавляя к бульону Хоттингера 2 % агар-агара.
Предприятия биологической промышленности выпускают готовые питательные бульон и агар в виде сухого порошка.
Питательный бульон содержит (г/л): триптический гидролизат кильки — 10,05, хлорид натрия — 4,95. Навеску порошка массой 15 г растворяют в 1 л дистиллированной воды, кипятят 2 мин, фильтруют через бумажный фильтр, разливают по емкостям и стерилизуют в автоклаве при 120 ºС 20 мин (рН 7,3).
Питательный агар содержит (г/л): ферментативный гидролизат кормовых дрожжей — 12,0; агар— 12,5; хлорид натрия — 5,5. Навеску порошка массой 36 г растворяют в 1 л дистиллированной воды, кипятят 3 мин, фильтруют через ватный фильтр, стерилизуют при 120 «С 20 мин (рН 7,3).
Обогащенные среды. Многие виды болезнетворных бактерий плохо растут на общеупотребительных питательных средах, поэтому в основные среды добавляют кровь, сыворотку крови, углеводы и т. д. Такие питательные среды получили название обогащенных.
Сывороточный и кровяной агары: к расплавленному и охлажденному до 45. 50°С стерильному питательному агару добавляют 5. 10% стерильной дефибринирован-ной крови барана (кролика) или сыворотки крови (лошади, крупного рогатого скота, кролика). Для получения дефибринирован-ной крови у барана кровь берут асептично из яремной вены стерильной иглой в стерильный флакон (или колбочку) со стеклянными (фарфоровыми) бусами или шариками, встряхивают вращательными движениями 15. 20 мин, чтобы предотвратить свертывание крови. Фибрин остается на бусах.
Компоненты перемешивают, разливают в чашки Петри, пробирки и оставляют до застывания питательной среды.
Сывороточный и кровяной бульоны готовят аналогичным образом.
Растворы углеводов (глюкоза и др.) стерилизуют текучим паром или фильтрованием и добавляют в количестве 0,5. 1 % к питательной среде.
Среда Терских состоит из фосфатной смеси Зеренсе-на и кроличьей сыворотки. Смесь Зеренсена: раствор А: гидрофосфат натрия — 11,876 г, вода дистиллированная — 1000 мл; раствор Б: дигидрофосфат калия — 9,078 г, вода дистиллированная — 1000 мл. К 90 мл раствора А добавляют 10 мл раствора Б и доводят объем дистиллированной водой до 1000 мл. Раствор разливают в пробирки по 5 мл, стерилизуют при 1,5 атм 20 мин. В каждую пробирку добавляют шесть—восемь капель стерильной инактивированной при 56 °С сыворотки кролика.
Элективные среды (лат. electus — избранный). Это питательные среды для избирательного выделения и накопления микроорганизмов определенного вида из материалов, содержащих несколько видов микробов. Элективные среды чрезвычайно многообразны по своему составу. В них включают компоненты, обеспечивающие преимущественный рост искомого микроорганизма и (или) подавляющие в той или иной степени рост сопутствующей микрофлоры. По консистенции среды данного типа могут быть плотными и жидкими. Жидкие элективные среды называют средами обогащения или накопления, их применяют, когда ставят цель увеличить количество искомого микроорганизма в смешанной популяции.
Молочно-солевой агар предназначен для избирательного культивирования стафилококков. К расплавленному МПА с рН 7,2. 7,4, содержащему 5. 7,5 % хлорида натрия, добавляют 10 % стерильного обезжиренного молока, перемешивают и разливают в чашки Петри.
Среда Шустовой предназначена для выделения сальмонелл. Представляет собой МПА (рН 7,4) с добавлением 10 % к объему среды 50%-го водного раствора тиосульфата натрия и 2 % раствора Люголя.
Среда Раппопорт предназначена для культивирования сальмонелл. К МПБ добавляют 1 % глюкозы, 10 % желчи, 1 % индикатора Андрэдэ. Стерилизуют текучим паром.
Среда Мюллера предназначена для культивирования сальмонелл. В колбу с 4,5 г стерильного мела наливают 90 мл МПБ, стерилизуют в автоклаве при 120 «С 30 мин. Затем стерильно добавляют 2 мл раствора Люголя и 10 мл раствора тиосульфата натрия (тиосульфат натрия — 50 г, дистиллированная вода — 100 мл), стерилизуют в аппарате Коха 30 мин.
Среда Кауфмана — это среда обогащения для сальмонелл. К 100 мл среды Мюллера добавляют 1 мл водного раствора бриллиантового зеленого, разведенного 1 : 1000, и 5 мл стерильной бычьей желчи. Смесь стерилизуют текучим паром 30 мин.
Казеиново-угольный агар (КУА) с пенициллином используют для культивирования бордетелл. К 1000 мл дистиллированной воды добавляют гидролизат казеина — 20 мл, хлорид натрия — 5 г, хлорид калия — 0,2 г, хлорид кальция — 0,002 г, карбонат натрия — 0,4 г, хлорид магния — 0,025 г, гидрофосфат калия — 0,24 г, растворимый крахмал — 1 г, цистин — 0,01 г, агар —20 г. Компоненты растворяют, устанавливают рН 7,2, стерилизуют при 0,5 атм 30 мин. Перед употреблением в расплавленный агар (50 °С) добавляют 3 % дрожжевого экстракта и 0,2 % сухого активированного угля и 0,5 ЕД/мл пенициллина. Компоненты перемешивают и разливают по чашкам Петри.
Дифференциально-диагностические среды. Предназначены для выявления ферментов у микроорганизмов. По консистенции могут быть жидкими, полужидкими, плотными. В состав этих сред входят основная питательная среда, обеспечивающая рост изучаемого микроорганизма, субстрат для обнаружения фермента и индикатор, по изменению цвета которого судят о сдвиге рН среды в результате расщепления субстрата.
К питательным средам такого типа относят среды Гисса, Эндо, Плоскирева, Левина и др.
Среды Гисса используют для изучения ферментативных свойств выделенных культур микроорганизмов. К 100 мл дистиллированной воды добавляют 1 % пептона, 0,5 г хлорида натрия. Компоненты растворяют, фильтруют через бумажный фильтр, устанавливают рН 7,0. 7,4, добавляют один из углеводов-субстратов (лактоза, глюкоза и т.д.), агар-агар (0,3. 0,4 %), а затем 1мл индикатора Андрэдэ или 0,1мл 1,6%-го раствора бромтимолового синего. Готовую среду разливают по 3 мл в пробирки, стерилизуют текучим паром три дня подряд по 30 мин или при 112 °С 20 мин.
Выпускают сухие среды Гисса с индикатором BP — смесь водно-голубого с розоловой кислотой (готовые среды — полужидкой консистенции).
Плотные дифференциально-диагностические среды применяют для первичной изоляции возбудителей из материала. В их состав нередко кроме известного субстрата входят вещества, придающие питательной среде селективные свойства.
Среда Эндо содержит лактозу в качестве субстрата и предназначена для дифференциации бактерий, различающихся по способности расщеплять лактозу.
К 1000 мл расплавленного МПА (рН 7,4) температурой 70 °С добавляют 1 г лактозы, предварительно растворенной в небольшом количестве дистиллированной кипяченой воды. В отдельных пробирках готовят: 2. 3 мл спиртового раствора основного фуксина; 10 мл 10%-го водного раствора сульфата натрия.
В стерильную пробирку вносят 1 мл раствора фуксина и добавляют раствор сульфита натрия до обесцвечивания фуксина. Приготовленную смесь вливают в расплавленный агар, перемешивают и разливают по чашкам Петри. Готовая среда бесцветна, при росте на ней микроорганизмов, расщепляющих лактозу, среда закисляется, обесцвеченный фуксин восстанавливается, и колония микроорганизма, например эшерихий, приобретает красный цвет с металлическим оттенком. Среду готовят за сутки до ее использования. Выпускают также сухую среду Эндо. Перед употреблением определенную навеску порошка вносят в дистиллированную воду, кипятят и разливают по чашкам Петри.
Среда Левина аналогична по целевому назначению среде Эндо, но содержит другой индикатор (эозин с метилено-вым синим). К 100 мл расплавленного МПА (рН 7,2. 7,4) добавляют 2 мл 0,5%-го водного раствора метиленового синего, 1,5 мл 2%-го раствора эозина желтого, 2 г лактозы, 0,2 г дигидрофосфата калия. Растворы красителей готовят на дистиллированной воде, стерилизуют текучим паром 60 мин. Лактозу и дигидрофос-фат калия предварительно разводят в небольшом количестве стерильной дистиллированной воды и кипятят. Колонии лактозопо-зитивных бактерий на этой среде окрашены в фиолетово-черный цвет.
Агар Плоскирева предназначен для выделения сальмонелл, содержит лактозу в качестве субстрата и компоненты, подавляющие рост сопутствующей микрофлоры. Среду выпускают в виде порошка, в ее состав кроме питательной агаровой основы входят: желчные соли, цитрат натрия, тиосульфат натрия, фосфат натрия, бриллиантовый зеленый, кальцинированная сода, йод, хлорид натрия, лактоза, нейтральный красный. Навеску порошка растворяют в воде, кипятят и разливают в чашки Петри. Готовая среда прозрачная или розоватая. Колонии сальмонелл бесцветные, эшерихий — брусничного цвета.
 |
Методы культивирования микроорганизмов. Наряду с общими принципами культивирование микроорганизмов различных физиологических групп имеет некоторые особенности Культивирование аэробных и факультативно-анаэробных бактерий. Плотные, жидкие или полужидкие питательные среды, засеянные чистыми культурами микроорганизмов или исследуемым материалом, помещают в термостаты (рис. 34), поддерживающие оптимальную для данного микроорганизма температуру. При температурах, превышающих верхнюю границу нормы, бактерии не только замедляют рост, но и быстро гибнут. При температуре ниже оптимальной скорость роста микроорганизма постепенно замедляется.
У мезофилов температурный оптимум находится в интервале 30. 37 ºС, у психрофилов — 10. 15 ºС, у термофилов — 50. 60 ºС.
Микроорганизмы в процессе культивирования на питательных средах при условии, что в среды не вносят дополнительные вещества, постепенно замедляют и затем прекращают свой рост из-за истощения питательного субстрата, изменения оптимальных значений биофизических показателей (рН, Eh и т.д.). Такое культивирование микроорганизмов называют периодическим. Если при этом жидкую питательную среду в процессе инкубирования посевов не перемешивают, то такой способ культивирования определяют как стационарный. При диагностических бактериологических исследованиях обычно используют именно такой способ культивирования. В биологической промышленности при производстве вакцин и других биопрепаратов, когда необходимо достичь максимального выхода бактериальной массы или экзотоксинов, применяют периодическое культивирование в жидких средах с их интенсивным перемешиванием.
При таких задачах аэробные бактерии культивируют в колбах, бутылях на шюттель-аппаратах с частотой колебания 150. 250 мин-1, что облегчает передачу бактериям кислорода и питательных компонентов.
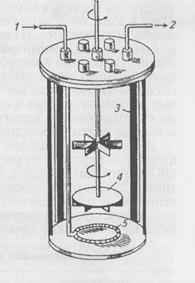
Рис. 35. Схема ферментера для глубинного культивирования аэробных микроорганизмов.
Наиболее эффективное культивирование бактерий в жидких питательных средах с максимальным выходом биопродукта достигают в ферментерах. Ферментеры (реакторы) представляют собой металлические или стеклянные культуральные сосуды емкостью от 500 мл до 1000 л (рис. 35). При культивировании бактерий в ферментерах среду перемешивают специальными мешалками с одновременной подачей необходимого количества стерильного воздуха. Ферментеры конструируют как автономные системы с автоматической регуляцией температуры и рН среды. В ферментерах также осуществляют непрерывное (проточное) культивирование, при котором в отличие от периодической культуры автоматически в среду подаются свежие питательные компоненты со скоростью, равной удалению аналогичного объема выросшей культуры бактерий. Такое непрерывное культивирование в хорошо отрегулированной системе в принципе можно продолжать неограниченно долго.
Культивирование анаэробных бактерий. Облигатные анаэробы — бактерии, у которых энергетический и конструктивный метаболизм происходит без молекулярного кислорода 02. У таких микроорганизмов в процессе дыхания конечными акцепторами
электронов являются окись углерода (IV), ионы сульфата, фумарат и др. Кроме того, молекулярный кислород действует на многие анаэробы губительно. Например, строгие анаэробы погибают при незначительных концентрациях кислорода (бактероиды, фузобак-терии), умеренные анаэробы менее чувствительны (С. perfringens), аэротолерантные анаэробы могут расти в условиях обычной атмосферы (молочнокислые бактерии). Большинство болезнетворных анаэробов относят к строгим или умеренным анаэробам. Для их культивирования используют специальные питательные среды и газовые смеси. Последними наполняют анаэростаты.
Необходимое условие роста облигатных анаэробов — не столько отсутствие молекулярного кислорода, сколько низкий ОКВП питательных сред. Резко восстановительных условий достигают, добавляя в среды редуцирующие (восстанавливающие) вещества и одновременно удаляя из них молекулярный кислород. В качестве редуцирующих веществ в питательные среды добавляют химические соединения, приведенные в таблице 1.
1. Восстанавливающие вещества для культивирования анаэробов