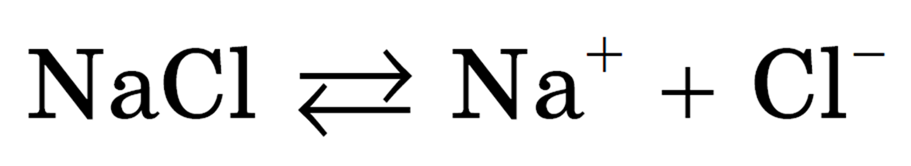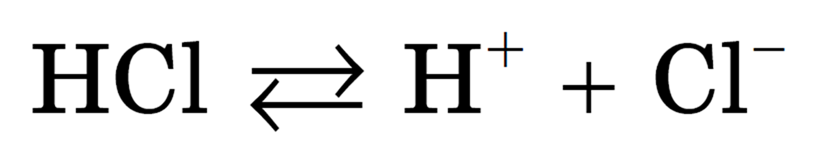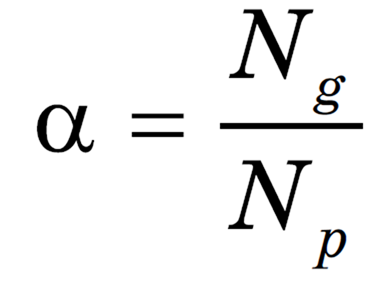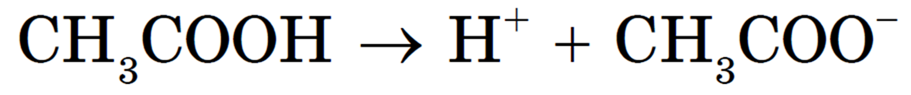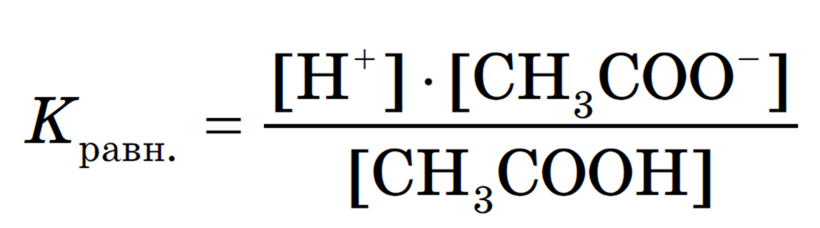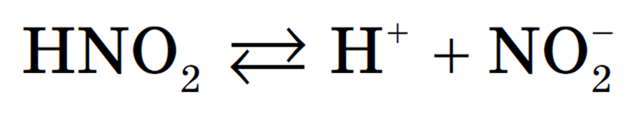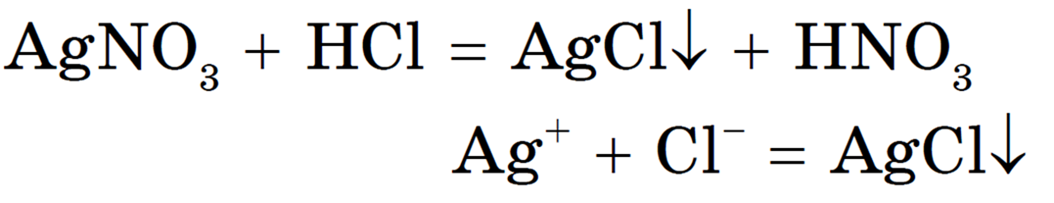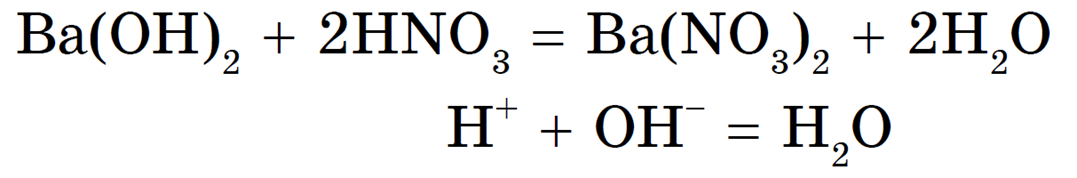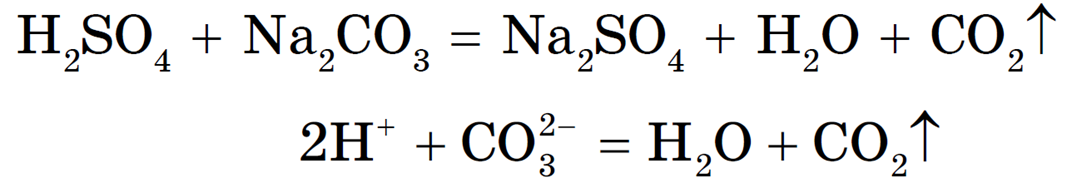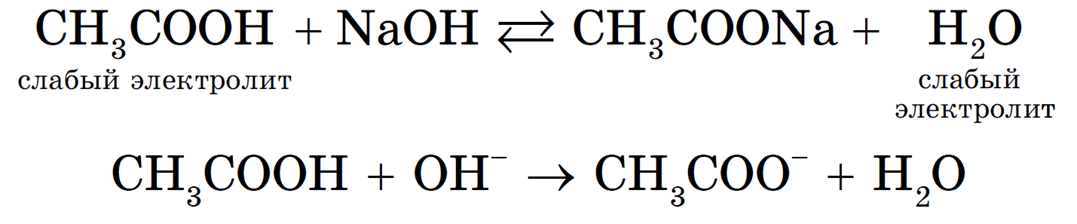Какова причина электролитической диссоциации в водных растворах что при этом образуется
Какова причина электролитической диссоциации в водных растворах что при этом образуется
Известно, что существуют две основные причины прохождения электрического тока через проводники: либо за счёт движения электронов в электрическом поле, либо за счет движения ионов. Электрическая проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединения, обладающим ионным строением, например, солям в твёрдом или расплавленном состояниях, а также многим водным и неводным растворам. В связи с этим все вещества принято условно делить на две категории:
а) вещества, растворы которых обладают ионной проводимостью, называются электролитами;
б) вещества, растворы которых не обладают ионной проводимостью, называются неэлектролитами.
К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например, спирты, углеводы.
Оказалось, что, кроме хорошей электропроводности, растворы электролитов обладают более низкими значениями давлениями пара растворителя и температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих свойств, шведский ученый С. Аррениус в 1887 г. предложил теорию электролитической диссоциации.
Сущность теории электролитической диссоциации С. Аррениуса
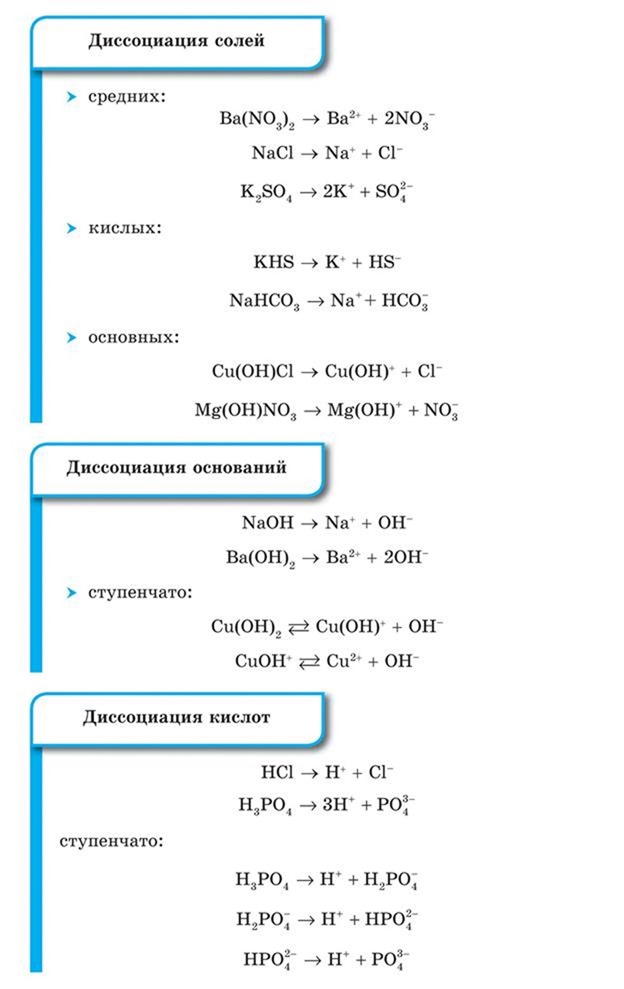
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы: положительные (катионы) и отрицательные (анионы).
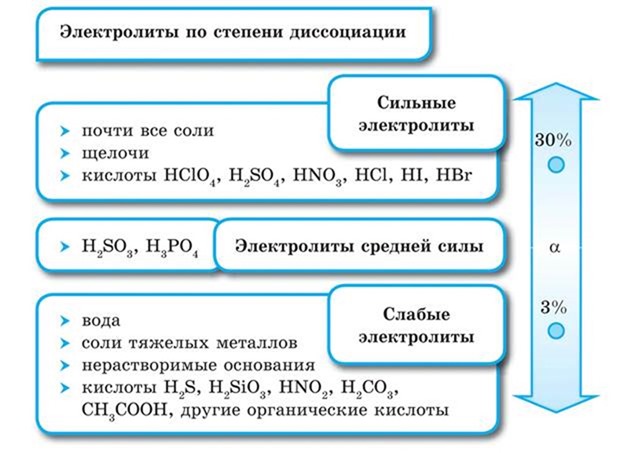
Электролиты подразделяются в зависимости от степени диссоциации на сильные и слабые.
вещества, которые диссоциируют полностью и необратимо, т. е. в растворе присутствуют только гидратиро-ванные ионы. Относятся все соли, сильные кислоты `»HI»`, `»HCl»`, `»HBr»`, `»HNO»_3`, `»H»_2″SO»_4`, `»HMnO»_4`, `»HClO»_4`, `»HClO»_3`, щелочи `»NaOH»`, `»LiOH»`, `»KOH»`, `»RbOH»`, `»CsOH»`, `»Ca»(«OH»)_2`, `»Ba»(«OH»)_2`, `»Sr»(«OH»)_2`.
С точки зрения теории электролитической диссоциации, кислотой называется соединение, образующее при диссоциации в водном растворе только ионы `»H»^+`:
Если кислота является двухосновной, то диссоциация кислоты происходит ступенчато. Количество стадий определяется основностью кислоты:
Сила бескислородных кислот возрастает в ряду однотипных соединений при переходе вниз по подгруппе кислотообразующего элемента: `»HCl»-«HBr»-«HI»`. Бромоводородная кислота `»HBr»` и йодоводородная `»HI»` кислоты сильнее хлороводородной, что объясняется увеличением межъядерных расстояний в их молекулах.
Фтороводородная (плавиковая) кислота `»HF»` растворяет стекло, но это вовсе не говорит о её силе. В ряду бескислородных галогенсодержащих кислот она относится к кислотам средней силы ввиду низкой концентрации в растворе ионов водорода из-за способности молекул `»HF»` к объединению (ассоциации), благодаря сильным водородным связям, возникающим при взаимодействии ионов `»F»^-` с молекулами `»HF»` (водородные связи) с образованием ионов `»HF»_2^-`, `»H»_2″F»_3^-` и других боле сложных частиц. В результате концентрация ионов водорода в водном растворе фтороводородной кислоты оказывается сильно пониженной.
Сила однотипных кислородных кислот изменяется в противоположном направлении, например, йодная кислота `»HIO»_4` слабее хлорной кислоты `»HClO»_4`. Если элемент образует несколько кислородных кислот, то наибольшей силой обладает кислота, в которой кислотообразующий элемент имеет самую высокую валентность.
Так, в ряду кислот `»HClO»-«HClO»_2-«HClO»_3-«HClO»_4` хлорная кислота наиболее сильная.
Схематически процесс распада (диссоциации) соляной кислоты на ионы можно представить следующим образом. Чтобы вещество в воде было электролитом, его молекула должна быть полярной.
Полярная молекула вещества окружена полярными молекулами воды, которые разрывают молекулу на две противоположно заряженные частицы – ионы.
с точки зрения теории электролитической диссоциации, представляет собой вещество, способное отдавать в растворе гидроксильную группу `»OH»^-`:
Диссоциация многокислотного гидроксида происходит ступенчато, например:
В свете теории электролитической диссоциации соли представляют собой соединения, образующие в водном растворе положительно заряженные ионы металла и отрицательно заряженные ионы кислотного остатка (для средних солей), а также кроме них ионы водорода (для кислых солей) и гидроксид-ионы (для основных солей):
вещества, которые диссоциируют частично и обратимо.
В растворе слабого электролита присутствуют гидратированные ионы и некоторая часть недиссоциированных молекул.
К слабым электролитам относятся:
3) оставшиеся кислоты, не относящиеся к сильным, например, `»HF»`, `»H»_2″S»`, `»HNO»_2`, `»H»_3″PO»_4` и другие, а также незамещённые органические кислоты. При растворении углекислого газа в воде образуется его гидрат `»CO»_2*»H»_2″O»` и в незначительном количестве угольная кислота `»H»_2″CO»_3`. Тем не менее, для диссоциации воспользуемся формулой угольной кислоты:
Практически диссоциация осуществляется лишь по первой ступени. Образующийся гидрокарбонат-ион `»HCO»_3^-` ведёт себя как слабый электролит.
Причиной диссоциации электролита в водных растворах является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем. В результате такого взаимодействия образуются гидратированные, т. е. связанные с молекулами воды, ионы.
Диссоциации проходит благодаря тому, что при гидратации ионов выделяется больше энергии, чем требуется на разрыв связи в молекуле. Примерно также происходит растворение ионного кристалла в воде и образование ионов. У кристаллов энергия гидратации ионов выше энергии кристаллической решётки.
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. При некоторой постоянной температуре в данной системе устанавливается химическое равновесие, при котором скорость диссоциации станет равной скорости ассоциации.
Основные свойства гидроксидов одного и того же элемента усиливаются с уменьшением его валентности. Так, основные свойства у гидроксида железа (II) выражены сильнее, чем у гидроксида железа (III) и наоборот.
Слабым электролитом является гидроксид аммония `»NH»_4″OH»`. При растворении аммиака `»NH»_3` в воде образуется раствор, который слабо проводит электрический ток и имеет горько-мыльный вкус. Среда раствора основная. В растворе образуются гидрат аммиака `»NH»_3*»H»_2″O»` и в незначительном количестве гидроксид аммония `»NH»_4″OH»`, который диссоциирует как слабый электролит с образованием ионов аммония `»NH»_4^+` и гидроксид-иона `»OH»^-`.
К слабым электролитам относят некоторые соли, например хлорид цинка `»ZnCl»_2`, тиоцианат железа `»Fe»(«NCS»)_3`, цианид ртути `»Hg»(«CN»)_2`, которые также диссоциируют по ступеням.
Разделение электролитов на сильные, средние и слабые зависит от доли продиссоциированных молекул или степени диссоциации `alpha`, которая показывает отношение числа молекул, распавшихся на ионы `(N_»д»)`, к общему числу введённых в раствор молекул `(N_»р»)`:
Степень диссоциации не является строгим показателем силы электролита, т. к. она зависит от концентрации раствора, природы растворителя, присутствия в растворе другие электролитов.
При понижении концентрации степень диссоциации может повышаться, и в очень разбавленных растворах слабый электролит может находиться в состоянии почти полной диссоциации, в то же время в концентрированном растворе сильный электролит может вести себя как слабый и даже как неэлектролит.
Степень диссоциации как сильных, так и слабых электролитов зависит от концентрации раствора (степень диссоциации тем выше, чем более разбавлен раствор). Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.
Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:
Поскольку диссоциация слабого электролита является обратимым равновесным процессом, то к данной реакции применим закон действующих масс, и можно определить константу равновесия как
`[AK]` – концентрация недиссоцированных молекул;
Рассчитайте количество ионов водорода в `1` л раствора серной кислоты с концентрацией `0,1` моль/л.
Количество ионов водорода равно `0,1` моль.
Запишем уравнение диссоциации по второй ступени и по справочным данным определим степень диссоциации (`0,3`):
Используем формулу для нахождения степени диссоциации (при решении задачи степень диссоциации удобно выразить в долях от единицы):
`n(«диссоцH»_2″SO»_4)=0,1` моль/л `*0,3=0,03` моль.
Таким образом, в растворе появилось ионов `»H»^+` :
`0,1` моль `+ 0,03` моль `= 0,13` моль.
Следовательно, концентрация ионов водорода в растворе серной кислоты равна `0,13` моль/л.
Степень диссоциации гидроксида бария по первой ступени `- 92%`, по второй ступени `- 56%`. Рассчитайте число катионов бария и число гидроксид-ионов в `0,5` л `1,5 M` растворе.
1) Запишем уравнение электролитической диссоциации гидроксида бария:
1 ступень: `»Ba(OH»)_2-> «BaOH»^+ + «OH»^-`,
2) Найдём количество вещества гидроксида бария, содержащегося в данном образце раствора:
3) Зная степень диссоциации вычислим число молекул `»Ba(OH»)_2` распавшихся на ионы по первой ступени диссоциации:
Согласно диссоциации по `»I»` ступени, это количество вещества равно количеству вещества гидроксид-ионов, образовавшихся по первой ступени диссоциации, и количество ионов `»Ba(OH»)^+`:
4) Исходя из количества вещества гидроксокатионов бария, образовавшихся на первой стадии диссоциации, и степени диссоциации по второй ступени, вычислим количество ионов `»Ba»(«OH»)^+`, диссоциирующих по второй ступени:
В соответствии с диссоциацией по `»II»` ступени, это количество вещества равно количеству вещества катионов `»Ba»^(2+)` и количеству ионов `»OH»^-`, образовавшихся по `»II»` ступени диссоциации:
5) Найдём число катионов `»Ba»^(2+)`, образующихся при диссоциации:
6) Вычислим количество вещества гидроксид-ионов, образовавшихся на обеих стадиях диссоциации, и их число:
Тема №33 «Электролитическая диссоциация электролитов в водных растворах и реакции ионного обмена.»
Тема №33 «Электролитическая диссоциация электролитов в водных растворах и реакции ионного обмена.»
Электролитическая диссоциация электролитов в водных растворах и реакции ионного обмена.
Оглавление
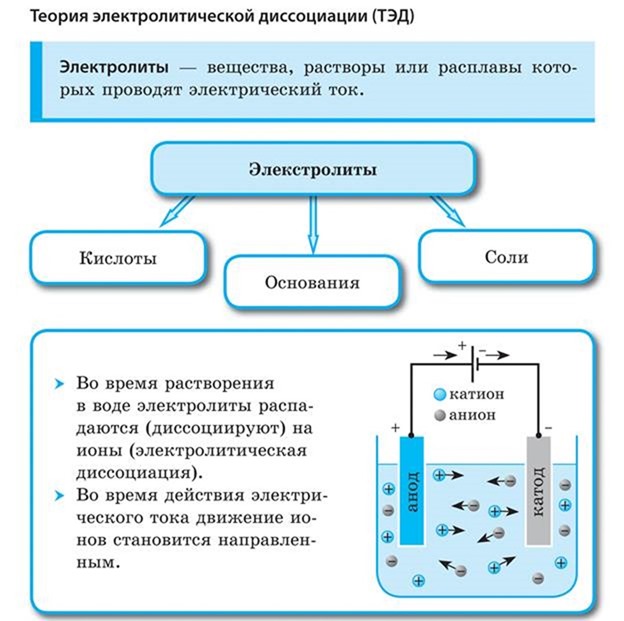
Электролиты и неэлектролиты
Из уроков физики известно, что растворы одних веществ способны проводить электрический ток, а других — нет.
Вещества, растворы которых проводят электрический ток, называются электролитами.
Вещества, растворы которых не проводят электрический ток, называются неэлектролитами. Например растворы сахара, спирта, глюкозы и некоторых других веществ не проводят электрический ток.
Электролитические диссоциация и ассоциация
Почему же растворы электролитов проводят электрический ток?
Шведский ученый С. Аррениус, изучая электропроводность различных веществ, пришел в 1877 г. к выводу, что причиной электропроводности является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электролитической диссоциацией.
С. Аррениус, который придерживался физической теории растворов, не учитывал взаимодействия электролита с водой и считал, что в растворах находятся свободные ионы. В отличие от него русские химики И. А. Каблуков и В. А. Кистяков- ский применили к объяснению электролитической диссоциации химическую теорию Д. И. Менделеева и доказали, что при растворении электролита происходит химическое взаимодействие растворенного вещества с водой, которое приводит к образованию гидратов, а затем они диссоциируют на ионы. Они считали, что в растворах находятся не свободные, не «голые» ионы, а гидратированные, т. е. «одетые в шубку» из молекул воды.
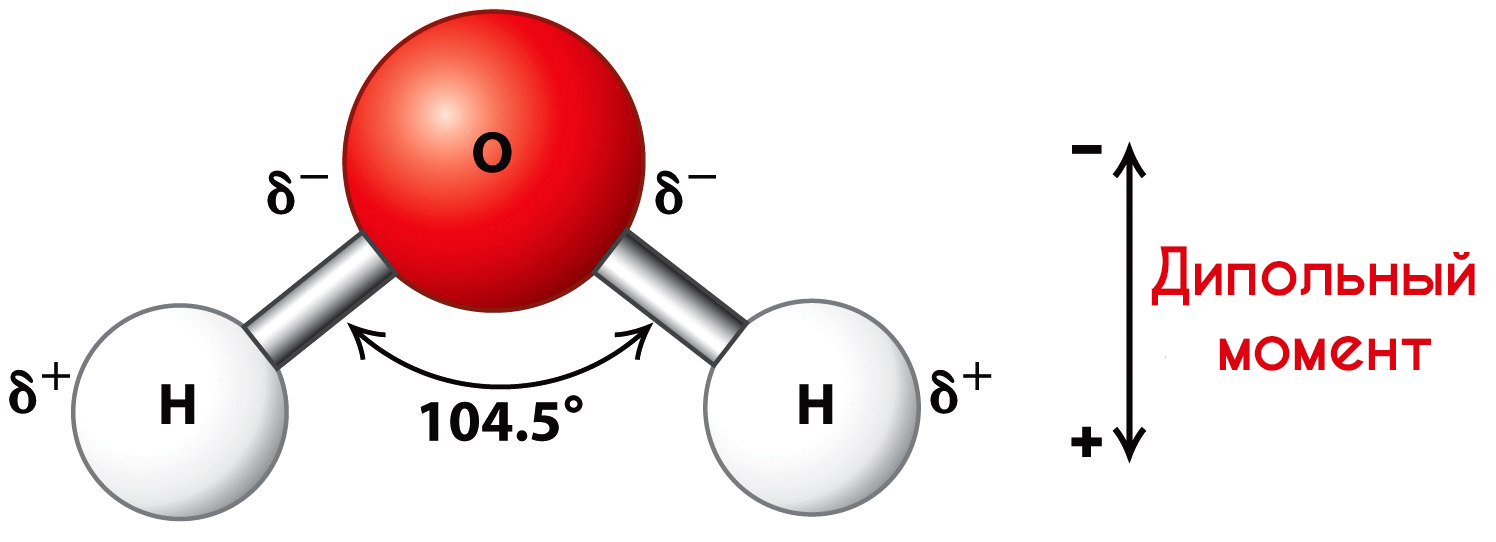
Молекулы воды представляют собой диполи (два полюса), так как атомы водорода расположены под углом 104,5°, благодаря чему молекула имеет угловую форму. Молекула воды схематически представлена ниже.
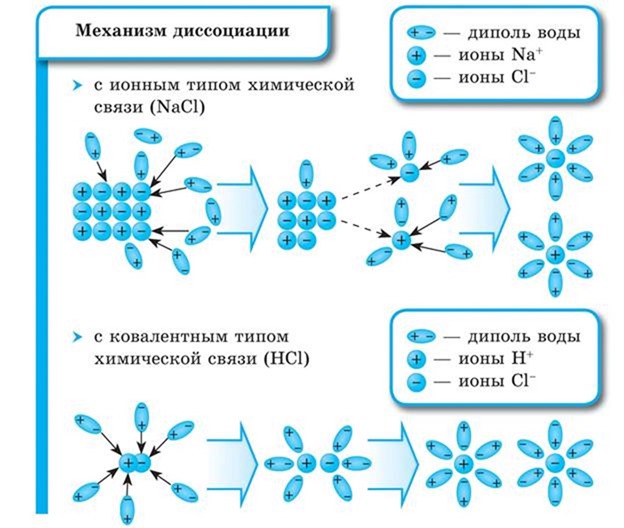
Как правило, легче всего диссоциируют вещества с ионной связью и, соответственно, с ионной кристаллической решеткой, так как они уже состоят из готовых ионов. При их растворении диполи воды ориентируются противоположно заряженными концами вокруг положительных и отрицательных ионов электролита.
Между ионами электролита и диполями воды возникают силы взаимного притяжения. В результате связь между ионами ослабевает, и происходит переход ионов из кристалла в раствор. Очевидно, что последовательность процессов, происходящих при диссоциации веществ с ионной связью (солей и щелочей), будет такой:
1) ориентация молекул (диполей) воды около ионов кристалла;
2) гидратация (взаимодействие) молекул воды с ионами поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированные ионы.
Упрощенно происходящие процессы можно отразить с помощью следующего уравнения:
Аналогично диссоциируют и электролиты, в молекулах которых ковалентная связь (например, молекулы хлороводорода HCl, смотри ниже); только в этом случае под влиянием диполей воды происходит превращение ковалентной полярной связи в ионную; последовательность процессов, происходящих при этом, будет такой:
1) ориентация молекул воды вокруг полюсов молекул электролита;
2) гидратация (взаимодействие) молекул воды с молекулами электролита;
3) ионизация молекул электролита (превращение ковалентной полярной связи в ионную);
4) диссоциация (распад) молекул электролита на гидратированные ионы.
Схема электролитической диссоциации хлорида натрия на гидратированные ионы
Упрощенно процесс диссоциации соляной кислоты можно отразить с помощью следующего уравнения:
Следует учитывать, что в растворах электролитов хаотически движущиеся гидратированные ионы могут столкнуться и вновь объединиться между собой. Этот обратный процесс называется ассоциацией. Ассоциация в растворах происходит параллельно с диссоциацией, поэтому в уравнениях реакций ставят знак обратимости.
Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
Свойства гидратированных ионов отличаются от свойств негидратированных. Например, негидратированный ион меди Cu 2+ — белый в безводных кристаллах сульфата меди (II) и имеет голубой цвет, когда гидратирован, т. е. связан с молекулами воды Cu 2+ • nH2O. Гидратированные ионы имеют как постоянное, так и переменное число молекул воды.
Степень электролитической диссоциации
В растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому растворы электролитов характеризуются степенью диссоциации, которая обозначается греческой буквой а («альфа»).
Степень диссоциации — это отношение числа частиц, распавшихся на ионы (Ng), к общему числу растворенных частиц (Np).
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если а = 0, то диссоциация отсутствует, а если а = 1, или 100 %, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, т. е. степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты делятся на сильные и слабые.
Сильные и слабые электролиты
Сильные электролиты — это электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: H2SO4, HCl, HNO3;
3) все щелочи, например: NaOH, KOH.
Слабые электролиты — это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
2) водный раствор аммиака NH3 • H2O;
Константа диссоциации
В растворах слабых электролитов вследствие их неполной диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Например, для уксусной кислоты:
Можно применить к этому равновесию закон действующих масс и записать выражение константы равновесия:
Константу равновесия, характеризующую процесс диссоциации слабого электролита, называют константой диссоциации.
Константа диссоциации характеризует способность электролита (кислоты, основания, воды) диссоциировать на ионы. Чем больше константа, тем легче электролит распадается на ионы, следовательно, тем он сильнее. Значения констант диссоциации для слабых электролитов приводятся в справочниках.
Основные положения теории электролитической диссоциации
1. При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы.
Ионы — это одна из форм существования химического элемента. Например, атомы металла натрия Na 0 энергично взаимодействуют с водой, образуя при этом щелочь (NaOH) и водород Н2, в то время как ионы натрия Na + таких продуктов не образуют. Хлор Cl2 имеет желтозеленый цвет и резкий запах, ядовит, а ионы хлора Cl — бесцветны, не ядовиты, лишены запаха.
Ионы — это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов одного или нескольких химических элементов в результате отдачи или присоединения электронов.
В растворах ионы беспорядочно передвигаются в различных направлениях.
2. Причиной диссоциации электролита в водных растворах является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
В результате такого взаимодействия образуются гидратированные, т. е. связанные с молекулами воды, ионы. Следовательно, по наличию водной оболочки ионы делятся на гидратированные (в раствоpax и кристаллогидратах) и негидратированные (в безводных солях).
3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока — катоду и поэтому называются катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду и поэтому называются анионами.
Следовательно, существует еще одна классификация ионов — по знаку их заряда.
4. Электролитическая диссоциация — процесс обратимый для слабых электролитов.
Наряду с процессом диссоциации (распад электролита на ионы) протекает и обратный процесс — ассоциация (соединение ионов). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости, например:
5. Не все электролиты в одинаковой мере диссоциируют на ионы.
Степень диссоциации зависит от природы электролита и его концентрации. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Реакции ионного обмена
Свойства растворов слабых электролитов обусловлены молекулами и ионами, образовавшимися в процессе диссоциации, которые находятся в динамическом равновесии друг с другом.
Свойства растворов сильных электролитов определяются свойствами ионов, которые образуются при их диссоциации.
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Этим обусловлена высокая скорость многих химических реакций в растворах электролитов.
Реакции, протекающие между ионами, называют ионными реакциями, а уравнения этих реакций — ионными уравнениями.
Реакции ионного обмена в водных растворах могут протекать:
1. Необратимо, до конца.
2. Обратимо, то есть протекать одновременно в двух противоположных направлениях. Реакции обмена между сильными электролитами в растворах протекают до конца или практически необратимы, когда ионы, соединяясь друг с другом, образуют вещества:
б) малодиссоциирующие (слабые электролиты);
Приведем несколько примеров молекулярных и сокращенных ионных уравнений:
Реакция необратима, т. к. один из ее продуктов — нерастворимое вещество.
Реакция нейтрализации необратима, т. к. образуется малодиссоциирующее вещество — вода.
Реакция необратима, т. к. образуется газ CO2 и малодиссоциирующее вещество — вода.
Если среди исходных веществ и среди продуктов реакции имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают.
В обратимых реакциях равновесие смещается в сторону образования наименее растворимых или наименее диссоциированных веществ.
Равновесие смещается в сторону образования более слабого электролита — H2O. Однако до конца такая реакция протекать не будет: в растворе остаются недиссоциированные молекулы уксусной кислоты и гидроксид-ионы.
Если исходные вещества — сильные электролиты, которые при взаимодействии не образуют нерастворимых или малодиссоциирующих веществ или газов, то такие реакции не протекают: при смешивании растворов образуется смесь ионов.
Шпаргалка
Справочный материал для прохождения тестирования:
1.4.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты.
Как известно из курса физики, электрическим током называют упорядоченное движение заряженных частиц. В случае металлов, электропроводность обеспечивается подвижными электронами в кристалле, слабо связанными c ядрами атомов, что позволяет им направленно двигаться под действием разности потенциалов.
Кроме металлов, существуют также вещества растворы или расплавы которых проводят электрический ток. Такие вещества называют электролитами.
Электролиты — вещества, расплавы или водные растворы которых проводят электрический ток.
Но за счет чего обеспечивается электрическая проводимость расплавов и растворов электролитов?
Рассмотрим такое соединение как хлорида натрия. Это вещество характеризуется ионным строением. В узлах его структурной решетки находятся попеременно в шахматном порядке катионы натрия и анионы хлора:
Как можно видеть, заряженные частицы, которые могли бы быть обеспечивать электрическую проводимость присутствуют, но статичны, т.е. неподвижны в узлах решетки. Поэтому, чтобы электрический ток смог протекать через хлорид натрия, нужно еще и обеспечить «подвижность» ионов, из которых он состоит.
Однако, добиться диссоциации хлорида натрия можно не только его плавлением, но также и его растворением в воде. Но каким образом, это становится возможным? Ведь для того чтобы произошло разрушение кристаллической решетки требуется сообщить ей энергию, что и происходило при расплавлении. Откуда же берется энергия на разрушение решетки в случае растворения?
При помещении кристалла NaCl в воду его поверхность подвергается «облепливанию» молекулами воды или гидратации, в результате которой, ионам в структурной решетке сообщается энергия, достаточная для выделения из структурной решетки и «отправления в свободное плавание» в «оболочке» из молекул воды:
или более упрощенно:
NaCl ↔ Na + + Cl − (участвующие в гидратации кристалла NaCl и ионов молекулы воды не записываются)
Если энергия, выделяющаяся при гидратации кристалла, меньше энергии кристаллической решетки, то его растворение и диссоциация становятся невозможными. Например, поверхность кристалла сульфата бария, помещенного в водную среду, также покрывается молекулами воды, но выделяющаяся в результате этого энергия недостаточна отрыва ионов Ba 2+ и SO4 2- из кристаллической решетки и, как следствие, становится невозможно его растворение (на самом деле возможно, но в крайне малой степени, т.к. абсолютно нерастворимых веществ не бывает).
Аналогичным образом диссоциация осуществляется также гидроксидами металлов. Например:
Помимо веществ ионного строения, электролитически диссоциировать способны также и некоторые вещества молекулярного строения с ковалентным полярным типом связи, а именно кислоты. Как и в случае ионных соединений, причина образования ионов из электронейтральных молекул кроется в их гидратации. Существование гидратированных ионов энергетически более выгодно, чем существование гидратированных молекул. Например, диссоциация молекулы соляной кислоты выглядит примерно следующим образом:
Тем не менее, даже в этом случае, чаще всего, уравнение диссоциации соляной кислоты, впрочем, как и любой другой, записывают, игнорируя явное участие в диссоциации кислот молекул воды.
Диссоциация многоосновных кислот протекает ступенчато, например:
Таким образом, как мы уже выяснили, к электролитам относят: соли, кислоты и основания.
Для описания способности электролитов к электролитической диссоциации используют величину, которая называется степенью диссоциации (α).
Степень диссоциации – отношение числа продиссоциировавших частиц, к общему числу растворенных частиц.