Кардиотоническое средство это что такое
Обзор таблеток от повышенного давления нового поколения
Частое повышение показателей артериального давления (АД) – причина развития серьезных заболеваний (инсульт, инфаркт миокарда и пр.). Гипертоническая болезнь в России диагностируется у каждого третьего человека преклонного возраста. Для борьбы с гипертонией многим пациентам приходится принимать препараты на протяжении всей жизни, чтобы исключить осложнения.
Современные фармакологические компании предлагают большой выбор лекарственных средств, эффективных при гипертонии. Если не знаете, как выбрать таблетки от повышенного давления, ознакомьтесь с рейтингом, представленным ниже. В ТОП вошли лучшие медикаменты с учетом эффективности, стоимости и отзывов.
Классификация препаратов от повышенного давления
Причины гипертонии
Когда нужно вызвать врача на дом при повышении давления?
Общепринятые показатели АД – 120/80. Параметры могут незначительно варьировать в зависимости от времени суток, физической активности и возраста человека.
Таблица – Показатели артериального давления и рекомендации
Лечение нарушений ритма сердца
Почему терапия аритмий считается одним из самых сложных разделов кардиологии? Как классифицируются аритмии? Какие группы лекарственных препаратов используются при лечении аритмий? Нарушения ритма сердца (аритмии) представляют собой один из самы
Почему терапия аритмий считается одним из самых сложных разделов кардиологии?
Как классифицируются аритмии?
Какие группы лекарственных препаратов используются при лечении аритмий?
Нарушения ритма сердца (аритмии) представляют собой один из самых сложных разделов клинической кардиологии. Отчасти это объясняется тем, что для диагностики и лечения аритмий необходимо очень хорошее знание электрокардиографии, отчасти — огромным разнообразием аритмий и большим выбором способов лечения. Кроме того, при внезапных аритмиях нередко требуется проведение неотложных лечебных мероприятий.
Одним из основных факторов, повышающих риск возникновения аритмий, является возраст. Так, например, мерцательную аритмию выявляют у 0,4% людей, при этом большую часть пациентов составляют люди старше 60 лет [1, 2, 4]. Увеличение частоты развития нарушений ритма сердца с возрастом объясняется изменениями, возникающими в миокарде и проводящей системе сердца в процессе старения. Происходит замещение миоцитов фиброзной тканью, развиваются так называемые «склеродегенеративные» изменения. Кроме этого, с возрастом повышается частота сердечно-сосудистых и экстракардиальных заболеваний, что также увеличивает вероятность возникновения аритмий [17, 18].
Основные клинические формы нарушений ритма сердца
По характеру клинического течения нарушения ритма сердца могут быть острыми и хроническими, преходящими и постоянными. Для характеристики клинического течения тахиаритмий используют такие определения, как «пароксизмальные», «рецидивирующие», «непрерывно рецидивирующие» [2].
Лечение нарушений ритма сердца
Показаниями для лечения нарушений ритма являются выраженные нарушения гемодинамики или субъективная непереносимость аритмии. Безопасные, бессимптомные или малосимптомные легко переносящиеся аритмии не требуют назначения специального лечения. В этих случаях основным лечебным мероприятием является рациональная психотерапия. Во всех случаях прежде всего проводится лечение основного заболевания.
Антиаритмические препараты
Основным способом терапии аритмий является применение антиаритмических препаратов. Хотя антиаритмические препаты не могут «вылечить» от аритмии, они помогают уменьшить или подавить аритмическую активность и предотвратить рецидивирование аритмий.
Любое воздействие антиаритмическими препаратами может вызывать как антиаритмический, так и аритмогенный эффект (то есть, наоборот, способствовать возникновению или развитию аритмии). Вероятность проявления антиаритмического эффекта для большинства препаратов составляет в среднем 40–60% (и очень редко для некоторых препаратов при отдельных вариантах аритмии достигает 90%). Вероятность развития аритмогенного эффекта составляет в среднем примерно 10%, при этом могут возникать опасные для жизни аритмии. В ходе нескольких крупных клинических исследований было выявлено заметное повышение общей летальности и частоты случаев внезапной смерти (в 2 — 3 раза и более) среди больных с органическим поражением сердца (постинфарктный кардиосклероз, гипертрофия или дилатация сердца) на фоне приема антиаритмических препаратов класса I, несмотря на то что эти средства эффективно устраняли аритмии [7, 8, 9].
Согласно наиболее распространенной на сегодняшний день классификации антиаритмических препаратов Вогана Вильямса, все антиаритмические препараты подразделяются на 4 класса:
I класс — блокаторы натриевых каналов.
II класс — блокаторы бета-адренергических рецепторов.
III класс — препараты, увеличивающие продолжительность потенциала действия и рефрактерность миокарда.
IV класс — блокаторы кальциевых каналов.
Применение комбинаций антиаритмических препаратов в ряде случаев позволяет достичь существенного повышения эффективности антиаритмической терапии. Одновременно отмечается уменьшение частоты и выраженности побочных явлений вследствие того, что препараты при комбинированной терапии назначают в меньших дозах [3, 17].
Следует отметить, что показаний для назначения так называемых метаболических препаратов пациентам с нарушениями ритма не существует. Эффективность курсового лечения такими препаратами, как кокарбоксилаза, АТФ, инозие-Ф, рибоксин, неотон и т. п., и плацебо одинаковы. Исключение составляет милдронат, препарат цитопротективного действия, имеются данные об антиаритмическом эффекте милдроната при желудочковой экстрасистолии [3].
Особенности лечения основных клинических форм нарушений ритма
Экстрасистолия
Клиническое значение экстрасистолии практически целиком определяется характером основного заболевания, степенью органического поражения сердца и функциональным состоянием миокарда. У лиц без признаков поражения миокарда с нормальной сократительной функцией левого желудочка (фракция выброса больше 50%) наличие экстрасистолии не влияет на прогноз и не представляет опасности для жизни. У больных с органическим поражением миокарда, например с постинфарктным кардиосклерозом, экстрасистолия может рассматриваться в качестве дополнительного прогностически неблагоприятного признака. Однако независимое прогностическое значение экстрасистолии не определено. Экстрасистолию (в том числе экстрасистолию «высоких градаций») даже называют «косметической» аритмией, подчеркивая таким образом ее безопасность.
Как было уже отмечено, лечение экстрасистолии с помощью антиаритмических препаратов класса I C значительно увеличивает риск смерти. Поэтому при наличии показаний лечение начинают с назначения β-блокаторов [8, 17, 18]. В дальнейшем оценивают эффективность терапии амиодароном и соталолом. Возможно также применение седативных препаратов. Антиаритмические препараты класса I C используют только при очень частой экстрасистолии, в случае отсутствия эффекта от терапии β-блокаторами, а также амидороном и соталолом (табл. 3)
Тахиаритмии
В зависимости от локализации источника аритмии различают наджелудочковые и желудочковые тахиаритмии. По характеру клинического течения выделяют 2 крайних варианта тахиаритмий (постоянные и пароксизмальные. Промежуточное положение занимают преходящие или рецидивирующие тахиаритмии. Чаще всего наблюдается мерцательная аритмия. Частота выявления мерцательной аритмии резко увеличивается с возрастом больных [1, 17, 18].
Мерцательная аритмия
Пароксизмальная мерцательная аритмия. В течение первых суток у 50% больных с пароксизмальной мерцательной аритмией отмечается спонтанное восстановление синусового ритма. Однако произойдет ли восстановление синусового ритма в первые часы, остается неизвестным. Поэтому при раннем обращении больного, как правило, предпринимаются попытки восстановления синусового ритма с помощью антиаритмических препаратов. В последние годы алгоритм лечения мерцательной аритмии несколько усложнился. Если от начала приступа прошло более 2 суток, восстановление нормального ритма может быть опасным — повышен риск тромбоэмболии (чаще всего в сосуды мозга с развитием инсульта). При неревматической мерцательной аритмии риск тромбоэмболий составляет от 1 до 5% (в среднем около 2%). Поэтому, если мерцательная аритмия продолжается более 2 суток, надо прекратить попытки восстановления ритма и назначить больному непрямые антикоагулянты (варфарин или фенилин) на 3 недели в дозах, поддерживающих показатель международного нормализованного отношения (МНО) в пределах от 2 до 3 (протромбиновый индекс около 60%). Через 3 недели можно предпринять попытку восстановления синусового ритма с помощью медикаментозной или электрической кардиоверсии. После кардиоверсии больной должен продолжить прием антикоагулянтов еще в течение месяца.
Таким образом, попытки восстановления синусового ритма предпринимают в течение первых 2 суток после развития мерцательной аритмии или через 3 недели после начала приема антикоагулянтов. При тахисистолической форме сначала следует уменьшить ЧСС (перевести в нормосистолическую форму) с помощью препаратов, блокирующих проведение в атриовентрикулярном узле: верапамила, β-блокаторов или дигоксина.
Для восстановления синусового ритма наиболее эффективны следующие препараты:
Сегодня с целью восстановления синусового ритма при мерцательной аритмии все чаще назначают однократную дозу амиодарона или пропафенона перорально. Эти препараты отличаются высокой эффективностью, хорошей переносимостью и удобством приема. Среднее время восстановления синусового ритма после приема амиодарона (30 мг/кг) составляет 6 ч, после пропафенона (600 мг) — 2 ч [6, 8, 9].
При трепетании предсердий кроме медикаментозного лечения можно использовать чреспищеводную стимуляцию левого предсердия с частотой, превышающей частоту трепетания, — обычно около 350 импульсов в минуту, продолжительностью 15–30 с. Кроме того, при трепетании предсердий очень эффективным может быть проведение электрической кардиоверсии разрядом мощностью 25–75 Дж после в/в введения реланиума.
Постоянная форма мерцательной аритмии. Мерцание предсердий является наиболее часто встречающейся формой устойчивой аритмии. У 60% больных с постоянной формой мерцательной аритмии основным заболеванием являются артериальная гипертония или ИБС. В ходе специальных исследований было выявлено, что ИБС становится причиной развития мерцательной аритмии примерно у 5% больных. В России существует гипердиагностика ИБС у больных с мерцательной аритмией, особенно среди людей пожилого возраста. Для постановки диагноза ИБС всегда необходимо продемонстрировать наличие клинических проявлений ишемии миокарда: стенокардии, безболевой ишемии миокарда, постинфарктного кардиосклероза.
Мерцательная аритмия обычно сопровождается неприятными ощущениями в грудной клетке, могут отмечаться нарушения гемодинамики и, главное, повышается риск возникновения тромбоэмболий, прежде всего в сосуды мозга. Для снижения степени риска назначают антикоагулянты непрямого действия (варфарин, фенилин). Менее эффективно применение аспирина [1, 17, 18].
Основным показанием для восстановления синусового ритма при постоянной форме мерцательной аритмии является «желание больного и согласие врача».
Для восстановления синусового ритма используют антиаритмические препараты или электроимпульсную терапию.
Антикоагулянты назначают, если мерцательная аритмия наблюдается более 2 суток. Особенно высок риск развития тромбоэмболий при митральном пороке сердца, гипертрофической кардиомиопатии, недостаточности кровообращения и тромбоэмболиях в анамнезе. Антикоагулянты назначают в течение 3 недель до кардиоверсии и в течение 3 — 4 недель после восстановления синусового ритма. Без назначения антиаритмических препаратов после кардиоверсии синусовый ритм сохраняется в течение 1 года у 15 — 50% больных. Применение антиаритмических препаратов повышает вероятность сохранения синусового ритма. Наиболее эффективно назначение амиодарона (кордарона) — даже при рефрактерности к другим антиаритмическим препаратам синусовый ритм сохраняется у 30 — 85% больных [2, 12]. Кордарон нередко эффективен и при выраженном увеличении левого предсердия.
Кроме амиодарона для предупреждения повторного возникновения мерцательной аритмии с успехом используются соталол, пропафенон, этацизин и аллапинин, несколько менее эффективны хинидин и дизопирамид. При сохранении постоянной формы мерцательной аритмии больным с тахисистолией для снижения ЧСС назначают дигоксин, верапамил или β-блокаторы. При редко встречающемся брадисистолическом варианте мерцательной аритмии эффективным может быть назначение эуфиллина (теопек, теотард).
Проведенные исследования показали, что две основные стратегии ведения больных с мерцательной аритмией — попытки сохранения синусового ритма или нормализация ЧСС на фоне мерцательной аритмии в сочетании с приемом непрямых антикоагулянтов — обеспечивают примерно одинаковое качество и продолжительность жизни больных [17].
Пароксизмальные наджелудочковые тахикардии
Пароксизмальные наджелудочковые тахикардии, встречающиеся гораздо реже, чем мерцательная аритмия, не связаны с наличием органического поражения сердца. Частота их выявления с возрастом не увеличивается.
Купирование пароксизмальных наджелудочковых тахикардий начинают с применения вагусных приемов. Наиболее часто используют пробу Вальсальвы (натуживание на вдохе около 10 с) и массаж сонной артерии. Очень эффективным вагусным приемом является «рефлекс ныряния» (погружение лица в холодную воду) — восстановление синусового ритма отмечается у 90% больных. При отсутствии эффекта от вагусных воздействий назначают антиаритмические препараты. Наиболее эффективны в этом случае верапамил, АТФ или аденозин.
У больных с легко переносящимися и сравнительно редко возникающими приступами тахикардии практикуется самостоятельное пероральное купирование приступов. Если в/в введение верапамила оказывается эффективным, можно назначить его внутрь в дозе 160–240 мг однократно, в момент возникновения приступов. Если более эффективным признается в/в введение новокаинамида — показан прием 2 г новокаинамида. Можно иcпользовать 0,5 г хинидина, 600 мг пропафенона или 30 мг/кг амиодарона внутрь.
Желудочковые тахикардии
Желудочковые тахикардии в большинстве случаев возникают у больных с органическим поражением сердца, чаще всего при постинфарктном кардиосклерозе [13, 14].
Лечение желудочковой тахикардии. Для купирования желудочковой тахикардии можно использовать амиодарон, лидокаин, соталол или новокаинамид.
При тяжелых, рефрактерных к медикаментозной и электроимпульсной терапии, угрожающих жизни желудочковых тахиаритмиях применяют прием больших доз амиодарона: внутрь до 4 — 6 г в сутки перорально в течение 3 дней (то есть по 20 — 30 табл.), далее по 2,4 г в сутки в течение 2 дней (по 12 табл.) с последующим снижением дозы [6, 10, 15, 16].
Предупреждение рецидивирования тахиаритмий
При частых приступах тахиаритмий (например, 1 — 2 раза в неделю) последовательно назначают антиаритмические препараты и их комбинации до прекращения приступов. Наиболее эффективным является назначение амиодарона в качестве монотерапии или в комбинации с другими антиаритмическими препаратами, прежде всего с β-блокаторами.
При редко возникающих, но тяжелых приступах тахиаритмий подбор эффективной антиаритмической терапии удобно проводить с помощью чреспищеводной электростимуляции сердца — при наджелудочковых тахиаритмиях — и программированной эндокардиальной стимуляции желудочков (внутрисердечное электрофизиологическое исследование) — при желудочковых тахиаритмиях. С помощью электростимуляции в большинстве случаев удается индуцировать приступ тахикардии, идентичный тем, которые спонтанно возникают у данного больного. Невозможность индукции приступа при повторной электрокардиостимуляции на фоне приема препаратов обычно совпадает с их эффективностью при длительном приеме [17, 18]. Следует отметить, что некоторые проспективные исследования продемонстрировали преимущество «слепого» назначения амиодарона и соталола при желудочковых тахиаритмиях перед тестированием антиаритмических препаратов класса I с помощью программированной электростимуляции желудочков или мониторирования ЭКГ.
При тяжелом течении пароксизмальных тахиаритмий и рефрактерности к медикаментозной терапии применяют хирургические способы лечения аритмий, имплантацию кардиостимулятора и кардиовертера-дефибриллятора.
Подбор антиаритмической терапии у больных с рецидивирующимим аритмиями
С учетом безопасности антиаритмических препаратов оценку эффективности целесообразно начинать с β-блокаторов или амиодарона. При неэффективности монотерапии оценивают действенность назначения амиодарона в комбинации с β-блокаторами [17]. Если нет брадикардии или удлинения интервала РR, с амиодароном можно сочетать любой β-блокатор. У больных с брадикардией к амиодарону добавляют пиндолол (вискен). Показано, что совместный прием амиодарона и β-блокаторов способствует значительно большему снижению смертности пациентов с сердечно-сосудистыми заболеваниями, чем прием каждого из препаратов в отдельности. Некоторые специалисты даже рекомендуют имплантацию двухкамерного стимулятора (в режиме DDDR) для безопасной терапии амиодароном в сочетании с β-блокаторами. Антиаритмические препараты класса I применяют только при отсутствии эффекта от β-блокаторов и/или амиодарона. Препараты класса I C, как правило, назначают на фоне приема бета-блокатора или амиодарона. В настоящее время изучается эффективность и безопасность применения соталола (β-блокатора, обладающего свойствами препаратов класса III).
П. Х. Джанашия, доктор медицинских наук, профессор
Н. М. Шевченко, доктор медицинских наук, профессор
С. М. Сорокoлетов, доктор медицинских наук, профессор
РГМУ, Медицинский центр Банка России, Москва
Кардиопротективные свойства антигипертензивных лекарственных средств
Всовременных рекомендациях по диагностике и лечению артериальной гипертензии (АГ) основная цель лечения определена как достижение максимального снижения долгосрочного риска сердечно-сосудистых осложнений (ССО).
Всовременных рекомендациях по диагностике и лечению артериальной гипертензии (АГ) основная цель лечения определена как достижение максимального снижения долгосрочного риска сердечно-сосудистых осложнений (ССО). Достичь этой цели возможно как за счет снижения повышенного артериального давления (АД), так и путем коррекции сопутствующих факторов риска. У всех пациентов с АГ следует снижать АД по меньшей мере до уровня 140/90 мм рт. ст. и ниже при хорошей переносимости.
В настоящее время основной концепцией антигипертензивной терапии является органопротекция, которая предполагает, с одной стороны, защиту органов-мишеней от повреждений, с другой — восстановление уже имеющихся в них структурных и функциональных изменений.
Если говорить о сердце как органе-мишени, то последствиями негативного воздействия на него повышенного АД являются гипертрофия миокарда левого желудочка (ЛЖ), развитие фиброза, различные варианты ремоделирования, апоптоз, что в конечном итоге повышает риск развития ССО.
На ранних стадиях артериальной гипертонии развитие гипертрофии миокарда является результатом структурной адаптации ЛЖ к повышенной нагрузке давлением. По результатам Фремингемского исследования эхокардиографические признаки гипертрофии миокарда ЛЖ были отмечены у 5–49% женщин и у 8–33% мужчин в возрасте от 30 до 70 лет. Степень гипертрофии ЛЖ определяют наследственные и конституциональные факторы (пол, возраст), факторы питания (избыточный вес, чувствительность к соли), а также состояние симпатической нервной и ренин-ангиотензин-альдостероновой (РААС) систем. Результаты многочисленных клинических исследований показали, что гипертрофия миокарда является независимым фактором риска развития ССО, таких как стенокардия напряжения, аритмия, инфаркт миокарда и сердечная недостаточность.
Гипертрофия миокарда ЛЖ (ГМЛЖ) приводит к нарушению функциональных свойств миокарда, причем в первую очередь нарушается его диастолическое наполнение, а затем и систолическая функция. При ГМЛЖ нарушается коронарное кровообращение, что проявляется снижением коронарного резерва и недостаточной перфузией субэндокардиальных слоев миокарда. При наличии ГМЛЖ частота желудочковых аритмий также повышается.
Риск развития коронарной недостаточности, желудочковых нарушений ритма сердца при увеличении массы миокарда левого желудочка на 50% возрастает по меньшей мере вдвое.
Было отмечено, что в группе с выраженной гипертрофией ЛЖ риск сердечной недостаточности возрастает в 5 раз. У 30–40% больных с признаками сердечной недостаточности отмечается нормальное состояние систолической функции, т. к. на ранних стадиях гипертрофического ремоделирования возникают прежде всего нарушения диастолического наполнения ЛЖ и признаки диастолической дисфункции. Таким образом, у больных АГ диастолическая дисфункция является самостоятельным фактором развития сердечной недостаточности. Говоря о кардиопротективных свойствах лекарственных средств (ЛС), мы в первую очередь оцениваем их влияние на ГМЛЖ.
Ретроспективный анализ клинических исследований показал, что антигипертензивная терапия, уменьшающая ГМЛЖ, позволяет добиться снижения риска ССО.
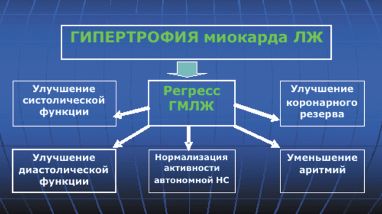
К чему приведет снижение массы миокарда ЛЖ в результате приема антигипертензивных ЛС? В настоящее время доказано, что регресс ГМЛЖ сопровождается улучшением систолической функции, уменьшением миокардиального фиброза и улучшением диастолической функции ЛЖ, увеличением коронарного резерва, нормализацией локальной нервной системы и уменьшением аритмий, что в конечном счете может снизить риск ССО и улучшить прогноз (рис. 1).
Поэтому, говоря о «кардиопротективности» применительно к антигипертензивным ЛС, мы предполагаем не только способность ЛС снижать ГМЛЖ, но и их способность влиять на жесткие конечные точки, такие как сердечно-сосудистая смертность и другие показатели сердечно-сосудистого риска.
Поскольку пусковым фактором развития ГМЛЖ является повышенное АД, следует предположить, что любой антигипертензивный препарат способен вызывать регресс ГМЛЖ.
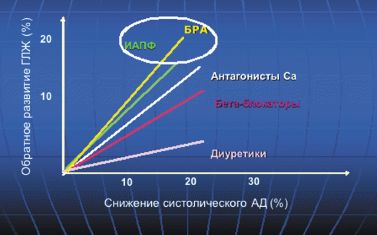
В настоящее время вопрос о влиянии различных антигипертензивных ЛС на процессы гипертрофического ремоделирования миокарда ЛЖ остается в центре внимания. В 90-х годах был опубликован ряд обзоров клинических исследований, сравнивающих эффективность различных групп антигипертензивных препаратов на степень регресса ГМЛЖ. Авторы четырех наиболее крупных метаанализов, в которых проводилось сравнение разных групп препаратов по способности вызывать регресс гипертрофии ЛЖ, пришли к согласованному заключению — наиболее эффективно уменьшают ГМЛЖ препараты, снижающие активность РААС, — на 11,8–15% от исходного уровня.
В работе Klingbeil и соавт. (метаанализ 80 двойных слепых клинических исследований) также показано, что наибольшая степень снижения индекса массы миокарда ЛЖ на 13% была отмечена у больных, получавших терапию блокаторами рецепторов ангиотензина (БРА), на 11% — антагонистами кальция пролонгированного действия (АК), на 10% — ингибиторами ангиотензин-превращающего фермента (АПФ), на 8% — диуретиками, на 6% — бета-адреноблокаторами (БАБ) (рис. 2).
Таким образом, лидирующие позиции в этом списке также занимают блокаторы ренин-ангиотензиновой системы — ингибиторы АПФ и БРА, что свидетельствует о высокой роли активации ангиотензиновых рецепторов 1 типа в процессах развития гипертрофии миокарда ЛЖ.
Ингибиторы АПФ и блокаторы рецепторов ангиотензина
Кардиопротективные свойства ингибиторов АПФ и БРА заключаются не только в их способности вызывать регресс гипертрофии миокарда ЛЖ за счет блокады компонентов циркулирующей и тканевой РААС. Потенциальные кардиопротективные эффекты, такие как антиишемическое и антиаритмическое действие, связаны с возможностью этих препаратов восстанавливать нарушенную функцию эндотелия, стимулировать высвобождение оксида азота и простациклина за счет снижения деградации брадикинина, уменьшать потребность миокарда в кислороде за счет регрессии гипертрофии миокарда, снижать активность симпато-адреналовой системы, обусловленной стимуляцией ангиотензина II.
Нами были изучены долгосрочные эффекты различных ингибиторов АПФ и БРА на процессы ремоделирования у больных АГ. Было выявлено достоверное снижение показателей ГМЛЖ на фоне длительной (до трех лет) терапии ингибиторами АПФ эналаприлом, рамиприлом и каптоприлом и БРА ирбесартаном и телмисартаном (рис. 3). Динамика снижения показателей суточного мониторирования АД за период наблюдения была однонаправленной и достоверно значимой при лечении всеми препаратами. При анализе динамики снижения индекса массы миокарда ЛЖ было отмечено более выраженное достоверно значимое снижение данного показателя в группе больных, получавших терапию БРА, что согласуется с данными ряда других исследований.
Особого внимания заслуживают антиишемические свойства ингибиторов АПФ, которые были подтверждены рядом клинических исследований. Так, в исследовании HOPE (Heart Outcomes prevention evaluation study) с рамиприлом (ингибитор АПФ с высокой аффинностью к тканевой АПФ) было включено 9297 больных старше 55 лет с высоким риском ССО. Через 4,5 года наблюдения было отмечено достоверное снижение риска развития острого инфаркта миокарда, инсульта и коронарных событий, требующих проведения реваскуляризации, — то есть тех осложнений, которые являются привычными «спутниками» прогрессирующего атеросклеротического процесса. Результаты этого исследования еще раз подтвердили обоснованность и правомочность концепции, согласно которой предупреждение сердечно-сосудистой заболеваемости и смертности возможно путем блокады РААС на тканевом уровне.
Клиническое изучение антиишемических свойств ингибиторов АПФ у больных АГ в сочетании с ишемической болезнью сердца (ИБС), стабильной стенокардией напряжения было проведено на нашей кафедре. Под влиянием лечения периндоприлом и эналаприлом у больных АГ в сочетании с ИБС, стабильной стенокардией напряжения хорошая антигипертензивная эффективность сочеталась с антиангинальным эффектом и положительной динамикой показателей теста с физической нагрузкой. У больных, получавших терапию периндоприлом, отмечено также снижение суммарной продолжительности эпизодов ишемии миокарда (по результатам Холтеровского мониторования ЭКГ), уменьшение проявлений дисфункции эндотелия, улучшение диастолической функции миокарда у больных с нарушениями релаксации, а также улучшение локальной сократимости миокарда в виде уменьшения количества гипокинетичных сегментов как в покое, так и на высоте физической нагрузки (в условиях проведения стресс-ЭХО-КГ).
В последние годы стали широко доступны результаты крупных многоцентровых клинических исследований, посвященных изучению различных аспектов кардиопротекции относительно нового класса антигипертензивных ЛС — блокаторов рецепторов ангиотензина II. Так, в клиническом исследовании LIFE (Losartan Intervention For Endpoint reduction in hypertension) кардиопротективные свойства лозартана оценивались у 9193 больных АГ с ГМЛЖ по амплитудным критериям ЭКГ. Больные были разделены на группы лечения лозартаном или атенололом. В случае недостаточного контроля АД к терапии добавляли гидрохлортиазид. Длительность лечения составила в среднем 4,8 года. Между группами не было различий по исходным показателям АД и степени снижения АД на фоне активного лечения. В группе больных, получавших лозартан, было отмечено более выраженное снижение количественных признаков гипертрофии миокарда, чем в группе атенолола. Риск развития ССО был на 13% меньше в группе лозартана (23,8 событий на 1000 больных в год), чем в группе атенолола (27,9 событий на 1000 больных в год). Смертность ССО в группе лозартана была недостоверно ниже.
В рандомизированном двойном слепом исследовании CATCH (Candesartan Assessment in the Treatment of Cardiac Hypertrophy) было проведено сравнение эффективности кандесартана (8–16 мг/сут) и эналаприла (10–20 мг/сут) у больных АГ с ГМЛЖ (по данным ЭХО-КГ — индекс массы миокарда ЛЖ (ИММЛЖ) > 100 г/м 2 у женщин и > 120 г/м2 у мужчин). Длительность наблюдения составила 1 год. В обеих группах отмечалось достоверное снижение ИММЛЖ (10,9 ± 15,5% и 8,4 ± 17,4%, p 2 у больных, получавших комбинированную терапию. У больных, получавших монотерапию эналаприлом, снижение данного показателя составило 3,9 ± 23,9 г/м 2 (p