Кипение что это такое в физике
Кипение что это такое в физике
Явление превращения вещества из жидкого состояния в газообразное называется парообразованием. Парообразование может осуществляться в виде двух процессов: испарение и кипение.
Кипение
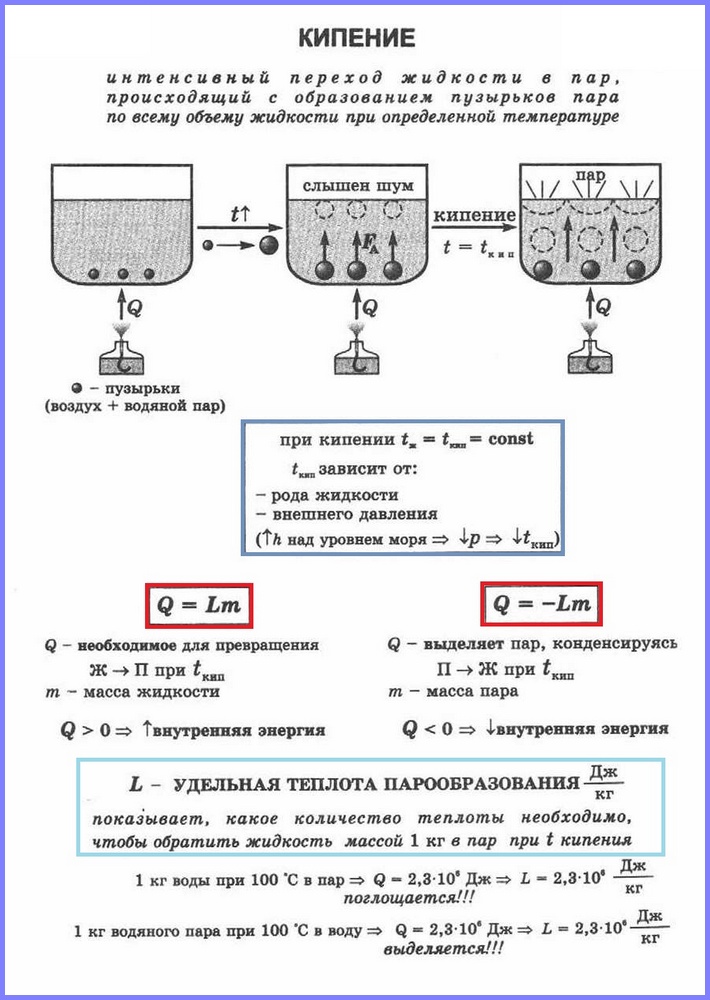
Второй процесс парообразования — кипение. Наблюдать этот процесс можно с помощью простого опыта, нагревая воду в стеклянной колбе. При нагревании воды в ней через некоторое время появляются пузырьки, в которых содержатся воздух и насыщенный водяной пар, который образуется при испарении воды внутри пузырьков. При повышении температуры давление внутри пузырьков растёт, и под действием выталкивающей силы они поднимаются вверх. Однако, поскольку температура верхних слоёв воды меньше, чем нижних, пар в пузырьках начинает конденсироваться, и они сжимаются. Когда вода прогреется по всему объёму, пузырьки с паром поднимаются до поверхности, лопаются, и пар выходит наружу. Вода кипит. Это происходит при такой температуре, при которой давление насыщенного пара в пузырьках равно атмосферному давлению.
Процесс парообразования, происходящий во всем объёме жидкости при определённой температуре, называют кипением. Температуру, при которой жидкость кипит, называют температурой кипения.
Эта температура зависит от атмосферного давления. При повышении атмосферного давления температура кипения возрастает.
Опыт показывает, что в процессе кипения температура жидкости не изменяется, несмотря на то, что извне поступает энергия. Переход жидкости в газообразное состояние при температуре кипения связан с увеличением расстояния между молекулами и соответственно с преодолением притяжения между ними. На совершение работы по преодолению сил притяжения расходуется подводимая к жидкости энергия. Так происходит до тех пор, пока вся жидкость не превратится в пар. Поскольку жидкость и пар в процессе кипения имеют одинаковую температуру, то средняя кинетическая энергия молекул не изменяется, увеличивается лишь их потенциальная энергия.
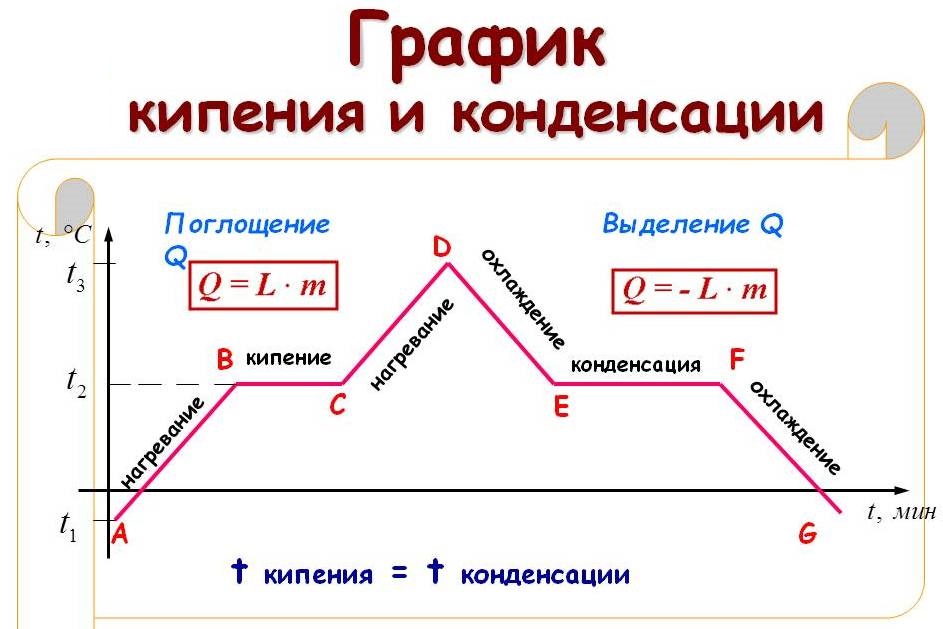
На рисунке приведён график зависимости температуры воды от времени в процессе её нагревания от комнатной температуры до температуры кипения (АВ), кипения (ВС), нагревания пара (CD), охлаждения пара (DE), конденсации (EF) и последующего охлаждения (FG).
Удельная теплота парообразования
Для превращения разных веществ из жидкого состояния в газообразное требуется разная энергия, эта энергия характеризуется величиной, называемой удельной теплотой парообразования.
Удельная теплота парообразования (L) — это величина, равная отношению количества теплоты, которое нужно сообщить веществу массой 1 кг, для превращения его из жидкого состояния в газообразное при температуре кипения.
Единица удельной теплоты парообразования — [L] = Дж/кг.
Чтобы рассчитать количество теплоты Q, которое необходимо сообщить веществу массой тп для его превращения из жидкого состояния в газообразное, необходимо удельную теплоту парообразования (L) умножить на массу вещества: Q = Lm.
При конденсации пара выделяется некоторое количество теплоты, причем его значение равно значению количества теплоты, которое необходимо затратить для превращения жидкости в пар при той же температуре.
Конспект урока «Кипение. Удельная теплота парообразования».
Кипение
Содержание
Для того чтобы превратить жидкость в пар, существует два способа: испарение и кипение. В прошлых уроках мы подробно разобрали, как происходит процесс испарения. В его ходе образуется пар, который в зависимости от условий может быть насыщенным или ненасыщенным.
Явление кипения мы часто наблюдаем в повседневной жизни. Для того чтобы приготовить чай или кофе, сначала мы доводим воду до кипения. Чтобы сварить суп, мы ждем, когда закипит вода в кастрюле.
В данном уроке мы рассмотрим, как физика описывает этот процесс, изучим изменения, происходящие при кипении и установим зависимости от других величин.
Процесс кипения
Проведем опыт: будем нагревать воду в открытом стеклянном сосуде и измерять ее температуру.
Отметим, что до того, момента как мы начнем нагревать воду, с поверхности воды идет испарение. Пар при этом не виден глазу, но, тем не менее, существует.
Начнем нагревать воду. Мы заметим, что в воде начинают появляться пузырьки (рисунок 1, а). С повышением температуры они начинают увеличиваться в размерах.
В воде всегда растворено некоторое количество воздуха. При повышении температуры этот воздух выделяется из воды в виде пузырьков. Внутри них – воздух и водяной пар. Водяной пар там присутствует, потому что окружающая вода испаряется внутрь этих пузырьков воздуха.
Когда пузырьки поднимаются в верхние слои жидкости (более холодные), они уменьшаются в размерах. Происходит это из-за конденсации пара внутри пузырьков. Под действием силы тяжести они опускаются вниз в более горячую воду.
И снова начинают подниматься к поверхности. Происходит попеременное увеличение и уменьшение пузырьков, в ходе которых они двигаются в жидкости. При этом мы слышим шум. Он предшествует закипанию воды.
Кипение – это интенсивный переход жидкости в пар, происходящий с образованием пузырьков пара по всему объему жидкости при определенной температуре.
Температура кипения
Если испарение происходит при любой температуре, то кипение происходит при некоторой определенной температуре. При этом:
Температура кипения – это температура, при которой жидкость кипит.
Во время кипения температура жидкости не меняется.
Вспомните, при приготовлении того же супа после закипания воды огонь уменьшают. Теперь он просто поддерживает эту самую температуру кипения. Это дает экономию топлива.
Температура кипения зависит от давления на поверхность жидкости. Давление насыщенного пара в пузырьках при кипении всегда больше внешнего давления.
Соответственно, если мы увеличим внешнее давление, то температура кипения увеличивается. Если уменьшим – температура кипения тоже снизится.
Температура кипения некоторых веществ
В таблице 1 представлены экспериментально полученные значения температуры кипения для различных веществ.
| Вещество | $t_<кип>, \degree C$ | Вещество | $t_<кип>, \degree C$ |
| Водород | -253 | Вода | 100 |
| Кислород | -183 | Ртуть | 357 |
| Эфир | 35 | Свинец | 1740 |
| Спирт | 78 | Медь | 2567 |
| Молоко | 100 | Железо | 2750 |
Талица 1. Температура кипения некоторых веществ (при нормальном атмосферном давлении)
Графики кипения жидкостей
На рисунке видно, что горизонтальные участки графиков соответствуют процессам кипения. Они параллельны оси времени, температура на них остается постоянной. Чтобы определить, какой график соответствует каждой жидкости, нам нужно обратиться к таблице 1.
$70 \degree C$ – температура кипения спирта. Значит, 2 – график нагревания и кипения спирта.
Физическое явление, знакомое каждому: кипение воды и его особенности
Существует множество физических явлений, над которыми обычно никто не задумывается — настолько они стали привычны и обыденны.
Однако иногда бывает полезно узнать о них подробнее. Одним из таких явлений является кипение воды.
Что это за явление?

От обычного испарения оно отличается высокой степенью интенсивности: если на испарение воды может потребоваться несколько дней или недель, то выкипеть такой же ее объем сможет за считанные часы.
При необходимости ёмкость можно прикрыть, тогда часть пара будет конденсироваться обратно, становясь капельками воды.
Процесс кипения условно можно разделить на два этапа:
Однако источник тепла нужен даже на этой стадии, ведь парообразование тоже требует энергетических затрат.
Какие факторы влияют на закипание?
На кипение влияет множество факторов:
Также часть тепла забирает ёмкость, в которой содержится вода, ведь она должна дойти до нужной температуры ещё раньше, чем ее содержимое. Поэтому посуда с более тонкими стенками, сделанная из легко проводящего тепло материала, например, металла, лучше подходит для кипячения.
От массы, а значит и от объёма вещества, кипение находится в обратной зависимости. Чем больше вес, тем больше энергии требуется на его нагревание, тем дольше будет необходимо ждать.

Давление также влияет на процесс. Чем оно выше, тем дольше будет закипать вода, потому что давление атмосферы как бы удерживает пузырьки газа внутри, а испаряться она начинает тогда, когда давление пара уравнивается с атмосферным.
Эта разница мало заметна, если сравнивать первый этаж жилого дома с пятым, однако становится ощутима, если речь идёт, например, о подъеме в горы.
В вакууме температура кипения всех веществ очень сильно снижается из-за понижения давления, обычно отличие составляет 100-200 градусов. Для воды она стремится к нулю по мере уменьшения количества воздуха, оставшегося в сосуде.
Не менее важны характеристики источника тепла. Чем больше его мощность, то есть количество выделяемой им энергии за единицу времени, тем быстрее идет процесс кипячения. На практике это означает, что на более сильном огне или при большей температуре конфорки на электроплите вода закипит скорее.
Сколько по времени закипает?
Становится понятно, что время кипения сильно зависит от условий, при которых оно происходит.
Величины:
Даже эта формула учитывает не все, ведь также существуют потери тепла, которое уходит в окружающую среду.
Однако такая точность редко бывает нужна в быту, кроме того, необходимые данные для расчётов получить затруднительно. Чаще всего кипение литра воды на плите при достаточно большом огне занимает около 10 минут. Здесь некоторую роль играет материал, из которого сделана посуда. Быстрее всего нагревается металл.
Как понять, что жидкость кипит?
По мере приближения к точке кипения в воде появляется все больше пузырьков. Сначала их можно увидеть на стенках сосуда, а потом они начинают всплывать на поверхность, отчего она становится неровной. Пропустить этот момент сложно из-за характерного бурления.
Даже спустя некоторое время после этого испарение будет продолжаться, потому что температура не сразу опустится ниже точки кипения. Например, от чашки горячего чая еще некоторое время идет пар.
Как быстро остывает после?

Например, электрочайник, вскипевший за пять минут, будет остывать около двух часов, чтобы дойти до комнатной температуры.
Если объем воды большой, то остывание при прочих равных займет более длительный промежуток времени, а чем холоднее воздух вокруг, тем быстрее охладится и сам кипяток. Его температура будет опускаться до того момента, пока не сравняется с окружающей.
Нюансы процесса
Кипение воды в чайнике и кастрюле немного различается между собой, но в обоих случаях оно происходит при 100 градусах. Рассмотрим особенности каждого процесса.
В чайнике
В электрическом чайнике процесс пойдёт быстрее, чем при кипячении в кастрюле, он займёт 3-4 минуты, точное время зависит от конкретной модели и ее мощности. Не потребуется даже выключать прибор – он сделает это автоматически.
Свист, которым чайник оповещает, что вода кипит, связан с прохождением пара через крышку на его носике.
В кастрюле

Не стоит наполнять ее до самого верха, потому что в таком случае при кипении брызги будут выплескиваться на плиту. Момент закипания сопровождается громким бурлением. Почти сразу после этого воду можно выключать.
Если накрыть кастрюлю крышкой, можно ускорить нагрев и закипание воды, потому что снизится количество тепла, уходящего в окружающую среду. Однако желательно оставить щель, через которую будет выходить пар.
Видео по теме статьи
О кипении жидкости расскажет видео:
Заключение
Хотя с точки зрения физики кипение — далеко не самый сложный процесс, говорить о нем можно долго, так как он связан со множеством факторов, под воздействием которых особенности его протекания несколько отличаются.
Даже общие знания из этой области могут быть полезны и найдут практическое применение, ведь в быту с необходимостью вскипятить воду регулярно сталкивается каждый.
Кипение и удельная теплота парообразования
Жидкость может переходить в парообразное состояние двумя способами – испарением и кипением. Испаряются жидкости во всем температурном диапазоне, в то время, как кипение происходит при строго определенной температуре для каждой конкретной жидкости.
Что такое кипение
Образование пара во всем объеме жидкости называют кипением.
Примечание: Интересен тот факт, что перед началом кипения от чайника с водой доносится специфический шум.
Различия между испарением и кипением
Характерным проявлением кипения может служить образование пузырьков пара внутри жидкости (рис. 1):
На следующем рисунке 2 представлены отличия процессов испарения и кипения подробнее:
Испарение происходит при любой температуре с поверхности, а кипение – только при одной конкретной температуре, но во всем объеме жидкости.
Процессы кипения и конденсации на графиках
Пусть небольшое количество воды находится в просторном закупоренном сосуде.
Разберем, как выглядят на температурных графиках процессы кипения и конденсации. Для начала рассмотрим график нагревания и кипения (рис. 3).
Вначале вода имела температуру +20 градусов Цельсия. Будем нагревать эту воду. Поначалу ее температура будет расти. На графике это показано наклонной синей линией, находящейся в левой части рисунка.
До бесконечности температура подниматься не будет. Как только температура достигнет некоторого предела, вода закипит. Из рисунка следует, когда температура воды достигла отметки +100 градусов Цельсия и начался процесс кипения. Этот процесс на рисунке схематично обозначен горизонтальной красной линией.
Горизонтальное положение линии кипения означает, что во время кипения температура воды не изменяется. Температура будет оставаться неизменной до тех пор, пока вся вода не превратится в газообразное состояние — пар. Для компактности рисунка я укоротил эту линию, на самом деле, длину этой линии нужно увеличить.
Уже после того, как вся вода превратилась в пар, температура пара начала повышаться. Это изображено на рисунке наклонной синей линией, находящейся правее красной линии.
Будем теперь отбирать тепловую энергию у молекул. Предположим, что мы охлаждаем горячий водяной пар, находящийся в закупоренном сосуде. Процессы его охлаждения и конденсации представлены на графике (рис. 4). Этот график можно получить, зеркально отразив вокруг вертикальной оси график, связанный с нагреванием, рассмотренный ранее.
Из графика следует:
Вначале температура пара уменьшается от +180 градусов Цельсия до +100 градусов. Это наклонная синяя линия, расположенная в левой части рисунка.
Затем, происходит конденсация пара. Молекулы пара собираются в капли жидкости. При этом, температура пара не изменяется и остается равной +100 градусам Цельсия.
Как только весь пар конденсируется, образовавшаяся жидкая вода начинает охлаждаться до конечной температуры + 20 градусов Цельсия. На графике охлаждение воды – это синяя наклонная линия, находящаяся справа от красной линии конденсации.
Температура кипения и как ее найти на графике
Чтобы жидкость закипела, ее нужно нагреть до температуры кипения.
На рисунке 5 представлен температурный график нагревания воды. Температуру кипения можно определить по горизонтальной линии, обозначающую процесс кипения. Нужно продолжить эту линию пунктиром по направлению к вертикальной оси температур. Точка, в которой пунктир упрется в ось и будет температурой кипения жидкости.
Температура кипения – это температура, при которой пар образуется во всем объеме жидкости. Такая температура у каждой жидкости своя, ее можно найти в справочнике физики.
Температуры кипения некоторых веществ
Сравним для наглядности значения температуры кипения некоторых веществ.
Нам известно, что температура кипения питьевой воды равна 100 градусам на шкале Цельсия.
При комнатной температуре некоторые вещества пребывают в газообразном состоянии, но при более низких температурах они превращаются в жидкости. Например, кислород превращается в кипящую жидкость при минус 183 градусах Цельсия.
В противоположность этому, вещества, которые мы привыкли видеть твердыми при комнатной температуре, в кипящую жидкость превратятся при более высоких температурах. К примеру, медь станет кипящей жидкостью при 2567 град. Цельсия, а железо – при 2500 град. Цельсия
На рисунке 6 представлен список некоторых веществ и указана температура, при которой эти вещества кипят.
Расширенный список жидкостей и их температуру кипения можно найти в справочнике физики.
Почему температура жидкости при кипении не изменяется
Тепловая энергия, которую получает жидкость во время кипения, тратится на образование пара во всем объеме жидкости. Поэтому во время кипения температура жидкости не изменяется.
Разберем подробнее, что происходит, когда мы сообщаем тепловую энергию какой-либо жидкости.
Получаемая от источника тепловая энергия передается молекулам жидкости. Скорость движения молекул увеличивается, а значит, растет их кинетическая энергия. Чем выше температура, тем быстрее будут двигаться молекулы.
Находясь в жидкости, каждая молекула притягиваются к соседним молекулам. То есть, молекулы удерживаются в жидкости силами притяжения соседних молекул. Если есть взаимодействие молекул – их взаимное притяжение, значит, есть потенциальная энергия такого взаимодействия.
По мере нагревания, энергия движения некоторых молекул увеличится настолько, что они преодолеют притяжение соседних молекул и, покинут жидкость. Чем выше температура, тем большее число молекул сможет покинуть жидкость.
Мы помним, что при испарении жидкость покидают молекулы, находящиеся только на ее поверхности. А во время кипения энергию, достаточную для того, чтобы вылететь из жидкости, получают не только молекулы на поверхности, но и молекулы, находящиеся внутри жидкости.
Примечания:
Как давление влияет на температуру кипения
Мы можем влиять на температуру кипения жидкостей, изменяя давление. Если давление воздуха увеличить, то температура кипения, так же, возрастет. К примеру, вода при давлении 220 атмосфер (это 21,6 миллионов Паскалей) закипит только тогда, когда ее температура поднимется до 370 градусов Цельсия.
А уменьшая давление, мы наоборот, температуру кипения жидкостей понизим. Именно из-за пониженного давления, температура кипения воды в высокогорных районах ниже, чем, на равнинной местности, которая ближе к уровню мирового океана. В горах вода закипает при температуре 90 градусов Цельсия. Из-за этого, некоторые продукты высоко в горах сварить не получится.
Чем выше давление, тем выше температура кипения жидкости. Уменьшив давление, мы понизим температуру кипения.
Что такое удельная теплота парообразования
Возьмем какую-либо жидкость массой 1 кг, предварительно нагретую до температуры кипения. Будем сообщать ей тепловую энергию, чтобы испарить эту жидкость полностью.
Та энергия (теплота), которую мы затратим, чтобы испарить с помощью кипения 1 кг жидкости, называется удельной теплотой парообразования. Удельной величиной эту теплоту называют потому, что она приходится на 1 кг жидкости.
Удельная теплота парообразования — это энергия, которую нужно затратить, чтобы испарить 1 кг жидкости, предварительно нагретой до температуры кипения.
\(\large L \left( \frac<\text<Дж>><\text<кг>>\right)\) – удельная теплота парообразования (конденсации).
На рисунке 7 представлена таблица, в которой содержится удельная теплота парообразования (конденсации) при температуре кипения для некоторых жидкостей и металлов в расплавленном состоянии.
Что происходит с энергией во время кипения и конденсации
Кипение: жидкость получает тепловую энергию (количество теплоты), из нее вырываются молекулы. Полученная энергия тратится на преодоление притяжения соседних молекул и на расширение образовавшегося пара.
Конденсация: молекулы пара отдают тепловую энергию в окружающее пространство, собираясь в капельки — превращаясь в жидкость.
Выполняется закон сохранения энергии. Именно поэтому теплота парообразования и теплота конденсации совпадают. Процессы кипения и конденсации протекают при одной и той же температуре. Различие кроется в том, что кипение происходит с поглощением энергии, а конденсация связана с выделением энергии.
Как удельная теплота парообразования связана с количеством теплоты — формула
Пусть жидкость предварительно нагрета до температуры кипения, и нам известны:
Мы можем посчитать общее количество теплоты, требуемое для перевода всей жидкости в пар. Расчеты нужно вести по формуле:
\(\large m \left( \text <кг>\right) \) – масса вещества;
\(\large L \left( \frac<\text<Дж>><\text<кг>> \right) \) – удельная теплота парообразования (конденсации);
\(\large Q \left( \text <Дж>\right) \) – количество теплоты, поглощенное жидкостью во время кипения, т. е. общая тепловая энергия для перевода всей жидкости в пар;
Формулу можно применять так же, чтобы рассчитать количество теплоты, выделяемое в окружающую среду молекулами пара при их конденсации.
Для процесса конденсации величина \(\large Q \) – это количество теплоты, выделенное молекулами пара в окружающую среду;
Чем удельная теплота парообразования отличается от количества теплоты
Отличия удельной теплоты парообразования от количества теплоты, приведены на рисунке 8:
В любом случае, жидкость предварительно нужно нагреть до температуры кипения.
Количество теплоты – это энергия, необходимая для конденсации или образования пара при температуре кипения для нескольких килограммов жидкости.
Удельная теплота парообразования – это энергия, необходимая для перевода в пар 1-го килограмма жидкости.