Пулированные тромбоциты что это
 Служба крови
Служба крови
Получение пулированного тромбоконцентрата из лейкотромбослоя
Введение
Пулирование отдельных доз лейкотромбослоя (Buffy coat), выделенного из консервированной крови, является широко распространенным в Европе способом получения тромбоцитов. Такой компонент содержит терапевтическую дозу тромбоцитов с минимальной примесью других клеток и по лечебному эффекту не отличается от концентрата, заготовленного методом автоматического афереза.
Щадящие условия центрифугирования на «биологической подложке» из эритроцитов и лейкоцитов обеспечивают низкую активацию тромбоцитов, и, как следствие, способность длительной циркуляции в сосудистом русле пациента.
Данный метод позволяет гарантированно обеспечивать лечебные учреждения высококачественным тромбоцитным концентратом (ТК), не требуя дополнительного времени и средств для проведения аппаратного тромбоцитафереза.
Технология рассчитана на максимальную реализацию донорского потенциала, а именно на получение трех компонентов из дозы цельной крови:
Использование систем контейнеров с консервантом CPD/SAGM и специальных систем для пулирования с интегрированным лейкофильтром позволяет получать терапевтическую дозу ТК очень высокого качества с содержанием тромбоцитов более 3,0 х 1011 и количеством остаточных лейкоцитов менее 0,2 х 106.
Воздухопроницаемые контейнеры позволяют хранить пулированный ТК до 5 дней при условии постоянного перемешивания.
Длительность циркуляции тромбоцитов в кровотоке пациента после трансфузии составляет 5-7 суток.
Существует возможность забора образца для определения бактериальной контаминации полученного ТК (eBBS, Pall).
Данный метод позволяет проводить последующую инактивацию патогенов в полученном ТК аппаратным методом (INTERSEPT, Cerus). Таким образом, сводится к минимуму риск инфицирования пациента.
Этапы получения пулированного тромбоконцентрата
Сбор цельной крови осуществляется в систему полимерных контейнеров с консервантом CPD/SAGM.
Консервированная кровь подвергается первичному «жёсткому» центрифугированию на рефрижераторной центрифуге.
Для фракционирования крови с дальнейшим получением эритроцитной взвеси, плазмы и стандартной дозы ЛТС (45-55 мл) рекомендуется использование автоматического фракционатора.
4-6 ЛТС объединяются по групповой совместимости в один мешок с дальнейшим разбавлением раствором PAS.
Для отделения ТК от других клеточных элементов пула используется «мягкий» режим центрифугирования. Отделение и лейкофильтрация богатой тромбоцитами надосадочной жидкости осуществляются на автоматическом фракционаторе.
ТК хранится при температуре 22 ± 2°С и постоянном помешивании. Срок хранения не должен превышать 5 дней после сбора.
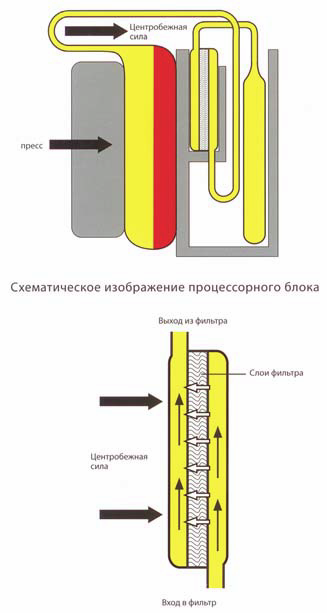
Принцип получения пулированного тромбоконцентрата
В фазе седиментации центробежная сила и фиксированное положение вкладышей с мешками приводят к вертикальной седиментации компонентов крови по направлению к стенкам вкладышей. В ходе фазы сепарации пулированный тромбоконцентрат проходит через встроенный фильтр, предназначенный для удаления лейкоцитов, и попадает в мешок для хранения. Центробежная сила в фазе сепарации стабилизирует слои и улучшает качество сепарации. Два оптических датчика обеспечивают четкое распознавание остаточного ЛТС, что дает максимальный выход тромбоцитов.
Фирма Terumo разработала новый фильтр IMUGARD® для тромбоцитов, используя полиуретановый материал с высокой биосовместимостью для получения в процессе лейкоредукции пулированного тромбоконцентрата. Расположение фильтра обеспечивает поступление суспензии тромбоцитов в фильтр со стороны днища и прохождение через пластины фильтра в направлении, противоположном действующей центробежной силе. Поступающие в фильтр эритроциты будут изначально накапливаться в его входной части.
Полиуретан как фильтрующий материал
Полиуретан – это полимер, в котором исходные молекулы соединены уретановыми связями путем реакции диизоцианатов и полиолов. Путем правильного выбора вариантов компонентов и их соотношений достигаются оптимальные физические, химические характеристики и характеристики биосовместимости.
Для создания лейкоцитарных фильтров в системах IMUGARD® III и IMUFLEX® фирма Terumo выбрала полиуретан с высочайшей биосовместимостью.
Исследование механизмов удаления лейкоцитов с применением полиурета на показывает, что большая часть лейкоцитов застревает механически в небольших порах или ямках материала.
Очень ограниченное взаимодействие клеток с материалом и отсутствие клеточной и протеиновой активации позволяют получать компоненты крови превосходного качества.
Заключение
Внедрение технологии получения тромбоцитов из ЛТС является перспективным направлением развития службы крови РФ.
Несмотря на распространение аферезного метода, приготовление тромбоцитов из ЛТС имеет ряд преимуществ. Высокое качество тромбоконцентрата. Технология обеспечивает хороший выход и низкую активацию тромбоцитов, их морфологическую гомогенность, незначительную примесь лейкоцитов и эритроцитов, длительность циркуляции в кровотоке до 5-7 суток (при отсутствии повышенного потребления). Оперативность и простота приготовления. Получив заявку, СПК имеет возможность приготовить лечебную дозу тромбоцитного концентрата из ЛТС, обследованных накануне, без затрат дополнительного времени и средств на вызов и обследование донора тромбоцитов.
Возможность заблаговременной заготовки тромбоцитов. Продление сроков хранения ТК до 5 суток позволяет СПК и ОПК поддерживать необходимый запас терапевтических доз ТК.
Доступность технологии для любой СПК. При фракционировании цельной крови на эритроциты и плазму достаточно выделять ЛТС, используя соответствующие режимы центрифугирования. Обязательной составляющей методики является расходный комплект для пулирования и устройство для стерильного соединения полимерных магистралей.
Возможность определения бактериальной контаминации и патогенной инактивации продукта.
Автоматизация процесса. По мере освоения технологии возможен переход к полной автоматизации (использование автоматических фракционаторов крови, расходных комплектов и аппарата TACSI компании Terumo).
Преимущества пулированной вирусинактивированной плазмы
С.Р. Мадзаев¹, У.С. Султанбаев², С.А. Трофимова³, Р.Ф. Аюпова², О.П. Килимчук³, Ф.Ф. Фархутдинов¹, Е.А. Шестаков¹
¹Национальный медико-хирургический центр имени Н.И. Пирогова, г. Москва
²Башкирская Республиканская станция переливания крови, г. Уфа
³Городская клиническая больница № 31, г. Санкт-Петербург
Трансфузиология №4, 2014
Резюме
По мере внедрения доказательных правил назначения компонентов крови доля реципиентов 1 дозы сокращается до менее 5%. При этом плазма смешивается (фактически – «пулируется») в организме реципиента. Есть техническое решение инактивации патогенов в пуле донорской плазмы. Технология инактивации патогенов Intercept в объединенных дозах плазмы, полученных из цельной крови донора, снижает расходы СПК: при объединении двух доз – на 114,7–189,8%, а при объединении трех доз – на 383,2–552,0%. Регламентацию пулирования монодонорских продуктов крови целесообразно предусмотреть при корректировке технического регламента о безопасности крови.
Ключевые слова: кровь, плазма, переливание, безопасность, инактивация патогенов, пулирование, экономическая эффективность.
Введение Переливание плазмы – распространенный способ коррекции дефицита факторов свертывания крови у пациентов с кровотечением [1].
Для повышения инфекционной безопасности переливания плазмы в течение нескольких десятилетий используют технологии инактивации (редукции) патогенов.
Для инактивации патогенов в плазме в заводских условиях используют технологию растворитель/детергент.
Для инактивации патогенов в единичных дозах плазмы на СПК используют три технологии:
1) с метиленовым синим (Терафлекс, Макофарма);
2) с амотосаленом (Интерсепт, Церус);
3) с рибофлавином (Мирасол, Терумо БСТ) [2–10].
Плазма: дозирование и пулирование
Из дозы цельной крови донора выделяют 200–300 мл плазмы. Если переливать правильно, то 1 доза плазмы эффективна для восстановления концентрации факторов свертывания только у детей массой тела менее 20 кг. Переливание одной дозы плазмы взрослому реципиенту – ошибка, поскольку количество факторов свертывания, содержащееся в дозе крови донора, недостаточно для коррекции коагулопатии (табл. 1).
По мере внедрения доказательных правил назначения компонентов крови [11–12] доля реципиентов 1 дозы сокращается до менее 5% (табл. 2 и 3).
При этом плазма смешивается (фактически – «пулируется») в организме реципиента.
Традиционно на этапе получения компонентов пулируют тромбоциты и криопреципитат, что:
1) упрощает логистику компонента,
2) сокращает трудозатраты врача, переливающего кровь,
3) сокращает риск перепутывания контейнеров в клинике,
4) сокращает количество материала, оставляемого в контейнере после переливания (по 5 мл в каждом контейнере) [13–16].
Компанией «Церус» найдено техническое решение инактивации патогенов в пуле донорской плазмы.
Цель исследования:
оценить экономическую эффективность пулирования плазмы для вирусинактивации.
Материалы и методы
На сайте Казначейства России (http: //reestrgk.roskazna.ru/index.php) изучен Реестр государственных контрактов, заключенных по итогам размещения заказов в 2013 году.
Результаты
Установлено, что по государственным заказам в указанный период поставлялись 3 типа систем для инактивации патогенов в плазме (табл. 4). При применении системы «Интерсепт» для инактивации патогенов в одной дозе плазмы затраты превышают аналогичные для системы «Терафлекс» на 46,3%, а для системы «Мирасол» – на 27,6%.
Однако, если нужно инактивировать патогены в двух дозах плазмы, полученных из цельной крови донора, то напротив, при применении системы Интерсепт затраты меньше аналогичных для системы «Терафлекс» на 114,7%, а для системы «Мирасол» –на 189,8%.
При инактивации патогенов в трех дозах плазмы, полученных из цельной крови донора, при применении системы «Интерсепт» затраты меньше аналогичных для системы «Тера флекс» на 383,2%, а для системы «Мирасол» – на 552,0% (табл.4).
Как внедрить пулирование плазмы
Пулирование плазмы для инактивации патогенов в Руководстве Совета Европы предусмотрено положением «процедуры редукции патогенов осуществляются в соответствии с инструкцией производителя по одной из следующих методик: с применением метиленового синего, амотосалена и рибофлавина (для пулов, состоящих менее чем из 12 одиночных доз, в целях редукции патогенов может использоваться поверхностно-активный агент, однако данная методика не рассматривается в настоящей статье) [17, стр. 386].
Существуют три способа внедрения вирусинактивированной плазмы:
1. Все дозы плазмы для переливания в стране (Бельгия, Франция, Финляндия, Норвегия, регионы Испании, Германии).
2. Все дозы плазмы в стране, предназначенные для переливания детям до 16 лет (Великобритания).
3. В инициативном порядке в качестве дополнительного метода повышения безопасности трансфузионной терапии (Италия, Швеция, Бразилия, Греция, Австрия и т. д.).
Различная ведомственная и региональная принадлежность организаций службы крови России предполагает внедрение технологии инактивации по третьему типу – в передовых центрах крови и клиниках. Первый опыт внедрения технологии вирусинактивации пулированных доз плазмы в России (Санкт-Петербург, Республика Башкортостан) показал как высокую клиническую, так и экономическую эффективность этой технологии [18–21].
В Европе помимо пулирования 2–3 доз плазмы есть технология пулирования пяти доз с последующим разделением в два контейнера для обработки амотосаленом, с итоговым получением шести доз вирусинактивированной плазмы для переливания. Полагают, что при такой технологии получается конечный продукт с более стандартным количеством факторов свертывания и сниженным риском ТРАЛИ [22, 23].
Тиражирование положительного опыта сталкивается с традиционным тормозом прогресса в производственной трансфузиологии – недостатками, запутанностью и разночтением нормативной базы [24], к которым с недавних пор добавилась еще и боязнь штрафа [25].
Пулирование входит в перечень основных методов получения компонентов крови, при этом условием его применения является обеспечение герметичности системы полимерных контейнеров [26].
Пулированные компоненты крови получают, объединяя продукты разных донаций. При этом их маркировка обеспечивает прослеживаемость каждой донации, вошедшей в пул [27].
Парадоксально, но пулирование вовсе не упомянуто в техническом регламенте о требованиях безопасности крови, что может сдерживать внедрение этой полезной технологии, сокращающей непроизводительный расход компонентов крови [28].
Заключение
Технология инактивации патогенов Intercept в объединенных дозах плазмы, полученных из цельной крови донора, снижает расходы СПК: при объединении двух доз – на 114,7–189,8%, а при объединении трех доз – на 383,2–552,0%.
Регламентацию пулирования монодонорских продуктов крови целесообразно предусмотреть при корректировке технического регламента о безопасности крови.
Литература
1. Жибурт Е.Б. Правила переливания плазмы. Руководство для врачей. – М.: Медицина, 2008. – 240 с.
2. Жибурт Е.Б., Филина Н.Г., Губанова М.Н. Вирусинактивация плазмы // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. – 2007. – Т. 2, № 1. –С. 105–110.
3. Жибурт Е.Б. Инактивация вирусов в дозе плазмы для переливания // Трансфузиология. – 2007. – Т. 8, № 3–4. – С. 40–46.
4. Жибурт Е.Б. Технология инактивации вирусов в дозе плазмы для переливания // Мед. техника. – 2008. – № 3. – С. 36–39.
5. Жибурт Е.Б., Копченко Т.Г., Губанова М.Н. Инактивация вирусов в дозе плазмы для переливания // Трансфузиология. – 2008. – Т. 9, № 2. – С. 36–48.
6. Вечерко А.В., Максимов В.А., Кузьмин Н.С., Жибурт Е.Б. Что выгоднее: внедрить вирусинактивацию или платить инфицированным при переливании крови? // Трансфузиология. – 2007. – Т. 8, № 1–2. – С. 16.
7. Вечерко А.В., Шестаков Е.А., Максимов В.А., Жибурт Е.Б. Существующие и перспективные методы вирусинактивации плазмы // Трансфузиология. – 2007. – Т. 8, № 1–2. – С. 16–17.
8. Жибурт Е.Б., Исмаилов Х.Г., Шестаков Е.А., Максимов В.А. «Новые» гемотрансмиссивные инфекции и их профилактика // Трансфузиология. – 2007. – Т. 8, № 1–2. – С. 18–19.
9. Шестаков Е.А., Максимов В.А., Кузьмин Н.С., Жибурт Е.Б. Вирусинактивация плазмы в документах Совета Европы // Трансфузиология. – 2007. – Т. 8, № 1–2. – С. 35–36.
10. Губанова М.Н., Анищик А.В., Жибурт Е.Б. Разработка типовой стандартной операционной процедуры вирусинактивации плазмы // Трансфузиология. – 2007. – Т. 8, № 1–2. –С. 59–60.
11. Жибурт Е.Б., Шестаков Е.А., Вергопуло А.А., Кузьмин Н.С. Правила и протоколы переливания крови. – М.: Национальный медико-хирургический центр имени Н.И. Пирогова, 2014. – 32 с.
12. Жибурт Е.Б., Мадзаев С.Р., Шестаков Е.А., Вергопуло А.А. Менеджмент крови пациента. – М.: Национальный медико-хирургический центр имени Н.И. Пирогова, 2014. – 64 с.
13. Жибурт Е.Б., Чечеткин А.В. Глава 9. Гемотрансфузионная терапия // Клиническая гематология: Руководство для врачей / Под ред. А.Н. Богданова и В.И. Мазурова. – СПб.: Фолиант, 2008. – С. 462–476.
14. Жибурт Е.Б. Бенчмаркинг заготовки и переливания крови. Руководство для врачей/ М.: РАЕН, 2009. – 364 с.
15. Жибурт Е.Б., Шестаков Е.А. Правила и аудит переливания крови. Руководство для врачей. – М., РАЕН, 2010. – 347 с.
16. Жибурт Е.Б. Трансфузиологический словарь. Руководство для врачей. – М.: РАЕН, 2012. – 319 с.
17. Руководство по приготовлению, использованию и обеспечению качества компонентов крови. 16-е издание. Совет Европы, 2011. – 490 с.
18. Инструкция по объединению одноименных по группе крови и резус-принадлежности доз плазмы для проведения процедуры инактивации патогенных биологических агентов (утв. Комитетом по здравоохранению Правительства Санкт-Петербурга 21 марта 2011 года).
19. Инструкция по объединению одноименных по группе крови и резус-принадлежности доз плазмы для проведения процедуры инактивации патогенных биологических агентов (плазма свежезамороженная, донорская, пулированная, вирусинактивированная) (утв. Минздравом Республики Башкортостан, без даты).
20. Стандарт предприятия «Забор и заготовка крови. Плазма свежезамороженная, донорская, пулированная, вирусинактивированная» СТП-05.1.21-12 (утв. приказом РСПК Башкортостана № 296 от 06.09.2012).
21. Стандартная операционная процедура на приготовление свежезамороженной моно- и полидонорской, пулированной вирусинактивированной плазмы. СОП ЭЦУЗКК 03-12. Введена РСПК Башкортостана с 20.11.2012.
22. Castro E., Pajares A.L., Barea L. et al. A new tool for increasing the efficiency of Intercept pathogen inactivation (PI) system for plasma // Vox Sang. – 2009. – Vol 96, Suppl. 1. – P. 220–221.
23. Жибурт Е.Б. Связанное с трансфузией острое повреждение легких (ТРАЛИ). – М.: Национальный медико-хирургический центр имени Н.И. Пирогова, 2010. – 64 с.
24. Жибурт Е.Б., Губанова М.Н., Коденев А.Т. и др. Вирусинактивированная плазма для переливания. Почему хороший продукт медленно внедряется // Вестник Росздравнадзора. – 2009. – № 4. – С. 14–17.
25. Жибурт Е.Б., Мадзаев С.Р., Вергопуло А.А. Нужно ли штрафовать трансфузиологов? // Общественное здоровье и здравоохранение. – 2013. – № 2. – С. 52–54.
26. ГОСТ Р 53420-2009. Национальный стандарт Российской Федерации. Кровь донорская и ее компоненты. Общие требования к обеспечению качества при заготовке, переработке, хранении и использовании донорской крови и ее компонентов (утв. и введен в действие Приказом Ростехрегулирования РФ от 28.10.2009 № 485-ст)».
27. Кровь донорская и ее компоненты. Контейнеры с консервированной кровью или ее компонентами. Маркировка. ГОСТ Р 52938-2008 (утв. Приказом Ростехрегулирования от 14.07.2008 № 139-ст).
28. Об утверждении технического регламента о требованиях безопасности крови, ее продуктов, кровезамещающих растворов и технических средств, используемых в трансфузионно-инфузионной терапии. Постановление Правительства РФ от 26.01.2010 № 29.
КЛЕТОЧНЫЕ ТЕХНОЛОГИИ В СЛУЖБЕ КРОВИ
КЛЕТОЧНЫЕ ТЕХНОЛОГИИ В СЛУЖБЕ КРОВИ
Они становятся вектором развития трансфузионной медицины
Международное общество переливания крови (International Society of Blood Transfusion, ISBT) самым перспективным направлением развития трансфузионной медицины полагает развитие технологий лечебного применения клеток крови – клеточной терапии. В С.-Петербурге в рамках Российской научно-практической конференции «Актуальные вопросы гематологии и трансфузиологии» состоялся симпозиум, посвященный современным клеточным технологиям.
Инактивация патогенов в компонентах крови
Руководитель центра крови университета Инсбрука (Австрия) Вальтер Нуссбаумер обобщил опыт внедрения и применения технологии инактивации патогенов в компонентах крови. Практическим врачам было интересно ознакомиться с практикой заготовки компонентов крови (см. табл. 1).
Заготовка компонентов крови в Австрии в 2007 г.
Компонент
Всего
На 1000 населения
Взвесь эритроцитов в SAGM
Плазма для фракционирования
Отличия австрийской практики от российской:
а) нет эритроцитной массы, готовят только эритроцитную взвесь;
б) дифференцированно учитывают пулированные и аферезные тромбоциты;
в) отдельные дозы тромбоцитов, выделенные из цельной крови, не переливают;
г) в клинику в основном выдают вирусинактивированную плазму;
д) использование карантинизированной плазмы сокращается, новая закладка в карантин не производится;
е) клиникой востребовано не более 25 % плазмы, выделенной из цельной крови; оставшиеся 75 % направляются на завод по производству препаратов плазмы.
Во всем мире, и в России тоже активно внедряется фотохимический метод вирусинактивации плазмы с использованием метиленового синего (МС-СЗП). Около 20 лет использования этого метода позволяют сделать заключение об отсутствии случаев передачи инфекций, снижении количества побочных реакций по сравнению с обычной плазмой, эффективности МС-СЗП в широком спектре клинических ситуаций:
— изолированные дефициты факторов свертывания V и XI;
— тромботическая тромбоцитопеническая пурпура;
— обменные трансфузии при желтухе у недоношенных детей;
— комплексные дефициты факторов свертывания различного генеза.
Интересен опыт Великобритании, где не переливают отечественную плазму из-за риска передачи прионов – возбудителя болезни Крейтцфельдта-Якоба. Вся плазма инмоприруется из США. При этом плазму, переливаемую детям до 18 лет, дополнительно вирусинактивируют метиленовым синим и видимым светом.
В дополнение к имеющимся данным о сохранности факторов свертывания в вирусинактивированной плазме в 2009 г. установлена сохранность тромбингенерирующего понетциала. Примечательно, что способность к генерации тромбина остается неизменной в течение 24 часов после размораживания как обычной плазмы, так и МС-СЗП.
В общем виде преимущества МС-СЗП:
— нет необходимости карантинизации;
— быстрый ответ на реальную клиническую потребность;
— использование в месте заготовки или переливания крови;
— объем плазмы на 50 мл больше по сравнению с плазмой, вирусинактивированной методом растворитель-детергент;
— высокая концентрация факторов свертывания;
— сниженное количество доз, необходимых для лечения одного пациента;
— накопленные данные о безопасности;
— воспроизводимые параметры качества;
— нет необходимости в дополнительном морозильном оборудовании;
— возможность отправить больше доз для фракционирования;
— возможность использовать плазму мужчин для профилактики связанного с трансфузией острого повреждения легких (ТРАЛИ).
С развитием онкологии и гематологии в мире возрастает количество пациентов, нуждающихся в трансфузиях тромбоцитов. Традиционный подход предполагает переливание тромбоцитов, взвешенных в плазме. При этом переливание донорской плазмы реципиенту тромбоцитов не нужно и несет с собой риск побочных реакций:
— фебрильные негемолитические трансфузионные реакции (их частота достигает 15 % у пациентов с реакциями в анамнезе и прямо пропорциональна сроку хранения тромбоцитов);
— аллергические реакции к белкам плазмы (местные, системные, анафилактические);
— аллергические реакции к веществам, растворенным в плазме;
Новое решение в приготовлении концентратов тромбоцитов – использование взвешивающих растворов. В закрытой системе 70 % плазмы, в которой исходно заготовлены аферезные либо пулированные тромбоциты, замещаются специальным раствором. В России зарегистрирован раствор SSP+ (табл. 2).
Таблица 2
Состав и назначение составляющих раствора
для взвешивания тромбоцитов SSP+
Компонент
Назначение
Профилактика активации тромбоцитов
Снижение продукции лактата
Поставщик энергии (АТФ)
Снижение выхода цитокинов из тромбоцитов
Показано, что при использовании взвешивающих растворов в концентрате тромбоцитов снижается содержание антиэритроцитарных антител. Соответственно: а) становится незначимой АВО-несовместимость; б) тромбоциты группы О становятся универсальной трансфузионной средой.
При аппаратной заготовке взвешивающий раствор позволяет сократить объем эксфузии плазмы у донора.
В центре крови взвешивающие растворы позволяют увеличить заготовку плазмы, отказаться от отмывания тромбоцитов, улучшить логистику за счет 7-дневного хранения тромбоцитов и отказа от необходимости подбора АВО-совместимых тромбоцитов.
Еще важный момент – взвешивающий раствор обеспечивает стандартность оптических свойств концентрата тромбоцитов, что является условием методов инактивации патогенов в тромбоцитах. Таких методов на сегодняшний день в мире известно три. Два фотохимических – с добавлением к тромбоцитам амотосалена либо рибофлавина. Еще один метод не предполагает внесения каких-либо веществ в трансфузионную среду. При этом инактивация патогенов происходит за счет повреждения нуклеиновых кислот ультрафиолетовым светом при интенсивном помешивании тромбоцитов в специальном контейнере. Параметры качества клеток при этом остаются в пределах нормы, а риск посттрансфузионного сепсиса или вирусной инфекции исчезает.
Фотохимиотерапия
Выступление Президента Французской ассоциации гемафереза Фархада Хешмати было посвящено фотохимиотерапии: ее истории, механизмам действия, показаниям и побочным реакциям.
Процедура фотохимиотерапии состоит из трех этапов:
— заготовка лейкоцитов (обогащенных мононуклеарами);
— обработка клеток 8-метоксипсораленом и облучение ультрафиолетом;
— реинфузия фотомодифицированных клеток.
Основы фотохимиотерапии были заложены в Древнем Египте и Индии, жители которых знали о содержании в некоторых растениях веществ, повышающих чувствительность кожи к действию солнечных лучей.
ПУВА-терапия (прием фотосенсибилизаторов и ультрафиолетовое облучение кожи) в настоящее время является эффективным способом лечения таких кожных заболеваний, как псориаз и атопический дерматит.
В 1982 г. был предложен метод экстракорпорального ультрафиолетового облучения клеток Сезари при одноименном синдроме на фоне орального приема псораленов.
В 1990 г. Ф.Хешмати и Ж.Андрэ создали устройство для экстракорпоральной обработки псораленом и ультрафиолетового облучения мононуклеаров периферической крови.
Показана эффективность этой процедуры при Т-клеточной лимфоме, аутоиммунных заболеваниях, рассеянном склерозе, отторжении трансплантата и болезни «трансплантат против хозяина», ВИЧ-инфекции, рестенозе коронарных артерий, атопическом дерматите.
При оптимальной схеме проведения процедур экстракорпоральная фотохимиотерапия имеет иммуномодулирующий эффект с участием процессов апоптоза, блокированием иммунопатологических процессов. При этом нет общей иммуносупрессии, нет повреждения органов, не накапливаются токсические продукты и нет увеличения частоты инфекций.
Основной недостаток технологии – необходимость доставки пациента в центр фотохимиотерапии. Нам такие центры еще предстоит создать.
Транплантация клеток пуповинной крови
Наибольшее внимание привлек доклад мировой звезды – руководителя лаборатории клинических исследований в клеточной терапии Парижского университета, руководителя онкогематологического отделения госпиталя Сент-Луис профессора Элиан Глюкман. Более 20 лет назад коллектив, возглавляемый доктором Глюкман, выполнил первую пересадку стволовых клеток пуповинной крови пациенту с анемией Фанкони. Весьма убедителен был слайд с фото этого пациента сегодня: крепкий молодой мужчина с женой и ребенком. Технология распространилась по всему миру, а ее автор, по мнению российских коллег, достойна Нобелевской премии.
На добровольной основе банки пуповинной крови и центры ее трансплантации объединены в сеть ЕВРОКОРД, по данным которой с 1988 г. по март 2009 г. в 437 центрах 47 стран выполнено 5223 пересадки пуповинной крови. Во Франции выполнено 1125 трансплантаций, в США – 904, в Испании – 653, в Италии – 589. В России пока выполнено всего 8 пересадок.
Начиная с 2006 г. стволовые клетки пуповинной крови чаще пересаживают взрослым, чем детям. Основные показания: острый лейкоз, миелодиспластический синдром, хронический миелолейкоз, хронический лимфолейкоз, лимфома, миеломная болезнь.
Пятилетняя выживаемость неродственных реципиентов при злокачественных заболеваниях составляет 40 %, а при незлокачественных – 56 %.
Для трансплантации клеток пуповинной крови характерно сниженная частота болезни «трансплантат против хозяина» по сравнению с пересадкой стволовых клеток костного мозга, сокращенный период нейтропении и тромбоцитопении. Скорость приживления прямо пропорциональна дозе введенных стволовых клеток, их оптимальное содержание – не менее 2×10 5 на кг веса тела реципиента.
Разрабатывается алгоритм выбора: при какой степени HLA-несовместимости взрослого пациента с аллогенным взрослым донором следует предпочитать пуповинную кровь.
Еще одно перспективное направление – введение стволовых клеток не в вену, а непосредственно в костный мозг (гребень подвздошной кости) реципиента. Такой способ обеспечивает скорейшее приживление, более быстрое восстановление тромбоцитов и менее тяжелую острую БТПХ.
Показана возможность ex vivo экспансии стволовых клеток. Тем самым в биотехнологическом инкубаторе можно многократно увеличить количество необходимых стволовых клеток. Предметом научных исследований в этом аспекте является выбор состава «цитокинового коктейля» питательной среды.
Также в регенеративной медицине можно использовать иные, «негемопоэтические» клетки пуповинной крови: кровь, эндотелий пуповины, Вартонов Студень, плаценту. Сейчас начато интенсивное изучение биологических особенностей этих клеток.
Таким образом выделено три направления консервирования стволовых клеток пуповинной крови:
Аутотрансфузии в неонатологии
На высоком уровне, заданном именитыми зарубежными коллегами, оказалось выступление руководителя отделения гравитационной хирургии крови Научного центра акушерства, гинекологии и перинатологии имени академика В.И.Кулакова профессора Татьяны Федоровой (Москва). Впервые были показаны возможности использования аутокомпонентов пуповинной крови в качестве альтернативы донорским трансфузиям в неонатологии.
Как и в медицине вообще, основная доктрина современной трансфузиологии в акушерстве, гинекологии и неонатологии:
— наиболее полное сохранение собственной крови пациента;
— минимальное использование компонентов донорской крови.
Интерес к применению пуповинной крови для аутотрансфузий обусловлен совершенствованием методик выхаживания глубоконедоношенных новорожденных и хирургической коррекции врожденных пороков развития в сочетании с потребностью в трансфузии донорских компонентов крови.
Для переливания крови в неонатологии характерны специфические проблемы:
— переливание крови взрослых доноров несет в себе существенный риск передачи гемотрансмиссивных заболеваний, иммунологической несовместимости, отличается по клеточному и биохимическому составу;
— методики аутодонорства практически не применимы у новорожденных.
— единственным видом аутологичного гемокомпонента в неонатологической практике является пуповинная кровь.
Возможны два подхода трансфузий пуповинной крови.
Во-первых, заготовка и аутотрансфузия цельной пуповинной крови. Этот способ применяется в основном для возмещения кровопотери при хирургической коррекции врожденных пороков развития. Существенный недостаток – невозможность длительного хранения из-за гемолиза и образования микросгустков
Второй подход – заготовка и аутотрансфузия эритроцитарной массы. Этот способ исследуется и применяется в ряде университетов Европы. Для его реализации необходимы специальные системы контейнеров для сбора, фракционирования и хранения пуповинной крови.
Аутологичную эритроцитную массу из пуповинной крови можно хранить в течение 21-42 дней.
Вопрос применения пуповинной аутоплазмы остается открытым, поскольку в каждом случае ее коагуляционный потенциал зависит от соотношения плазма / антикоагулянт.
В Научном центре акушерства, гинекологии и перинатологии имени академика В.И.Кулакова с 2006 г. разрабатываются методы заготовки, хранения и применения аутокомпонентов пуповинной крови.
Показания для заготовки:
— гестационный возраст при рождении 28-37 недель;
— наличие внутриутробно диагностированных пороков развития, требующих хирургической коррекции, независимо от срока гестации при рождении;
— острая гипоксия при рождении, независимо от срока гестации при рождении;
— вероятность рождения ребенка с редкой группой крови, затрудняющей подбор донора;
— отказ родителей от трансфузии новорожденному донорских компонентов крови.
Противопоказания для заготовки:
— наличие у матери инфекций: ВИЧ, гепатиты В и С, сифилиса;
— наличие у матери острого инфекционно-воспалительного или септического процесса любой локализации;
— хорионамнионит (по данным УЗИ);
— наличие гемолитической болезни у плода любой степени тяжести (конфликт по резус-фактору или АВО);
— пороки плода, несовместимые с жизнью.
Получено 56 образцов пуповинной крови с использованием системы контейнеров для сбора, фракционирования и хранения пуповинной крови с 21 мл антикоагулянта СРD. Кровь разделена на эритроцитную массу и плазму.
Объем образцов цельной крови – 77,6 ± 30,7 мл (от 36 до 200 мл).
Эритроциты хранили при +4 ºС в течение 21 суток.
Разработаны методики клинического применения аутоэритромассы для терапии анемии у новорожденных. Определены показания к аутотрансфузии.
В первые сутки жизни – концентрация гемоглобина менее 130 г/л.
Начиная со вторых суток жизни:
— концентрация гемоглобина менее 100 г/л в сочетании с тяжелыми дыхательными и гемодинамическими нарушениями;
— концентрация гемоглобина менее 80 г/л – при наличии клинических признаков анемии;
— восполнение кровопотери и коррекция анемии после оперативных вмешательств.
Аутологичные эритроциты перелиты 18 новорожденным для лечения анемии при тяжелой сочетанной патологии и/или недоношенности (29-34 недели гестации); 38 новорожденным для восполнения кровопотери и коррекции анемии в послеоперационном периоде.
Во всех случаях аутотрансфузии оказалось достаточно для купирования анемии и восстановления нормальных гемоконцентрационных показателей без дополнительных донорских трансфузий.
Ни в одном из 56 случаев посттрансфузионных реакций и осложнений не отмечено.
Трансфузия донорских эритроцитов в группе сравнения приводила к меньшему приросту гемоглобина, нежели переливание аналогичной дозы эритроцитов пуповинной крови.
Таким образом, наряду с совершенствованием традиционных технологий получения и применения компонентов крови вектором развития трансфузионной медицины становится применение клеточных технологий.
Евгений Жибурт
заведующий кафедрой трансфузиологии Института усовершенствования врачей, профессор.
 Служба крови
Служба крови