Рассеянный склероз 2 типа что это
Стадии рассеянного склероза
Рассеянный склероз (РС) — это сложное заболевание, поражающее центральную нервную систему. Симптомы РС возникают в результате того, что иммунная система организма по ошибке начинает атаковать нервные волокна, а точнее — белковую оболочку вокруг них [1]. Повреждения влияют на передачу сигналов по нервам, которые должны идти от головного и спинного мозга к различным частям организма. Поскольку РС может влиять на множество различных функций организма, каждый пациент испытывает симптомы немного по-разному [2].
Существует четыре основных типа РС, которые отличаются по характеру течения и прогрессирования [3]. Изучение каждого из этих типов болезни позволяет совершенствовать методы диагностики и лечения. Давайте разберемся, какие типы и стадии РС существуют.
Клинически изолированный синдром (КИС)
КИС — первый и единственный клинический эпизод нарушения неврологических функций, вызванный повреждением одного или нескольких отделов центральной нервной системы (ЦНС), длящийся свыше 24 часов, при этом имеющиеся данные клиники и МРТ-картины не удовлетворяют критериям диагностики РС [4]. Для того чтобы в точности определить, есть ли у человека РС, необходимо обратиться к врачу. Для диагностики врач может назначить МРТ, чтобы найти активные повреждения нервов или их следы. Раннее лечение КИС может помочь отсрочить начало заболевания.
Рецидивирующе-ремиттирующий РС (РРРС)
У большинства людей развивается именно этот тип РС [3]. В жизни пациента с РРРС будут возникать периоды улучшения и ухудшения симптомов. После каждого обострения может наблюдаться достаточно длительный период, в течение которого симптомы улучшатся или могут вовсе исчезнуть до следующего рецидива. Однако в некоторых случаях симптомы становятся постоянными, а во время ремиссий состояние человека только немного улучшается. Выраженность симптомов может варьировать в зависимости от степени и места повреждения нерва. Из-за этого варьирует и время ремиссии.
Первично-прогрессирующий РС (ППРС)
ППРС встречается реже, чем РРРС. Национальный институт неврологических расстройств и инсульта заявляет, что этот тип РС встречается чаще всего после 40 лет с одинаковой частотой среди женщин и мужчин [5]. У людей с ППРС симптомы постепенно ухудшаются с течением времени без периодов восстановления или ремиссии.
Вторично-прогрессирующий РС (ВПРС)
ВПРС начинается с РРРС, характеризуется постепенным нарастанием тяжести неврологического дефицита (инвалидизации), возникающим после периода ремиттирующего РС, при этом могут сохраняться типичные обострения заболевания. Затем прогрессирование идет неуклонно, без четких признаков обострений [5].
Классификация активности болезни
Врачи классифицируют РС также по активности заболевания [4]. Активность — это любое обострение и выявление новых очагов. Итак, РС может быть:
Выделяют и особые формы РС [4]: злокачественный РС, быстропрогрессирующий РС и высокоактивный РС. При злокачественном РС течение заболевания быстрое и без ремиссий, однако такая форма РС относительно редка. Быстропрогрессирующий РС можно диагностировать при двух или более обострениях в течение года. Для того чтобы установить эту форму РС, такие обострения должны вести к ухудшению состояния пациента и его постепенной инвалидизации. Высокоактивный РС также диагностируется при двух или более обострениях в течение года, однако они не ведут к значительной инвалидизации человека.
Стадии заболевания
По стадиям РС разделяют на периоды [4]:
К сожалению, навсегда излечиться от РС на данный момент нельзя. Однако с помощью современных лекарств можно отсрочить прогрессирование заболевания и значительно улучшить качество жизни человека. Поэтому так важно вовремя начать лечение и придерживаться его.
Рассеянный склероз
Рисунок 1. МР-томограмма мозга, показывающая более плотные участки белого вещества, типичные для рассеянного склероза Морфологически рассеянный склероз (РС) характеризуется многочисленными очагами демиелинизации в головном и спинном мозге
 |
| Рисунок 1. МР-томограмма мозга, показывающая более плотные участки белого вещества, типичные для рассеянного склероза |
Морфологически рассеянный склероз (РС) характеризуется многочисленными очагами демиелинизации в головном и спинном мозге, которые отличаются от нормальной нервной ткани цветом и консистенцией. Микроскопически это картина периаксиальной демиелинизации нервных волокон. Происходит разрастание микроглии соединительной ткани, формируются глиозные рубцы, замещающие погибшую ткань. Так образуется неактивная бляшка РС, плотная на ощупь, имеющая сероватый оттенок.
Несмотря на многолетние исследования, причина возникновения РС до сих пор не выяснена. Условно исследование этиологических факторов можно разделить на две группы.
К внешним этиологическим факторам относится также инфекционный фактор экзогенной интоксикации.
Клиника РС
В многообразии клинических проявлений РС можно выделить две группы симптомов.
Первая группа включает наиболее распространенные классические симптомы, которые являются непосредственным проявлением поражения проводящих путей мозга. Сюда же входят симптомокомплексы, отражающие особенности клинических проявлений многоочагового демиелинизирующего процесса. Ко второй группе относятся редкие клинические проявления заболевания.
Типичные клинические симптомы
Симптомы поражения пирамидного пути. Это наиболее частое поражение при РС, оно составляет 85-97%. В зависимости от локализации очага возникают геми- или парапарезы, реже монопарезы. Наиболее часто страдают нижние конечности, реже верхние; они вовлекаются позднее. Клинически проявляются патологические пирамидные рефлексы, повышение надкостничных, сухожильных рефлексов, снижение или полное отсутствие брюшных рефлексов. Последний симптом — это тонкое, раннее проявление заинтересованности поражения пирамидного пути.
Центральные парезы и параличи сопровождаются изменениями мышечного тонуса — как спастикой, так и гипотонией, дистонией. Одной из проблем для больных РС представляется повышение тонуса по спастическому типу. Как правило, оно наблюдается у больных с нижними парапарезами.
| Рассеянный склероз — демиелинизирующее заболевание, которое характеризуется признаками многоочагового поражения нервной системы. Впервые был описан Шарко в 1968 году. Высокая значимость проблемы определяется его значительной распространенностью, а также тем, что заболевают преимущественно лица молодого возраста |
Симптомы поражения мозжечка. Встречаются в 62-87% случаев. Больные жалуются на нарушение походки и равновесия. Клинически проявляются нарушениями координации и снижением мышечной силы. Часто встречается динамическая и стратегическая атаксия, дисметрия, асинергия, интенционное дрожание, скандированная речь, мегалография. Характерно пароксизмальное нарастание атаксии до невозможности ходить.
Симптомы поражения черепных нервов. Наблюдаются в 36-81% случаев. Очаги демиелинизации зачастую образовываются во внутримозговых частях нервов, поэтому могут отмечаться симптомы как центрального, так и периферического поражения двигательных черепных нервов, чаще III, V, VI, VII пары нервов. Наиболее частым клиническим симптомом поражения ствола мозга являются глазодвигательные нарушения, которые вызывают двоение.
Характерен симптом дискоординированного движения глазных яблок, недоведение глазных яблок в стороны, иногда наблюдается легкий птоз. Редко встречаются изменения зрачковых реакций. Одним из основных проявлений РС является нистагм как следствие поражения верхних отделов ствола.
Симптомы нарушения чувствительности. Встречаются у 56-92% пациентов. Один из наиболее частых симптомов РС — изменение глубокой и поверхностной чувствительности. Чаще на ранних стадиях отмечается небольшое расстройство болевой чувствительности, дизестезия в дистальных отделах конечностей. Особенностью нарушений чувствительности является то, что больные не могут четко их описать и часто предъявляют жалобы на онемение и жжение в конечностях.
Симптомы зрительных нарушений. Встречаются в 36-52% случаев. К зрительным нарушениям относится снижение остроты зрения, а также изменение полей зрения. Часто ретробульбарный неврит является первым симптомом заболевания. При офтальмологическом исследовании выявляются центральные скотомы, сужение полей зрения, преходящее снижение остроты зрения.
Симптомы нарушения функции тазовых органов. Наблюдаются в 26-53% случаев. Это один из первых и наиболее часто встречающихся симптомов при РС. Наиболее рано проявляются нарушения мочеиспускания по центральному типу, могут быть как учащения, так и задержка мочи, а также императивные позывы. На более поздних стадиях это, как правило, недержание мочи. У мужчин может быть снижение потенции, связанное с повреждением спинного мозга очагом демиелинизации.
Нейропсихологические симптомы. Имеют место в 65-95% случаев. Они могут включать в себя нарушение памяти, остроты мышления и всевозможные нарушения эмоционального характера. Особое внимание заслуживает депрессия с состояниями апатии и тревоги. Часто при РС отмечается эйфория, сочетаемая со снижением интеллекта. У женщин отмечаются истерические реакции, что является причиной несоответствия жалоб больной и объективной неврологической симптоматики.
Редкие клинические проявления
РС в детском возрасте
Возрастные границы РС в настоящее время подвергаются пересмотру. Встречаются сообщения о развитии заболевания как в пожилом, так и в старческом возрасте. Но более актуальна проблема заболевания в детском возрасте.
Описаны случаи развития РС в двухлетнем возрасте, а в материалах НИИ неврологии АМН отмечено самое раннее начало заболевания в возрасте 11-15 лет. Диагностика РС в детском возрасте еще более затруднительна из-за многообразия синдромологических вариантов и типов течения.
Современные методы диагностики РС
Полиморфизм РС сильно затрудняет раннюю диагностику. Число и диапазон ошибок остаются значительными. Важнейшие критерии диагностики:
Для обследования пациентов с подозрением на РС определен оптимальный диагностический алгоритм:
Патологические изменения при МРТ наиболее часто локализуются в перивентикулярной области. Редко очаги демиелинизации видны в стволе и мозжечке. Отчетливой связи между числом очагов демиелинизации и тяжестью заболевания не наблюдается.
Дифференциальный диагноз РС
В начальных стадиях РС следует дифференцировать с ВСД, невротическими расстройствами, синдромом Меньера, ретробульбарным невритом, опухолью головного и спинного мозга, мозжечка, рассеянным энцефаломиелитом, дегенеративными заболеваниями нервной системы. Спинальные формы РС могут проявляться аналогично опухолям спинного мозга. Но симптоматика РС в начальных стадиях характеризуется меньшей выраженностью парезов, чувствительных и тазовых расстройств. От болезни Штрюмпеля РС отличается наличием признаков поражения других отделов нервной системы.
Варианты течения и прогноз
Течение РС носит хронический характер. В большинстве клиник приняты следующие термины для обозначения периодов заболевания.
Если заболевают люди старше 40 лет, при этом болезнь носит ремитирующий характер с первой ремиссией не менее года и длительностью первого обострения не более трех месяцев, то можно говорить о благоприятном процессе заболевания. Все остальные случаи считаются неблагоприятными.
Лечение РС
Лечение РС складывается из мероприятий, направленных на борьбу с демиелинизацией ЦНС, и симптоматической терапии. К методам, направленным против демиелинизации, относят лечение обострений и хронически прогрессирующего заболевания. Некоторые виды терапии способны уменьшать частоту и выраженность рецидивов. Поскольку ни один из известных способов не вызывает ремиелинизацию, то главной задачей является замедление или стабилизация нарастания неврологического дефекта.
Препаратом выбора при лечении РС остаются кортикостероиды и препараты АКТГ. Полагают, что их назначение особенно показано во время острых эпизодов, частых рецидивов.
Эти средства призваны ограничить воспалительный процесс и степень разрушения миелина.
Одним из методов лечения РС является плазмоферез, обычно в сочетании с гормонотерапией. Наблюдается положительный эффект при лечении бетафероном. Он эффективен в основном при ремитирующей форме РС. Его назначают для уменьшения частоты обострений, а также для снижения скорости прогрессирования патологического процесса. Это говорит о том, что бетаферон не излечивает полностью, а лишь приостанавливает прогредиентное развитие заболевания.
Что касается эффективности биологических препаратов, то судить об этом трудно, так как нет объективных лабораторных маркеров для оценки активности демиелинизирующего процесса.
К симптоматической терапии РС относится лечение спастичности и флексорных спазмов. В этих случаях применяют миорелаксанты.
В период ремиссии назначается общеукрепляющая, ноотропная, сосудистая терапия, поощряется физическая нагрузка.
В целях профилактики больные должны избегать инъекций, интоксикации, переутомления, не рекомендуется смена климата, противопоказана гиперинсоляция. Вопрос о беременности и родах обсуждаем, хотя чаще в литературе встречаются данные об обострении заболевания в этот период.
Клинический случай
 |
| Рисунок 2. Компьютерная томограмма головного мозга: выявлены характерные для рассеянного склероза изменения |
Женщина, 32 года, предъявляла жалобы на преходящую слабость в левой руке и ноге в течение года. Этот симптом почти полностью исчез за два месяца до госпитализации, но за последнюю неделю перед госпитализацией левая нога настолько ослабла, что больная часто спотыкалась при ходьбе. В течение последних трех месяцев отмечалось периодическое недержание мочи. В возрасте 18 лет имел место эпизод диплопии, которая спонтанно регрессировала.
Неврологическое обследование выявило бледность височной половины диска левого зрительного нерва, слабость в левой руке при пожатии, повышение рефлексов на левых конечностях, отсутствие поверхностных брюшных рефлексов с обеих сторон, симптом Бабинского слева. Наблюдалась гемиплегическая походка. Миелография и исследование спинномозговой жидкости не выявили патологических изменений. Выявлены характерные изменения на КТ (рис. 2)
Таким образом, у больной был диагностирован рассеянный склероз.
Рассеянный склероз
Рассеянный склероз (РС) — хроническое воспалительное, демиелинизирующее и нейродегенеративное заболевание центральной нервной системы (ЦНС). Оно является гетерогенным, иммуноопосредованным и обусловленным воздействием комплекса генетических и окружающих факторов.
Наибольшую распространенность РС отмечают в западных странах — 1 случай на 400 человек при соотношении мужчин и женщин 1 : 3. Средний возраст дебюта заболевания колеблется при рецидивирующе-ремиттирующей форме между 20 и 35 годами, тогда как средний возраст начала первично-прогрессирующей формы — 40 лет (однако у 10 % пациентов отмечается манифестация в детском или юношеском возрасте). Общая продолжительность жизни у больных РС снижена в среднем на 7–14 лет относительно остальной популяции.
Формы РС
На данный момент принято считать, что прогрессирование заболевания при РРРС происходит ступенчато, от рецидива к рецидиву, однако исследователи предлагают вовсе перестать обозначать эту форму в рамках РС, ввиду наличия прогрессирования вне зависимости от рецидивов среди подавляющего числа пациентов [1].
Злокачественные типы РС
Патогенез РС
Ключевым аспектом патогенеза являются фокальные бляшки (повреждения) — зоны демиелинизации, обычно располагающиеся вокруг посткапиллярных венул и сопровождающиеся нарушением целостности гематоэнцефалического барьера (ГЭБ).
Поражение белого вещества
Ранние фазы РС (КИС и РРРС) характеризуются наличием активных очагов демиелинизации. Эти очаги обусловлены тяжелой лимфоцитарной инфильтрацией (в основном CD8+ T-лимфоцитами, CD20+ B-лимфоцитами и в меньшей степени CD4+ Т-лимфоцитами), активированной микроглией (фагоцитирующей миелиновый «мусор» по периферии очага), макрофагами и крупными, иногда многоядерными, реактивными астроцитами. Наличие таких поражений не характерно для первично и вторично прогрессирующих форм, что предполагает меньшую выраженность атак у пациентов. Для данных форм свойственно наличие неактивных или малоактивных очагов. Они имеют отчетливую границу, меньшее клеточное представительство, видимую демиелинизацию, сниженное количество аксонов, астроглиоз, активированную микроглию (без макрофагов) только на периферии бляшек и меньшую плотность лимфоцитов. Однако в 57 % случаев у пациентов с ПП и ВП формами РС встречаются как активные, так и неактивные очаги поражения, при этом активные очаги коррелируют с тяжестью заболевания.
Другие типы бляшек включают в себя хронически активные и медленно распространяющиеся очаги поражений. Хронически активные чаще встречаются среди пациентов с длительным течением заболевания и при ВПРС. Для них свойственно наличие макрофагов по краям очага с меньшим их количеством в центре поражения. Медленно распространяющиеся поражения выявляются у пациентов с ВПРС. Они демонстрируют медленно прогрессирующую демиелинизацию и аксональную дегенерацию, характеризуясь неактивным центром демиелинизации, активированной микроглией по краям очага, поврежденными аксонами и макрофагами, содержащими миелиновые «мусор».
Нормальное встречающееся белое вещество
Вдобавок к фокальным поражениям макроскопически нормальное белое вещество (МНБВ, или NAWM — normal-appearing white matter) при РС часто демонстрирует диффузное воспаление и нейро-аксональные нарушения. Аномалии в МНБВ определяются у пациентов с РРРС, но гораздо более выражены у пациентов с прогрессирующими формами. Они включают в себя снижение плотности волокон, обусловленное аксональной дегенерацией и демиелинизацией; лимфоцитарную и макрофагальную инфильтрацию, диффузно активированную микроглию и глиоз. Первоначально МНБВ относилось к вторично обусловленным проявлениям аксонального поражения внутри очагов, однако эти распространенные нарушения слабо коррелирует с количеством, размерами, локализацией и выраженностью фокальных поражений белого вещества головного и спинного мозга, что наводит на мысль о независимости этих явлений.
Поражения серого вещества
Среди пациентов с РС наблюдается обширная корковая демиелинизация в переднем мозге и мозжечке, обычно на ранних стадиях заболевания (в т. ч. и при КИС) и с куда большей выраженностью среди пациентов с прогрессирующими формами; в исключительных случаях вовлекается более 60 % коры. Поражения могут наблюдаться в базальных ядрах, а также в спинном мозге, где демиелинизация серого вещества куда более обширна, нежели белого. Механизмы, лежащие в основе дифференциации демиелинизации белого и серого вещества еще до конца не изучены, однако разница может зависеть от наличия продемиелинизирующих растворимых факторов в цереброспинальной жидкости (ЦСЖ).
Корковые очаги в преобладающем количестве наблюдаются в бороздах и на поверхности щелей коры, а расположение их часто связано с локализацией воспалительных инфильтратов мягкой мозговой оболочки. Само формирование поражений, вероятно, обусловлено провоспалительными медиаторами, секретирующимися из менингеальной оболочки. В отличие от очагов в белом веществе, корковые поражения демонстрируют меньшую проницаемость ГЭБ, выраженность отека, воспалительную активность микроглии и макрофагов, а также более существенную ремиелинизацию. В очагах можно увидеть рассеченные нейриты, апоптоз нейронов, потерю нейро-аксональных связей, глиальных клеток. Кроме того, вне очага поражения коры обнаруживается схожее с МНБВ серое вещество — также макроскопически нормальное, — внутри которого происходит процесс потери синапсов.
В зависимости от локализации в сером веществе принято идентифицировать следующие типы поражения:
Ремиелинизация
При РС может наблюдаться ремиелинизация очагов, что, как предполагается, является морфологическим субстратом клинически заметного восстановления после обострения. Очаги ремиелинизации, так называемые «теневые бляшки», характеризуются полным или частичным восстановлением миелина, четко ограничиваясь от МНБВ. Ремиелинизация имеет гетерогенную выраженность и происходит в границах самой бляшки, чаще встречаясь в очагах серого вещества (90 %) и реже — белого (40–50 %). Встречаемость ремиелинизации и ее характер зависит от возраста пациента, продолжительности заболевания, локализации очага и наличия клеток-предшественников олигодендроцитов и целостности аксонов.
Патофизиология иммунной агрессии
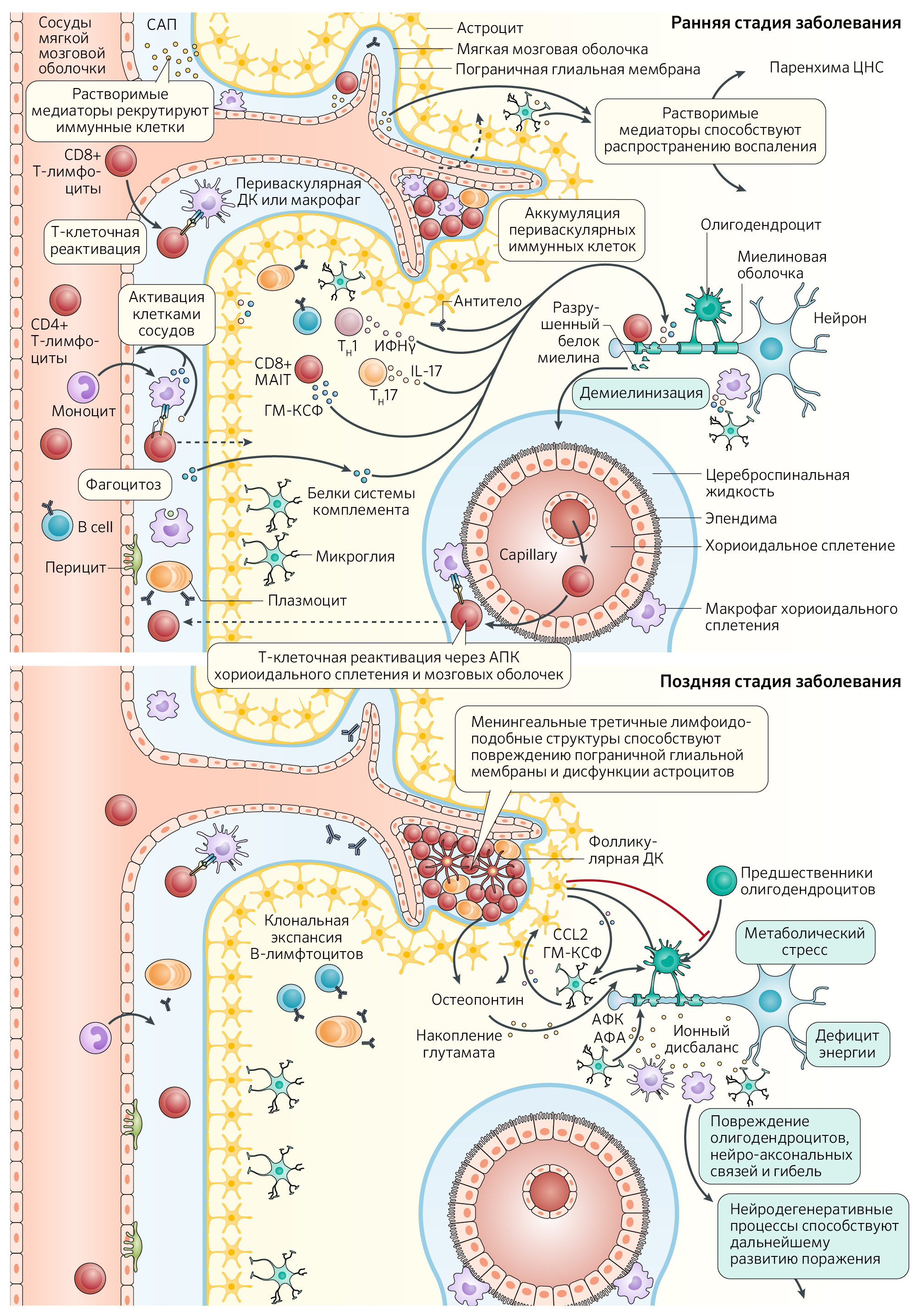
В механизмы аутоиммунного поражения вовлечены как резидентные клетки ЦНС (микроглия и астроциты), так и периферические Т- и B-лимфоциты и миелоидные клетки. Совместная их деятельность обусловливает секрецию огромного количества провоспалительных и нейротоксичных веществ, приводя к демиелинизации, нейродегенерации и нейровоспалению (рис. 1).
Т-клеточное вовлечение. Изначально предполагалось, что именно Т-клеточная агрессия вносит основной вклад в развитие РС. Наиболее известные данные собраны на основе экспериментов, проводившихся путем гиперактивации Т-клеточного иммунитета для развития у животных экспериментального аутоиммунного энцефалита (ЭАЭ). Его развитие было обусловлено активацией провоспалительных ЦНС-специфичных эффекторных Т-клеток (включая CD4+ и CD8+), которые проникали в паренхиму ЦНС, где обеспечивали периваскулярную демиелинизацию и активацию глиальных клеток, повреждая нейро-аксональные связи. Одна из потенциальных причин развития РС — нарушение работы регуляторных Т-клеток (Трег), модулирующих работу эффекторных Т-лимфоцитов. Так были исследованы факторы, обусловливающие отсутствие нормальной работы регуляторных клеток, например, снижение экспрессии кластера дифференцировки FOXP3+. Кроме того, редуцированное количество или недостаточный противовоспалительный ответ для Трег, экспрессирующих CD46, CD39, γ-интерферон (ИФНγ), а также дефицит фолликулярных Tрег клеток в крови у пациентов с РС, рассматриваются как способствующие нарушению функции эффекторных T-клеток.
Т-хелперы 17 типа (Тх17) — один из самых широко изученных типов Т-клеток, оказывающий непосредственное влияние на, возможно, активацию и экзацербацию аутоиммунного процесса. Предполагается, что именно Тх17 и CD8+ эффекторные клетки ответственны за прицельную бомбардировку олигодендроцитов и нейронов (точные механизмы прямой аутоагрессии неизвестны, но мы обсудим их позже), вовлекая в это дело еще и макрофагов. Другие эффекторные клетки, такие как Т-хелперы 1 типа (Тх1, CD4+), секретирующие ИФНγ, провоспалительные ИЛ, ФНОα и гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), также играют не последнюю роль. Точный прикладной механизм ГМ-КСФ в развитии РС не ясен, однако известна его способность активировать миелоидные клетки и CD8+ инвариантные T-клетки, связанные со слизистыми (MAIT), что было продемонстрировано на модели ЭАЭ.
Для активации Т-клеток в рамках РС необходима презентация антигена со стороны антигенпрезентирующих клеток (АПК), таких как B-лимфоциты и миелоидных клеток (макрофагов, дендритных клеток, микроглии) на периферии и в ЦНС. Тем не менее еще до конца не изучены антигены, активация через которые обусловливает развитие РС. На экспериментальной модели ЭАЭ фокус внимания был сосредоточен на основном белке миелина (ОБМ), протеолипидном белке миелина (или, липофилине) и миелиновом олигодендроцитарном гликопротеиде (МОГ). Разумеется, множество исследований поддерживают теорию о повышении частоты активации, поддержании провоспалительного ответа, вследствие экзацербации Т-лимфоцитов через представление этих антигенов. Однако наличие аутореактивных на эти антигены Т- и B-клеток может встречаться и у здоровых людей, никак не проявляющих симптомы заболевания. Это приводит к выводу о недостаточности одних аутореактивных клеток для развития заболевания. Кроме миелиновых белков к развитию РС у детей может подталкивать наличие активации Т-клеточного иммунитета к белкам, вовлеченным в формирование нейро-аксональных связей. Также в качестве одного из звеньев патогенеза рассматривается молекулярная мимикрия в случае инфицирования вирусом Эпштейна-Барр (ВЭБ). Эпидемиологические исследования демонстрируют ассоциацию между инфицированием ВЭБ, риском развития РС и временем манифестации заболевания. Молекулы ВЭБ схожи с ОБМ; иммунный ответ CD4+ и CD8+ клеток на вирусные частицы теоретически может привести к развитию РС. Более того, вирус способен индуцировать провоспалительную активацию B-клеток на периферии, что в свою очередь формирует аутореактивные Т-клетки, провоцируя рецидивы РС. Кроме того, иммунная аутоактивация может быть следствием поражения ЦНС, повышения проницаемости ГЭБ и прохождения через него белков миелина, с дальнейшим распознаванием неизвестных ранее для периферических иммунных клеток молекул как антигенов.
Один из главных вопросов — как аномально активированный иммунитет действует на иммунологически привилегированный орган? На данный момент обсуждается нарушение проницаемости ГЭБ, облегчающее миграцию провоспалительных клеток в паренхиму ЦНС. Не так давно был описан дренаж ликвора через глубокие лимфатические узлы шеи (опосредованно) [3]. Таким образом, иммунная система может постоянно контактировать с ЦНС, осуществляя нормальную надзорную функцию, тогда как при РС данный контакт обусловливает развитие аутоагрессии.
После активации на периферии иммунные клетки рекрутируются через молекулы клеточной адгезии и хемокины, осуществляя таксис, инфильтрацию и поражение ЦНС. Основной вклад в продвижение Т-клеток в ЦНС на моделе ЭАЭ и среди пациентов с РС вносят хемокиновые рецепторы (CCR6, CCR2, CCR5) и молекулы клеточной адгезии — гликопротеин MUC18 (он же MCAM, меланома-клеточная молекула адгезии), нинджурин-1 (NINJ1). Вдобавок, молекулы, подобные контактным адгезивным (junctional adhesion molecule-like, JAML) играют роль в миграции CD8+ T-клеток и моноцитов через эндотелии сосудов мозга, тогда как MUC18 используется CD8+ и CD4+ с целью инфильтрации в ЦНС, а нинджурин-1 селективно опосредует миграцию миелоидных клеток в ЦНС. Стоит отметить, что кроме как через посткапиллярные венулы (которые являются классической локализацией очагов периваскулярного поражения при РС), иммунные клетки могут мигрировать через субарахноидальное пространство и гематоликворный барьер (его образуют эпителиальные клетки хориоидального сплетения и паутинная мембрана).
Биологический механизм развития ремиссии РС еще до конца не изучен, но маловероятно, что это просто пассивное снижение деятельности провоспалительных эффекторных клеток и подавление иммунного ответа через активацию Трег. Кроме того, ремиссия, вероятно, будет включать вызванную активацией провоспалительных цитокинов гибель клеток. Длительно действующий провоспалительный клеточный фенотип может иметь повышенную регуляцию поверхностных молекул, что делает их более восприимчивыми к уничтожению другими иммунными клетками. Действительно, несколько исследований показали, что апоптоз иммунных клеток (таких как миелин-реактивные Т-клетки) может оказывать положительное влияние, подавляя нейровоспаление.
B-клеточная экспансия. Практическим доказательством вовлечения B-клеточного иммунитета в патогенез заболевания служит высокая эффективности анти-B-клеточной терапии (анти-CD20+ моноклональных антител). У здоровых людей обнаруживается довольно-таки малая концентрация антител в ЦНС, по сравнению с таковой в периферической крови (отношение 1 : 300). У пациентов с РС обратная ситуация — антитела, выявляемые в ЦСЖ и называемые олигоклональными группами/бандами (ОКБ, или же олигоклональные полосы, т. к. они формируют полосы при электрофорезе) и встречаются более чем в 90 % случаев. Однако применение анти-B-клеточной терапии никак не коррелирует с уровнем антител в ЦСЖ, что ставит перед исследователями (и интересующимися) следующий вопрос: какой механизм, кроме как иммуноглобулин-опосредованного, может обусловливать B-клеточную аутоагрессию при РС?
B-клетки больных РС обладают провоспалительным профилем и способны производить в избыточном количестве ИЛ-6, ГМ-КСФ, ФНОα, лимфотоксин-α и меньшие объемы противовоспалительных цитокинов, например, ИЛ-10. Подкласс B-клеток, CD27+ ГМ-КСФ-секретирующие B-клетки памяти, синтезируют аномальные уровни ИЛ-6 и ФНОα и вовсе не экспрессируют ИЛ-10. В свою очередь, это способствует дифференцировке наивных T-клеток в Тх1 и Тх17, ответственных за рецидивы заболевания.
Как подмечено из описанного патогенеза, а также из подбора рекомендованных препаратов при терапии РС, основной упор делается на теорию вовлеченности в патогенез в основном приобретенного иммунитета.
Но и тут не все так просто. Недавнее исследование выявило менделевское наследование среди семей, члены которых страдали РС [4]. Так, среди 132 пациентов из 34 семей было выявлено 12 мутантных генов, после чего было проведено исследование с участием 2502 больных РС, у которых также выявили эти РС-ассоциированные варианты. Мутации в этих генах чрезвычайно редки и имеют низкую пенетрантность. Однако наличие хотя бы одного РС-ассоциированного варианта гарантированно приведет к развитию РС в течение жизни.
Эти гены ответственны за фибринолиз, систему комплемента, сборку инфламмасом, Wnt-сигналинг, ядерные рецепторные комплексы, работу ионных каналов, функции которых способствуют формированию связей между иммунологическими путями.
То есть эти гены в основном вовлечены в регуляцию врожденного иммунитета.
Считается, что иммунные клетки проникают в ЦНС при РС через кровеносные сосуды ГЭБ, субарахноидальное пространство (САП) и сосудистое сплетение (пунктирные стрелки). При рецидивах РС, которые более заметны на ранних стадиях заболевания, лежащие в основе патогенеза механизмы запускают инфильтрацию клеток врожденной и адаптивной иммунной системы (таких как CD4+, CD8+ T- и B-лимфоциты и миелоидные клетки) в паренхиму ЦНС с периваскулярным распределением вокруг посткапиллярных венул ГЭБ. Предполагается, что эти иммунные клетки вместе с активированной микроглией и астроцитами способствуют повреждению олигодендроцитов, демиелинизации и нейро-аксональному повреждению посредством межклеточных механизмов и секреции растворимых факторов. На более поздних стадиях заболевания эпизодическая инфильтрация иммунных клеток в ЦНС снижается. Механизмы, способствующие продолжающемуся повреждению тканей (и клиническим проявлениям прогрессирующего заболевания), включают нейродегенерацию с точки зрения нейро-аксонального повреждения; поражения астроцитов и олигодендроцитов вследствие острого или хронического окислительного стресса. Вероятно, они вызваны активацией врожденных и адаптивных иммунных клеток, митохондриальной дисфункцией, накоплением внеклеточного железа, потерей трофической поддержки миелина, гипоксии, нарушения гомеостаза глутамата и провоспалительной активности с возможным вовлечением цитотоксических факторов и активацией комплемента. Хроническое воспаление может быть опосредовано инфильтрацией менингеальных иммунных клеток (например, В-лимфоцитов), которые могут образовывать лимфоидно-подобные структуры, и резидентными врожденными иммунными клетками ЦНС (микроглией). Например, CC-хемокиновый лиганд 2 (CCL2) и гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), продуцируемые астроцитами, могут стимулировать рекрутирование и активацию микроглии; сами же астроциты могут ограничивать ремиелинизацию, предотвращая дифференцировку клеток-предшественников олигодендроцитов в зрелые олигодендроциты.
АПК, антигенпрезентирующая клетка; ДК, дендритная клетка; MAIT, инвариантные T-клетки, связанные со слизистыми; NO, оксид азота; АФА, активные формы азота; АФК, активные формы кислорода; TH1, Тх1, T-хелпер 1 типа; TH17, Тх17, T-хелпер 17 типа.
Клиническая картина
Клинические характеристики РС представлены в таблице 1.
Таблица 1. Клинические характеристики рассеянного склероза.
Оптический неврит — обычно односторонний (афферентный зрачковый дефект, чувство размытости перед глазами или центральная скотома, снижение остроты зрения, дисхроматопсия, возможен отек диска зрительного нерва); реже двусторонняя
симптоматика.
Поражение ствола мозга и/или мозжечка (межъядерная офтальмоплегия, разнонаправленный нистагм, парез VI ЧН, атаксия, вертиго, нарушение чувствительности или парестезии лица, дисметрия, дизартрия, дисфагия, нарушение слуха, тошнота; реже альтернирующие синдромы).
Миелит (чувствительные нарушения с характерными симптомами Лермитта и феноменом Утхоффа; моторные нарушения в виде пирамидной симптоматики; поражение тазовых органов; реже поперечный миелит и синдром Броун-Секара).
Синдром поражения полушария ГМ: гемисиндром; гораздо реже энцефалопатия, эпилепсия, корковая слепота, головные боли, интракраниальная гипертензия.
Диагностика
Золотым стандартом в диагностике РС является МРТ, с помощью которой можно рассмотреть диссеминацию в пространстве Т2-гиперинтенсивных очагов поражения. Диссеминацию во времени подскажет накопление контраста гадолиния. С целью однозначного определения диагноза ниже приведены критерии МакДональда от 2017 года, основанные на МРТ визуализации. Кроме того, в ЦСЖ у 88 % пациентов выявляются олигоклональные IgG.
Критерии МакДональда от 2017 года
Постановка диагноза РС может быть выполнена при соблюдении любых из пяти нижеперечисленных групп критериев, в зависимости от количества клинических атак:
II группа:
III группа:
IV группа:
V группа:
Первично прогрессирующий рассеянный склероз (ППРС):
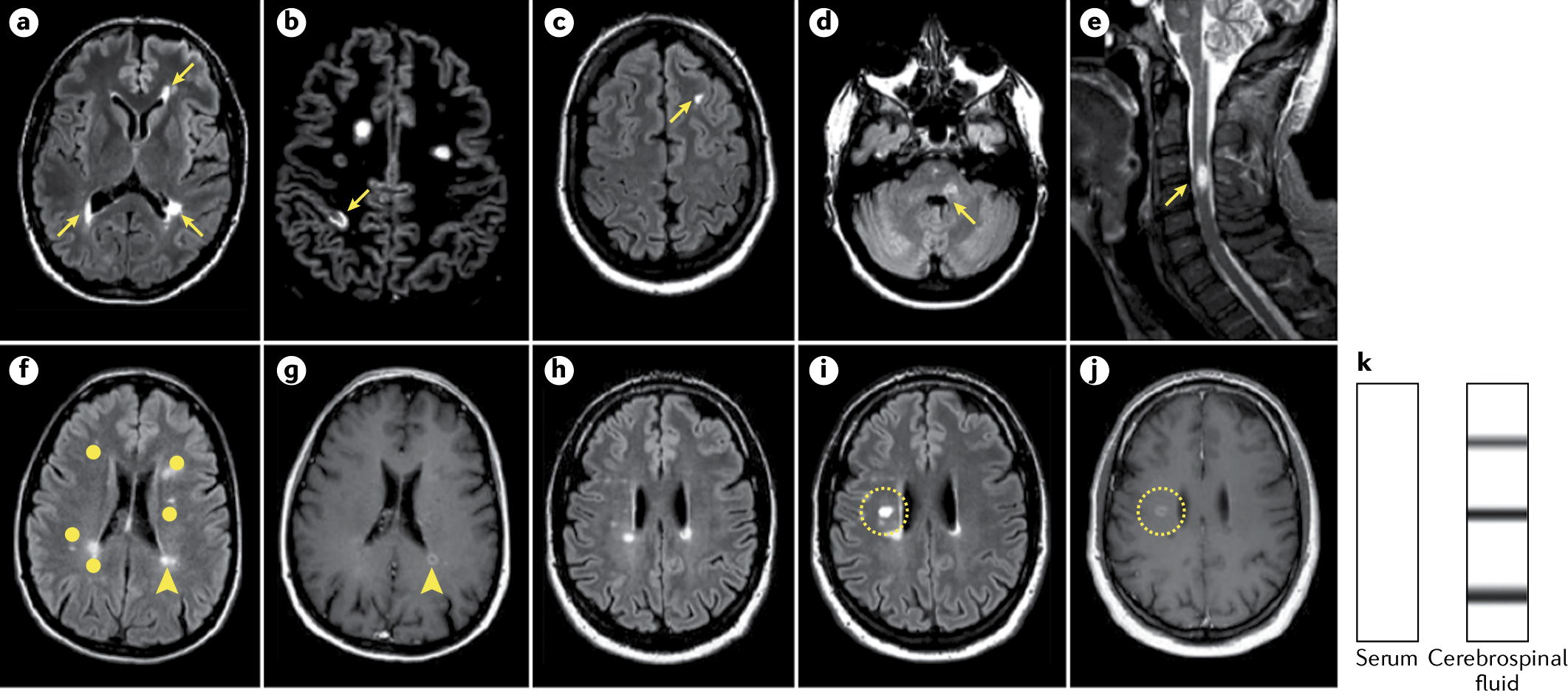
Диссеминация в пространстве (рис. 2) требует наличия ≥ 1 T2-гиперинтенсивного очагов (≥ 3 мм по длинной оси), симптоматических и/или асимптоматических, типичных для РС, в ≥ 2 из следующих локализаций:
Диссеминация во времени (рис. 2) может быть установлена по одному из критериев:
Области поражения:
• Перивентрикулярная область — поражение белого вещества больших полушарий, прилегающего к боковым желудочкам мозга.
• Кортикальная область — поражение коры головного мозга.
• Юкстакортикальная область — поражение белого вещества головного мозга, примыкающего к коре и не отделенного от него белым веществом (здоровым).
• Инфратенториальная область — поражение ствола мозга, мозжечка или его ножек.
f –j | Диссеминация во времени (ДВВ) может быть продемонстрирована непосредственным усилением сигнала (f) либо отсутствием усиления при использовании гадолиния (g) в любое время, несмотря на наличие/отсутствие симптоматики поражения; новым T2-гиперинтенсивным и/или накапливающим гадолиний сигналом с ссылкой на предыдущее сканирование (h–j), независимо от даты предыдущей МРТ или наличия в ЦСЖ специфичных олигоклональных антител, которые не выявляются в сыворотке (k). Несколько очагов повреждения белого вещества визуализируется на Т2-скане в режиме подавления жидкости (FLAIR) (f); один очаг с накоплением гадолиния (стрелка) (g), тогда как большинство остальных не демонстрируют усиление сигнала (точки).
По сравнению с предыдущим результатом МРТ в режиме Т2-FLAIR (h), визуализируются новые Т2-гиперинтенсивные (i) и захватывающие контраст (j) (обведено кружком) очаги.
О возможностях выявления новых очагов на МРТ
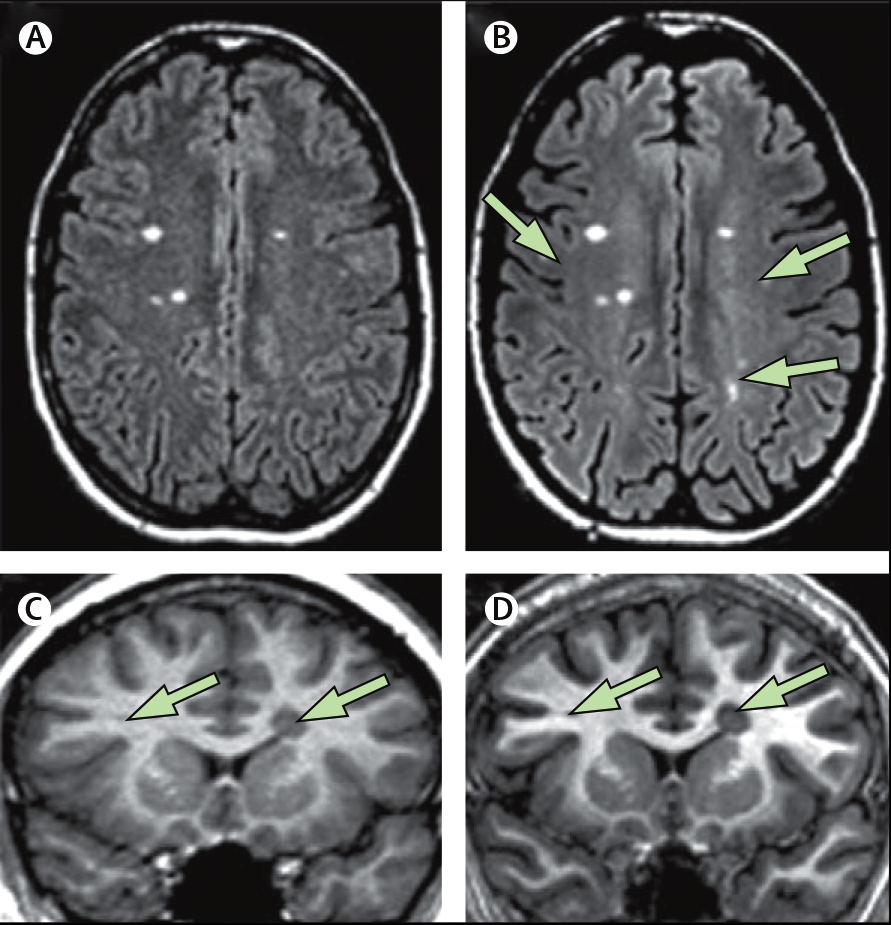
Постановка диагноза, эффективность терапии, а также прогнозирования тяжелой инвалидизации пациентов требует точного подсчета количества очагов. Однако при малой разрешающей способности аппарата МРТ существует вероятность пропустить поражения. В некоторых случаях, рекомендуется проводить МРТ исследования с мощностью более 1,5 Тесла (Т) [5].
Ниже на рис. 3 можно наблюдать разницу в разрешении 1,5 Т (A, C) и 3 Т (B, D) МРТ.
Дифференциальная диагностика
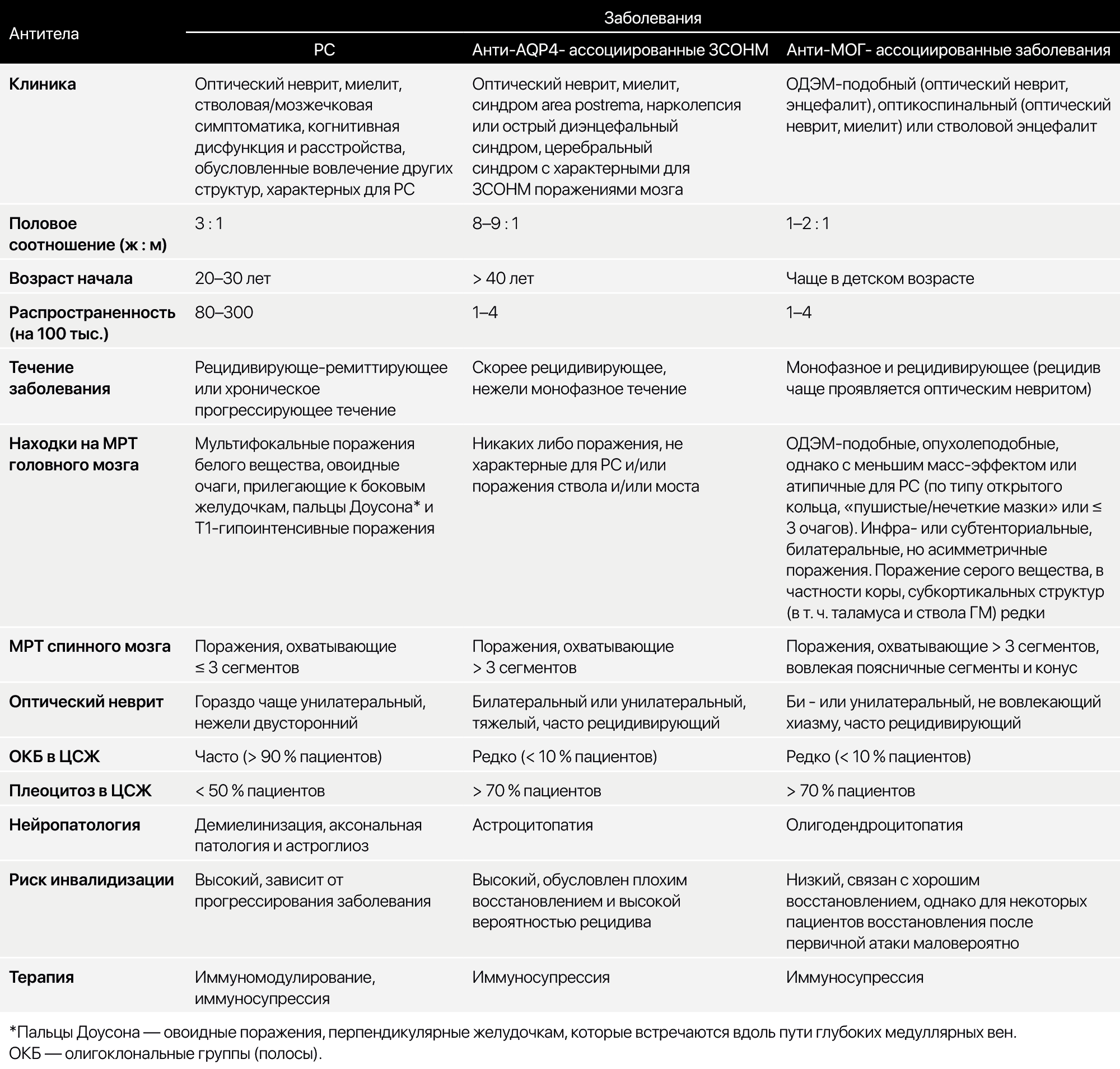
1. Острый/мультифазный диссеминированный энцефаломиелит (ОДЭМ/МДЭМ) — постинфекционный или поствакционный изолированный аутоиммунный синдром, поражающий ЦНС и приводящий к диффузной демиелинизации. Обычно имеет острое начало с вовлечением моторной, сенсорной, мозжечковой функций, черепных нервов и развитием энцефалопатии. Нарушение сознание прогрессирует до комы с вероятностью летального исхода 30 %. Может наблюдаться фульминантный геморрагический компонент, так называемый острый геморрагический энцефаломиелит или лейкоэнцефалит Уэстона Херта. Дополнительные характеристики можете подчеркнуть из табл. 2. Заболевание обычно хорошо отвечает на стероиды.
2. Заболевания спектра оптиконевромиелита (ЗСОНМ) — аутоиммунное заболевание, обычно ассоциированное с присутствием антител к аквапорину-4 (AQP-4), проявляющееся различными неврологическими поражениями, не попадающими под критерии РС. Кроме того, выделяют серонегативные оптиконевромиелиты. Узнать больше можно в табл. 2 и статье https://medach.pro/post/1864.
3. Сывороточные антитела IgG к миелин-олигодендроглиальному гликопротеиду (МОГ), которые когда-то считались маркерами активности РС, теперь признаны для обозначения отдельного заболевания, называемого МОГ-энцефаломиелитом (МОГ-ЭМ). Заболевание характеризуется множеством проявлений, связанных с демиелинизацией ЦНС, включая рецидивирующий и двусторонний неврит зрительного нерва, поперечный миелит, энцефалит ствола мозга и ОДЭМ.
На МРТ визуализируются продольные, обширные поражения спинного мозга (≥ 3 смежных сегментов), поражения конуса спинного мозга и объемные поражения зрительного нерва (например, более половины прехиазмальной длины зрительного нерва). Поражения спинного мозга обычно демонстрируют H-образную картину Т2-гиперинтенсивности, ограниченную серым веществом на аксиальном срезе МРТ, без усиления сигнала при контрастировании. В отличие от РС, овоидные или круглые поражения на МРТ головного мозга, прилегающие к боковым желудочкам, или радиально ориентированные поражения в сагиттальной плоскости (поражения типа пальцев Доусона*), как правило, не обнаруживаются при МОГ-ЭМ. Большинство пациентов с МОГ-ЭМ не имеют ОКБ в ЦСЖ, в отличие от РС [7].
Таблица 2. Сравнение РС, ЗСОНМ, ассоциированного с антителами к AQP-4, и анти-МОГ-ассоциированных заболевания.
4. Первичные опухолевые заболевания (например, астроцитомы, эпендимомы) и метастазы в спинной или головной мозг должны быть исключены при диагностике заболевания. В этом вам помогут различные методы визуализации, онкомаркеры, и т. д. [8].
5. Мигрень. При гемиплегической мигрени МРТ-визуализация может продемонстрировать отек и гиперинтенсивность коры, Т2-гиперинтенсивность семиовального центра, аналогичную изменению глубокого белого вещества при болезни мелких сосудов. Проявления приступов гемиплегической мигрени могут варьироваться от временного гемипареза до рецидивирующей комы, длительного гемипареза, эпилепсии или когнитивных расстройств. Нарушения на МРТ можно обнаружить только в отдельных случаях и в зависимости от сроков проведения томографии (если, конечно, мигрень не осложнится инсультом) [9, 10].
6. Хроническое лимфоцитарное воспаление с поражением моста, контрастным усилением периваскулярных пространств в мосту по данным МРТ, отвечающее на терапию глюкокортикостероидными препаратами (CLIPPERS-синдром) — энцефаломиелит с преимущественным поражением моста. Синдром имеет ремиттирующе-рецидивирующее течение и включает в себя развитие диплопии, атаксии, дизартрии и лицевой парестезии. Нейровизуализация выявляет точечные, криволинейные, накапливающие гадолиний очаги, покрывающие мост, с вариабельным вовлечением продолговатого мозга, средних мозговых ножек, мозжечка, среднего мозга и спинного мозга. Гистологическое исследование поражений ствола и мозжечка демонстрирует Т-лимфоцитарную инфильтрацию в периваскулярное белое вещество. CLIPPERS-синдром хорошо отвечает на длительную глюкокортикоидную терапию.
7. Саркоидоз. Поражение ЦНС происходит в 4–10 % случаев у пациентов с саркоидозом. На МРТ с контрастированием визуализируется усиление сигнала от очагов поражения.
Клиника нейросаркоидоза зависит от вовлеченных структур: краниальных нервов, мягких и твердых оболочек головного и спинного мозга, паренхимы мозга, гипоталамо-нейрогипофизарной системы и периферических нервов. Достоверная диагностика состоит в биопсии и определении неказеозных гранулем (в отсутствии другого гранулематозного заболевания). Учитывая частоту вовлечения легочной системы (80–90 %), предпочтительней проводить биопсию медиастинальных лимфатических узлов. Выявить системное поражение других органов достоверно позволит позитронно-эмиссионная томография (ПЭТ) с контрастированием 18-фтордезоксиглюкозой [11].
8. Церебральная аутосомно-доминантная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией (CADASIL) является заболеванием, поражающим мелкие и средние сосуды головного мозга. Оно характеризуется периодическими головными болями, инсультами или транзиторными ишемическими атаками. Этиология — мутация в гене Notch3. При выявлении на МРТ множества очагов поражения белого вещества у молодых людей с CADASIL, может быть ошибочно диагностирован РС. Классические локализации гиперинтенсивных поражений CADASIL на МРТ включают лобные, височные доли и глубокое серое вещество (базальные ганглии и таламус). Семейный анамнез головных болей и инсультов должен подтолкнуть диагностический поиск к CADASIL.
9. Поперечный миелит — термин, обычно обозначающий идиопатическую воспалительную миелопатию. МРТ демонстрирует отек и гиперинтенсивный сигнал, часто на более протяженном участке, нежели при РС. Также в рамках дифференциального диагноза необходимо исключить другие вероятные причины развития воспалительного миелита, например ЗСОНМ, при которых характерно вовлечение в патологию от 3 и более сегментов спинного мозга.
10. Инфаркт спинного мозга наиболее часто возникает на уровне грудных сегментов. Вовлечение структур спинного мозга соответствует анатомическому расположению пораженных артерий. Данная характеристика и острое начало разграничивает эту патологию от типичного миелита при РС (но не от атипичного). В таком случае МР-ангиография, сбор анамнеза с уточнением наличия факторов риска и сопутствующей патологии, повышающей возможность сосудистых катастроф, будет смещать вероятность в сторону развития инфаркта.
11. Васкулит, редко возникающий в рамках изолированного васкулита ЦНС. Анамнез, лабораторные исследования (воспалительные маркеры и антитела), исследование на мультисистемность поражения помогут подтвердить/исключить диагноз.
12. Лучевой миелит. Обычно возникает только у пациентов, которые получили дозы выше 4000 сГр. Однако комбинация с химиотерапией может оказывать синергический эффект (т. е. может приводить к радиосенсибилизации, вызывая миелит при меньших дозах облучения). Латентный период составляет 1–3 года. Визуализация может продемонстрировать поражения периферической нервной системы.
13. Артериовенозная фистула. Обычно выявляется среди мужчин старше 50 лет с анамнезом боли в спине, чаще в грудопоясничной области. На КТ-ангиографии визуализируется расширенная извитая серпантинная вена в полости позвоночного канала.
14. Прогрессирующий мультифокальный лейкоэнцефалит (ПМЛ) — инфекционное заболевание, обусловленное активацией оппортунистического вируса JC (John Cunningham), в результате выраженного иммунодефицита. К ПИТРС (препаратам, изменяющим течение РС), способным индуцировать этот процесс, относятся натализумаб, диметилфумарат, финголимод (остальные в меньшей степени). Первый с большей вероятностью приведет к экзацербации вируса и развертыванию заболевания. ПМЛ характеризуется наличием множества дискретных очагов, которые затем сливаются в крупные. Вовлекается любая структура головного мозга, но чаще всего прослеживается поражение коры теменно-затылочной и лобной долей. МР-картина может предшествовать клинике, что позволяет заподозрить развитие заболевания до его клинической манифестации [12].
15. Подострая сочетанная дегенерация спинного мозга — неврологическое проявление группы заболеваний, обусловленных дефицитом витамина B12. Проявляется поражением спинного мозга (нарушение глубокой чувствительности, атаксия, позже — нарушение моторных функций), периферических нервов (нарушение поверхностной чувствительности, затем развитие периферических парезов) и, реже, головного мозга (психиатрическая симптоматика, зрительные нарушения — скотомы, атрофия диска зрительного нерва, нистагм, битемпоральная гемианопсия в результате поражения хиазмы) [13].
16. Нейроборрелиоз — неврологическая манифестация болезни Лайма. Проявляется краниальной нейропатией (чаще вовлекается VII ЧН), головной болью, менингитом. При отсутствии лечения, через несколько месяцев — год появляется новая неврологическая симптоматика в виде подострой энцефалопатии, хронического прогрессирующего энцефаломиелита, поздней аксональной нейропатии и радикулонейропатии.
Боррелиозный энцефаломиелит — редкое, но тяжелое проявление болезни Лайма. Прогрессирует ступенчато, между рецидивами наблюдается небольшое улучшение состояния. Основные клинические проявления: гемипарез, атаксия, припадки, когнитивные нарушения, тазовые расстройства, потеря слуха.
Боррелиозный миелит встречается у 50 % больных поздним боррелиозом. Проявляется прогрессирующим парапарезом или квадриплегией в целом [14].
Кроме того, инфекционные заболевания, которые также могут имитировать РС, перечислены в табл. 3 [15].
17. Ишемическая болезнь мелких сосудов, затрагивающая в основном головной мозг и вызванная заболеваниями-факторами сосудистого риска, такими как диабет, артериальная гипертензия, гиперлипидемия, пожилой возраст.
Таблица 3. Часто встречаемая анатомическая локализация инфекционных поражений ЦНС при нейровизуализации.
Ведение и терапия
Факторы риска развития РС:
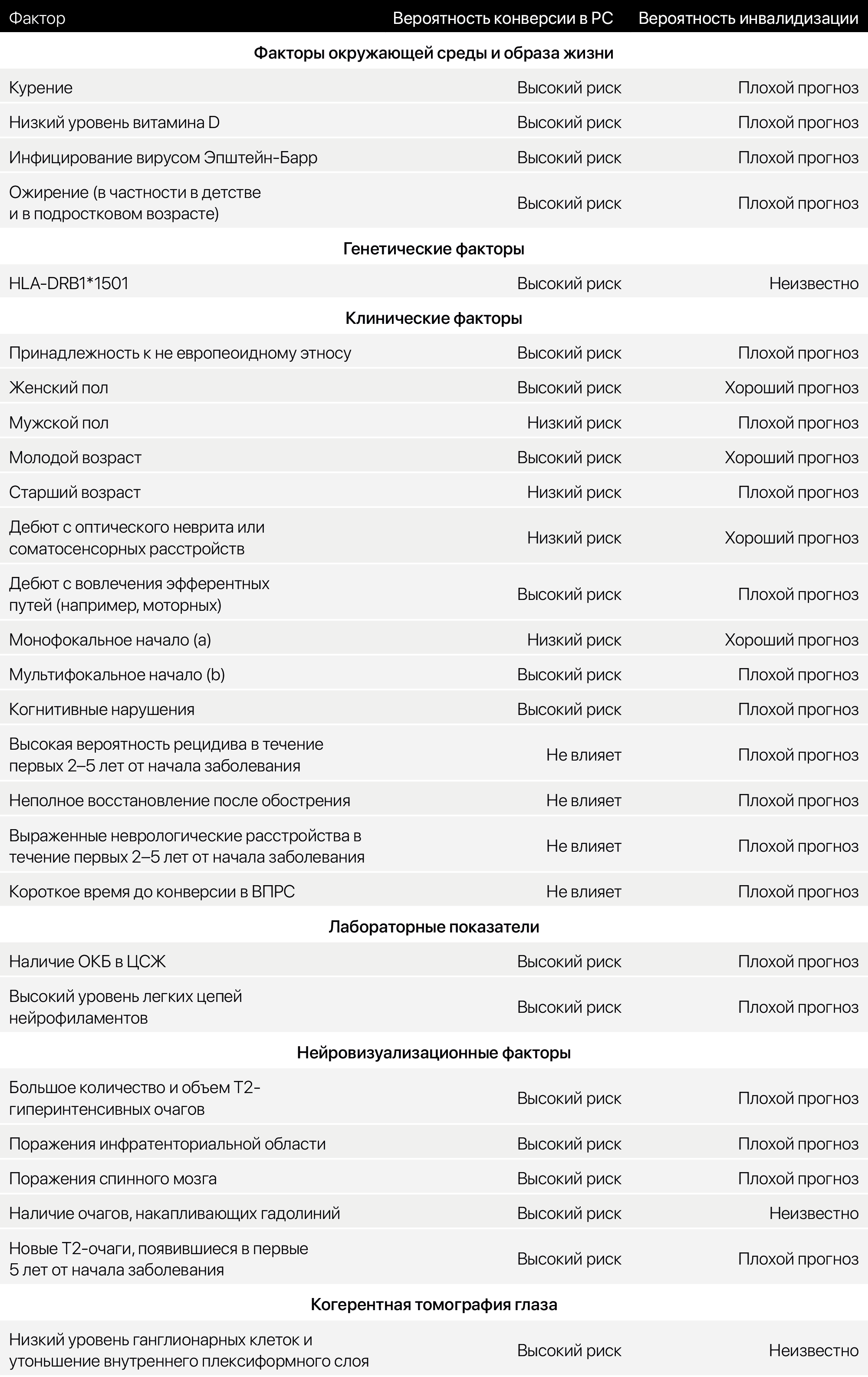
С факторами, обусловливающими конверсию КИС в РС, можно ознакомится в табл.4
Таблица 4. Факторы, обусловливающие конверсию КИС в РС, и вероятность инвалидизации.
Терапия
В остром периоде — глюкокортикоиды (пульс-терапия метилпреднизолоном).
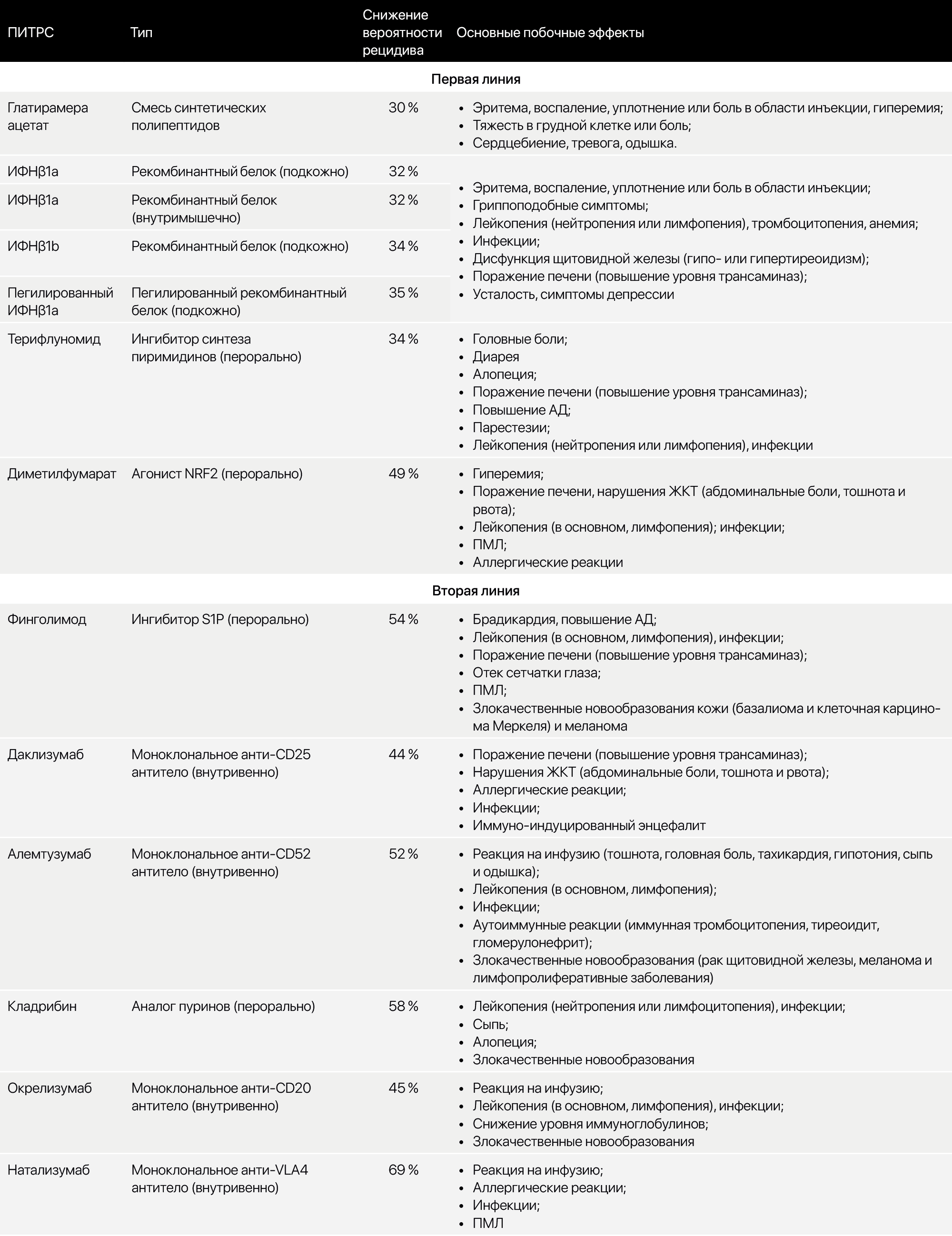
В дальнейшем с целью предотвращения повторных эпизодов либо замедления прогрессирования заболевания — ПИТРС (препараты, изменяющие течение рассеянного склероза) (табл. 5). Самые ранние представители — глатирамера ацетат (смесь синтетических полипептидов) и интерферон β1 (ИФНβ1). Затем к ним присоединились терифлуномид (ингибитор синтеза пиримидинов), диметилфумарат (агонист NRF2). Препараты второй линии: финголимод (ингибитор S1P), даклизумаб (моноклональные антитела к CD25), алемтузумаб (моноклональные антитела к CD52), кладрибин (аналог пуринов), окрелизумаб (моноклональные антитела к CD20), натализумаб (моноклональные антитела к VLA4).
Кроме того, используется симптоматическая терапия, направленная на смягчение (при их наличии) выраженности нейропатических болей, дисфункции мочеполовой системы, когнитивных расстройств, эпилептических припадков, сопутствующих психических расстройств.
Таблица 5. Некоторые из используемых ПИТРС.
Оценка тяжести больного, его состояния, выраженности обострения, эффективности лечения основывается на шкалах EDSS (Expanded Disability Status Scale — расширенная шкала оценки степени инвалидизации) и шкалах повреждения функциональных системы (пирамидной, мозжечковой, стволовой, мочевого пузыря и т.д.) по Дж. Куртцке. Кроме того, на основании шкалы EDSS производится оценка степени инвалидизации пациента.
Посмотреть эти шкалы Вы можете в российских рекомендациях от 2018 года [16]. Однако некоторые исследователи утверждают о необходимости пересмотра шкалы EDSS, ввиду вероятности попадания в одну группу инвалидности людей с вариабельностью нарушения систем более 20 % [17].
Градация обострений, терапия и подбор препаратов, изменяющих течение РС, неплохо описаны в российских рекомендациях, однако симптоматическая терапия оставляет желать лучшего.
Обратимся к симптоматической терапии чуть позже. Давайте пока рассмотрим ПИТРС. Стоит добавить к уже отмеченным в табл. 5 следующие препараты. Митоксантрон (который используется при агрессивном течении заболевания, при ВПРС), ритуксимаб (как и окрелизумаб, является моноклональным антителом к CD20+ B-клеткам, но не зарегистрирован как препарат от РС, хотя им все равно пользуются), терифлуномид (ингибитор дигидрооротат дегидрогеназы синтеза пиримидинов — снижает уровень лимфоцитов в ЦНС, используется при рецидивирующих формах), а также недавно одобренный FDA препарат офтанумаб (тоже как и окрелизумаб является моноклональным антителом к CD20+ клеткам), распространяющийся в виде инъекционной ручки, что позволяет проводить введение препарата в домашних условиях) [18].
На данный момент принято использовать метод эскалации терапии: начинать с первой линии, затем при развитии толерантности, тяжелых побочных явлений и/или непереносимости, либо агрессивного течения заболевания — переходят на вторую линию препаратов.
Однако исследования, проводимые с применением новых препаратов из второй линии (натализумаб, алемтузумаб), продемонстрировали, что применение этих препаратов при РРРС со старта обеспечивает лучшую переносимость и снижение тяжести инвалидизации в дальнейшем, ставя под сомнение необходимость использования препаратов первой линии (терифлуномида и финголимода) [19]. Раннее начало использования окрелизумаба, натализумаба, ритуксимаба, алемтузумаба, митоксантрона в перспективе от 2 до 10 лет также снижает тяжесть инвалидизации, по сравнению с использованием других ПИТРС [20].
Но существуют и противники данных (возможных) практических нововведений. Основными аргументами против раннего назначения новых препаратов вместо эскалации являются отсутствие крупных длительных исследований на большой когорте пациентов, при выборке пациентов с, вероятно, более тяжелыми формами РС, чем они встречаются в целом в популяции [21]. И конечно же — цена вопроса. Стоимость курса моноклональных антител гораздо выше, чем стоимость других ПИТРС.
Стоит все же рассматривать именно пациенто-ориентированную стратегию, направленную на выявление тех пациентов, которым назначение ПИТРС второго поколения с самого начала заболевания будет обоснована тяжестью течения и скоростью наступления выраженной инвалидизации.
Симптоматическая терапия необходима пациентам с РС с целью купирования спастичности, нарушения ходьбы, выраженной нейропатической и мышечно-скелетной боли, нарушения мочеиспускания и дефекации, когнитивных расстройств, депрессии и усталости.
Усталость. К сожалению, в РФ терапия этого состояния состоит из назначения разрешенных псевдо-препаратов, типа цитофлавина, мексидола, кортексина, глицина и т. д. Рекомендуется разве что два препарата, один из которых — амантадин (данных о котором много, а качество исследований страдает [22, 23]), другой — пирацетам (назван препаратом исключительно на фоне описанных до амантадина примеров). Исследования по пирацетаму имеются только в российских журналах и имеют малую выборку, да и исследованиями их можно назвать с натяжкой.
Кроме того, плацебо-контролируемое исследование «TRIUMPHANT», завершившееся в 2020 г., не продемонстрировало каких-либо преимуществ приема модафинила, амантадина и метилфенидата по сравнению с плацебо [24].
Помимо вышеперечисленных препаратов, рекомендуется прием витамина D, транскраниальная магнитная стимуляция мозга, физические упражнения, когнитивно-поведенческая терапия. Учитывая отсутствие других возможностей для терапии, рациональным считается использование (из данных препаратов) витамина D и амантадина.
Коррекция когнитивных нарушений. В рекомендациях указываются разве что центральные ингибиторы ацетилхолинэстеразы (АХЭ), но и у тех из прямых показаний — болезнь Альцгеймера и сосудистые деменции («с натяжкой», хотя бы из-за частого сопутствия этих патологий друг другу). Лично я не имею ничего против назначения этого препарата при отсутствии развития побочных явлений, однако систематические ревью и мета-анализы не демонстрируют улучшения когнитивных функций пациентов с РС, принимающих ингибиторы АХЭ [25].
Другие «препараты» являются бюрократической профанацией и необходимостью заполнить лист назначений. Из действительно действенных методов, способных улучшить когнитивные функции, стоит приглядеться к когнитивно-поведенческой терапии, а также терапии сопутствующей депрессии и нормализации социального взаимодействия.
Боль. Нейропатическая боль корректируется габапентиноидами (габапентин, прегабалин), трициклическими антидепрессантами, селективными ингибиторами обратного захвата серотонина и норадреналина (СИОЗСиН), реже СИОЗС (и в этом случае используются разве что сертралин и пароксетин, но никак не описанный в рекомендациях флуоксетин, который демонстрирует эффективность при терапии сопутствующей фибромиалгии, но не нейропатии). Назначение карбамазепина как препарата первой линии является рациональным скорее при невралгии тройничного нерва.
При среднетяжелой и тяжелой боли рекомендуется назначать опиоидные анальгетики (в т. ч. трамадол). Использование каннабиноидов в рамках терапии болевого синдрома разрешено в некоторых странах и американских штатах как третья линия борьбы с болью.
Спастика. Кроме описанных в рекомендациях препаратов (баклофен, тизанидин, ботулотоксин А и т. д.), западные коллеги предлагают использовать набиксимолс — препарат, выпускающийся в виде перорального спрея, демонстрирующий эффективность в терапии спастичности у пациентов именно с РС. Необходимо отметить из-за чего данный препарат не подлежит к использованию в РФ — содержание тетрагидроканнабинола. Препарат основан не на синтетических изомерах, а имеет натуральное происхождение.
Улучшение нейротрансмиссии и функции ходьбы демонстрирует препарат далфампридин. Будучи блокатором потенциал-зависимых калиевых каналов, он способствует нейротрансмиссии в демиелинизированных аксонах. Патент на производство данного препарата, принадлежащий Acorda Therapeutics уже закончился, в результате чего следует ожидать появления дженериков далфампридина и снижение его стоимости.
Тазовые расстройства. Нарушение мочеиспускания вносит большой вклад в нарушение качества жизни пациента, а также в появление осложнений в виде инфекций и почечной недостаточности. Кроме описанного в рекомендациях, предлагается использование самокатетеризации, инъекций ботулотоксина А в мочевой пузырь с использованием цистоскопа, а также пластические операции с целью облегчения опорожнения пузыря в тяжелых случаях.
Сон. Для улучшения качества и продолжительности жизни необходимо выявлять обструктивное апноэ сна и проводить соответствующую интервенцию (CPAP), а также диагностировать и купировать синдром беспокойных ног.
Пока еще неизвестно, является ли необходимым вводить применение статинов при выявлении РС целью дальнейшей профилактики ССЗ.
На данный момент проводятся исследования по инфицированию нематодами больных РС с иммунномодулирующей целью. Было проведено рандомизированное исследование, в рамках которого удалось добиться неплохих результатов: снижение вероятности развития рецидива заболевания на 51 % среди пациентов с ППРС. Больным подселяли не более 25 личинок на несколько лет, что обычно не приводило к выраженным негативным эффектам. Профилактировать передачу от человека к человеку не трудно — достаточно мыть руки [27].
Причиной успешного лечения данным методом предполагают увеличение количества Т-хелперов, которые привлекаются в ответ на воздействие эффекторных Т-лимфоцитов на паразитов. У экспериментальной группы наблюдалось увеличение CD4+ CD25 FOXP3+ Т-клеток относительно плацебо-группы.