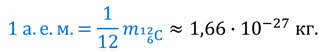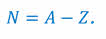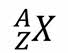Расскажите о составе атомного ядра что такое изотопы
Расскажите о составе атомного ядра что такое изотопы
Раздел ОГЭ по физике: 4.3. Состав атомного ядра. Изотопы.
Экспериментальное изучение строения атомного ядра осуществлял Резерфорд. Он облучал β-частицами атомы азота и других элементов.
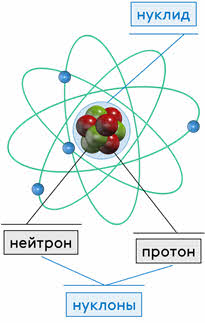
Ядро атома состоит из положительно заряженных протонов и не имеющих заряда нейтронов. Протоны и нейтроны называются нуклонами. Число нуклонов в ядре называется массовым числом.
Заряд ядра кратен элементарному электрическому заряду Q = Ze. Число Z называется зарядовым числом, оно совпадает с номером элемента в периодической системе элементов Менделеева. Число нейтронов N равно разности массового и зарядового чисел: N = A – Z.
То, что ядра химических элементов устойчивы, нельзя объяснить гравитационным взаимодействием нуклонов:
Ядро химического элемента обозначается как 
Например: в ядре атома лития 
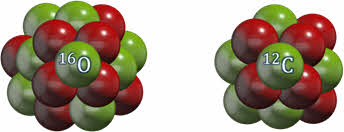
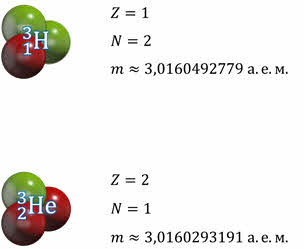
Ядра одного и того же химического элемента могут содержать разное число нейтронов. При этом они имеют одинаковое зарядовое число, но разное массовое число. Например, ядра 

Изотопы имеют одинаковые химические свойства, что обусловлено одинаковым электрическим зарядом ядра, но разные физические свойства.
Конспект урока «Состав атомного ядра. Изотопы».
Строение атома. Изотопы
В 1913 г. английский физик Г. Мозли установил, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Д. И. Менделеева.
Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов. Атом является электронейтральной частицей, поэтому число протонов равно числу электронов. Следовательно:
Например, элемент железо Fe имеет порядковый номер 26. Следовательно, заряд ядра атома железа равен +26, т. е. ядро содержит 26 протонов, а вокруг ядра движутся 26 электронов.
Элементарные частицы имеют следующие абсолютные и относительные массы:
Данные этой таблицы показывают, что масса протона, как и масса нейтрона, приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома.
Атомы одного элемента, которые имеют разные массовые числа, называются изотопами.
Атомы изотопов одного элемента имеют одинаковое число протонов (Z) и отличаются друг от друга числом нейтронов (N).
Изотопы обозначаются символами соответствующих элементов, слева от которых вверху записывают массовое число изотопа, а внизу — порядковый номер (заряд ядра атома) элемента. Например:
12 6C — изотоп углерода с массовым числом 12;
18 8О — изотоп кислорода с массовым числом 18.
Иногда в символах изотопов записывают только массовые числа ( 12 С, 18 О, 27 Al и т. д.)
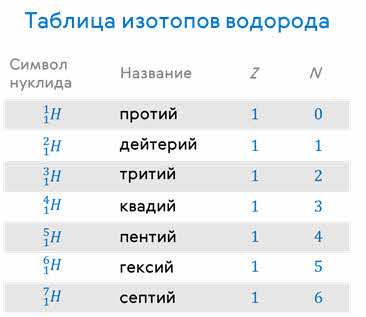
Элемент водород имеет три изотопа, каждый из которых имеет свое название:
В названиях изотопов других элементов указываются их массовые числа. Например: 12 6С — углерод-12; 35 17Cl — хлор-35 и т. д.
В природе различные элементы имеют разное число изотопов с разным процентным содержанием каждого из них.
Относительная атомная масса элемента Аr, которая приводится в периодической системе, — это средняя величина массовых чисел природных изотопов этого элемента с учетом процентного содержания каждого изотопа.
Например, в природе все атомы хлора представляют собой два вида изотопов: 35 Cl (процентное содержание 75,5%) и 37 Cl (24,5%). Относительная атомная масса хлора
Химические свойства всех изотопов одного элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы, а от заряда ядра.
Поэтому современная формулировка периодического закона читается так:
Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома, или порядкового номера элемента.
Формулировка периодического закона Д. И. Менделеевым и современная формулировка не противоречат друг другу, потому что для большинства элементов при увеличении заряда ядра относительная атомная масса тоже увеличивается. Существуют лишь немногие исключения из этого правила. Например, элемент № 18 аргон Ar имеет большую атомную массу, чем элемент № 19 калий K.
Скачать:
Скачать бесплатно реферат на тему:«Строение атома и атомного ядра» СТРОЕНИЕ-АТОМА-И-АТОМНОГО-ЯДРА.docx (247 Загрузок)
Рефераты по другим темам можно скачать здесь
Физика атомного ядра. Состав ядра.
Атомное ядро — это центральная часть атома, состоящая из протонов и нейтронов (которые вместе называются нуклонами).
Протон (от греч. protons — первый, символ p) — стабильная элементарная частица, ядро атома водорода.
Второй частицей, входящей в состав ядра, является нейтрон.
Нейтрон (от лат. neuter — ни тот, ви другой, символ n) — это элементарная частица, не имеющая заряда, т. е. нейтральная.
Нейтрон был открыт в 1932 г. учеником Э. Резерфорда Д. Чедвигом при бомбардировке бериллия α-частицами. Возникающее при этом излучение с большой проникающей способностью (преодолевало преграду из свинцовой пластины толщиной 10-20 см) усиливало свое действие при прохождении через парафиновую пластину (см. рисунок). Оценка энергии этих частиц по трекам в камере Вильсона, сделанная супругами Жолио-Кюри, и дополнительные наблюдения позволили исключить первоначальное предположение о том, что это γ-кванты. Большая проникающая способность новых частиц, названных нейтронами, объяснялась их электронейтральностью. Ведь заряженные частицы активно взаимодействуют с веществом и быстро теряют свою энергию. Существование нейтронов было предсказано Э. Резерфордом за 10 лет до опытов Д. Чедвига. При попадании α-частиц в ядра бериллия происходит следующая реакция:
Здесь 
15 мин. распадается на протон, электрон и нейтрино — частицу, лишенную массы покоя.
После открытия Дж. Чедвиком нейтрона в 1932 г. Д. Иваненко и В. Гейзенберг независимо друг от друга предложили протонно-нейтронную (нуклонную) модель ядра. Согласно этой модели, ядро состоит из протонов и нейтронов. Число протонов Z совпадает с порядковым номером элемента в таблице Д. И. Менделеева.
Заряд ядра Q определяется числом протонов Z, входящих в состав ядра, и кратен абсолютной величине заряда электрона e:
Число Z называется зарядовым числом ядра или атомным номером.
Массовым числом ядра А называется общее число нуклонов, т. е. протонов и нейтронов, содержащихся в нем. Число нейтронов в ядре обозначается буквой N. Таким образом, массовое число равно:
Нуклонам (протону и нейтрону) приписывается массовое число, равное единице, электрону — нулевое значение.
Представлению о составе ядра содействовало также открытие изотопов.
Изотопы (от греч. isos — равный, одинаковый и topoa — место) — это разновидности атомов одного и того же химического элемента, атомные ядра которых имеют одинаковое число протонов (Z) и различное число нейтронов (N).
Изотопами называются также ядра таких атомов. Изотопы являются нуклидами одного элемента. Нуклид (от лат. nucleus — ядро) — любое атомное ядро (соответственно атом) с заданными числами Z и N. Общее обозначение нуклидов имеет вид ……. где X — символ химического элемента, A = Z + N — массовое число.
Изотопы занимают одно и то же место в Периодической системе элементов, откуда и произошло их название. По своим ядерным свойствам (например, по способности вступать в ядерные реакции) изотопы, как правило, существенно отличаются. Химические (b почти в той же мере физические) свойства изотопов одинаковы. Это объясняется тем, что химические свойства элемента определяются зарядом ядра, поскольку именно он влияет на структуру электронной оболочки атома.
Исключением являются изотопы легких элементов. Изотопы водорода 1 Н — протий, 2 Н— дейтерий, 3 Н — тритий столь сильно отличаются по массе, что и их физические и химические свойства различны. Дейтерий стабилен (т.е. не радиоактивен) и входит в качестве небольшой примеси (1 : 4500) в обычный водород. При соединении дейтерия с кислородом образуется тяжелая вода. Она при нормальном атмосферном давлении кипит при 101,2 °С и замерзает при +3,8 ºС. Тритий β-радиоактивен с периодом полураспада около 12 лет.
У всех химических элементов имеются изотопы. У некоторых элементов имеются только нестабильные (радиоактивные) изотопы. Для всех элементов искусственно получены радиоактивные изотопы.
Изотопы урана. У элемента урана есть два изотопа — с массовыми числами 235 и 238. Изотоп 

Состав атомного ядра. Ядерные силы
Урок 48. Физика 9 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Состав атомного ядра. Ядерные силы»
Практически сразу после открытия нейтрона советским физиком Дмитрием Иваненко и немецким учёным Вернером Гейзенбергом была предложена протонно-нейтронная модель атомного ядра. Согласно ей, ядра всех химических элементов (за исключением водорода) состоят из двух видов частиц: протонов и нейтронов. Протоны и нейтроны называют нуклонами (от латинского «нуклеус» — ядро), а ядра атомов — нуклидами.
Общее число нуклонов в ядре называют массовым числом и обозначают буквой А. Оно ставится вверху перед буквенным обозначением химического элемента.
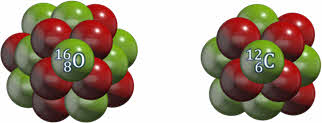
Например, массовое число кислорода равно 16, а углерода — 12.
Мы уже говорили о том, что массовое число принято выражать в атомных единицах массы (сокращённо, а. е. м.) и округлять до целых чисел. Напомним также, что атомную единицу массы выражают через массу атома углерода; она равна 1/12 части массы атома углерода:
Число протонов в ядре соответствует порядковому или атомному номеру элемента в таблице Менделеева и называется зарядовым числом, поскольку оно определяет заряд ядра. Обозначается зарядовое число буквой Z.
В наших примерах, зарядовое число кислорода равно восьми, а углерода — 6.
Как видно из приведённых примеров, зарядовое число ставится внизу перед буквенным обозначением элемента.
Напомним, что заряд протона положителен и равен элементарному электрическому заряду. Следовательно, зарядовое число численно равно заряду ядра, выраженному в элементарных электрических зарядах.
Так как атом в целом электрически нейтрален, то зарядовое число определяет одновременно и число электронов в атоме.
Число нейтронов в ядре обозначают большой буквой N. Нетрудно догадаться, что оно равно разнице между массовым и зарядовым числом:
Таким образом, ядро любого атома обозначается буквенным символом элемента. Вверху указывается значение его массового числа, а внизу — зарядового.
В общем случае любой химический элемент периодической таблицы Дмитрия Ивановича Менделеева можно представить в виде:
где под X подразумевается символ химического элемента.
Ещё раз уточним, каким образом определяется число протонов, электронов и нейтронов в ядре атома любого химического элемента. Во-первых, необходимо посмотреть в таблице Менделеева порядковый номер интересующего нас химического элемента. Таким образом мы найдём зарядовое число, то есть количество протонов и электронов в ядре. Затем, всё в той же таблице, необходимо посмотреть атомную массу этого элемента и округлить её до целых. Тем самым мы найдём массовое число, то есть общее количество нуклонов в ядре. И наконец, чтобы определить количество нейтронов в ядре атома, мы должны будем вычесть из массового числа зарядовое.
На основе новой, протонно-нейтронной модели строения атомных ядер, было дано объяснение многим экспериментальным фактам. Так, например, ещё в 1906—1907 годах учёными было выявлено, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. При этом атомы обладали одинаковыми химическими свойствами, а отделить их друг от друга было невозможно никакими химическими методами. Впервые, на существование таких атомов обратил внимание Фредерик Содди в 1910 году. Он предложил называть такие разновидности атомов одного и того же химического элемента изотопами (что по-гречески означает «равноместные»), так как по своим химическим свойствам они должны быть помещены в одну и ту же клетку таблицы Менделеева.
На основании многих экспериментов, было установлено, что изотопы одинаково вступают в химические реакции и образуют одинаковые соединения. Это говорило о том, что число электронов в электронных оболочках, а, значит, и заряд ядра у изотопов одинаковы. Следовательно, ядра изотопов различаются только числом нейтронов. Иными словами, химические свойства элементов определяются не атомной массой, а зарядовым числом ядра. Действительно, например, нуклиды водорода-три и гелия-три имеют близкие по величине атомные массы, но принципиально разные химические свойства.
Из всех известных на сегодняшний день изотопов (а они есть у всех химических элементов) только изотопы водорода имеют названия:
Протий является самым распространённым изотопом в природе, а его ядро содержит только один протон. Изотоп дейтерия (его ещё называют тяжёлой водой), содержит в своём ядре один протон и один нейтрон. Соответственно, у трития — один протон и два нейтрона. В настоящее время в лабораториях получены изотопы водорода и с большим числом нейтронов: тремя, четырьмя, пятью и даже шестью.
Следует отметить, что у разных атомов существует разное количество изотопов. Например, у урана их 26, но самыми распространёнными в природе являются два — это уран-235 (около 0,7 %), и уран-238 (чуть более 99 %). Вы, наверное, обратили внимание на то, что мы не называли зарядового числа изотопов урана. Дело в том, что обычно изотопы называют по их массовым числам, так как зарядовые числа у них одинаковые.
Отметим, что изотопы бывают устойчивые (или стабильные) и неустойчивые (то есть радиоактивные). Стабильные изотопы сохраняются сколь угодно долго.
А нестабильные изотопы со временем превращаются в другие химические элементы в результате радиоактивных превращений.
В настоящее время известно около 280 стабильных изотопов химических элементов и более 2 тыс. радиоактивных изотопов.
Как правило, природные элементы представляют собой смесь нескольких изотопов, поэтому возникает задача их разделения. Как мы уже знаем, магнитное поле искривляет траекторию движения заряженных частиц. На этом свойстве магнитного поля основано действие устройства, называемого масс-спектрографом, который используется для разделения изотопов по массовому числу.
В заключении отметим, что предложенная Иваненко и Гейзенбергом протонно-нейтронная модель строения ядра впоследствии полностью была подтверждена экспериментально. Однако оставался нерешённым ещё один вопрос: почему ядра атомов не распадаются на отдельные нуклоны? Действительно, ведь мы знаем, что ядра атомов являются весьма устойчивыми образованиями, хотя в их состав входят одинаково заряженные частицы — протоны. А поскольку размеры ядер очень малы, то между протонами должны существовать огромные силы электрического отталкивания — порядка 230 ньютонов, что для частиц с массой порядка 10 –27 степени килограмм является очень большой силой. Поэтому возникает вопрос: какое взаимодействие препятствует взаимному отталкиванию между одноимённо заряженными частицами?
Мы знаем, что, кроме электромагнитных сил, в природе существуют также гравитационные силы. Может быть, стабилизирующую роль в ядрах играет именно гравитационное взаимодействие между нуклонами?
Другой особенностью ядерных сил является то, что они очень быстро убывают с увеличением расстояния между ядерными частицами. Проще говоря, они действуют на расстояниях, сравнимыми с размерами самих ядер.
Расскажите о составе атомного ядра что такое изотопы
С помощью данного урока вы узнаете, из чего состоит атом, а также познакомитесь с историей появления и развития представлений о сложном строении атома. На уроке рассматриваются результаты некоторых физических опытов, которые позволили установить состав и строение атома.
I. Атом: термин и эволюция понятия
Идея о том, что все вещества состоят из мелких, невидимых частиц возникла у людей еще до нашей эры в Древней Индии и Древней Греции. Известный греческий философ Демокрит, будучи одним из первых материалистов, впервые ввел термин «атом» (от греч.atomos- неделимый). Последователь идей Демокрита, Эпикур (341-270 г. до н.э.) впервые высказал предположение об атомном весе.
Дальнейшее развитие атомизм, как теория, получил в философии и науке Средних веков и Нового времени. В середине XVII в. французский философ и физик Пьер Гассенди (1592—1655) заново пересказал учение Демокрита и Эпикура, дополнив его новым понятием «молекула» для обозначения различного сочетания атомов друг с другом.
Р. Бойль (1627-1691 г.г.) написал знаменитую книгу «Химик-скептик», в которой доказал нереальность «начал» Аристотеля и ввел представление о химических элементах как о веществах, не поддающихся дальнейшему разложению. Определив задачей химии изучение элементов и их соединений. Р. Бойль поставил ее на научную основу.
Далее атомистическая теория получила свое логическое развитие в работах Ломоносова, Лавуазье, Дальтона и оформилась в атомно-молекулярное учение.
II. Модель Дж. Томсона («сливовый пудинг» или «булочка с изюмом»). Открытие электрона
В своих опытах по отклонению катодных лучей в электрических и магнитных полях, Томсон убедительно показал, что эти лучи представляют собой поток заряженных частиц, а самое главное, ему удалось измерить удельный заряд (e/m) этих частиц. (Он оказался примерно в 2000 раз меньше удельного заряда иона водорода, известного из опытов по электролизу.) Томсон сразу же предположил, что электроны входят в состав атомов – откуда еще им было взяться? Дальнейшие работы ученых-физиков подтвердили это предположение. Таким образом, к концу 19 века электрон считался элементарной заряженной частицей, масса которой в 2000 раз меньше массы атома водорода.
После открытия электрона Томпсон предложил модель строения атома, которую обычно называют «сливовый пудинг» (или «пудинг с изюмом») или на русский манер «булочка с изюмом». Согласно Томпсону атом представляет собой положительно заряженную сферу, в которую вкраплены (как изюм в булочке) отрицательно заряженные электроны. Однако, эта модель была опровергнута опытом Резерфорда.
Так появилась одна из первых моделей строения атома, которую предложил английский физик Джозеф Томсон (Рис. 1). В соответствии с этой моделью, атом представляет собой шар, состоящий из положительно заряженного вещества с вкраплениями отрицательно заряженных электронов (наподобие изюма в бисквите).
Рис. 1. Модель строения атома, предложенная Дж. Томсоном
Особенность модели Томсона заключалась в предположении того, что положительный заряд «размыт» внутри атома и не «вылетает» из него, т. к. обладает значительно большей массой по сравнению с электронами.
Следующим удивительным экспериментальным фактом было открытие Беккерелем в 1896 г. явления радиоактивности. Было обнаружено, что атомы некоторых элементов самопроизвольно распадаются с образованием новых атомов, электронов и α-частиц. Также установили, что α-частицы имеют положительный заряд и относительно большую массу.
В 1911 г англ. учёный Э. Резерфорд доказал нa опыте, что в центре атома имеется положительно заряженное ядро.
С помощью α-частиц Эрнест Резерфорд и его ученики провели эксперимент, результаты которого опровергли модель строения атома Дж. Томсона. Англичанин Эрнест Резерфорд и его ученики поставили следующий эксперимент: направляли быстрый поток α-частиц на тонкую золотую фольгу. Оказалось, что большинство α-частиц проходит через фольгу беспрепятственно, небольшая часть отклоняется на различные углы, а примерно 1 на 10 000 частиц отскакивает в обратном направлении (Рис. 2).
Рис. 2. Схема опыта Э. Резерфорда
Результаты опыта противоречили модели Томсона. Частица с большой массой и положительным зарядом может отскочить назад, если только встретит в качестве препятствия большой положительный заряд, сконцентрированный в одном месте.
Положительный заряд, сконцентрированный в центре атома, Резерфорд назвал ядром и предложил свою модель строения атома: в центре атома находится положительно заряженное ядро, вокруг которого вращаются отрицательно заряженные электроны (Рис.3). При этом основная масса атома сосредоточена в ядре, масса электронов очень мала.
Суммарный заряд ядра и электронов должен быть равен нулю, т. к. атом в целом электронейтрален.
Модель Резерфорда напоминает Солнечную систему, поэтому ее назвали «планетарной».
Рис. 3. Планетарная модель атома, предложенная Резерфордом
III. Модель Бора (планетарная модель)
В 1913 Нильсом Бором была предложена модель строения атома, известная как «планетарная модель». По Бору электроны вращаются по орбитам расположены на строго определенном удалении от атомного ядра, точно также как планеты Солнечной системы вращаются вокруг солнца (отсюда и название модели). Эти орбиты (сейчас всем известны как энергетические уровни)- стационарные и вне их электрон существовать не может. К сожалению, объяснить это утверждение Бору на тот момент не удалось. Кроме того, предложенная модель Бора противоречила законам физики:
В начале прошлого века на смену планетарной модели строения атома пришла волновая модель, которая разрешила возникшие противоречия и на сегодняшний момент считается общепринятой.
Современное представление о строении атома было бы невозможно без открытия явления радиоактивности, элементарных частиц (электрона, протона и нейтрона). Решающий вклад в установлении строения атома внесли Дальтон, Дж.Дж. Томпсон (или Томсон), Э. Резерфорд, Н. Бор, Э. Шредингер, М. Планк, Люис, Паули.
История развития представлений о строении атома условно изображена на схеме ниже:
IV. Современное строение атома
Атом — электронейтрален, то есть количество положительно заряженных частиц в нем равно количеству отрицательно заряженных частиц.
Долгое время считалось, что протоны и нейтроны являются элементарными (то есть неделимыми) частицами. Но на сегодняшний момент признано, что они имеют сложное строение и состоят из кварков. Электрон же до сих пор считается элементарной частицей. Положительно и нейтрально заряженные частицы (протоны и нейтроны, соответственно) сосредоточены в ядре, чья масса составляет около 99,97% от массы атома. Радиус атома, как правило, составляет несколько ангстрем (10−10 м), радиус ядра в 10 000 раз меньше радиуса атома.
Заряд ядра равен порядковому номеру химического элемента
Заряд ядра атома = Порядковому номеру = Числу протонов = Число электронов
Число нейтронов = Атомная масса (Ar) – Порядковый номер
Например, определите состав атома бора?
Изотопы одного и того же химического элемента имеют разную массу, так как в ядрах содержится разное количество нейтронов.
Какое количество электронов, протонов и нейтронов содержится в изотопах углерода 12 и 13?
Для изотопа углерода 12:
Z→6 A→12 C , порядковый номер N=6, массовое число A=12
N(n 0 ) = A — Z = 12 — 6 = 6
Углерод-12 содержит 6 электронов, 6 протонов и 6 нейтронов
Для изотопа углерода 13:
Z→6 A→13 C, порядковый номер N=6, массовое число A=13
N(n 0 ) = A — Z = 13 — 6 = 7
Углерод-13 содержит 6 электронов, 6 протонов и 7 нейтронов
V. Химический элемент
Химический элемент – это вид атомов с одинаковым зарядом ядра.
В природе химические элементы существуют в виде смесей изотопов. Изотопный состав одного и того же химического элемента выражают в атомных долях (ωат.), которые указывают какую часть составляет число атомов данного изотопа от общего числа атомов всех изотопов данного элемента, принятого за единицу или 100%.
Ar средняя= ωат.(1) ∙ Ar(1) + … + ωат.(n) ∙ Ar(n)
Ar средняя (Cl) = 0,754 ∙ 35 + 0,246 ∙ 37 = 35,453
VI. Задания для закрепления
Задание №1. Определите атомный состав изотопов хлора 35 Cl и 37 Сl. Почему изотопы хлора имеют разное массовое число?
Задание №2. Определите относительную атомную массу элемента кремния, если известно, что он состоит из трёх изотопов: 28 Si (атомная доля 92,3%), 29 Si (4,7%), 30 Si (3%).