Раствор имеющий большее осмотическое давление чем кровь называется
Медицинская биохимия, принципы измерительных технологий в биохимии, патохимия, диагностика, биохимия злокачественного роста. Часть 2.
Вода и электролиты
Растворителем, в котором работают почти все известные живые системы, служит окись водорода, или вода (H 2O). В молекуле воды атом кислорода соединен с двумя атомами водорода одинарными ковалентными связями.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Электроотрицательность — сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Это понятие ввел Лайнус Полинг (Linus Carl Pauling). Самый электроотрицательный элемент — фтор, за ним на шкале электроотрицательности следует кислород. Иными словами, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора (который в биологической химии практически не встречается). Запомним этот факт.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующие ее электроны никуда не смещены (в рамках старинной планетарной модели атома можно сказать, что они находятся точно посредине между атомами, как на картинке). Такая ковалентная связь называется неполярной.
Если ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого выше электроотрицательность. Такая связь называется полярной. При очень большой разнице в электроотрицательности она может даже стать ионной — это случится, если один атом полностью “отберет” у другого общую пару электронов.
Связь между водородом и кислородом в молекуле воды — типичный пример ковалентной полярной связи. Электроотрицательность кислорода намного выше, поэтому общие электроны смещены к нему. В результате на кислороде возникает маленький отрицательный заряд, а на водороде маленький положительный; эти заряды принято обозначать буквой δ (“дельта”).
Связи кислорода с водородом или углеродом (H-O или C-O) — всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде. В то же время связь между углеродом и водородом (C-H) считается неполярной: разница в электроотрицательности между этими элементами так мала, что смещение электронов незаметно. Например, молекулы углеводородов в силу этого полностью неполярны, они не несут никаких частичных зарядов ни на каких атомах.
При наличии полярных связей между водородом и кислородом частичные заряды на этих атомах (отрицательные на кислороде и положительные на водороде) притягиваются друг к другу, образуя водородные связи. Эти связи гораздо слабее ковалентных, но могут давать сильный эффект, если их много. Например, именно из-за колоссального количества водородных связей у воды очень высокая теплоемкость — ее трудно нагреть и трудно остудить. Строго говоря, водородная связь может образоваться не только с кислородом, но и с другими электроотрицательными атомами (например, с азотом или фтором).
Любые заряженные частицы в водном растворе гидратируются, то есть окружаются молекулами воды — конечно, по-разному ориентированными в зависимости от того, положительная это частица или отрицательная. Любые ионы, растворенные в воде, на самом деле присутствуют там в гидратированном состоянии, то есть с водной оболочкой. На картинке для примера показана растворенная поваренная соль (NaCl) — образец чисто ионного вещества.
Полярные молекулы (а тем более ионы) хорошо взаимодействуют с водой, образуя с ней водородные связи и (или) подвергаясь гидратации. Такие вещества хорошо растворяются в воде и называются гидрофильными. Неполярные молекулы взаимодействуют с водой гораздо слабее, чем друг с другом. Такие вещества плохо растворяются в воде и называются гидрофобными. Типичные гидрофобные вещества — углеводороды. Типичные гидрофильные вещества — спирты, такие как этанол или показанный на картинке глицерин. Вообще кислородсодержащие соединения углерода, как правило, гидрофильны, если только в них нет совсем уж огромных углеводородных радикалов.
Могут ли подойти для жизни другие растворители, кроме воды? Ответ — да. Например, двуокись углерода (CO 2) при более высоких давлениях, чем наше атмосферное, становится жидкостью и представляет собой хороший гидрофильный растворитель, в котором успешно идут многие биохимические реакции. В этом растворителе могут жить даже земные микроорганизмы: например, на дне Окинавского желоба в Восточно-Китайском море обнаружено целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии (Inagaki et al., 2006).
Некоторые исследователи предполагают, что океаны жидкой двуокиси углерода могут существовать на планетах-“суперземлях” с массой, в несколько раз превосходящей массу Земли (Budisa, Schulze-Makuch, 2014). На картинке — художественное изображение планеты GJ1214b в созвездии Змееносца.
На крупнейшем спутнике Сатурна — Титане — есть углеводородные озера и даже моря, состоящие из метана (CH 4), этана (C 2H 6) и пропана (C 3H 8). Это гидрофобный растворитель, в котором тоже иногда предполагают существование жизни, хотя прямых подтверждений тому пока нет. На картине — пейзаж Титана. Жидкой воды на поверхности Титана нет, там слишком холодно.
Аммиак (NH 3) — гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом, и напоминающий воду по физико-химическим свойствам. На более холодных планетах, чем Земля, аммиак находится в жидком состоянии и вполне может быть средой для жизни.
Теоретически возможно существование холодных землеподобных планет с аммиачными океанами (на картинке художественное изображение такой планеты). Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть сомнения, то углеродную жизнь в неводном растворителе представить гораздо легче.
Можно придумать и другие экзотические варианты — например, океан из плавиковой кислоты (HF) на планете, описанной в фантастической повести Ивана Ефремова “Сердце Змеи”. “Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…” Возвращаясь к земной биохимии, будем помнить, что она — не единственная теоретически возможная.
Раствор имеющий большее осмотическое давление чем кровь называется
а) Белки плазмы создают коллоидно-осмотическое давление. В отдельной статье на сайте дана основная характеристика осмотического давления. Там подчеркивалось, что только те молекулы и ионы, которые не проходят через поры полупроницаемых мембран, участвуют в создании осмотического давления. Поскольку белки являются растворенными в плазме и тканевой жидкости компонентами, которые не проходят через поры капиллярной стенки, именно они ответственны за величину осмотического давления по обе стороны стенки капилляров. Чтобы отличать осмотическое давление, которое существует по обе стороны клеточной мембраны, от осмотического давления, которое существует по обе стороны стенки капилляра, последнее стали называть коллоидно-осмотическим давлением, или онкотическим давлением.
Термин «коллоидноосмотическое давление» исторически возник из представления о том, что раствор белков является коллоидным раствором, хотя в действительности он является истинным молекулярным раствором.
б) Нормальная величина коллоидно-осмотического давления. Коллоидно-осмотическое (онкотическое) давление плазмы крови здорового человека в среднем равно 28 мм рт. ст. Из них 19 мм рт. ст. создается молекулами растворенных белков, а 9 мм рт. ст. — благодаря эффекту Доннана за счет осмотического давления натрия, калия и других катионов, связанных с белками плазмы.
в) Влияние различных белков плазмы на коллоидно-осмотическое давление. Белки плазмы представляют собой смесь, содержащую альбумины (молекулярная масса которых составляет в среднем 69000), глобулины (молекулярная масса 140000), фибриноген (молекулярная масса 400000). Таким образом, 1 г глобулина содержит только половину числа молекул, которые составляют 1 г альбумина, а 1 г фибриногена содержит всего 1/6 числа молекул, составляющих 1 г альбумина. Величина осмотического давления зависит от числа молекул, растворенных в жидкости, а не от их массы. Далее в таблице приведены как концентрации разных белков в плазме крови (г/дл), так и вклад белка каждого типа в общее коллоидно-осмотическое давление плазмы (Ркопл).
Из таблицы видно, что около 80% общего коллоидно-осмотического давления плазмы создается альбуминами, 20% — глобулинами и ничтожно малая часть — фибриногеном. Таким образом, для поддержания динамического равновесия между жидкостью в капиллярах и тканях наиболее важное значение имеют альбумины.
Коллоидно-осмотическое давление интерстициальной жидкости
Обычно размеры пор капиллярной стенки меньше, чем размеры белковых молекул, однако это справедливо не для всех пор, поэтому небольшое количество белков плазмы может проходить через стенку капилляра в интерстициальное пространство.
Общее содержание белков в 12 л интерстициальной жидкости организма немного больше, чем общее количество белков плазмы, но поскольку этот объем в 4 раза больше объема плазмы, концентрация белков интерстициальной жидкости составляет только 40% концентрации белков плазмы, т.е. примерно 3 г/дл. Легко рассчитать, что эта концентрация белков соответствует коллоидно-осмотическому (онкотическому) давлению 8 мм рт. ст.
Видео физиология состава крови
Редактор: Искандер Милевски. Дата публикации: 2.12.2020
Нарушения метаболизма. Биохимия специализированных тканей. (Для клин.ордов КЛД)
Вода и электролиты
Растворителем, в котором работают почти все известные живые системы, служит окись водорода, или вода (H 2O). В молекуле воды атом кислорода соединен с двумя атомами водорода одинарными ковалентными связями.
Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Электроотрицательность — сила, с которой атом в составе молекулы оттягивает на себя общие с другим атомом электроны, образующие ковалентную связь. Это понятие ввел Лайнус Полинг (Linus Carl Pauling). Самый электроотрицательный элемент — фтор, за ним на шкале электроотрицательности следует кислород. Иными словами, кислород превосходит по электроотрицательности все другие атомы, за исключением фтора (который в биологической химии практически не встречается). Запомним этот факт.
Электроотрицательность одинаковых атомов по определению равна. Если между двумя одинаковыми атомами есть ковалентная связь, то образующие ее электроны никуда не смещены (в рамках старинной планетарной модели атома можно сказать, что они находятся точно посредине между атомами, как на картинке). Такая ковалентная связь называется неполярной.
Если ковалентную связь образуют два разных атома, то общие электроны смещаются к тому из них, у которого выше электроотрицательность. Такая связь называется полярной. При очень большой разнице в электроотрицательности она может даже стать ионной — это случится, если один атом полностью “отберет” у другого общую пару электронов.
Связь между водородом и кислородом в молекуле воды — типичный пример ковалентной полярной связи. Электроотрицательность кислорода намного выше, поэтому общие электроны смещены к нему. В результате на кислороде возникает маленький отрицательный заряд, а на водороде маленький положительный; эти заряды принято обозначать буквой δ (“дельта”).
Связи кислорода с водородом или углеродом (H-O или C-O) — всегда полярные. Молекулы, в которых много таких связей, несут многочисленные частичные заряды, отрицательные на кислороде и положительные на водороде или углероде. В то же время связь между углеродом и водородом (C-H) считается неполярной: разница в электроотрицательности между этими элементами так мала, что смещение электронов незаметно. Например, молекулы углеводородов в силу этого полностью неполярны, они не несут никаких частичных зарядов ни на каких атомах.
При наличии полярных связей между водородом и кислородом частичные заряды на этих атомах (отрицательные на кислороде и положительные на водороде) притягиваются друг к другу, образуя водородные связи. Эти связи гораздо слабее ковалентных, но могут давать сильный эффект, если их много. Например, именно из-за колоссального количества водородных связей у воды очень высокая теплоемкость — ее трудно нагреть и трудно остудить. Строго говоря, водородная связь может образоваться не только с кислородом, но и с другими электроотрицательными атомами (например, с азотом или фтором).
Любые заряженные частицы в водном растворе гидратируются, то есть окружаются молекулами воды — конечно, по-разному ориентированными в зависимости от того, положительная это частица или отрицательная. Любые ионы, растворенные в воде, на самом деле присутствуют там в гидратированном состоянии, то есть с водной оболочкой. На картинке для примера показана растворенная поваренная соль (NaCl) — образец чисто ионного вещества.
Полярные молекулы (а тем более ионы) хорошо взаимодействуют с водой, образуя с ней водородные связи и (или) подвергаясь гидратации. Такие вещества хорошо растворяются в воде и называются гидрофильными. Неполярные молекулы взаимодействуют с водой гораздо слабее, чем друг с другом. Такие вещества плохо растворяются в воде и называются гидрофобными. Типичные гидрофобные вещества — углеводороды. Типичные гидрофильные вещества — спирты, такие как этанол или показанный на картинке глицерин. Вообще кислородсодержащие соединения углерода, как правило, гидрофильны, если только в них нет совсем уж огромных углеводородных радикалов.
Могут ли подойти для жизни другие растворители, кроме воды? Ответ — да. Например, двуокись углерода (CO 2) при более высоких давлениях, чем наше атмосферное, становится жидкостью и представляет собой хороший гидрофильный растворитель, в котором успешно идут многие биохимические реакции. В этом растворителе могут жить даже земные микроорганизмы: например, на дне Окинавского желоба в Восточно-Китайском море обнаружено целое озеро жидкой углекислоты, в котором постоянно живут довольно разнообразные бактерии (Inagaki et al., 2006).
Некоторые исследователи предполагают, что океаны жидкой двуокиси углерода могут существовать на планетах-“суперземлях” с массой, в несколько раз превосходящей массу Земли (Budisa, Schulze-Makuch, 2014). На картинке — художественное изображение планеты GJ1214b в созвездии Змееносца.
На крупнейшем спутнике Сатурна — Титане — есть углеводородные озера и даже моря, состоящие из метана (CH 4), этана (C 2H 6) и пропана (C 3H 8). Это гидрофобный растворитель, в котором тоже иногда предполагают существование жизни, хотя прямых подтверждений тому пока нет. На картине — пейзаж Титана. Жидкой воды на поверхности Титана нет, там слишком холодно.
Аммиак (NH 3) — гидрофильный растворитель, образующий много водородных связей, в данном случае между водородом и азотом, и напоминающий воду по физико-химическим свойствам. На более холодных планетах, чем Земля, аммиак находится в жидком состоянии и вполне может быть средой для жизни.
Теоретически возможно существование холодных землеподобных планет с аммиачными океанами (на картинке художественное изображение такой планеты). Есть ли там жизнь, никто не знает. Но почему бы и нет? Если насчет альтернатив углеродной жизни есть сомнения, то углеродную жизнь в неводном растворителе представить гораздо легче.
Можно придумать и другие экзотические варианты — например, океан из плавиковой кислоты (HF) на планете, описанной в фантастической повести Ивана Ефремова “Сердце Змеи”. “Люди Земли увидели лиловые волны океана из фтористого водорода, омывавшие берега черных песков, красных утесов и склонов иззубренных гор, светящихся голубым лунным сиянием…” Возвращаясь к земной биохимии, будем помнить, что она — не единственная теоретически возможная.
Что такое осмотическое давление воды
Явление осмотического давления в воде было обнаружено и описано еще в 1748 году французским физиком-экспериментатором Жаном-Антуаном Нолле.
Проводя свой эксперимент, Нолле наполнил сосуд этанолом и, закрыв его плотной мембраной, опустил в емкость с чистой водой. Под действием физических сил вода поступала внутрь сосуда с концентрированной жидкостью и создавала там давление, под действием которого сосуд раздувался. В процессе его эксперимента хватало пяти часов, чтобы объем в сосуде увеличился, а мембрана раздулась. Тогда он решил провести обратный опыт и наполнил колбу водой, поместив ее в сосуд со спиртом. Объем в колбе стал уменьшаться, а мембрана начала прогибаться вниз.
Нолле объяснил это явление, как избирательный перенос молекул через мембрану: когда жидкость с меньшей плотностью легко проходила через стенки мембраны, вторая, концентрированная, не могла осуществить диффузию.
Позже было доказано, что если к концентрированному раствору будет приложено давление, то перенос молекул растворителя можно замедлить или остановить в зависимости от величины давления. Наименьшее давление, за исключением давления самого растворителя, которое нужно приложить к раствору, чтобы предотвратить перемещение молекул чистого вещества через мембрану, было названо»«соматическое», а сам процесс произвольного перехода молекул растворителя стали называть «осмос».
От чего зависит осмотическое давление воды
Важным условием осмоса является наличие полупроницаемой мембраны, то есть такого материала, поры которого будут достаточного размера, чтобы свободно пропускать молекулы растворителя и удерживать в растворе частицы растворенного вещества.
Осмотическое давление воды зависит от двух основных факторов:
Это объясняется уравнением Вант-Гоффа. Осмотическое давление воды равно: π = RCT,
Ученый выявил, что осмотическое давление жидкостных растворов, подчиняется тем же законам, что и давление газовых систем. С помощью данного уравнения определяется величина давления.
Оно не зависит от состава растворенного вещества, поэтому осмотическое давление считается коллигативным свойством раствора, то есть обусловленным самопроизвольным движением молекул, их количеством, а не составом.
Для возникновения осмотического давления воды в системе необходимо два критерия:
Как определить осмотическое давление воды
Динамический метод определение осмотического давления воды позволяет быстро и точно получить результат. Он основывается на определении объемной скорости пропускания и выдавливания молекул растворителя через мембраны с различным давлением в ячейке с последующим вычислением промежуточных значений среди полученных результатов.
Многие приборы позволяют проводить вычисления обоими методами. Единственным важным условиям проведения измерения является правильный подбор полупроницаемой мембраны. На практике чаще всего применяются:
Роль осмотического давления воды для живых организмов
Не менее важную роль осмос играет в экологии водоемов. При изменении концентрации солей в воде, обитатели могут погибнуть, так, например, если поместить пресноводное животное в морскую воду, то оно вскоре потеряет пятую часть своего веса, а если морского обитателя перенести в пресную воду, то из-за диффузии молекул повысится уровень внутриклеточной жидкости, клетки его органов разбухнут и лопнут.
Осмотическое давление морской воды
Осмотическое давление морской воды составляет примерно 25 бар, что существенно выше осмотического давления пресной воды. Поэтому процесс опреснения морской воды методом обратного осмоса проходит при существенно больших давлениях (40-60 бар). Естественно, для разных морей и океанов величина осмотического давления будут разниться за счет разной концентрации солей.
Где применяют осмотическое давление воды
Знание и правильное применение законов осмотического давления воды необходимо в медицине, биологии, энергетике и промышленности. На них основываются многие физико-биологические процессы, процессы получения веществ, а также способы очистки воды.
Осмотическое давление
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
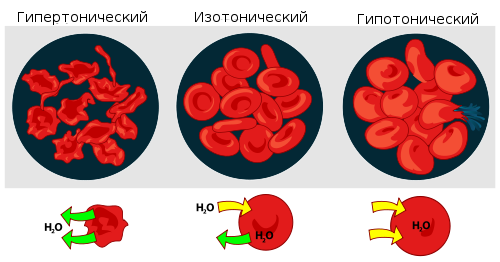
Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой мембраной, называется тоничность. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Осмотическое давление может быть весьма значительным. В дереве, например, под действием осмотического давления растительный сок (вода с растворёнными в ней минеральными веществами) поднимается по ксилеме от корней до самой верхушки. Одни только капиллярные явления не способны создать достаточную подъёмную силу — например, секвойям требуется доставлять раствор на высоту до 100 метров. При этом в дереве движение концентрированного раствора, каким является растительный сок, ничем не ограничено.
Если же подобный раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причине лекарства, предназначенные для введения в кровь, растворяют в изотоническом растворе, содержащем столько хлорида натрия (поваренной соли), сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью осмотическое давление. Если бы вводимые лекарственные препараты были изготовлены на воде или очень сильно разбавленном (гипотоническом по отношению к цитоплазме) растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида натрия (3-5-10 %, гипертонические растворы), то вода из клеток будет выходить наружу, и они сожмутся. В случае растительных клеток происходит отрыв протопласта от клеточной оболочки, что называется плазмолизом. Обратный же процесс, происходящий при помещении сжавшихся клеток в более разбавленный раствор, — соответственно, деплазмолизом.
Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нём веществ (или ионов, если молекулы вещества диссоциируют), следовательно, осмотическое давление является коллигативным свойством раствора. Чем больше концентрация вещества в растворе, тем больше создаваемое им осмотическое давление. Это правило, носящее название закона осмотического давления, выражается простой формулой, очень похожей на некий закон идеального газа:

Это показывает также схожесть свойств частиц растворённого вещества в вязкой среде растворителя с частицами идеального газа в воздухе. Правомерность этой точки зрения подтверждают опыты Ж. Б. Перрена (1906): распределение частичек эмульсии смолы гуммигута в толще воды в общем подчинялось закону Больцмана.
Осмотическое давление, которое зависит от содержания в растворе белков, называется онкотическим (0,03 — 0,04 атм.). При длительном голодании, болезни почек концентрация белков в крови уменьшается, онкотическое давление в крови снижается и возникают онкотические отёки: вода переходит из сосудов в ткани, где πОНК больше. При гнойных процессах πОНК в очаге воспаления возрастает в 2-3 раза, так как увеличивается число частиц из-за разрушения белков. В организме осмотическое давление должно быть постоянным (≈ 7,7 атм.). Поэтому пациентам вводят изотонические растворы (растворы, осмотическое давление которых равно πПЛАЗМЫ ≈ 7,7 атм. (0,9 % NaCl — физиологический раствор, 5 % раствор глюкозы). Гипертонические растворы, у которых π больше, чем πПЛАЗМЫ, применяются в медицине для очистки ран от гноя (10 % NaCl), для удаления аллергических отёков (10 % CaCl2, 20 % глюкоза), в качестве слабительных лекарств (Na2SO4∙10H2O, MgSO4∙7H2O).
Закон осмотического давления можно использовать для расчёта молекулярной массы данного вещества (при известных дополнительных данных).