Реактивная фиброплазия что это
Прогрессирующая оссифицирующая фибродисплазия ( Параоссальная гетеротопическая оссификация )
Прогрессирующая оссифицирующая фибродисплазия – тяжелое генетическое заболевание, характеризующееся нарушением обмена в тканях мышц, сухожилий и связок, что приводит к образованию в них кальцинатов. Симптомами этого состояния являются уплотнения в мягких тканях шеи, спины и конечностей, мышечная гипотония, в дальнейшем – выраженные деформации позвоночника, скованность движений вплоть до инвалидизации больных. Диагностика прогрессирующей оссифицирующей фибродисплазии производится на основании данных настоящего статуса пациента, рентгенологических и молекулярно-генетических исследований. Специфического лечения патологии на сегодняшний день не существует, но имеются обнадеживающие результаты опытов на клеточных культурах больных данным заболеванием.
Общие сведения
Прогрессирующая оссифицирующая фибродисплазия (ФОП, параоссальная гетеротопическая оссификация) – редкое генетическое заболевание, при котором возникают процессы патологического окостенения сухожилий, фасций, межмышечных перегородок и других структур, состоящих из волокнистой соединительной ткани. Впервые это состояние было упомянуто французским врачом Гаем Петимом еще в 1692 году, однако его наиболее полное описание и изучение произвел в 70-х годах XX века американский врач-генетик Виктор Маккьюзик, который и дал название этому заболеванию.
Прогрессирующая оссифицирующая фибродисплазия чаще всего является результатом спонтанных герминативных мутаций, однако описаны и семейные случаи этой патологии, при этом она характеризуется аутосомно-доминантным механизмом передачи со 100% пенетрантностью. Встречаемость оценивается примерно в 1:1 800 000-2 000 000, заболевание с равной долей вероятности поражает как мальчиков, так и девочек. Характерной особенностью прогрессирующей оссифицирующей фибродисплазии является тот факт, что любые попытки оперативного лечения этого состояния (устранение очагов оссификации или облегчение движений в суставах) приводят к взрывному росту новых гетеротопических участков костной ткани.
Причины ФОП
Этиология прогрессирующей оссифицирующей фибродисплазии заключается в нарушении регуляции процессов формирования костной ткани. В эмбриональном периоде за развитие костей отвечает ряд рецепторов, работа которых приводит к образованию твердой соединительной ткани в соответствующих областях тела. При развитии этого заболевания возникает мутация гена ACVR1, расположенного на 2 хромосоме.
Продуктом экспрессии данного гена является специфический белок – активин-рецептор 1 типа. Он относится к более обширной группе BMP-рецепторов, которые обладают способностью связывать вещества-факторы роста костной ткани и передавать соответствующие сигналы внутрь клеток. Чаще всего причиной прогрессирующей оссифицирующей фибродисплазии являются миссенс-мутации (например, Arg206His) в 6 экзоне гена ACVR1. В результате этого генетического нарушения происходит образование дефектной формы активина-рецептора 1 типа, который начинает образовываться не только в эмбриональном периоде и в остеобластах у взрослого человека, но и в клетках волокнистой соединительной ткани.
Дальнейший патогенез прогрессирующей оссифицирующей фибродисплазии изучен недостаточно по причине редкости этого состояния. Однако большинство исследователей склоняются к мнению, что дефектный рецептор становится способным реагировать не только на соединения из группы BMP (bone morphogenetic protein – белки костного морфогенеза), но и на другие вещества – в частности, факторы воспаления. Доказательством этой теории служит тот факт, что очаги гетеротопической оссификации чаще всего возникают на месте повреждения мягких тканей – ушибов, порезов, укусов насекомых. Кроме того, при гистологическом изучении патологических уплотнений в них всегда наблюдается умеренная лимфоцитарная инфильтрация, что указывает на воспалительный или иммунный характер процесса.
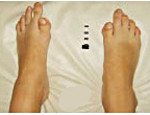
Мутации гена ACVR1 приводят не только к аномальному костному морфогенезу у детей и взрослых, они также нередко обуславливают ряд врожденных пороков развития опорно-двигательного аппарата. Наиболее распространенными проявлениями прогрессирующей оссифицирующей фибродисплазии такого типа являются микродактилии, варусное искривление большого пальца стопы (клинодактилия). Из других, более редких костных аномалий, отмечают сращение тел шейных позвонков, дисплазии метафизов, сращение реберно-позвоночных суставов. По причине сочетания дисплазии костной ткани и слабости мышечного корсета спины у больных часто развиваются тяжелые искривления позвоночника, что приводит к вторичным неврологическим нарушениям.
Симптомы ФОП
При рождении прогрессирующая оссифицирующая фибродисплазия может проявлять себя лишь нарушениями формирования костей пальцев рук и ног, никаких других изменений при этом не обнаруживается. Начало заболевания внезапное, может произойти без всяких видимых причин в возрасте от нескольких месяцев до 3-5 лет. Обычно первыми симптомами данной патологии становятся уплотнения в мышечных тканях шеи, спины и рук, размеры которых могут составлять от 1 до 10 сантиметров. При пальпации очаги бывают болезненными, кожа над ними либо не изменена, либо (в редких случаях) гиперемирована. При прогрессирующей оссифицирующей фибродисплазии такие уплотнения могут появляться на месте ушибов, порезов и других травм мягких тканей.
Походка больных прогрессирующей оссифицирующей фибродисплазией, как правило, характеризуется скованностью, малыми шагами. Лицо амимичное на фоне напряженных мышц шеи и спины. По мере нарастания количества и размеров уплотнений объем движений в суставах постепенно уменьшается, приводя на терминальных этапах заболевания практически к полному обездвиживанию. Нередко отмечаются боли неврологического характера, обусловленные сдавлением корешков спинномозговых нервов, также могут поступать жалобы на нарушение кожной чувствительности. Все эти проявления прогрессирующей оссифицирующей фибродисплазии постепенно нарастают и становятся все более выраженными.
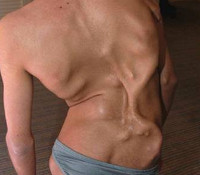
Описаны случаи, когда очаги на первоначальном этапе развития самопроизвольно рассасываются (в том числе и под воздействием некоторых лекарственных средств), однако в последующем уплотнения неизменно возникают снова. В течение 2-3 недель происходит оссификация, после чего их самопроизвольное или терапевтическое разрешение становится невозможным. У взрослых больных прогрессирующей оссифицирующей фибродисплазией выявляются десятки таких очагов, которые могут сливаться между собой, образуя картину «второго скелета». Это обстоятельство наряду с многочисленными деформациями костей приводит к глубокой инвалидизации больных и нередко провоцирует развитие многочисленных нарушений со стороны внутренних органов с последующим летальным исходом.
Диагностика и лечение
Диагностика прогрессирующей оссифицирующей фибродисплазии осуществляется на основании данных осмотра пациента, рентгенологических и генетических исследований. Как правило, результаты осмотра больных зависят от возраста и выраженности заболевания. У детей до 10-12 лет основными симптомами являются очаги уплотнения мягких тканей на голове, шее, иногда на спине. У пациентов старшего возраста очаги оссификации могут располагаться на любом участке тела, нередко отмечается резкое ограничение подвижности суставов, выраженные искривления позвоночника.
Уплотнения мягких тканей приводят к появлению характерных бугров на коже и зачастую сильно уродуют больного прогрессирующей оссифицирующей фибродисплазией. Иногда в качестве дополнительного метода диагностики прибегают к биопсии и последующему гистологическому исследованию очагов уплотнения, однако многие специалисты выступают против этой техники, поскольку такая инвазивная процедура способна спровоцировать развитие нового очага оссификации.
Рентгенологическое исследование на ранних этапах заболевания может обнаруживать врожденные пороки развития опорно-двигательного аппарата – клинодактилию больших пальцев ног, дисплазию метафизов, укорочение длинных трубчатых костей конечностей. По мере развития гетеротопической оссификации в сухожилиях, фасциях, межмышечных соединительнотканных перегородках выявляются сначала одиночные, а затем и множественные тени, имеющие костную плотность. В далеко зашедших случаях прогрессирующей оссифицирующей фибродисплазии тени сливаются между собой и нередко затрудняют визуализацию внутренних органов и других глубоко расположенных структур. При помощи методов современной генетики можно диагностировать это состояние путем поиска мутаций в гене ACVR1.
Специфического лечения прогрессирующей оссифицирующей фибродисплазии не существует, а паллиативная терапия резко ограничена в своих возможностях по причине детского возраста большинства пациентов и специфической реакции организма. Многочисленные попытки устранить очаги гетеротопической оссификации хирургическим путем заканчивались неудачно – после операции из-за повреждения тканей рост уплотнений резко усиливался. На ранних этапах заболевания немного затормозить развитие патологических очагов можно при помощи высоких доз кортикостероидных препаратов и других средств, угнетающих воспалительные процессы (НПВС, ингибиторы лейкотриенов, блокаторы мастоцитов).
В последние годы получены первые лабораторные данные по поводу специфического лечения прогрессирующей оссифицирующей фибродисплазии – при помощи особой РНК удалось ингибировать экспрессию дефектного гена ACVR1, не затрагивая его здоровую гомологичную копию в стволовых клетках больных. Возможно, в дальнейшем это позволит с успехом лечить пациентов, страдающих данным заболеванием, или, как минимум, значительно повысить их качество жизни.
Прогноз и профилактика
Прогноз прогрессирующей оссифицирующей фибродисплазии крайне неблагоприятный – проявления заболевания неуклонно нарастают, эктопические очаги оссификации становятся крупнее и сливаются между собой, деформации позвоночника практически лишают больного подвижности. Как правило, летальный исход наступает в 25-40 лет от нарушений дыхания, пневмонии, других расстройств со стороны внутренних органов. Описаны случаи развития очагов оссификации в жевательной мускулатуре, что приводило к невозможности открыть рот и требовало срочных мер по организации питания больного. Поддерживающее лечение при прогрессирующей оссифицирующей фибродисплазии теоретически может замедлить развитие патологии, но на практике его эффективность очень сильно отличается у разных больных. Каких-либо методов профилактики этого редкого генетического заболевания на сегодняшний день не разработано.
Как научиться жить с диагнозом прогрессирующая оссифицирующая фибродисплазия?
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
ДОСТУПНЫЕ ЦЕНЫ НА КУРС ЛЕЧЕНИЯ
Мягко, приятно, нас не боятся дети
Исторические данные и клиническая картина
Случаи выявления диагноза фиксируются один на два миллиона. Один из самых первых пациентов, пораженных данным заболеванием, был зарегистрирован в 1648 году. На сегодняшний день насчитывается не более 300 случаев.
Источником возникновения недуга выступает мутирование клеток на генетическом уровне.
Симптомы фибродисплазии
Нередко фибродисплазию ошибочно принимают за раковую опухоль, так как при ней тоже происходит отечность тканей. Но, при попытке удаления оссификатов ситуация только усугубляется, провоцируя рост новых образований.
Проведение лабораторного обследования и профилактика заболевания
При обнаружении вышеперечисленных признаков прогрессирующей оссифицирующей фибродисплазии необходимо незамедлительно обратиться к специалисту и ни в коем случае не заниматься самолечением. Врач назначит пройти генетическое тестирование, по результатам которого предполагаемый диагноз либо подтвердится, либо будет опровергнут.
Сегодня молекулярно-генетическое исследование входит в перечень услуг большинства диагностических центров. Это несложная процедура и осуществляется путем забора крови с утра на голодный желудок. Важно учесть, что за сутки до анализа нельзя принимать алкогольные напитки. Результаты тестирования будут готовы примерно через семь дней.
Лишь только при обнаружении мутирующего гена ACVR1, отвечающего за формирование и восстановление костной системы, врач имеет право подтвердить диагноз.
Люди, страдающие этим недугом, должны быть крайне аккуратны в обыденной жизни, избегая ушибов, царапин, травм и даже простудных и воспалительных заболеваний. Так как эти факторы могут отрицательно повлиять на течение болезни и привести к появлению новых костных уплотнений.
Лечение фибродисплазии в перспективе
Американские исследователи при университете Томаса Джефферсона создали новый препарат, блокирующий мутацию гена ACVR1/ALK2, и опробовали его на лабораторных мышах. Он оказал эффективное воздействие на ход лечения гетеротопической оссификации: прогресс заболевания приостановился, и снизились воспалительные процессы в поврежденных заболеванием тканях. Изобретенное средство может противостоять «болезни второго скелета», образовавшейся на фоне полученных повреждений и имеющей наследственный характер. В ближайшие три-пять лет американские учёные-генетики будут продолжать тестировать препарат и совершенствовать его возможности. За более короткий промежуток времени провести исследования не представляется возможным, так как синдром каменного человека крайне редкое явление, и каждый случай уникален.
Прогрессирующая оссифицирующая фибродисплазия
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Прогрессирующая оссифицирующая фибродисплазия (ПОФ) (от лат. fibro – волокно, dis – расстройство, нарушение, plasis – строение, структура и os, ossis – кость, facio – делать, окостенение) – редкое аутосомно-доминантное заболевание, характеризующееся прогрессирующим гетеротопическим истинным окостенением мягких тканей скелета (соединительнотканных прослоек в толще мышц, фасций, апоневрозов, сухожилий) и ассоциирующееся с множественными врожденными скелетными аномалиями. В МКБ-10 ПОФ представлена отдельной рубрикой – M 61.1.
ПОФ – это редкая нозологическая форма, характеризующаяся рецидивирующими болезненными эпизодами припухлости мягких тканей, ведущими к гетеротопической оссификации через стадию эндохондрального процесса, т. е. превращением соединительной ткани межмышечных прослоек, сухожилий и связочного аппарата в костную ткань [1, 2].
В литературе это заболевание можно встретить под названиями: параоссальная гетеротопическая оссификация, болезнь Мюнхмайера, «болезнь второго скелета», опухоль Стернера [3, 4]. Наиболее часто употреблявшееся ранее название – «оссифицирующий миозит» («превращение мышцы в кость») в настоящее время считается некорректным, поскольку не вполне отражает патогенетические и патоморфологические основы болезни. Общепризнанным научным термином, обозначающий данную патологию, является термин «прогрессирующая оссифицирующая фибродисплазия», что указывает на вовлечение в процесс окостенения соединительнотканных структур вследствие особого характера воспалительных процессов в сухожилиях, связках, фасциях, апоневрозах и мышцах, заканчивающихся окостенением. Расовой, половой и географической предрасположенности к ПОФ не обнаружено [5].
Интерес к этому заболеванию существует с давних времен. Первое упоминание о ПОФ относится к 1648 г., когда Patin описал «окостеневшую» пациентку [6]. В 1996 г. R. Smith et al. проанализировали клиническую картину ПОФ у 28 больных, которых они наблюдали в течение 24 лет. При этом оссификация скелетных мышц начиналась в первые месяцы или годы от рождения с мышц шеи, верхних отделов спины, мышц, окружающих крупные суставы, с последующим распространением на бедра, плечи; поражались также и жевательные мышцы. Примечательно, что скорость прогрессирования болезни и выраженность ограничения движений не зависели от возраста дебюта болезни [7].
Гистопатология пораженных тканей при ПОФ хорошо описана в литературе [8–12]. Исследование тканей ранних проявлений ПОФ говорит об интенсивной мононуклеарной и периваскулярной инфильтрации моноцитов, макрофагов, мастоцитов, T- и B-клеток. Их точная роль в эволюции обострений ПОФ неизвестна, хотя установлено, что любое локальное воспаление независимо от причины его возникновения может спровоцировать активизацию болезни.
Последующая миграция одноядерных воспалительных клеток в пораженную мышечную ткань предшествует масштабной гибели скелетных мышц – процессу, после которого происходит формирование гетеротопического эндохондрального зачатка. За скоротечной воспалительной стадией следует период интенсивной фибробластной пролиферации, сопровождаемой мощным ангиогенезом. Фибробластическое поражение на раннем этапе в отношении гистологии неотличимо от агрессивного ювенильного фиброматоза, но по мере созревания ткани фиброзная ткань проходит через фазу бессосудистого уплотнения до состояния хряща, а затем наступает этап реваскуляризации с остеогенезом и характерным процессом эндохондральной оссификации.
Все стадии гистологического развития активных патологий указывают на то, что различные участки пораженного участка ПОФ проходят полный процесс эндохондральной оссификации с разной скоростью. Примечательно, что образующаяся в результате новая гетеротопическая кость гистологически выглядит как нормальная сформировавшаяся кость и часто содержит включения костного мозга. Мастоциты обнаруживаются на всех этапах формирования тканей при поражении ПОФ, и их количество значительно выше, чем в обычных скелетных мышцах или мышечных тканях больного вне зоны поражения ПОФ. При поражениях ПОФ на этапе фибробластной пролиферации количество мастоцитов многократно превышает показатель, свойственный любой другой форме воспалительной миопатии [13].
При том, что процесс гетеротопного костеобразования в некоторых отношениях схож с формированием костей скелета при эмбриональном развитии или постнатальном заживлении переломов, важнейшим отличием является отсутствие воспалительного компонента при первичном скелетообразовании. Впрочем, возможно, эти различия вполне условны и объясняются недостаточным объемом накопленных данных о морфологии ПОФ на различных стадиях болезни и малой перспективностью их дополнения, поскольку проведение биопсии пораженных (и даже клинически непораженных) тканей, проведение любого, даже малотравматичного хирургического вмешательства сопряжено с исключительно высоким риском образования новых очагов и быстрого прогрессирования болезни. Хотя процесс гетеротропического костеобразования в некоторых отношениях схож с формированием костей скелета при эмбриональном развитии и послеродовом заживлении переломов, важнейшим отличием является отсутствие воспалительного компонента при первичном скелетообразовании.
Генетика ПОФ и семейные исследования. Семейная ПОФ – чрезвычайно редкое заболевание в популяции и имеет аутосомно-доминантный тип наследования с полной пенетрантностью [14]. Хотя большинство зарегистрированных случаев заболевания являются спорадическими (единичными в семье), в литературе описаны семьи, в которых поражены родитель – потомок/потомки: братья, сестры, в т. ч. близнецы. Представляет интерес наблюдение J.M. Connor et al. [15], описавших семью, где ПОФ была диагностирована в 3-х поколениях у 5 лиц. В 1-м поколении пораженным был мужчина, который имел 2-х больных дочерей и 2-х больных внучек. Примечательна выраженная фенотипическая изменчивость тяжести течения заболевания в этой семье. Так, мужчина имел асимптоматическое течение до момента травмы, после которой у него развилась тугоподвижность шеи, спины, конечностей и нижней челюсти. Однако в 70 лет он передвигался, используя трость, и умер в возрасте 72 лет от инфаркта миокарда. Диагноз ПОФ ему был поставлен на основании наличия врожденной деформации большого пальца стопы и рентгенологического обследования, выявившего генерализованный анкилоз позвоночника, множественные зоны оссификации мягких тканей. Одна из его дочерей также не имела признаков заболевания до 22 лет, когда после экстракции зуба с последующим протезированием у нее развилась тугоподвижность челюсти. Ее сестра в возрасте 15 лет отметила спонтанную припухлость левой голени, когда на основании биопсии была диагностирована фибросаркома. Однако дальнейшее течение болезни (характерные болезненные припухлости и прогрессирующее ограничение объема движений) свидетельствовало в пользу ПОФ. Летальный исход наступил в 28 лет от пневмонии в состоянии полной обездвиженности. Также имели ПОФ 2 внучки больного от старшей дочери.
F.S. Kaplan et al. [16] представили данные о передаче ПОФ от пораженного отца 2-м дочерям и сыну. Так, 27-летний мужчина (от брака клинически здоровых родителей, 3-й сын в семье, 2 брата здоровы), имеющий характерную микродактилию большого пальца, заболел в 2 года после травмы. Клинически наблюдалось появление болезненных узлов в области шеи с последующей генерализацией процесса и эктопической оссификацией, прогрессированием болезни и формированием значительного двигательного дефицита. Рентгенологически определялись укорочение и расширение шеек бедренных костей. У 3-х его потомков также присутствовала врожденная микродактилия больших пальцев с дальнейшим развитием типичной картины ПОФ, при этом у одного из его сыновей первые оссификаты четырехглавой мышцы бедра появилась в 2-месячном возрасте после в/м инъекции, у 2-х других детей – в 3-летнем возрасте.
Как свидетельствуют и другие литературные наблюдения [17], авторами часто описывается фенотипическая гетерогенность ПОФ: характер послеродовой гетеротопической оссификации отличается в зависимости от анамнеза, случаев травматизации мягких тканей и заболеваемости вирусными болезнями. По мнению N. Hebela et al. [18], формирование фенотипа заболевания в период пренатального развития определяется генетическими факторами, в то время как сопутствующие (средовые) факторы влияют на послеродовой ход гетеротопической оссификации.
Молекулярная генетика. Е.М. Shore et al. [19] провели полногеномный анализ сцепления на материале 5 семей с ПОФ и выявили сцепление заболевания с регионом 23–24 хромосомы 2 (2q 23-q24), в котором картируется ген ACVR1 (Activine A Rreceptor, type I) (альтернативное название ACK2 – Activine Receptor-like Kinase 2). Секвенирование всех белок-кодирующих экзонов и экзон-интронных областей позволило ученым выявить гетерозиготную мутацию R(206)H (замена аминокислоты аргинин на гистидин в позиции 206) у всех пораженных ПОФ членов 5 семей, а также 32 больных со спорадическим ПОФ. Исследование молекулярно-генетических основ ПОФ в различных популяциях позволило установить, что заболевание тесно сцеплено главным образом с гетерозиготной мутацией de novo R(206)H при спорадической ПОФ [20–22]. Также обнаружена гетерозиготная миссенс-мутация de novo G(356)D в этом же гене [23].
Исследования показали, что во всех случаях спорадических и семейно-наследственных заболеваний у пациентов с классической клинической картиной ПОФ выявлена мутация R(206)H в гене ACVR1/ALK [24–26]. Данный ген кодирует рецептор ACVR1, относящийся к семейству BMP (bone morphogenetic protein)-рецепторов. BMP – регуляторный белок, участвующий в процессе эмбрионального формирования и постнатального восстановления костей скелета (индуцирует развитие мезодермы, формирование костной ткани, зубов, костеобразование и репарацию переломов) [27]. Преобразование сигналов ВМР происходит через рецепторы типа 1: BMPR1А, BMPR1B и ACVR1/ALK2 [28].
A.B. Shafrits et al. [29] обнаружили повышенные уровни белка BMP4 и его экспрессии (мРНК) в лимфобластоидных клетках у 26 из 32 больных с ПОФ и у 1 из 12 здоровых лиц (р Литература
Только для зарегистрированных пользователей