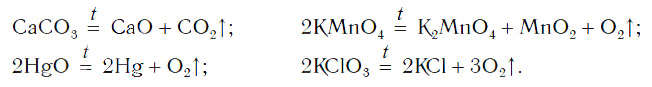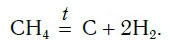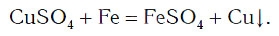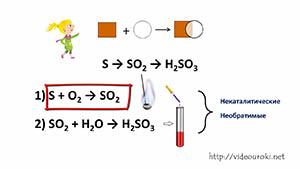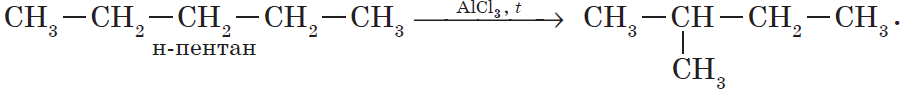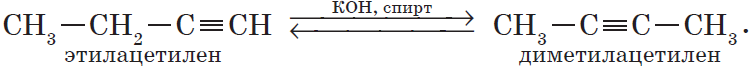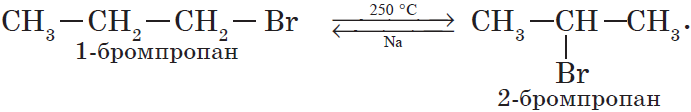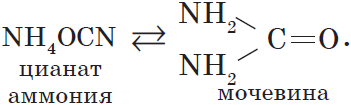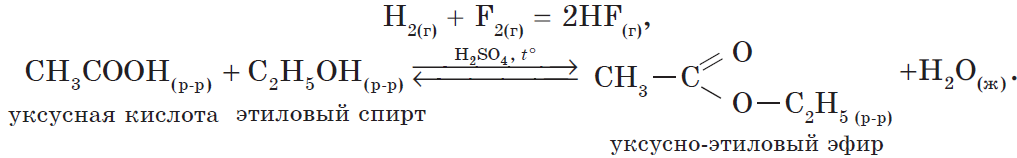Реакция соединения что это
Урок 13. Типы химических реакций
В уроке 13 «Типы химических реакций» из курса «Химия для чайников» мы узнаем о типах химических реакций; подробно рассмотрим каждый тип и научимся их различать.
Мир химических реакций весьма разнообразен. Самые различные химические реакции постоянно происходят в природе, осуществляются человеком. Можно ли классифицировать химические реакции? Что положить в основу их классификации? Сущность всякой химической реакции состоит в превращении веществ: разрушаются исходные вещества и образуются продукты реакций, меняется число и состав исходных веществ и продуктов реакции. Характер этих изменений и положен в основу классификации химических реакций.
Реакции соединения
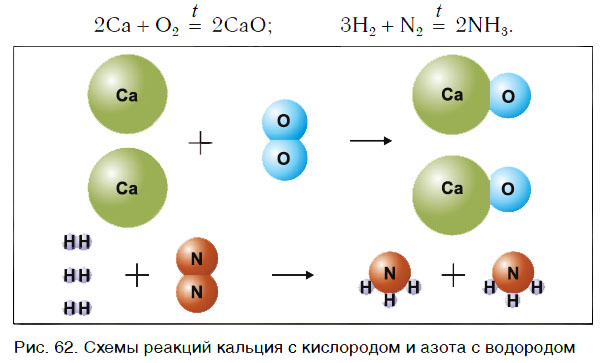
Рассмотрим уравнения следующих реакций (рис. 62):
Чем сходны данные реакции между собой? Тем, что в результате взаимодействия двух веществ получается только одно вещество. Такие реакции получили название реакций соединения.
Реакции соединения — это реакции, в результате которых из двух или нескольких веществ образуется одно новое сложное вещество.
В одних случаях из двух простых веществ получается одно сложное, в других — соединяются два и более простых или сложных веществ:
Реакции разложения
Рассмотрим уравнения следующих реакций:
Можно заметить, что из одного сложного вещества получается два или более новых веществ. Это реакции разложения. В них могут образовываться как простые, так и сложные вещества.
Реакции разложения — это реакции, в результате которых из одного сложного вещества образуется несколько новых веществ.
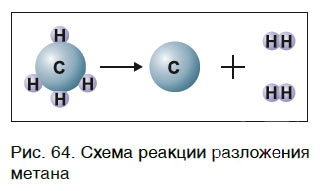
Для начала реакции разложения обычно необходимо нагреть исходные вещества. Например, негашеную известь CaO в промышленности получают нагреванием известняка CaCO3, реакция разложения происходит при температуре около 1000 °С. К такому типу реакций относится и реакция разложения метана CH4 (рис. 64) — составной части природного газа:
Реакции замещения
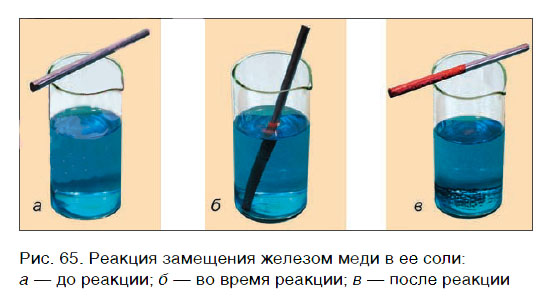
А могут ли взаимодействовать между собой два вещества: одно простое и одно сложное? Проверим это на опыте. В раствор медного купороса опустим небольшой кусочек железа — кнопку, гвоздь, канцелярскую скрепку с хорошо очищенной поверхностью. Через 2—3 мин извлечем железо из раствора и увидим, что на его поверхности образовался темно-красный налет меди. В химическую реакцию вступили простое (Fe) и сложное (CuSO4) вещества, и образовались новое простое (Cu) и новое сложное (FeSO4) вещества:
Из опыта и уравнения химической реакции хорошо видно, что атомы железа заместили атомы меди в сложном веществе (рис. 65). Такие химические реакции относятся к реакциям замещения.
Реакции замещения — это реакции, в результате которых атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Для протекания таких реакций необходимо соблюдать некоторые особые условия. Не все простые вещества обязательно должны взаимодействовать со сложными веществами. В дальнейшем при изучении химии вы познакомитесь с этими условиями, а также с другими типами химических реакций.
Краткие выводы урока:
Надеюсь урок 13 «Типы химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Классификация химических реакций
Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
В ходе химической реакции разрушаются химические связи, и образуются новые.
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
2. Реакции, протекающие с изменением состава
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
AB + CD = AC + BD
К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
Реакция газообразного водорода с твердым йодом также эндотермическая:
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Также экзотермическими являются:
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Также эндотермическими являются:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практичсеки не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так: A + K = AK; AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом. К обратимым реакциям относятся большинство гомогенных реакций, этерификация; реакции гидролиза; гидрирование-дегидрирование, гидратация-дегидратация; получение аммиака из простых веществ, окисление сернистого газа, получение галогеноводородов (кроме фтороводорода) и сероводорода; синтез метанола; получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях. Примеры необратимых реакций: горение; реакции, идущие со взрывом; реакции, идущие с образованием газа, осадка или воды в растворах; растворение щелочных металлов в воде; и др.
Реакции соединения
Урок 29. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Реакции соединения»
В реакциях соединения, в отличие от реакций разложения, происходит образование одного сложного вещества из одного или нескольких исходных.
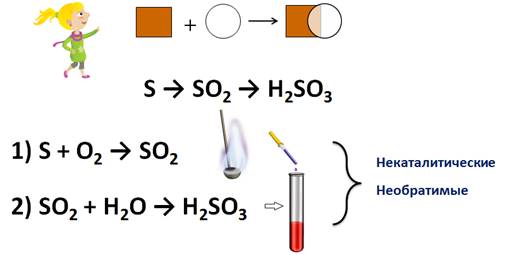
Рассмотрим эти реакции с помощью цепочек переходов. Запишем схему перехода: S → SO2 → H2SO3. Сера превращается в оксид серы (IV), который затем превращается в сернистую кислоту. Число стрелок в цепочке превращений показывает число химических реакций.
Первый процесс – это превращение серы в оксид серы (IV). Для этого запишем реакцию соединения серы с кислородом: S + O2 → SO2. Если в ложечке сжечь серу, то она горит синим пламенем с образованием сернистого газа, об этом можно судить по появлению запаха жженой серы. Если в колбу с образовавшимся сернистым газом добавить воды, то дым исчезает. К этому раствору можно добавить лакмуса, и он окрасится в красный цвет, что является доказательством образования сернистой кислоты: SO2 + H2O → H2SO3.
Все рассмотренные реакции протекали без участия катализатора, поэтому их называют некаталитическими. Кроме того, все эти реакции протекают в одном направлении, т.е. они являются необратимыми.
В первой реакции из двух простых веществ образовалось одно сложное, во второй реакции – из двух сложных веществ – одно сложное. Одно сложное вещество может образоваться и при взаимодействии одного сложного и одного простого, как в реакции образования оксида серы (VI) и оксида серы (IV): 2SO2 + O2 ↔ 2SO3. Эта реакция является обратимой, т.е. протекает как в прямом направлении с образованием продукта реакции и в обратном направлении, когда из конечного продукта образуются исходные вещества. Условно обратимые реакции обозначают с помощью знака обратимости.
Поэтому реакции, протекающие одновременно в двух противоположных направлениях, называют обратимыми.
В реакции образования оксида серы (VI) участвует катализатор V2O5, который указывают над знаком обратимости, поэтому эта реакция является каталитической.
Поэтому, если реакции протекают с участием катализатора, то они называются каталитическими, если реакции протекают без участия катализатора, то такие реакции называются некаталитическими, если реакции протекают с участием биологических катализаторов – ферментов, то такие реакции называются ферментативными.
В реакциях соединения сложное вещество может образоваться не только из двух веществ, но и из трех, как в реакции получения азотной кислоты:
Расставим коэффициенты в этом уравнении. Атомов азота одинаковое число в левой и правой части уравнения, поэтому азот не нужно уравнивать. Атомов водорода до реакции 2, а после реакции один атом, поэтому перед формулой азотной кислоты ставим коэффициент 2. Теперь необходимо и перед формулой оксида азота (IV) поставить коэффициент 2. Считаем число атомов кислорода: до реакции 5 атомов, после реакции – 6 атомов. Следовательно, нужно удвоить все коэффициенты. Перед оксидом азота (IV) ставим коэффициент 4, перед формулой воды – 2, перед формулой азотной кислоты – 4. Теперь осталось поставить коэффициент перед формулой кислорода. Для этого подсчитаем число атомов кислорода в правой части уравнения, их 12. В левой тоже, следовательно, вместо стрелки можно поставить знак равенства.
Классификация химических реакций в неорганической и органической химии
Теория к заданию 19 из ЕГЭ по химии
Классификация химических реакций в неорганической и органической химии
Химические реакции, или химические явления, — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению.
При химических реакциях обязательно происходит изменение веществ, при котором рвутся старые и образуются новые связи между атомами.
Химические реакции следует отличать от ядерных реакций. В результате химической реакции общее число атомов каждого химического элемента и его изотопный состав не меняются. Иное дело ядерные реакции — процессы превращения атомных ядер в результате их взаимодействия с другими ядрами или элементарными частицами, например, превращение алюминия в магний:
Классификация химических реакций многопланова, т.е. в ее основу могут быть положены различные признаки. Но под любой из таких признаков могут быть отнесены реакции как между неорганическими, так и между органическими веществами.
Рассмотрим классификацию химических реакций по различным признакам.
Классификация химических реакций по числу и составу реагирующих веществ. Реакции, идущие без изменения состава вещества
В неорганической химии к таким реакциям можно отнести процессы получения аллотропных модификаций одного химического элемента, например:
В органической химии к этому типу реакций могут быть отнесены реакции изомеризации, которые идут без изменения не только качественного, но и количественного состава молекул веществ, например:
1. Изомеризация алканов.
Реакция изомеризации алканов имеет большое практическое значение, т.к. углеводороды изостроения обладают меньшей способностью к детонации.
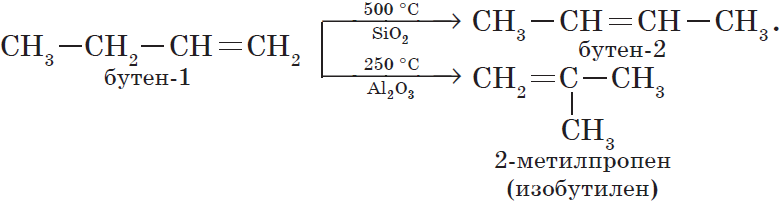
2. Изомеризация алкенов.
3. Изомеризация алкинов (реакция А. Е. Фаворского).
4. Изомеризация галогеналканов (А. Е. Фаворский).
5. Изомеризация цианата аммония при нагревании.
Впервые мочевина была синтезирована Ф. Велером в 1882 г. изомеризацией цианата аммония при нагревании.
Реакции, идущие с изменением состава вещества
Можно выделить четыре типа таких реакций: соединения, разложения, замещения и обмена.
1. Реакции соединения — это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
В неорганической химии все многообразие реакций соединения можно рассмотреть на примере реакций получения серной кислоты из серы:
1) получение оксида серы (IV):
$S+O_2=SO_2$ — из двух простых веществ образуется одно сложное;
2) получение оксида серы (VI):
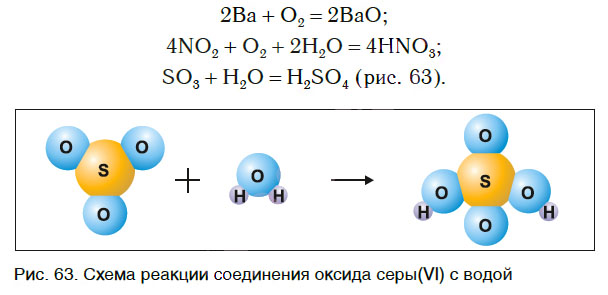
3) получение серной кислоты:
$SO_3+H_2O=H_2SO_4$ — из двух сложных веществ образуется одно сложное.
Примером реакции соединения, при которой одно сложное вещество образуется из более чем двух исходных, может служить заключительная стадия получения азотной кислоты:
В органической химии реакции соединения принято называть реакциями присоединения. Все многообразие таких реакций можно рассмотреть на примере блока реакций, характеризующих свойства непредельных веществ, например этилена:
1) реакция гидрирования — присоединение водорода:
2) реакция гидратации — присоединение воды:
3) реакция полимеризации:
2. Реакции разложения — это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ.
В неорганической химии все многообразие таких реакций можно рассмотреть на примере блока реакций получения кислорода лабораторными способами:
1) разложение оксида ртути (II):
$2HgO<→>↖
2) разложение нитрата калия:
$2KNO_3<→>↖
3) разложение перманганата калия:
$2KMnO_4<→>↖
В органической химии реакции разложения можно рассмотреть на примере блока реакций получения этилена в лаборатории и промышленности:
1) реакция дегидратации (отщепления воды) этанола:
2) реакция дегидрирования (отщепления водорода) этана:
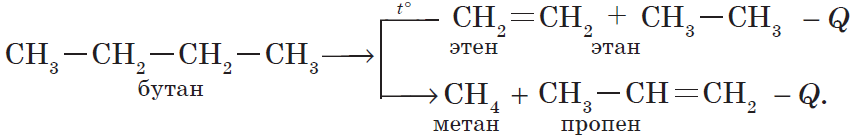
3) реакция крекинга (расщепления) пропана:
3. Реакции замещения — это такие реакции, в результате которых атомы простого вещества замещают атомы какого-либо элемента в сложном веществе.
В неорганической химии примером таких процессов может служить блок реакций, характеризующих свойства, например, металлов:
1) взаимодействие щелочных и щелочноземельных металлов с водой:
2) взаимодействие металлов с кислотами в растворе:
3) взаимодействие металлов с солями в растворе:
Предметом изучения органической химии являются не простые вещества, а только соединения. Поэтому как пример реакции замещения приведем наиболее характерное свойство предельных соединений, в частности метана, — способность его атомов водорода замещаться на атомы галогена:
Другой пример — бромирование ароматического соединения (бензола, толуола, анилина):
Обратим внимание на особенность реакций замещения у органических веществ: в результате таких реакций образуются не простое и сложное вещества, как в неорганической химии, а два сложных вещества.
В органической химии к реакциям замещения относят и некоторые реакции между двумя сложными веществами, например, нитрование бензола:
Она формально является реакцией обмена. То, что это реакция замещения, становится понятным только при рассмотрении ее механизма.
4. Реакции обмена — это такие реакции, при которых два сложных вещества обмениваются своими составными частями.
В неорганической химии это может быть блок реакций, характеризующих, например, свойства щелочей:
1) реакция нейтрализации, идущая с образованием соли и воды:
2) реакция между щелочью и солью, идущая с образованием газа:
3) реакция между щелочью и солью, идущая с образованием осадка:
В органической химии можно рассмотреть блок реакций, характеризующих, например, свойства уксусной кислоты:
2) реакция, идущая с образованием газа:
3) реакция, идущая с образованием осадка:
Классификация химических реакций по изменению степеней окисления химических элементов, образующих вещества
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции.
К ним относится множество реакций, в том числе все реакции замещения, а также те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество, например:
Как вы помните, сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса:
В органической химии ярким примером окислительно-восстановительных реакций могут служить свойства альдегидов:
1. Альдегиды восстанавливаются в соответствующие спирты:
2. Альдегиды окисляются в соответствующие кислоты:
Реакции, идущие без изменения степеней окисления химических элементов.
К ним, например, относятся все реакции ионного обмена, а также:
Классификация химических реакций по тепловому эффекту
По тепловому эффекту реакции делят на экзотермические и эндотермические.
Эти реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения. Редкое исключение составляют эндотермические реакции синтеза оксида азота (II) из азота и кислорода и реакция газообразного водорода с твердым иодом:
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
Гидрирование этилена — пример экзотермической реакции:
Она идет при комнатной температуре.
Эндотермические реакции
Эти реакции протекают с поглощением энергии.
Очевидно, что к ним относятся почти все реакции разложения, например:
а) обжиг известняка:
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (фазовому составу)
Это реакции, в которых реагирующие вещества и продукты реакции находятся в разных агрегатных состояниях (в разных фазах):
Это реакции, в которых реагирующие вещества и продукты реакции находятся в одном агрегатном состоянии (в одной фазе):
Классификация химических реакций по участию катализатора
Некаталитические реакции идут без участия катализатора:
Каталитические реакции идут с участием катализатора:
Так как все биологические реакции, протекающие в клетках живых организмов, идут с участием особых биологических катализаторов белковой природы — ферментов, все они относятся к каталитическим или, точнее, ферментативным.
Классификация химических реакций по направлению
Необратимые реакции протекают в данных условиях только в од ном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды), и все реакции горения.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия-антонимы процессов:
Обратимы все реакции этерификации (противоположный процесс, как вы знаете, носит название гидролиза) и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость лежит в основе важнейшего процесса в живом организме — обмена веществ.