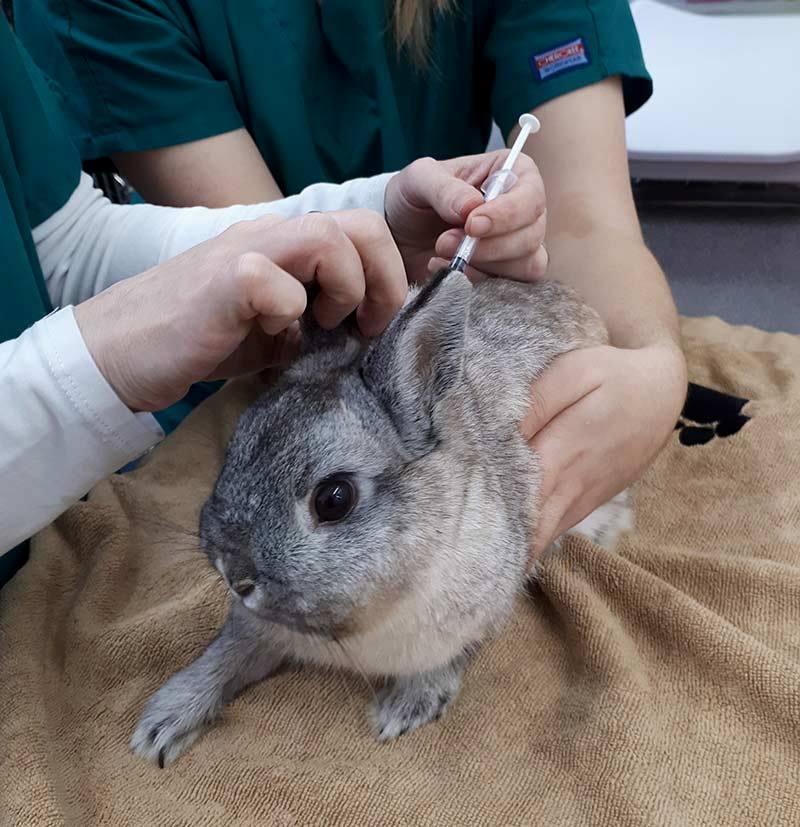
Как сделать укол кролику внутримышечно
Внутримышечное и подкожное введение лекарственных веществ первично
*Доп. оплачиваются расход. материалы: да
Доп. оплачивается амбулат. прием: да
Многие заболевания имеют одинаковую симптоматику, и только квалифицированный доктор может оказать помощь вашему пернатому другу, поэтому заниматься самолечением не рекомендуется, так как птице можно нанести не поправимый вред.
Птица больше других животных подвержена стрессу и любое неловкое движение во время лечебных или профилактических мероприятий может к нему привести. Не редко состояние стресса заканчивается гибелью.
Многие препараты при введении их через пищеварительную систему разрушаются или не всасываются в кровь, поэтому применяют парентеральные, то есть минуя желудочно-кишечный тракт, методы введения. Одними из таких методов являются внутримышечное и подкожное введение.

Способ введения всех препаратов регламентирован наставлением по их применению, которое необходимо соблюдать неукоснительно, так как не все лекарственные средства, предназначенные для внутримышечного введения, пригодны для подкожного и наоборот. Количество и дозировка лекарственных средств производится с учетом массы, возраста, общего состояния и величины птицы. Владелец обязан ставить в известность лечащего врача обо всех изменениях, которые происходят с птицей.
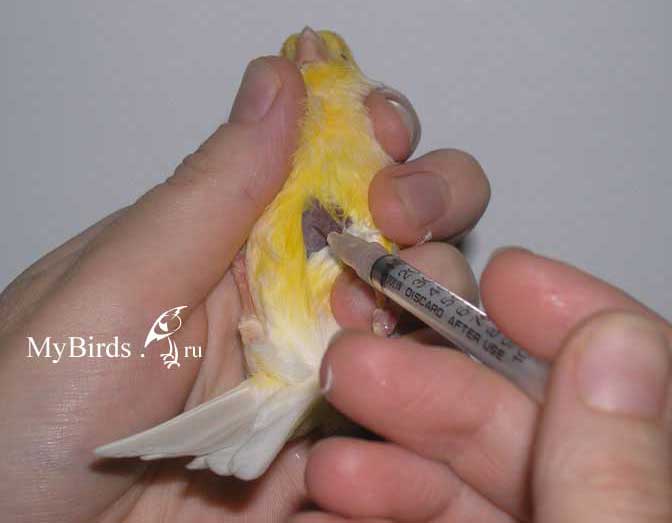
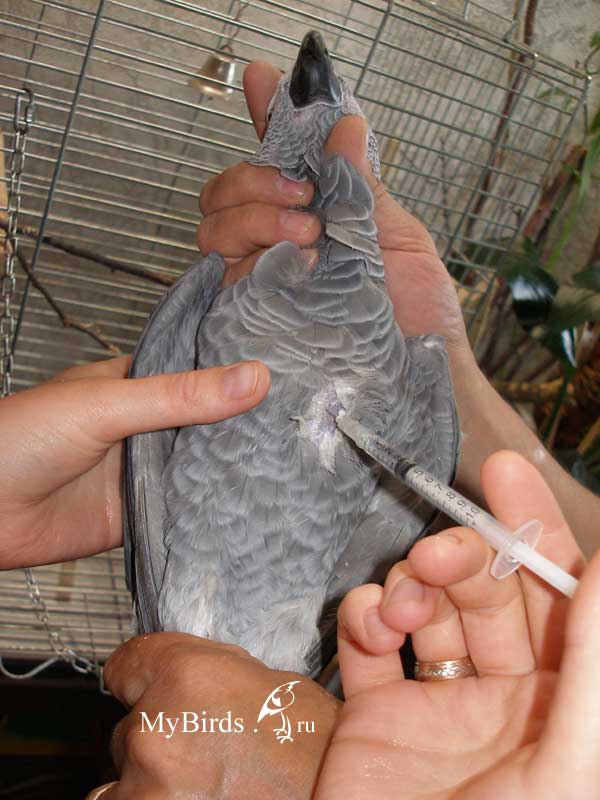
Крупным птицам лекарственный препарат вводится внутримышечно через шприц емкостью в 1 мл с тонкой иглой (инсулиновый шприц) в бедренную или грудную мышцу сбоку от края килевой кости, реже подкожно в область локтевого сустава.
Для инъекций следует использовать только стерильные шприцы и иглы.
Набрав лекарство в шприц, необходимо выпустить из шприца все пузырьки воздуха. Для этого следует поднять шприц иглой вверх и выдавить немного жидкости в колпачок от шприца.
Место инъекции обязательно следует обработать антисептиком. Перед введением лекарства в мышцу поршень шприца нужно потянуть на себя, для того чтобы убедиться, что игла не находится в сосуде. В том случае, если в шприце появилась кровь, иглу следует аккуратно продвинуть немного вглубь.
Категорически запрещается делать внутримышечную инъекцию по направлению от головы к хвосту, так как это может привести к проколу грудных мышц, введению препарата в печень и смертельному исходу. В случае правильного введения иглы препарат проходит свободно и через несколько часов рассасывается.
Инъекция в мышцы бедра несложна, однако легко вызвать парез и паралич конечностей в случае, если травмируется нерв, что еще раз подтверждает то, что
ЛЕЧЕНИЕМ ПТИЦЫ ДОЛЖЕН ЗАНИМАТЬСЯ ВЕТЕРИНАРНЫЙ ВРАЧ,
дабы минимизировать проблемные случаи.
а также это позволит врачу отслеживать весь процесс лечения и снимает ответственность с владельца животного за качество проведения процедуры.
Большинство смесей препаратов (витамины + антибиотики) мелкие птицы не переносят, поэтому их следует вводить отдельно во избежание шока.
Большой объем жидкости может привести к хромоте.
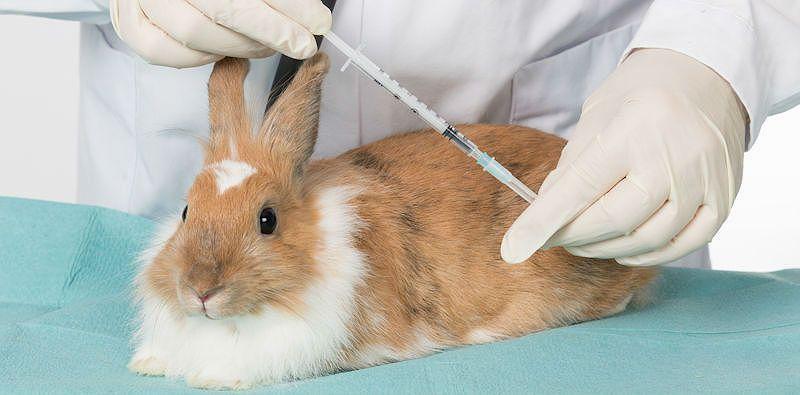
При подкожном введении местом для инъекции является дорсальная часть тела или область верхней трети шеи. Во избежание вытекания жидкости из иглы, необходимо при введении одновременно слегка двигать иглу. При замедленной инъекции кожу массируют пальцем. Введение раствора под кожу верхней трети шеи проводят оттягиванием кожи, а шприц с иглой направляют от головы вниз шеи.
Как и перед любой другой инъекцией следует место введение иглы обработать антисептическим раствором.
ПОПУГАИ НЕ ПЕРЕНОСЯТ СТРЕПТОМИЦИН И ПРОКАИНПЕНИЦИЛЛИН.
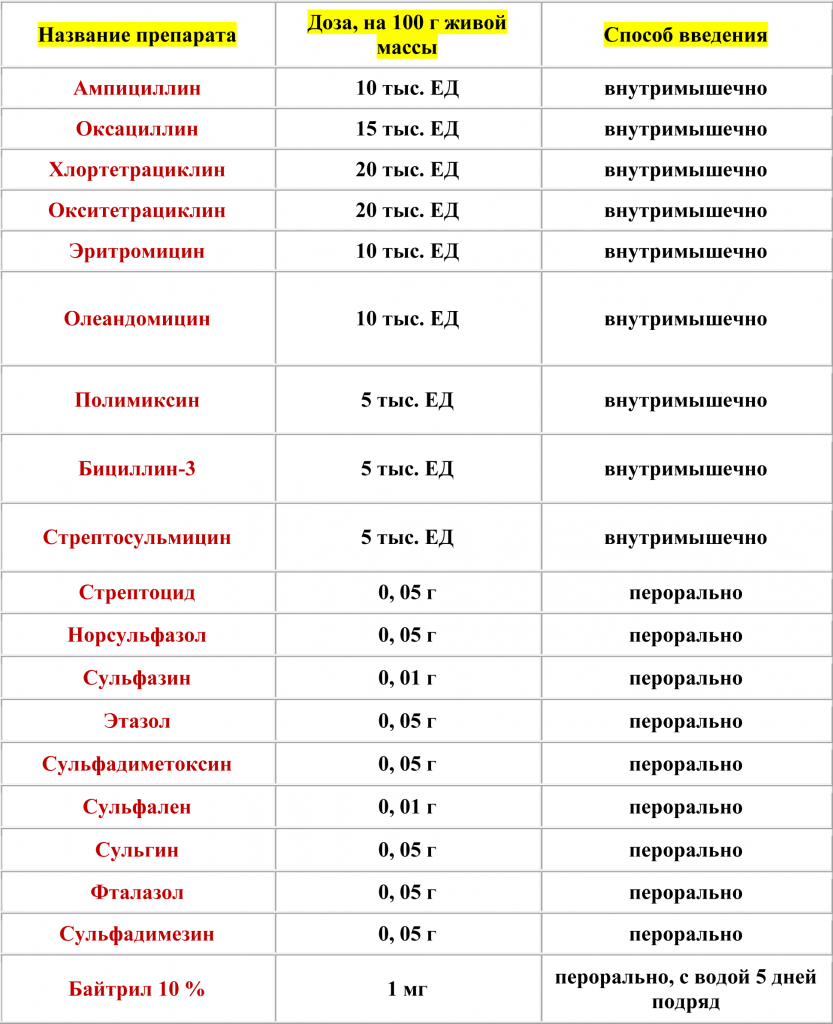
Антибиотики и сульфаниламидные препараты, применя емые при лечении попугаев
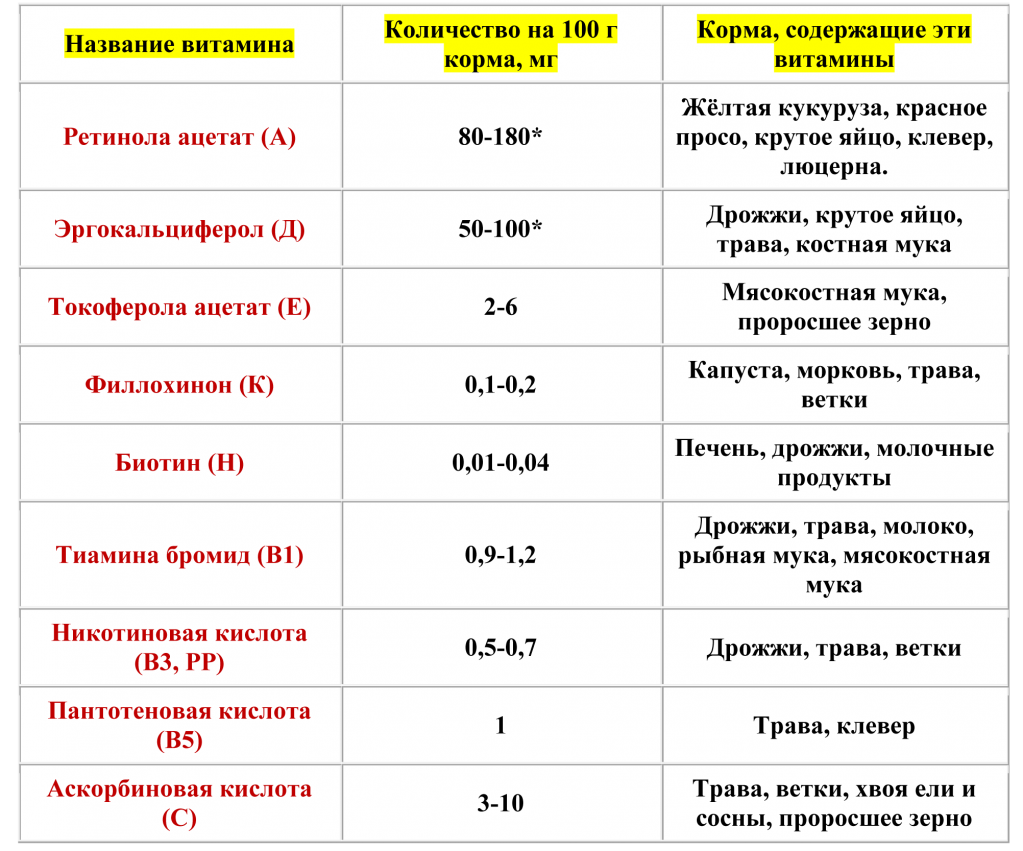
Потребность в витаминах для попугаев и корма, содержащие эти витамины.
Виду того, что на первичном приеме осуществляется клинический осмотр животного, за который взимается плата, на проводимую при этом процедуру введения препарата предоставляется скидка, инъекции на последующих приемах оплачиваются без скидки.
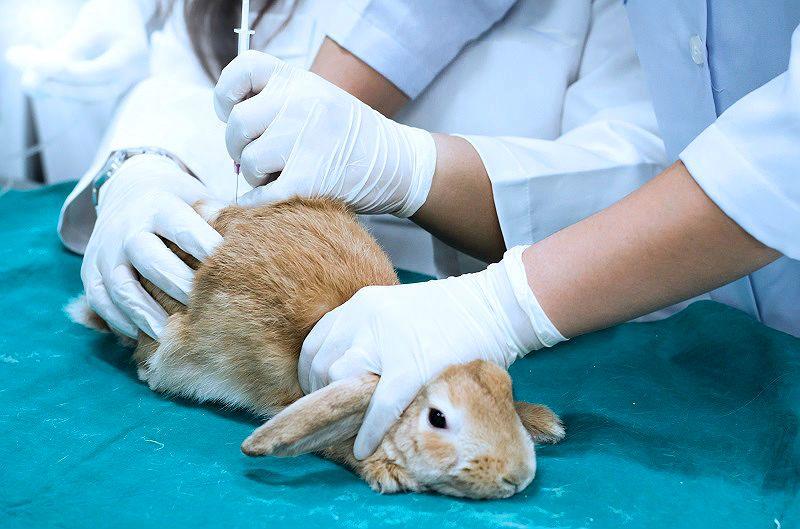
Как самостоятельно делать уколы кроликам
Содержание
У владельцев не всегда есть возможность посетить ветеринарную клинику с целью вакцинирования кролика или выполнения иной инъекции в рамках лечения. Именно поэтому многие стараются самостоятельно проводить подобную процедуру.
Узнаем, как правильно делать уколы кроликам подкожно и внутримышечно.
Как делать кроликам уколы
Отсутствие клиники поблизости, занятость фермера, экономия и другие причины затрудняют пользование ветеринарными услугами. Поэтому многие владельцы учатся делать уколы кролика самостоятельно. Процедуру может выполнить каждый, если знать технику ее выполнения и некоторые нюансы фиксации животных.
Кролики в домашнем хозяйстве должны быть вакцинированы от бешенства, паратифа, пастереллеза и листериоза. Также производятся комплексные вакцины. Их действие направлено на защиту сразу от нескольких опасных болезней.
Важно! Прививки от геморрагической пневмонии и миксоматоза являются обязательными.
Кролики ежегодно должны прививаться ассоциированной вакциной от двух заболеваний. Остальные прививки вводятся в период вспышек этих болезней в конкретном регионе. У новорожденных крольчат иммунитет поддерживается через молоко матери. Но с завершением лактационного периода их организмы становятся восприимчивыми к окружающим болезням. Поэтому первая инъекция делается животным в возрасте 2 месяцев. А повторная – к 5 месяцу жизни – закрепляет здоровье и иммунитет крольчат.
Важно! Вакцина для кроликов предполагает особые правила по ее хранению. В противном случае она утрачивает свои свойства.
Для проведения вакцинации или лечения животных с помощью инъекций понадобятся:
Подкожно
Подкожные уколы животным делаются в холку. Для этого понадобится соблюдение ряда этапов:
Важно! Неправильный или болезненный укол может привести к шоку и даже летальному исходу. Поэтому вместе с вакциной кролику вкалываются обезболивающие или успокоительные препараты.
Такой способ подразумевает медленное всасывание лекарственного препарата, поскольку под кожей располагается сеть мелких капилляров.
Внутримышечно
Внутримышечное введение предполагает прокол мышцы задней лапы. Такой способ обеспечивает быстрое всасывание лекарства, так как в этом месте проходят крупные сосуды.
Технология подразумевает несколько этапов:
Важно! Для внутримышечного укола используются инсулиновые шприцы или обыкновенные на 2 мл. Больший объем не рекомендуется из-за толстой иголки и болезненности процедуры.
Для самостоятельного проведения внутримышечных или подкожных уколов требуется не только знание всех нюансов, но также надежная фиксация питомца и спокойствие его владельца. Ведь страх и неуверенность передаются животным, и от этого кролик может бояться еще больше.
💡 На заметку. А сегодня для того что бы получить консультацию ветеринара для грызунов совершенно не обязательно ехать в ветклинику. Более половины вопросов, связанных со здоровьем грызуна, можно решить удаленно: по телефону либо в онлайн переписке. На сайте консультаций ратолога Вы можете получить помощь специалиста, в любое время и удобным для Вас способом. Стоимость услуги: 399 руб.
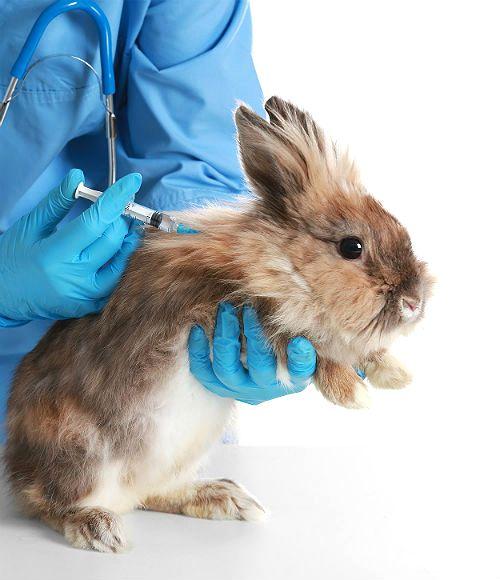
Как делать уколы кроликам и грызунам
Нередко случается, что для лечения различных заболеваний Вашего питомца, приходиться делать уколы, так как давать препараты через рот не всегда удобно, да и лечебный эффект препарата при его введении внутримышечно, подкожно или внутривенно достигается бесспорно быстрее и иногда это играет решающую роль (особенно, когда речь идет о жизни и смерти).
К тому же препараты часто приходиться колоть ежедневно, а в некоторых случаях и по несколько раз в день. Поэтому удобнее, дешевле и менее стрессово для питомца делать уколы самому дома. Конечно, первый раз хорошо бы, чтобы ветеринарный врач показал вам наглядно куда, как и в какой дозировке колется препарат. Все препараты делаются на вес, поэтому если вам нужно самому прибегнуть к лечению, то необходимы будут весы, чтобы взвесить питомца и рассчитать дозировку.
Чаще всего дома владелец может делать внутримышечные и подкожные уколы, а если у животного установлен внутривенный катетер, то еще и внутривенные (если это того требует). Внутривенный катетер может стоять в вене до 5 дней, за ним нужно внимательно следить, чтобы животное его не сняло, не погрызло. Иногда он может выйти из вены и тогда вводимый препарат попадает под кожу, это сразу будет заметно по отеканию в области катетера в момент введения препарата. Тогда нужно будет либо самостоятельно снять катетер (место, где он был установлен обработать перекисью и наложить повязку на 10 минут), или же обратиться для этого в клинику, где при необходимости снимут старый и установят новый. Для введения растворов в катетер необходимо набрать препарат в шприц, выпустить из шприца лишний воздух и подсоединить шприц (сняв иглу) к порту катетера (открутив крышку катетера). Препараты вводятся медленно, чтобы не повредить тонкие вены грызуна. После введения закрываем крышку катетера и заматываем катетер бинтом.
Подкожные и внутримышечные инъекции.
Каждый укол делается отдельным стерильным шприцом. Обычно используются шприцы на 1 мл (100ед), 2 мл, 5 мл. В первую очередь необходимо набрать препарат в шприц, выпустить воздух, чтобы количество препарата в шприце после этого соответствовала назначенной дозировке. Будьте внимательнее, существуют инсулиновые шприцы 1 мл на 40 единиц, у них шкала немного другая и соответственно может не подходить под написанную в назначениях цифру. В таком случае попросите ветеринарного врача подсказать, как будет выглядеть такая дозировка на данном шприце.
После того как вы подготовили шприц с препаратом, необходимо зафиксировать питомца. Удобнее, чтобы в этом вам кто-то помогал, так как в момент укола и введения животное может дернуться, да и вообще вести себя беспокойно и даже кусаться.
Дезинфицировать кожу в месте инъекции у животных не нужно, а если и обрабатывать то препаратами, не содержащими спирт (например, хлоргексидин).
Подкожные инъекции проводят в области холки (на спине между лопатками) или с боков, ближе к задним лапкам. В этих местах достаточно большое подкожное пространство и кожа легко оттягивается. В месте инъекции раздвигаем шерсть, и собирает кожу в складку. В основание донной складки (в основание получившегося этакого треугольника из кожи) делаем прокол параллельно поверхности тела. Обычно чувствуется, когда игла прокалывает кожу. Вводим препарат. После инъекции слегка массируем место введения, а заодно и проверяем, не ввели ли мы препарат мимо.
Внутримышечные инъекции делают во внешнюю поверхность бедра. Прокол совершают перпендикулярно поверхности бедра. Если на месте инъекции появилась кровь, обработайте место перекисью или хлоргексидином. Ничего страшного в этом нет, вы просто задели сосудик во время прокола. В зависимости от размера животного глубина введения иглы может быть разная (у мелких видов это всего лишь несколько мм, у более крупных 0,5–1 см).
Делайте инъекции как можно более уверенно и спокойно, состояние переживаний и страха передается от владельца питомцу, и он может начать еще сильнее нервничать.
Сама процедура уколов это, несомненно, стресс для Вашего питомца, поэтому после выполнения ее успокойте, погладьте и ласково поговорите с ним. Можно даже приготовить в качестве компенсации любимое лакомство.
Лечение железодефицитной анемии и дефицита железа
Лечение железодефицитной анемии и дефицита железа
О современных представлениях коррекции дефицита железа и основных характеристиках железосодержащих препаратов, принципах их выбора и дозирования при железодефицитных состояниях.
Диета при железодефиците и источники железа в пище
Основным источником железа для человека являются продукты животного происхождения. В природе железо существует в двух химических формах: 2-валентное (гемовое) и 3-валентное (негемовое). Гемовое железо хорошо всасывается в кишечнике. Наиболее богаты гемовым железом мясо, особенно говядина, кровяная колбаса. В птице и рыбе гемового железа гораздо меньше. Печень (свиная и телячья), почки, сердце, ливерная колбаса богаты ферритином и гемосидерином, содержащими негемовое железо (последнее плохо всасывается в желудочно-кишечном тракте). Много негемового железа содержится в некоторых марках красного вина, фруктовых соках, яблоках, гранатах, гречневой крупе, молочных продуктах, яйцах, орехах и шоколаде. Биодоступность такого железа минимальна, и все эти продукты не являются источником железа. Вегетарианство является мощным фактором риска железодефицитной анемии (ЖДА) в любом возрасте. При этом в рацион должны входить зелень, овощи, фрукты, т. к. усвоение железа улучшается при наличии в пище витамина С. Всасывание железа ухудшают танин (содержащийся в чае и кофе), фитин (содержащийся в рисе, соевой муке), молоко и творог из-за высокого содержания кальция. Поскольку усвоение железа из пищи ограничено, медикаментозная терапия анемии является основной.
Всемирной организацией здравоохранения (ВОЗ) в 1993 – 2005 годах проведено глобальное исследование, показавшее, что 24,4% всех жителей земного шара страдает разными формами анемии. Чаще всего анемия встречается у детей дошкольного возраста (47% от общей популяции), беременных женщин (41,8%) и небеременных женщин детородного возраста (30,2%). В структуре анемий: 37% занимает железодефицитная анемия, 27% – анемия при хронических заболеваниях (АХЗ).
Среди женщин фертильного возраста лидирующие позиции занимает железодефицитная анемия (ЖДА). Анемический синдром является самым частым гематологическим синдромом, встречающимся в клинической практике. Анемия – это не диагноз, а только синдром, требующий особого алгоритма дифференциальной диагностики.
Исследование ВОЗ свидетельствуют о том, что ЖДА является третьей по распространенности причиной временной потери трудоспособности у женщин в возрасте 15–44 лет. Наряду с собственно ЖДА существует скрытый дефицит железа, который в Европе и России составляет 30–40%, в отдельных регионах – 50–60%. По данным ВОЗ, дефицит железа определяется у 20–25% всех младенцев, 43% – у детей в возрасте до 4 лет и до 50% – у подростков (девочки). Таким образом, наиболее частыми анемиями как в Беларуси, так и в других странах, являются ЖДА и АХЗ. Анемия является ведущим фактором ухудшения самочувствия пациента, по приблизительным оценкам ею страдают 2,4 млрд населения земного шара.
Основными причинами развития железодефицитной анемии являются: кровопотери (обильные менструальные кровотечения, беременность, роды, желудочно-кишечные, легочные, при заболевании почек); нарушения всасывания железа (резекция желудка и кишечника, недостаточность поджелудочной железы, глютеновая энтеропатия, болезнь Крона); повышенная потребность в железе (быстрый рост, недоношенные, новорожденные дети, подростки, беременность и лактация); недостаточное поступление с пищей (вегетарианская или веганская диета).
Необходимо помнить, что ЖДА – финал выраженного железодефицита, при котором снижается эритропоэз (кроветворение) и, как следствие, уменьшается содержание гемоглобина.
Предлатентный дефицит железа характеризуется снижением запасов микроэлемента без уменьшения расходования железа на эритропоэз. Латентный дефицит железа наблюдается при полном истощении запасов микроэлемента в депо, однако признаков развития анемии нет. Манифестный дефицит железа, или железодефицитная анемия (ЖДА), возникает при снижении гемоглобинового фонда железа и имеет характерные симптомы. Снижение концентрации сывороточного ферритина ниже 12 мкг/л у здоровых детей и 15 мкг/л у взрослых, с поправкой ниже 30 мкг/л у детей и 70 мкг/л у взрослых с инфекционными или воспалительными заболеваниями, означает неизбежное снижение концентрации гемоглобина в последующем.
Основой патогенетической терапии ЖДА является применение препаратов железа внутрь. Лечение препаратами железа должно быть длительным и зависит от исходной тяжести анемии (уровня гемоглобина и дефицита железа).
На амбулаторном этапе лечение осуществляется при уровне гемоглобина >80 г/л и удовлетворительном общем состоянии пациента. Пероральное назначение железосодержащих ЛС в дозе 200-300 мг/сутки в течение 4-6 недель до нормализации уровня гемоглобина, после чего продолжается прием ЛС в дозе 100 мг/сутки в течение 2-3 месяцев до содержания ферритина не менее 40 мкг/л. Необходим поиск причины дефицита железа и устранение причины дефицита железа – это лечение основного заболевания, вызвавшего дефицит железа.
Принципы выбора препарата железа для терапии
В настоящее время пероральные препараты железа разделены на две основные группы: ионные и неионные (последние представлены протеиновым и гидроксиполимальтозным комплексом 3-валентного железа).
Ионные препараты представлены солями 2-валентного железа, в т. ч. сульфатом железа (феррофол, тардиферон, ферроплекс, сорбифер, ферро-фольгамма и др.); хлоридом железа (гемофер); полисахаридными соединениями – глюконат-фумаратными комбинациями (хеферол, ферронал, мегаферрин). Хелаты 2-валентного железа (цитрат, лактат, глюконат, сукцинат) всасываются лучше, чем сульфат железа. В случае непереносимости солевых препаратов 2-валентного железа, являющихся на сегодняшний день наиболее эффективными в лечении анемии и восполнении депо железа, возможно использование неионных препаратов 3-валентного железа в виде гидроксиполимальтозного комплекса (мальтофер, биофер, феррум лек и др.).
При выборе лекарственного препарата и оптимального режима дозирования необходимо помнить, что адекватный прирост показателей гемоглобина при ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг 2-валентного железа. Учитывая, что при развитии ЖДА всасывание железа увеличивается на 25–30% (при нормальных запасах железа в организме – всего 3–7%), назначают от 100 до 300 мг 2-валентного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Степень абсорбции 2-валентных солей железа в несколько раз выше, чем 3-валентного, поэтому препараты, содержащие 2-валентное железо, дают быстрый эффект и нормализуют уровень гемоглобина в среднем через 1–2 месяцев, а нормализация уровня железа в депо происходит через 3–4 месяца от начала лечения и зависит от степени тяжести анемии и дозы препарата. Требуется более длительное применение препаратов, содержащих железо в 3-валентном состоянии, в случае дефицита меди в организме они будут неэффективны. Нормализация уровня гемоглобина при лечении препаратом 3-валентного железа наступит только через 2–4 месяца, а восполнение дефицита железа в депо – через 5–7 месяцев от начала терапии. Степень абсорбции отражается и на частоте развития побочных эффектов. Уменьшить нежелательное влияние твердых форм препаратов железа (таблетированных, капсулированных) на слизистую оболочку ЖКТ можно, принимая их во время еды, но при этом уменьшается всасывание железа.
При приеме препаратов в достаточной дозе на 7–10-й день от начала лечения наблюдается повышение количества ретикулоцитов. Нормализация уровня гемоглобина отмечается через 3–4 недели от начала лечения, а в ряде случаев затягивается до 6–8 недель. Общая длительность лечения зависит от исходной тяжести анемии. Стандартные сроки проведения ферротерапии ЖДА: при легкой степени тяжести – 4-6 недель, при средней степени – 8–12 недель, при тяжелой – 16 недель и более. На фоне применения ферропрепаратов внутрь наиболее часто возникают тошнота, рвота, анорексия, запоры (т. к. железо связывает сероводород, являющийся физиологическим стимулятором моторики), реже – поносы, металлический привкус во рту, окрашивание слизистых оболочек и зубов в черный цвет, аллергические реакции, головная боль. Эти побочные эффекты приводят к частым отказам пациентов от лечения.
Биодоступность двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они свободно диффундируют через каналы ДМТ1-белков и ферропортин. Фармакологический эффект препаратов быстрый, и нормализация уровня гемоглобина в среднем происходит через 2 недели ‒ 2 месяца, а восполнение депо железа происходит уже через 3‒4 месяца от начала лечения, в зависимости от тяжести анемии и дозировки препарата. В связи с чем ВОЗ рекомендует препараты двухвалентного железа в качестве стартовой терапии железодефицитной анемии. Всасывание ионов из препаратов трехвалентного железа более медленное, так как необходима активная (энергозависимая) трансформация с участием феррооксидаз. Поэтому такие препараты требуют более длительного применения, а в случае дефицита меди в организме будут неэффективны вообще.
Лекарственный препарат Феррофол производства УП «Минскинтеркапс» содержит в одной капсуле 50 мг сульфата железа (II) и 500 мкг фолиевой кислоты. Применяя Феррофол в среднесуточной дозировке по 1 капсуле 2-3 раза в день за 1 час до еды (100-150 мг в сутки), достигается цель лечения железодефицитной анемии – введение железа в количестве, необходимом для нормализации уровня гемоглобина, соответствует рекомендации ВОЗ об оптимальной лечебной дозе.
Лекарственный препарат Феррофол отвечает основным требованиям к проведению лечения препаратами железа:
Преимущества препарата Феррофол:
выпускается в форме капсул пролонгированного действия, активные ингредиенты содержатся в пеллетах (микрогранулах), которые обеспечивают их всасывание в верхнем отделе тонкой кишки, в связи с чем отсутствует местное раздражающее действие на слизистую оболочку желудка, что обеспечивает хорошую желудочно-кишечную переносимость. Использование пеллет в капсулах Феррофол позволяет изолировать друг от друга активные вещества – фолиевую кислоту и железо в одной готовой форме. Фолиевая кислота повышает синтез ДНК в кроветворных клетках, что положительно влияет на скорость синтеза гемоглобина, а значит, более быстрое купирование анемии.
Лекарственный препарат Феррофол показан для профилактики и латентного дефицита железа и железодефицитной анемии, особенно во время беременности.
Профилактика железодефицитной анемии и латентного дефицита железа показана пациентам группы риска, к которым относятся:
Феррофол – комбинированный лекарственный препарат, восполняющий дефицит железа и фолиевой кислоты в организме.
Капсулы нужно глотать целиком, запивая стаканом воды. Капсулу нельзя рассасывать, разжевывать и держать во рту.
Прием осуществляют до или во время приема пищи, в зависимости от желудочно-кишечной переносимости.
Имеются медицинские противопоказания и нежелательные реакции.
ПЕРЕД ПРИМЕНЕНИЕМ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ОЗНАКОМЬТЕСЬ С ИНСТРУКЦИЕЙ
Cовременная терапия хронической обструктивной болезни легких
Хроническая обструктивная болезнь легких (ХОБЛ) — заболевание, характеризующееся прогрессирующей, частично обратимой бронхиальной обструкцией, которая связана с воспалением дыхательных путей, возникающим под влиянием неблагоприятных факторов внешней сред
Хроническая обструктивная болезнь легких (ХОБЛ) — заболевание, характеризующееся прогрессирующей, частично обратимой бронхиальной обструкцией, которая связана с воспалением дыхательных путей, возникающим под влиянием неблагоприятных факторов внешней среды (курения, профессиональных вредностей, поллютантов и др.). Установлено, что морфологические изменения при ХОБЛ наблюдаются в центральных и периферических бронхах, легочной паренхиме и сосудах [8, 9]. Это объясняет использование термина «хроническая обструктивная болезнь легких» вместо привычного «хронического обструктивного бронхита», подразумевающего преимущественное поражение у больного бронхов.
В опубликованных недавно рекомендациях ведущих экспертов Американского и Европейского торакальных обществ подчеркивается, что развитие ХОБЛ у больных можно предупредить, а при ее лечении вполне реально добиться успехов [7].
Заболеваемость и смертность пациентов от ХОБЛ продолжают расти во всем мире, что в первую очередь обусловлено широкой распространенностью курения. Показано, что этим заболеванием страдают 4–6 % мужчин и 1–3 % женщин старше 40 лет [8, 10]. В европейских странах оно ежегодно является причиной смерти 200–300 тыс. человек [10]. Высокое медико-социальное значение ХОБЛ стало причиной издания по инициативе ВОЗ международного согласительного документа, посвященного ее диагностике, лечению, профилактике и основанного на принципах доказательной медицины [8]. Аналогичные рекомендации выпущены Американским и Европейским респираторными обществами [7]. В нашей стране недавно опубликовано 2-е издание Федеральной программы по ХОБЛ [1].
Задачами терапии ХОБЛ являются предупреждение прогрессирования болезни, уменьшение выраженности клинических симптомов, достижение лучшей переносимости физической нагрузки и повышение качества жизни больных, предупреждение осложнений и обострений, а также снижение смертности [8, 9].
Основными направлениями лечения ХОБЛ являются уменьшение воздействия неблагоприятных факторов внешней среды (в том числе отказ от курения), обучение больных, использование лекарственных средств и немедикаментозная терапия (оксигенотерапия, реабилитация и др.). Различные комбинации этих методов используются у пациентов с ХОБЛ в фазу ремиссии и обострения.
Уменьшение влияния на больных факторов риска является неотъемлемой частью лечения ХОБЛ, позволяющей предупредить развитие и прогрессирование этого заболевания. Установлено, что отказ от курения позволяет замедлить нарастание бронхиальной обструкции. Поэтому лечение табачной зависимости актуально для всех пациентов, страдающих ХОБЛ. Наиболее эффективны в этом случае беседы медицинского персонала (индивидуальные и групповые) и фармакотерапия. Существуют три программы лечения табачной зависимости: короткая (1–3 мес), длительная (6–12 мес) и программа снижения интенсивности курения [2].
Назначать лекарственные препараты рекомендуется в отношении больных, с которыми беседы врача оказались недостаточно эффективны. Следует взвешенно подходить к их применению у людей, выкуривающих менее 10 сигарет в день, подростков и беременных. Противопоказанием к назначению никотинзамещающей терапии являются нестабильная стенокардия, нелеченая пептическая язва двенадцатиперстной кишки, недавно перенесенные острый инфаркт миокарда и нарушение мозгового кровообращения.
Повышение информированности пациентов позволяет повысить их работоспособность, улучшить состояние здоровья, формирует умение справляться с болезнью, повышает эффективность лечения обострений [8]. Формы обучения больных различны — от распространения печатных материалов до проведения семинаров и конференций. Наиболее эффективно интерактивное обучение, которое проводится в рамках небольшого семинара.
Принципы лечения ХОБЛ стабильного течения [6, 8] следующие.
Хирургическое лечение
Роль хирургического лечения у больных ХОБЛ в настоящее время является предметом исследований. Сейчас обсуждаются возможности использования буллэктомии, операции по уменьшению легочного объема и трансплантации легких.
Показанием для буллэктомии при ХОБЛ является наличие у пациентов буллезной эмфиземы легких с буллами большого размера, вызывающими развитие одышки, кровохарканья, легочных инфекций и боли в грудной клетке. Эта операция приводит к уменьшению одышки и улучшению функции легких.
Значение операции по уменьшению легочного объема при лечении ХОБЛ изучено пока недостаточно. Результаты завершившегося недавно исследования (National Emphysema Therapy Trial) свидетельствуют о положительном влиянии этого хирургического вмешательства по сравнению с медикаментозной терапией на способность выполнять физическую нагрузку, качество жизни и летальность больных ХОБЛ, имеющих преимущественно тяжелую верхнедолевую эмфизему легких и исходно низкий уровень работоспособности [12]. Тем не менее эта операция остается пока экспериментальной паллиативной процедурой, не рекомендуемой для широкого применения [9].
Трансплантация легких улучшает качество жизни, функцию легких и физическую работоспособность больных. Показаниями для ее выполнения являются ОФВ1 ё25% от должного, РаСО2>55 мм рт. ст. и прогрессирующая легочная гипертензия. К числу факторов, лимитирующих выполнение этой операции, относятся проблема подбора донорского легкого, послеоперационные осложнения и высокая стоимость (110–200 тыс. долларов США). Операционная летальность в зарубежных клиниках составляет 10–15%, 1-3-летняя выживаемость, соответственно, 70–75 и 60%.
Ступенчатая терапия ХОБЛ стабильного течения представлена на рисунке.
Лечение легочного сердца
Легочная гипертензия и хроническое легочное сердце являются осложнениями ХОБЛ тяжелого и крайне тяжелого течения. Их лечение предусматривает оптимальную терапию ХОБЛ, длительную (>15 ч) оксигенотерапию, использование диуретиков (при наличии отеков), дигоксина (только при мерцательной терапии и сопутствующей левожелудочковой сердечной недостаточности, так как сердечные гликозиды не оказывают влияния на сократимость и фракцию выброса правого желудочка). Спорным представляяется назначение вазодилятаторов (нитратов, антагонистов кальция и ингибиторов ангиотензинпревращающего фермента). Их прием в ряде случаев приводит к ухудшению оксигенации крови и артериальной гипотензии. Тем не менее антагонисты кальция (нифедипин SR 30–240 мг/сут и дилтиазем SR 120–720 мг/cут), вероятно, могут применяться у больных с тяжелой легочной гипертензией при недостаточной эффективности бронхолитиков и оксигенотерапии [16].
Лечение обострений ХОБЛ
Обострение ХОБЛ характеризуется нарастанием у больного одышки, кашля, изменением объема и характера мокроты и требует изменений лечебной тактики. [7]. Различают легкие, средней тяжести и тяжелые обострения болезни (см. табл. 3).
Лечение обострений предусматривает использование лекарственных препаратов (бронхолитиков, системных глюкокортикоидов, по показаниям–антибиотиков), оксигенотерапии, респираторной поддержки.
В связи с трудностью дозирования и большим числом потенциальных побочных эффектов применение теофиллинов короткого действия при лечении обострений ХОБЛ является предметом дискуссии. Некоторые авторы допускают возможность их использования в качестве препаратов «второго ряда» при недостаточной эффективности ингаляционных бронхолитиков [6, 9], другие не разделяют эту точку зрения [7]. Вероятно, назначение препаратов этой группы возможно при соблюдении правил введения и определении концентрации теофиллина в сыворотке крови. Наиболее известный из них препарат эуфиллин, представляющий собой теофиллин (80%), растворенный в этилендиамине (20%). Схема его дозирования приведена в таблице 5. Следует подчеркнуть, что препарат должен вводиться только внутривенно капельно. Это уменьшает вероятность развития побочных эффектов. Его нельзя назначать внутримышечно и ингаляционно. Введение эуфиллина противопоказано у больных, получающих теофиллины длительного действия, из-за опасности его передозировки.
Инвазивная ИВЛ предусматривает интубацию дыхательных путей или наложение трахеостомы. Соответственно связь больного и респиратора осуществляется через интубационные или трахеостомические трубки. Это создает риск развития механических повреждений и инфекционных осложнений. Поэтому инвазивная ИВЛ должна использоваться при тяжелом состоянии больного и только при неэффективности других методов лечения.
Показания для инвазивной ИВЛ [8, 9]:
Больные с легкими обострениями могут лечиться амбулаторно.
Амбулаторное лечение легких обострений ХОБЛ [7–9] включает следующие этапы.
Пациенты с обострениями средней тяжести, как правило, должны госпитализироваться. Их лечение осуществляется по следующей схеме [7–9].
А. В. Емельянов, доктор медицинских наук, профессор
СПБ ГМУ, Санкт-Петербург